QUÍMICA I
AULA 04: ESTRUTURA ELETRÔNICA DOS ÁTOMOS
TÓPICO 02: ESPECTROS ATÔMICOS
2.1 ENERGIA RADIANTE
A luz ou energia eletromagnética é uma radiação que pode ser
transmitida através do vácuo a uma velocidade de 3,0x108m.s-1.
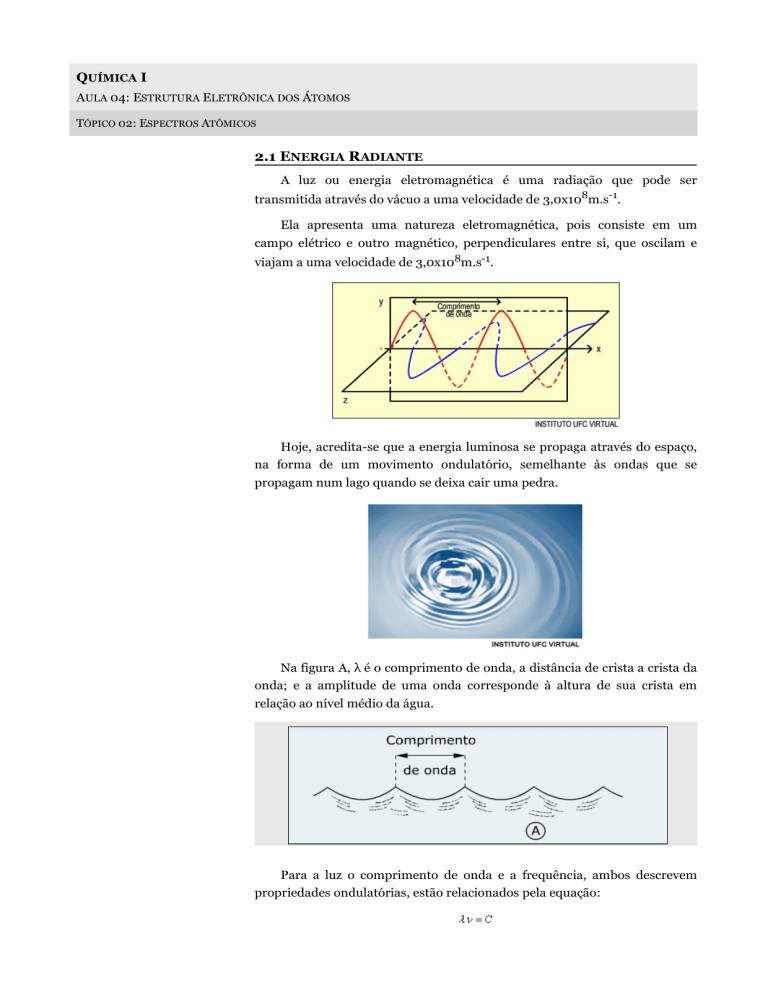
Ela apresenta uma natureza eletromagnética, pois consiste em um
campo elétrico e outro magnético, perpendiculares entre si, que oscilam e
viajam a uma velocidade de 3,0x108m.s-1.
Hoje, acredita-se que a energia luminosa se propaga através do espaço,
na forma de um movimento ondulatório, semelhante às ondas que se
propagam num lago quando se deixa cair uma pedra.
Na figura A, λ é o comprimento de onda, a distância de crista a crista da
onda; e a amplitude de uma onda corresponde à altura de sua crista em
relação ao nível médio da água.
Para a luz o comprimento de onda e a frequência, ambos descrevem
propriedades ondulatórias, estão relacionados pela equação:
Onde é a frequência, λ é o comprimento de onda e C é a velocidade da
luz.
A figura acima representa o espectro eletromagnético que incluem
ondas de radio de grande comprimento de onda ate raios gama de
comprimento de onda muito curto.
O olho humano só é capaz de interpretar radiações de comprimento de
onda na faixa de 400 nm a 700 nm que correspondem respectivamente às
cores violeta e vermelha da região visível do espectro eletromagnético.
Ambos os modelos, o corpuscular e o ondulatório, parecem definitivos.
A luz quando se propaga através do espaço, apresenta um comportamento
ondulatório; e quando interage com a matéria, em processos de troca de
energia assume uma natureza corpuscular.
A NATUREZA DUAL DA MATÉRIA
Broglie[1]
O físico francês DE BROGLIE observou que, se a luz apresenta
caráter tanto ondulatório como corpuscular, deve existir na matéria
uma propriedade com características tanto ondulatórias como
corpuscular.
Aproveitando a ideia de Einstein de que massa e energia estão
relacionadas através da relação: E = mc2, de Broglie observou a
quantidade de movimento p (massa x velocidade) de um fóton (uma
propriedade corpuscular) está, relacionada com o seu comprimento de
onda (uma propriedade ondulatória) através da expressão:
P = massa x velocidade
A quantidade de movimento e o comprimento de onda são
inversamente proporcionais, através da constante de Planck.
De Broglie postulou que, as partículas materiais de massa m e de
velocidade v, estariam associadas a um comprimento de onda
pela equação:
dado
LEITURA COMPLEMENTAR
Aprenda mais e leia sobre a história da espectroscopia e a descoberta
dos elementos químicos nesse fascinante texto[2].
Espectroscopia Atômica
DESAFIO
Para continuar o estudo segue abaixo quatro questionamentos. Leia a
aula, faça uma reflexão e tente resolver mentalmente os desafios. Clique
aqui para abrir.
FONTES DAS IMAGENS
1. http://upload.wikimedia.org/wikipedia/commons/d/d2/Broglie_Big.jpg
2.http://qnesc.sbq.org.br/online/qnesc03/historia.pdf
Responsável: Eduardo H. Silva de Sousa
Universidade Federal do Ceará - Instituto UFC Virtual












