tabela periodica foi adicionado
Modificar minhas definições de alerta | Exibição tabela periodica | Exibição Feed_Posts
Título:
tabela periodica
Corpo:
Boa noite ,como estudar as propriedades dos elementos no grupo familia e periodo
na tabela periodica ex.por favor
Escola:
F.B. Paranavaí - PR
Área do
Conhecimento:
Ciências da Natureza II - EM
Modificado:
01/07/2016 20:20
Criado:
01/07/2016 20:20
Cara Marluce,
As propriedades periódicas dos elementos químicos são características inerentes a
esses elementos que variam de acordo com a posição ocupada na tabela periódica, ou
seja, com o número atômico.
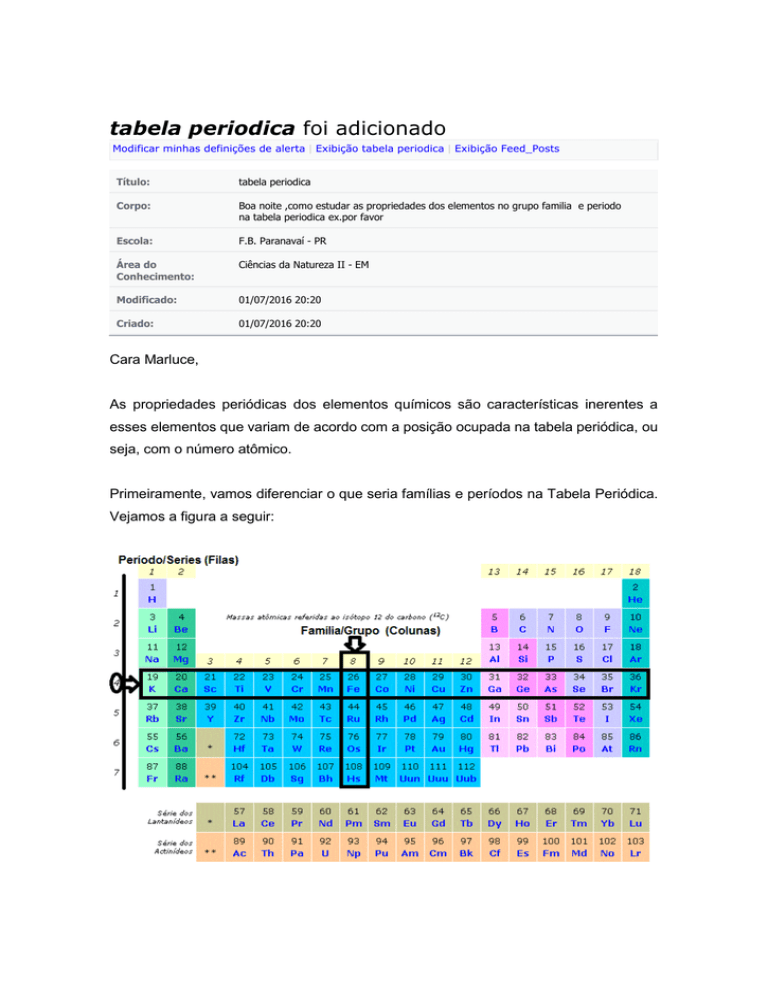
Primeiramente, vamos diferenciar o que seria famílias e períodos na Tabela Periódica.
Vejamos a figura a seguir:
Conforme destaca a figura anterior, os períodos e as famílias da Tabela Periódica são,
respectivamente, as colunas horizontais e verticais nas quais os elementos químicos
estão organizados. Vale ressaltar que os elementos químicos estão dispostos em ordem
crescente de número atômico e esse valor define as propriedades periódicas de cada
elemento. As principais propriedades periódicas são: Raio atômico, Energia de
Ionização, Afinidade eletrônica, Eletronegatividade, Eletropositividade e Potencial
de Ionização. Vamos conhecer cada uma delas nos tópicos a seguir.
Nesse momento, volte para a imagem da tabela e repare que ela apresenta sete colunas
horizontais, portanto, sete períodos, que indicam a quantidade de níveis que um átomo
de um elemento apresenta. Desta forma, quanto maior o número do período do
elemento, maior será a quantidade de níveis que cada um dos átomos do elemento
apresenta.
Suponha que um determinado elemento está posicionado no 5o Período da Tabela
Periódica, por exemplo, isso quer dizer que cada um de seus átomos apresenta cinco
níveis eletrônicos ou cinco camadas eletrônicas.
Vejamos outros exemplos:
Na (terceiro período) = seus átomos apresentam três níveis;
Po (sexto período) = seus átomos apresentam seis níveis;
H (primeiro período) = seus átomos apresentam um nível;
Cu (quarto período) = seus átomos apresentam quatro níveis.
As colunas verticais, que são em número de 18, são denominadas de famílias. A Tabela
apresenta 18 colunas, que formam apenas 16 famílias divididas em oito do tipo A e oito
do tipo B.
Representação das 18 colunas verticais da Tabela Periódica
As famílias A são formadas pelas duas primeiras e pelas seis últimas colunas verticais
da Tabela. Sendo assim, cada uma das colunas recebe a seguinte indicação:
coluna 1 = Família IA (com exceção do Hidrogênio-quadrado azul na tabela)
coluna 2 = Família IIA
coluna 13 = Família IIIA
coluna 14 = Família IVA
coluna 15 = Família VA
coluna 16 = Família VIA
coluna 17 = Família VIIA
coluna 18 = Família VIIIA
Representação das famílias “A” da Tabela Periódica
Já as famílias B são compostas pelas colunas de 3 a 12. É importante observar que
temos um total de 10 colunas que formam as famílias B. Por que então só consideramos
oito famílias? Os elementos químicos que compõem as colunas 8 (coluna do ferro), 9
(coluna do cobalto) e 10 (coluna do níquel) apresentam características semelhantes e,
por isso, consideramos essas três colunas como sendo uma única família. Sendo assim,
cada uma das colunas recebe a seguinte indicação:
coluna 3 = Família IIIB
coluna 4 = Família IVB
coluna 5 = Família VB
coluna 6 = Família VIB
coluna 7 = Família VIIB
coluna 8, 9 e 10 = Família VIIIB
coluna 11 = Família IB
coluna 12 = Família IIB
Representação das Famílias B da Tabela Periódica
Observação: As duas colunas horizontais localizadas do lado de fora da Tabela
Periódica pertencem, respectivamente, ao sexto e sétimo períodos da família IIIB. Elas
foram posicionadas assim para não descaracterizarem a tabela, já que cada uma delas
apresenta 15 elementos diferentes.
Representação do sexto e sétimo períodos da família IIIB
Propriedades Periódicas dos Elementos Químicos
Conforme comentamos as propriedades periódicas são características dos elementos
que refletem sua localização na Tabela Periódica. As principais são: Raio atômico,
Energia de Ionização, Afinidade eletrônica, Eletronegatividade, Eletropositividade e
Potencial de Ionização
Vamos conhecer algumas delas:
Raio atômico: Refere-se ao tamanho do átomo. Quanto maior o número de níveis,
maior será o tamanho do átomo. O átomo que possui o maior número de prótons exerce
maior atração sobre seus elétrons. Em resumo, é a distância do núcleo de um átomo à
sua eletrosfera na camada mais externa.
O raio atômico cresce de cima para baixo na família da tabela periódica, acompanhando
o número de camadas dos átomos de cada elemento e da direita para a esquerda nos
períodos da tabela periódica.
Eletronegatividade: é a força de atração exercida sobre os elétrons de uma ligação.
Na tabela periódica a eletronegatividade aumenta de baixo para cima e da esquerda
para a direita. Essa propriedade tem relação com o raio atômico: quanto menor o
tamanho de um átomo, maior é a força de atração sobre os elétrons.
Potencial de Ionização: é a energia necessária para remover um elétron de um átomo
isolado no estado gasoso. À medida que aumenta o tamanho do átomo, aumenta a
facilidade para a remoção de um elétron da camada de valência. Portanto, quanto maior
o tamanho do átomo, menor o potencial de ionização.
O Potencial de Ionização mede o contrário da afinidade eletrônica: a energia necessária
para retirar um elétron de um átomo neutro, em estado fundamental e no estado gasoso.
A retirada de elétron na primeira vez utilizará uma quantidade de energia maior que na
segunda retirada e assim sucessivamente.
Possui comportamento igual ao da afinidade eletrônica e da eletronegatividade,
portanto, o Flúor e o Cloro são os elementos que possuem os maiores potenciais de
ionização da tabela periódica.











