Física e Química A
10.º ano
Massa e tamanho dos átomos
1. Seleciona a opção que completa corretamente a frase.
O ião Y2+ formou-se por …
a)
b)
c)
d)
perda de dois protões.
ganho de dois eletrões.
ganho de dois protões.
perda de dois eletrões.
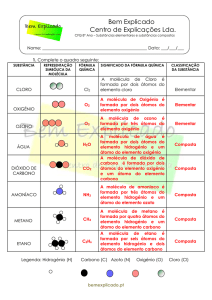
2. Considera o néon, o cloreto de sódio e a água e completa a frase com as opções corretas.
No néon, as unidades estruturais são __________, no cloreto de sódio são __________e na água
são __________.
Opções: moléculas; átomos; eletrões; iões
3. Os seguintes iões são isoeletrónicos, apresentando 10 eletrões. Coloca-os por ordem
crescente de número atómico.
A.
B.
C.
D.
Al3+
FO2Na+
4. Associa o número do item da coluna I ao número identificativo do elemento da coluna II.
Coluna I
Coluna II
1-
A- O número de protões é inferior ao número de eletrões.
13Al
+
B- Partícula que tem maior carga nuclear.
2-
12Mg
C- Ião com 12 eletrões.
D- Partícula eletricamente neutra.
3- 7N3-
E- Anião.
1/6
Física e Química A
10.º ano
5. Considera as representações e classifica as seguintes afirmações em verdadeiras (V) ou falsas
(F). As letras representam genericamente átomos.
12
6A
a)
b)
c)
d)
13
6B
14
6C
1
1D
2
1E
3
1F
35
17G
37
17H
O número de protões da espécie A é 7.
A espécie G tem tendência a formar iões G+.
O número de neutrões da espécie H é 20.
Estão representadas 3 espécies químicas diferentes.
6. Responde à seguinte questão.
Sabendo que a massa molar da água é de 18 g mol-1, qual a massa que é necessário medir para
obter 0,25 moles dessa substância?
7. Completa as frases seguintes com os valores em falta.
A massa de 4,6 gramas de etanol (C2H6O) contém ______________ moles de etanol, que
correspondem a _____________ moléculas de etanol.
Por sua vez, o numero de átomos de carbono presentes nesta quantidade de etanol é de
______________, o número de átomos de hidrogénio é de ______________ e o número de
átomo de oxigénio é de _____________ .
8. A massa atómica relativa do bromo é aproximadamente 80.
Seleciona a opção correta.
a) A massa de 1 molécula de bromo (Br2) é 160 vezes maior do que 1/12 da massa do átomo
de carbono-12.
b) A massa da molécula de bromo (Br2) é 80 vezes maior do que a massa de 1 átomo de
hidrogénio.
c) A massa de 1 átomo de bromo é 80 vezes maior do que a massa de 1 átomo de carbono.
d) A massa de 1 átomo de bromo é 80 vezes menor do que 1/12 da massa do átomo de carbono12.
e) A massa de 1 átomo de bromo é igual à massa de 1 átomo de hidrogénio.
f) O número atómico do bromo é 80.
2/6
Física e Química A
10.º ano
9. Completa as frases com as opções corretas.
A ________________ estuda a manipulação da matéria à escala _______________ e
_____________.
Pequenas mudanças na estrutura da matéria, de tamanho nanométrico, acarretam __________
mudanças nas suas características ____________ e ____________ criando novos materiais.
Opções: geologia; celular; físicas; significativas; de origem; atómica; humana; químicas;
nanotecnologia; molecular; poucas; de estado físico
10. Responde às seguintes questões.
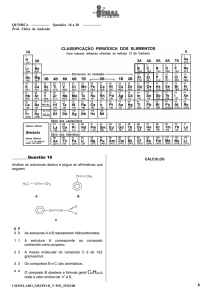
O elemento cloro é constituído por dois isótopos, o cloro-35 e o cloro-37, de massas isotópicas
relativas 34,97 e 36,97, respetivamente. A sua massa atómica relativa é 35,45.
a) Sem efetuares cálculos, indica, justificando, qual dos dois isótopos é mais abundante.
b) Confirma, através de cálculos, a resposta dada na alínea anterior.
11. Classifica as seguintes afirmações em verdadeiras (V) ou falsas (F).
A fórmula química da glicose é C6H12O6.
a) Existem 12 átomos de carbono e oxigénio numa molécula de glicose.
b) Os elementos químicos que entram na constituição da glicose são o carbono, o hidrogénio e
o oxigénio.
c) A massa molecular relativa da glicose é 180 g.
d) Em 10 moléculas de glicose existem 22 átomos de hidrogénio.
e) Em 100 moléculas de glicose existem 600 átomos de carbono.
12. Associa o número do item da coluna I ao número identificativo do elemento da coluna II.
Coluna I
1-
Micrómetro - 10
Coluna II
-6
m
A-
Adequado ao tamanho de moléculas
2- Nanómetro - 10-9 m
B- Adequado ao tamanho de átomos
3- Picómetro - 10-12 m
C- Adequado ao tamanho de células
3/6
Física e Química A
10.º ano
13. Completa as frases com as opções corretas.
A molécula de água oxigenada (H2O2) é constituída por 4 ______________ de hidrogénio e
oxigénio. A massa molecular relativa é ____________. Significa que a massa da molécula de
água oxigenada é 34 vezes ____________ do que a massa de _____________.
Opções: moléculas; 1 átomo de carbono; maior; 18; menor; átomos; 1/12 do átomo carbono12; 34; 1/12 do átomo de hidrogénio
14. Coloca as seguintes substâncias por ordem crescente da sua massa molecular relativa.
A. C2H2Cl2
B. Na2SO4
C. Fe2O3
15. Considera o sal nitrato de bário e responde às seguintes questões.
a)
b)
c)
d)
Escreve a fórmula química do composto.
Calcula a sua massa molar.
Calcula a massa de 0,5 mol deste sal.
Calcula o número de iões bário presentes em 0,5 mol deste sal.
16. Responde às seguintes questões.
Na molécula de amoníaco, de fórmula química NH3, a fração mássica do nitrogénio é de 0,82 e
a fração mássica do hidrogénio é de 0,18. A partir da relação entre fração mássica e fração
molar…
a) determina a fração molar do hidrogénio na molécula de amoníaco.
b) determina a fração molar do nitrogénio na molécula de amoníaco.
17. Responde às seguintes questões.
A molécula de água é constituída por átomos de hidrogénio e oxigénio.
a) Calcula a fração molar do elemento hidrogénio na molécula de água.
b) Calcula a fração molar do elemento oxigénio na molécula de água.
18. Responde às seguintes questões.
O amoníaco é um gás incolor cuja fórmula química é NH3. Calcula:
a) a fração mássica do elemento nitrogénio na molécula de amoníaco.
b) a fração mássica do elemento hidrogénio na molécula de amoníaco.
4/6
Física e Química A
10.º ano
19. Responde à seguinte questão.
Calcula a massa de um átomo de prata, em gramas.
20. Responde à seguinte questão.
Uma garrafa de gás propano (C3H8) tem de massa 27 kg. A mesma garrafa vazia tem apenas
16 kg.
Calcula a quantidade de matéria de gás propano que a garrafa contém.
5/6
Física e Química A
Massa e tamanho dos átomos
10.º ano
Soluções
1. d)
2. átomos; iões; moléculas
3. C; B; D; A
4. 1 – B, C; 2 – D; 3 – A, E
5. a) F; b) F; c) V; d) V
6. 4,5 g
7. 0,1; 6,02×1023; 1,2×1023; 3,61×1023; 6,02×1022
8. a)
9. nanotecnologia; atómica; molecular; significativas; físicas; químicas
10. a) A massa atómica relativa do cloro é próxima do isótopo com maior abundância. Assim, o
isótopo mais abundante é o cloro-35.
b) Abundância relativa do cloro-35= 76%; Abundância relativa do cloro-37= 24%
11. a) F; b) V; c) F; d) F; e) V
12. 1 – C; 2 – A; 3 – B
13. átomos; 34; maior; 1/12 do átomo carbono-12
14. A; B; C
15. a) Ba(NO3)2
b) M(Ba(NO3)2) = 261,33 g mol-1
c) 130,67 g
d) 3,01 × 1023 iões
16. a) 0,75
b) 0,25
17. a) 0,67
b) 0,33
18. a) 0,82
b) 0,18
19. 1,79 × 10 -22 g
20. 249,4 mol
6/6