Aula 00
Química p/ Bombeiros-DF (Condutor e Operador de Viaturas) - Com videoaulas
Professor: Wagner Bertolini
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
AULA 00: Apresentação do curso
SUMÁRIO
PÁGINA
1. Saudação e Apresentação do professor
01
2. Breve apresentação do curso
02
3. Cronograma das Aulas
04
4. Modelos Atômicos
06
4.1. Introdução ao estudo dos modelos atômicos
07
4.2. Estudo inicial dos átomos
08
5. ATOMÍSITCA
14
6. ELEMENTO QUIMICO
28
7. CLASSIFICAÇÃO E PROPRIEDADES PERIÓDICAS
34
1.
Saudação e apresentação do professor
Olá meus novos amigos(as),
É com grande satisfação que apresento a vocês este curso de QUÍMICA,
projetado especialmente para atender às necessidades daqueles que se
preparam para o concurso de condutor e operador de viaturas
BOMBEIROS DO DF.
Agora que foi confirmada a ANULAÇÃO do concurso, muitos buscarão
00000000000
intensificar os estudos para este concurso.
Também teremos uma grande vantagem: vimos os temas e tipos de
questionamentos nas questões da banca.
A prova foi de nível surreal, com questões altamente específicas. Mencionei
nas resoluções das provas aplicadas de que haviam feito mer--. E acabaram
por tentar limpar este mer__ anulando o concurso.
Por via das dúvidas, os temas abordados que estavam em desacordo com
o material (devido ao alto grau de particularidades) terão aulas especiais,
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 1 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
que adicionarei com as resoluções das questões e direcionamento dos
assuntos ao que seria um complemento das aulas postadas.
Para tranquilizá-lo: se houver alguma modificação ou divergência de
conteúdos entre este curso e alterações que possam ocorrer no conteúdo
previsto no edital farei as devidas adequações.
As aulas já estão todas postadas. Então, você terá condições de fazer a sua
programação de estudos independente de qualquer fator, pois, não
dependerá mais de minhas postagens.
Permitam-me fazer uma breve apresentação de minha trajetória acadêmica
e profissional:
- Aprovado no concurso para Perito Criminal da PCSP, 2013.
-graduado pela Faculdade de Ciências Farmacêuticas pela USP-RP, em
1990;
- Mestre em síntese de complexos bioinorgânicos de Rutênio, com liberação
de óxido nítrico, pela Faculdade de Ciências Farmacêuticas USP-RP;
- Doutor em farmacotécnica, estudando o efeito de promotores de absorção
cutânea visando a terapia fotodinâmica para o câncer de pele, Faculdade
de Ciências Farmacêuticas pela USP-RP;
- Especialista em espectrometria de massas, pela Faculdade de Química,
USP-RP;
- professor de Química em ensino Médio e pré-vestibulares (Anglo,
00000000000
Objetivo, COC) desde 1992.
- professor de Química (Orgânica, Geral, Analítica, Físico-Química e
Inorgânica) em cursos de graduação;
- Professor de Química Farmacêutica, em curso de graduação em Farmácia;
- Professor de Pós-Graduação em Biotecnologia (controle de produtos e
processos biotecnológicos);
- Analista Químico em indústria farmacêutica, AKZO do Brasil, em São
Paulo-SP.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 2 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
- Consultor de pesquisa entre empresa-Universidade, em Ribeirão Preto,
onde resido atualmente.
2.
Breve apresentação do curso
A proposta do curso é facilitar o seu trabalho e reunir toda a teoria e
inúmeros exercícios, no que tange aos assuntos do Edital, em um só
material.
Nosso curso será completo (teoria detalhada com questões
comentadas) e com dezenas de questões resolvidas.
Ao mesmo tempo, não exigirá conhecimentos prévios. Portanto, se
você está iniciando seus estudos em QUÍMICA fique tranquilo, pois, nosso
curso atenderá aos seus anseios perfeitamente
Se você já estudou os temas, e apenas quer revisá-los, o curso também
será bastante útil, pela quantidade de exercícios que teremos e pelo rigor
no tratamento da matéria, o que lhe permitirá uma excelente revisão do
conteúdo.
A Aula Demonstrativa a apresentar a didática e a metodologia do
professor. Em suma: este curso trará toda matéria completa durante o seu
transcorrer.
Você encontrará vários comentários sobre o que é importante ou o
que não cai nas provas. Não se assuste. É só para direcionar seu
00000000000
tempo sobre os tópicos que realmente são importantes para não
perder tempo com “fagulhas”.
Serão disponibilizadas muitas questões durante as aulas, inclusive da banca
selecionada (prometo buscar tudo o que conseguir desta banca em
química, nos concursos mais recentes), dos concursos mais recentes
para este cargo e semelhantes, para que você se familiarize com o estilo
das perguntas. Isto é muito importante, pois, permite a você uma maior
segurança e tranquilidade no momento da prova.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 3 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
PRESTE
SEMPRE
MUITA
ATENÇÃO
QUANDO
APARECER
A
CORUJINHA.
AO LADO APARECE UMA DELAS. Estas corujinhas serão empregadas para
chamar a sua atenção para vários aspectos
dentro do nosso curso.
OLHO NELAS!!!!!
Esperamos contribuir muito para que você consiga alcançar seu objetivo (e
por sinal o objetivo de milhares de brasileiros) que á a aprovação em um
concurso público. Portanto, mãos à obra e muita atenção, dedicação e
sucesso!!!!
3. CRONOGRAMA DAS AULAS
Praticamente todo o curso já está com as aulas gravadas.
AULA
00
CONTEUDO
DATA
VIDEO
1 Classificação periódica dos elementos químicos. 1.1
15
17.1
Tabela Periódica: histórico e evolução. 1.2 Classificação
00000000000
FEV
17.2
dos elementos em metais, não metais, semimetais e
4.1
gases nobres. 1.3 Configuração eletrônica dos
elementos ao longo da Tabela. 1.4 Propriedades
4.2
periódicas e aperiódicas.
01
2 Radioatividade. 2.1 Natureza das emissões
radioativas. 2.2 Leis da radioatividade. 2.3 Cinética da
29
FEV
desintegração radioativa. 2.4 Fenômenos de fissão
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 4 de 66
00000000000 - DEMO
7
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
nuclear e fusão nuclear. 2.5 Riscos e aplicações das
reações nucleares.
02
3 Ligações químicas. 3.1 Ligações iônica, covalente e
metálica. 3.2 Ligações intra e intermoleculares.
03
4 Matéria e mudança de estado. 4.1 Sólidos, líquidos,
gases e outros estados da matéria (ideais e reais). 4.2
15
3; 3.3
MAR
30
MAR
9.1
9.2
Mudanças de estado e diagramas de fase. 4.3
Características e propriedades de gases, líquidos e
sólidos. 4.4 Ligações químicas nos sólidos, líquidos e
gases. 4.5 Métodos de separação de misturas.
04
5 Gases. 5.1 Teoria cinética. 5.2 Leis dos gases. 5.3
Densidade dos gases. 5.4 Difusão e efusão dos gases. 5.5
15
ABRIL
13.1;
13.2
Misturas gasosas.
05
6 Termoquímica. 6.1 Energia e calor. 6.2 Reações
exotérmicas e endotérmicas. 6.3 Entalpia, entropia e
30
12
ABRIL
energia livre. 6.4 Espontaneidade de uma reação. 6.5
Entalpias de formação e de combustão das substâncias.
6.6 Calor de reação em pressão constante e em volume
constante.
06
15
11
MAIO
11.1
8 Tecnologias associadas à química orgânica:
30
1.3
petroquímica, polímeros sintéticos, aditivos em
MAIO
7 Eletroquímica. 7.1 Potenciais de oxidação e
redução. 7.2 Espontaneidade de uma reação de
00000000000
oxirredução. 7.3 Pilhas e acumuladores. 7.4 Eletrólise.
7.5 Corrosão.
07
alimentos, agroquímica, drogas, medicamentos e
biotecnologia.
08
Simulado e possíveis complementos pós-edital
Prof. Wagner Luiz
05
www.estrategiaconcursos.com.br Página 5 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
JUN
As datas acima poderão ser antecipadas. Todas as aulas já estão
preparadas e todas elas com vídeo aulas.
Mas, as datas mencionadas estão garantidas, ou seja: serão postadas (na
pior das hipóteses) nestas datas.
Meu trabalho é feito com muita dedicação para você. É uma sensação muito
intensa para uma pessoa poder ajudar outra a mudar de vida, a ter um
melhor padrão, melhores condições financeiras para sua família e melhor
qualidade de vida.
Por isto dedico toda a atenção para suas dúvidas e críticas e elogios (que
se merecidos são muito gratificantes para quem tem amor pelo que faz).
Observação importante:
Este curso é protegido por direitos autorais (copyright), nos termos
da Lei 9.610/98, que altera, atualiza e consolida a legislação sobre
direitos autorais e dá outras providências.
Grupos de rateio e pirataria são clandestinos, violam a lei e
prejudicam os professores que elaboram os cursos. Valorize o
trabalho de nossa equipe adquirindo os cursos honestamente
através do site Estratégia Concursos ;-)
00000000000
Conte comigo para sanar suas dúvidas. Sempre busco atendê-lo de uma
forma bem tempestiva.
Sempre que você tiver alguma dúvida, ao recorrer ao fórum indique
a aula, página e número da questão, se for o caso.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 6 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
4.
ESTUDO DOS ÁTOMOS E DOS ELEMENTOS QUÍMICOS
Farei uma introdução com tópicos essenciais para que se possa ter uma
plena preparação. Nosso público é muito heterogêneo e creio que irá
auxiliar muitos candidatos.
Mas, se você já conhece todos estes tópicos que coloco como “extra’, pode
ir diretamente para o estudo da classificação periódica.
O assunto da aula é sobre a estrutura doa átomos e a classificação periódica
dos elementos químicos. Teremos conceitos iniciais sobre modelos
atômicos, átomos, partículas elementares, distribuição eletrônica, etc. Caso
você já tenha segurança nestes tópicos pode avançar e ir direto para o
assunto principal (Classificação e propriedades periódicas).
Aproveito para dizer o seguinte a vocês: estudem bem os fundamentos dos
tópicos básicos de cada assunto. Mas estudem pra não margem de erro
(daí a importância de se fazer muitos exercícios. Fazendo muitos você se
acostuma com as diversas maneiras de se abordar o mesmo assunto). Em
um concurso não passa quem acerta as questões fora da normalidade.
Entra quem não erra as questões básicas e acerta uma parte das mais
exigentes.
4.1. Modelos Atômicos
Modelo corpuscular da matéria
Em 1808, John Dalton a partir da ideia filosófica de átomo estabelecida por
00000000000
Leucipo e Demócrito, realizou experimentos fundamentados nas Leis
Ponderais, propôs uma Teoria Atômica, também conhecida como modelo
da bola de bilhar, a qual expressa, de um modo geral, o seguinte:
- O átomo é constituído de partículas esféricas, maciças, indestrutíveis e
indivisíveis.
- A combinação de átomos de elementos diferentes, numa proporção de
números inteiros, origina substâncias químicas diferentes.
- Numa transformação química, os átomos não são criados nem destruídos:
são simplesmente rearranjados, originando novas substâncias químicas.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 7 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
- Elementos químicos diferentes apresentam átomos com massas, formas
e tamanhos diferentes.
- Um conjunto de átomos com as mesmas massas, formas e tamanhos
apresenta as mesmas propriedades e constitui um elemento químico.
- Na época de Dalton haviam sido isolados apenas 36 elementos químicos
e ainda se utilizavam símbolos vindos da alquimia para representar tais
elementos. O próprio Dalton foi autor de uma destas simbologias.
Modelo atômico de Thomson: natureza elétrica da matéria e
existência do elétron. (“Pudim com passas”)
Já na Grécia antiga, os humanos já tinham percebido a propriedade de
certos materiais de atrair outros. Uma explicação razoável para esse
fenômeno é que toda matéria, no estado normal, contém partículas
elétricas que se neutralizam mutuamente; quando ocorre atrito, algumas
dessas partículas tendem a migrar de um corpo para outro, tornando-os
eletrizados. O estudo de descargas elétricas em gases (raios em uma
tempestade, por exemplo) também contribuiu para o melhor entendimento
da estrutura atômica.
Esses fatos levaram os cientistas a imaginar que esses “raios” seriam
formados por pequenas partículas denominadas elétrons. Por convenção,
a carga dessas partículas foi definida com negativa. Surgiu assim, pela
primeira vez, uma ideia que contrariava a hipótese de Dalton. Observando
o comportamento do gás após perder elétrons, observou-se que este
00000000000
apresentava carga positiva. Imaginou-se então a existência de uma
segunda partícula subatômica, o próton. Com isso, Thomson propôs um
novo modelo atômico, que explicasse os novos fenômenos observados. Ele
imaginou que o átomo seria composto por uma “pasta” de carga positiva
“recheada” com elétrons de carga.
O modelo atômico de Thomson explicava satisfatoriamente os seguintes
fenômenos:
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 8 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
- eletrização por atrito, entendendo-se que o atrito separava cargas
elétricas;
- corrente elétrica, vista como um fluxo de elétrons;
- formação de íons, negativos ou positivos, conforme tivessem excesso ou
falta de elétrons;
- descargas elétricas em gases, quando os elétrons são arrancados de seus
átomos.
Modelo atômico de Rutherford e núcleo atômico.
Rutherford realizou uma experiência que
veio
alterar
e
melhorar
profundamente a compreensão do átomo. Veja abaixo o aparato que ele
empregou em seu experimento:
00000000000
Os resultados evidenciaram três comportamentos diferentes:
1. A maior parte das partículas alfa consegue atravessar a lâmina de ouro
sem sofrer nenhum desvio. Esse fato indica que essas partículas não
encontram nenhum obstáculo pela frente e seguem seu percurso em linha
reta.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 9 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
2. Algumas partículas
conseguem atravessar a lâmina, porém sofrendo
um desvio muito forte em seu caminho. Esse fato mostra que essas
partículas encontravam algum obstáculo, porém não muito grande, quando
atravessavam os átomos da lâmina.
3. Pouquíssimas partículas alfa não conseguem atravessar a lâmina e
voltam para o mesmo lado de onde são lançadas. Esse fato evidencia que
essas partículas encontram um obstáculo irremovível ao colidirem em
algum ponto dos átomos da lâmina.
Rutherford observou que a maior parte das partículas ultrapassava a
lâmina de ouro, enquanto apenas uma pequena parte era desviada ou
rebatida. Como explicar isso? Ele se viu obrigado então, a admitir que
lâmina de ouro não era constituída de átomos maciços e justapostos
(“colados” uns nos outros) como pensaram Dalton e Thomson. Portanto, o
átomo deveria ser constituído de núcleos pequenos e positivos, distribuídos
em grandes espaços vazios:
00000000000
Isso explicaria o porquê de a maior parte das partículas ultrapassarem.
Entretanto, se o núcleo é positivo, como explicar o fato de a lâmina de ouro
ser eletricamente neutra?
Para completar seu modelo, Rutherford imaginou que girando ao redor do
núcleo estariam os elétrons, bem menores do que o núcleo, mas
contrabalanceado a carga e garantindo a neutralidade elétrica do átomo. O
espaço ocupado pelos elétrons é chamado de eletrosfera. Repare que o
átomo teria modelo semelhante ao do sistema solar. O núcleo representaria
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 10 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
o sol, e os elétrons representariam os planetas girando em órbitas ao redor
do sol:
Conclusões de RUTHERFORD
- O átomo não é maciço, apresentando mais espaço vazio do que
preenchido;
- A maior parte da massa do átomo se encontra em uma pequena
região central (núcleo) dotada de carga positiva, onde estão os prótons;
- Os elétrons estão localizados em uma região ao redor do núcleo,
chamada de eletrosfera.
- Esse modelo ficou conhecido como “modelo do sistema solar”, em que o
sol seria representado pelo núcleo e os planetas pelos elétrons ao redor
do núcleo (na eletrosfera)
Problemas com o Modelo
- De acordo com a teoria de Rutherford, os elétrons podiam orbitar o núcleo
a qualquer distância. Quando os elétrons circundam em volta do núcleo,
00000000000
estariam mudando constantemente sua direção. A eletrodinâmica clássica
(que trata do movimento dos elétrons) explica que, tais elétrons que
mudam constantemente sua direção, seu sentido, sua velocidade ou
ambos, devem continuamente emitir radiação. Ao fazer isto, perdem
energia e tendem à espiralar para o núcleo. Isto poderia ser o colapso do
átomo.
- Outra dúvida: se o núcleo é formado por partículas positivas, porque estas
não se repelem, desmoronando o núcleo?
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 11 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Alguns anos depois, foi descoberta a terceira partícula subatômica, o
nêutron. Este não teria carga elétrica e teria o mesmo peso e tamanho do
próton. De certa maneira, os nêutrons “isolam” os prótons, evitando suas
repulsões e mantendo o núcleo inteiro.
Modelo atômico de Bohr: aspectos qualitativos.
O modelo de Rutherford, apesar de explicar muitos fenômenos e
proporcionar um entendimento melhor do átomo, possuía deficiências.
Rutherford se viu obrigado a assumir que os elétrons giram em torno do
núcleo
pois,
caso
contrário,
estes
seriam
atraídos
pelo
núcleo,
desmontando-o. Entretanto, a assumir que os elétrons giravam, ele criou
outro paradoxo. A Física Clássica diz que toda partícula elétrica em
movimento (como o elétron) emite energia. Portanto, o elétron perderia
energia até se chocar com o núcleo.
O cientista dinamarquês Niels Bohr aprimorou o modelo atômico de
Rutherford utilizando a teoria de energia quantizada de Max Planck.
00000000000
Planck havia admitido a hipótese de que a energia não seria emitida de
forma contínua, mas em “pacotes”. A cada “pacote” de energia foi dado o
nome de quantum. Assim, surgiram os postulados de Bohr:
1- Os elétrons giram ao redor do núcleo em órbitas circulares (modelo
de
Rutherford),
porém
sem
emitir
energia
radiante
(estado
estacionário).
2- Um átomo emite energia sob a forma de luz somente quando um elétron
pula de um orbital de maior energia para um orbital de menor energia.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 12 de 66
00000000000 - DEMO
E
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
= h.f, a energia emitida é igual a diferença de energia dos dois orbitais
envolvidos no salto.
3- As órbitas possíveis são aquelas em que o elétron possui um momento
angular múltiplo inteiro de h/2 .
Ao “saltar” de uma órbita estacionária para outra, o elétron absorve ou
emite uma quantidade bem definida de energia, chamada quantum de
energia.
Aplicações do modelo de Bohr
Teste da chama;
Fogos de artifício;
Luminosos e lâmpadas (neônio e lâmpadas de vapor de Na ou Hg);
Fluorescência e Fosforescência;
Raio Laser;
Bioluminescência: a luz dos vaga-lumes;
MODELO ATÔMICO DE SOMMERFELD
00000000000
Os estudos sobre modelo atômico continuaram e foram obtidas novas
informações. Sommerfeld solucionou o problema surgido logo após Niels
Bohr enunciar seu modelo atômico, pois verificou-se que um elétron, numa
mesma camada, apresentava energias diferentes.
Tal fato não poderia ser possível se as órbitas fossem circulares. Então,
Sommerfeld sugeriu que as órbitas fossem elípticas, pois elipses
apresentam diferentes excentricidades, ou seja, distâncias diferentes do
centro, gerando energias diferentes para uma mesma camada eletrônica.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 13 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Para isto, Sommerfeld introduziu o número quântico secundário, que
define o formato da órbita do elétron.
Utilizando a Teoria da Relatividade Restrita, Sommerfeld foi capaz de
explicar o desdobramento da série clássica de Balmer relativa ao átomo de
Hidrogênio.
A série de Balmer corresponde às transições entre o nível 2 e os níveis
3,4,5...
NOVAS CONTRIBUIÇÕES PARA O ESTUDO DO ÁTOMO
Louis Victor De Broglie (1925): propõe que o elétron também
apresenta, tal como a luz, uma natureza dualística de onda e partícula
00000000000
(comportamento duplo), justificado mais tarde, em 1929, pela primeira
difração de um feixe de elétrons obtida pelos cientistas Davisson e Germer.
Werner Heisenberg (1927): demonstrou, matematicamente, que é
impossível determinar ao mesmo tempo, a posição, a velocidade e a
trajetória de uma partícula subatômica, sendo importante caracterizá-la
pela sua energia, já que não é possível estabelecer órbitas definidas. Este
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 14 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
enunciado recebeu a denominação de Princípio da Incerteza ou
Indeterminação de Heisenberg.
Erwin Schrödinger (1933): valendo-se do comportamento ondulatório
do elétron, estabeleceu complexas equações matemáticas que permitiam
determinar a energia e as regiões de probabilidade de encontrar os elétrons
(orbitais, e não órbitas definidas). Schrödinger recebe o Prêmio Nobel por
seu trabalho sobre Mecânica Quântica Ondulatória e suas aplicações à
estrutura atômica. Abandonava-se definitivamente o modelo planetário do
átomo de Rutherford-Bohr e surgia um novo modelo atômico, o modelo
mecânico-quântico do átomo.
Assim, segue um resumo das informações mais importantes para
trabalharmos com o estudo dos átomos:
- O átomo pode ser dividido;
- Como o átomo pode ser dividido, ele é, obviamente, composto por
partículas menores;
- As partículas básicas que compõem o átomo são os prótons, os neutros
e os elétrons. (Estas também podem ser divididas, mas isto não é
abordado neste nível). Estas são as chamadas partículas fundamentais;
- A maior parte da massa do átomo está no seu núcleo;
- Os elétrons não estão posicionados a uma distância qualquer do núcleo,
mas sim em regiões bem determinadas, chamadas de órbitas.
00000000000
- Os orbitais também são chamados de camadas, e as camadas são
denominadas pelos símbolos K, L, M, N, O, P e Q.
- Quanto mais afastada do núcleo é a órbita (camada) de um elétron, maior
é a sua energia;
- Quando um elétron pula de um orbital para outro ele deve emitir ou
absorver energia na forma de luz (um fóton).
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 15 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
5. ATOMÍSTICA
Prótons, nêutrons e elétrons. Número atômico e número de massa.
- Partículas fundamentais do átomo
Vários experimentos levaram os cientistas a suporem que o átomo é divisível,
sendo constituído de uma parte central, chamada de núcleo, existindo, ao
redor, os elétrons, que constituem a coroa ou eletrosfera.
Os elétrons são partículas dotadas de carga elétrica, que convencionamos
atribuir
o
valor
negativo.
No
núcleo
existem
os
prótons,
que
convencionamos atribuir o valor positivo, e os nêutrons, sem carga elétrica.
Essas três partículas são denominadas de partículas fundamentais, pois
todas devem estar presentes em um átomo neutro (única exceção é o
Hidrogênio comum, que não tem nêutron, mas tem um próton e um elétron).
Massas relativas das partículas fundamentais
As massas do próton e a do nêutron são praticamente iguais. A massa do
próton (e, consequentemente, a massa do nêutron) é cerca de 1840 vezes
maior que a massa do elétron. Portanto, podemos generalizar que a massa de
um átomo é a massa de seu núcleo, porque contém as partículas
fundamentais que são mais pesadas, pois, consideramos a massa do elétron
praticamente desprezível quando comparada à das demais partículas.
Dimensões do átomo e do núcleo
Através de experimentos realizados admitem-se os seguintes valores para os
diâmetros do átomo e do núcleo: o diâmetro do átomo é cerca de 10 000 vezes
00000000000
maior que o do núcleo. Como comparação, se o diâmetro do núcleo tivesse
1cm, o diâmetro da eletrosfera teria 100m.
Carga elétrica relativa das partículas fundamentais
Como as cargas elétricas das partículas fundamentais são muito pequenas,
criou-se uma escala relativa, tomando a carga do próton como unitária e
atribuindo-lhe o valor de 1 u.e.c., isto é, uma unidade elementar de carga
elétrica. Assim, os elétrons possuem carga elétrica negativa, de mesmo valor
absoluto que a dos prótons, e que se representa por -1 u.e.c. Quando o
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 16 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
átomo é neutro, concluímos que o número de elétrons é igual ao de prótons.
Há Z prótons, cuja carga total é +Ze, e Z elétrons, cuja carga total é -Ze. A
carga total do átomo é nula.
Os átomos podem se combinar e formar um conjunto denominado
molécula. Dependendo dos átomos envolvidos nestas combinações estas
moléculas serão classificadas em dois tipos de substâncias:
Resumindo, temos o seguinte:
Carga
Valor relativo Massa
elétrica
das cargas
relativa
Próton
Positiva
+1
1
Nêutron
Não existe
0
1
Elétron
Negativa
-1
1/1836
- Número atômico (Z) e massa atômica (A)
O número atômico geralmente é representado pela letra Z. O número atômico
de um átomo, por definição, é o número de prótons existentes no seu núcleo;
Z representa, portanto, a carga nuclear relativa e caracteriza cada tipo de
átomo.
Atualmente, o número atômico Z é colocado à esquerda (subescrito) do
00000000000
símbolo que identifica o átomo de dado elemento químico (convenção
internacional).
O átomo de magnésio (Mg) tem número atômico 12 (Z = 12).
Significado: no núcleo do átomo de Mg existem 12 prótons. No átomo neutro
de Mg existem 12 prótons e 12 elétrons.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 17 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Número de massa (A)
O número de massa (A) de um átomo é obtido fazendo-se a soma do número
de prótons e de nêutrons do núcleo desse átomo.
Representa-se geralmente pela letra A.
Assim, sendo N o número de nêutrons de um núcleo, é evidente que:
Observação: o número de massa somente pode apresentar valores
inteiros (pois, não temos partículas fracionárias para prótons e
nêutrons).
Exemplo:
Um átomo neutro de um certo elemento E tem 19 prótons e 21 nêutrons,
portanto:
Z = 19
N = 21
A = Z + N = 19 + 21 = 40
00000000000
Neste tópico é comum pessoas terem certa dificuldade porque pensam ser
necessário DECORAR as características das igualdades entre átomos. Mas, se
lembrar que ISO significa “igual”, “mesmo” e buscar a letra que indica próton,
massa e nêutron tudo fica muito mais fácil.
Exemplificando:
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 18 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
ISÓTOPOS
ISÓBAROS
ISÓTONOS
Mesmo nº de Prótons
mesmo nº de Massa mesmo
nº
de
Nêutrons
Além da parte conceitual é comum serem cobradas questões com
cálculos. Caso sejam exigidos cálculos entre átomos basta igualar o
que estes têm numericamente em comum, conforme será verificado
em questões futuras.
ISÓTOPOS
Os elementos químicos são identificados pelo número de prótons no núcleo.
Em alguns casos acontece de um mesmo elemento ter átomos com número
de nêutrons diferentes. Nestes casos são chamados de isótopos. Portanto,
isótopos são átomos que têm o mesmo número de prótons no núcleo, ou
seja, possuem o mesmo número atômico (pertencem ao mesmo elemento
químico) e diferem quanto ao número de nêutrons e de massa. Podemos citar
como exemplo o Hidrogênio, que possui três isótopos:
00000000000
Hidrogênio Comum ou Prótion – 1H
-formado por 1 próton, 1 elétron e 0 nêutron – É o isótopo mais abundante do
hidrogênio.
Deutério – 2H
- formado por 1 próton, 1 elétron e 1 nêutron – É muito utilizado na indústria
nuclear.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 19 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Trítio – 3H
- formado por 1 próton, 1 elétron e 2 nêutrons – Utilizado nas reações de
fusão nuclear.
Podemos observar que nos três isótopos do hidrogênio o número de prótons
é igual; diferem quanto ao número de nêutrons.
OBS: Somente os isótopos do Hidrogênio apresentam nomes “especiais”. Os
demais elementos têm seus isótopos diferenciados pelo número de massa
(EX: Cloro 35 ou Cloro 37).
Exemplos
ISÓBAROS
00000000000
Chamam-se isóbaros os elementos que têm mesmo número de massa.
Logo, estes átomos provavelmente não pertencem ao mesmo elemento
químico.
Exemplos
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 20 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Observe que ambos têm o mesmo número de massa (28), porém, são
representados por símbolos diferentes; apresentam números atômicos
diferentes (12 e 14) e também números de nêutrons diferentes (16 e 14).
ISÓTONOS
Chamam-se isótonos os elementos cujos átomos têm mesmo número de
nêutrons.
Observe que ambos têm diferentes números de massa (10 e 11); são
representados por símbolos diferentes (elementos diferentes), pois,
apresentam números atômicos diferentes (5 e 4). Entretanto os números de
nêutrons são iguais (6) (B= 11 – 5) (Be= 10 – 4).
Resumindo:
00000000000
Muitos isótopos não são estáveis, com o tempo o seu núcleo se decompõe.
Por exemplo, o núcleo do trítio se decompõe com o passar dos anos; nessa
decomposição ele emite uma radiação, portanto ele é radioativo. Esses
isótopos com núcleos não estáveis são importantes e têm várias aplicações:
Na determinação da idade de objetos pré-históricos, utiliza-se o isótopo do
carbono, o carbono-14. O tipo mais comum do carbono é o carbono-12. Como
no ar existe gás carbônico que tem o C-14 em quantidades muito pequenas,
as plantas absorvem esse gás na atmosfera, que é sempre o mesmo e, em
consequência, a concentração nas plantas também é a mesma. Quando a
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 21 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
planta morre e para de absorver o gás carbônico e o C-14, esse C-14 sofre
decomposição;
a
concentração
desse
isótopo
começa
a
diminuir
aproximadamente pela metade a cada 5.500 anos.
Medindo o quanto de C-14 ainda resta, pode-se determinar a idade de fósseis.
Esta técnica é aplicável à madeira, carbono, sedimentos orgânicos, ossos,
conchas marinhas, ou seja, todo material que conteve carbono em alguma de
suas formas. Como o exame se baseia na determinação de idade através da
quantidade de carbono-14 e que esta diminui com o passar do tempo, ele só
pode ser usado para datar amostras que tenham entre 50 mil e 70 mil anos de
idade.
Na Medicina, os isótopos radioativos são muito utilizados. Por exemplo, o
Cobalto-60, utilizado no tratamento do câncer; como esse isótopo emite
radiação de muita energia, ele penetra no corpo e mata as células doentes. O
problema é que, como são muito penetrantes, afetam também outras células
sadias, ocasionando a queda de cabelo, queimadura na pele e outros. Além
disso, são utilizados em radiologia diagnóstica, na utilização de feixes de raios
X que geram imagem numa chapa fotográfica, para que o médico possa ver
internamente o problema do paciente.
Em Biologia, é usado nas áreas de Genética – estudo das mutações
genéticas em insetos induzidos por radiação, botânica na localização e
transporte de moléculas nas plantas, entre outros.
ÍONS
00000000000
Como vimos anteriormente, um átomo é eletricamente neutro quando o
número de prótons é igual ao número de elétrons. Porém, um átomo pode
perder ou ganhar elétrons na eletrosfera, sem sofrer alteração no seu núcleo,
originando partículas carregadas positiva ou negativamente, denominadas
íons.
Se um átomo ganha elétrons, ele se torna um íon negativo, chamado ânion.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 22 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Se um átomo perde elétrons, ele se torna um íon positivo, chamado cátion.
As bancas adoram trabalhar com íons, pois, muitos candidatos erram a
determinação das partículas elementares. O aluno tem a tendência em
pensar que quando um íon tem carga positiva significa que ele ganhou
prótons. E acaba errando questões básicas. Basta você sempre pensar no
seguinte: NUNCA terá ganhou ou perda de próton na formação de íons.
Apenas, ganhou ou perda de ELÉTRONS.
Portantno, passo a você um esqueminha: p = e + c.
Onde:
p = quantidade de prótons
e = quantidade de elétrons
c = carga do íon.
Há uma outra possibilidade de igualdade que pode aparecer (e acho que é
bem legal você entender a importância desta igualdade para ligações
00000000000
químicas: espécies ISOELETRÔNicas.
Pelo destaque que dei ao nome da igualdade ficou fácil saber do que se
trata: são espécies que apresentam o mesmo número de elétrons.
Se um átomo A tem 9 elétrons e ganha um elétron ela passa a ter 10
elétrons e passa a ser representada como íon A-, certo?
Se um átomo B tem 11 elétrons e perde um elétron ele passa a ter 10
elétrons também e passa a ser representado pelo íon B+. Portanto, A- e B+
são espécies isoeletrônicas.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 23 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
QUESTÕES RESOLVIDAS
01. Os fogos de artifício propiciam espetáculos em diferentes eventos. Para
que esses dispositivos funcionem, precisam ter em sua composição uma
fonte de oxigênio, como o clorato de potássio (KClO3), combustíveis, como
o enxofre (S8) e o carbono (C), além de agentes de cor como o SrCl2 (cor
vermelha), o CuCl2 (cor verde esmeralda) e outros. Podem conter também
metais pirofóricos como Mg que, durante a combustão, emite intensa luz
branca, como a do flash de máquinas fotográficas.
a) Escreva as equações químicas, balanceadas, que representam:
— a decomposição do clorato de potássio, produzindo cloreto de potássio e
oxigênio diatômico;
— a combustão do enxofre;
— a combustão do magnésio.
b) Considerando o modelo atômico de Rutherford-Bohr, como se explica a
emissão de luz colorida pela detonação de fogos de artifício?
Gab:
a) Decomposição do clorato de potássio, produzindo cloreto de potássio e
oxigênio diatômico;
2KClO3(s) 2KCl(s) + 3O2(g)
A combustão do enxofre;
2S(s) + 3O2(g) 2SO3(g)
A combustão do magnésio;
00000000000
2Mg(s) + O2(g) 2MgO(s)
b) Durante o processo de queima, ocorre a excitação dos elétrons para
níveis mais externos que, de acordo com o modelo de Rutherford-Bohr,
possuem maior energia. Quando esses elétrons retornarem para níveis
mais internos, de menor energia, ocorrerá liberação de luz de cores
diferentes para elementos diferentes.
02. Dalton, na sua teoria atômica, propôs, entre outras hipóteses, que:
a) “os átomos são indivisíveis;
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 24 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
b) “os átomos de um determinado elemento são idênticos em massa”;
Á luz dos conhecimentos atuais, quais são as críticas que podem ser
formuladas a cada uma dessa hipóteses?
Gab:
a) não. Os átomos são considerados, atualmente, como partículas
divisíveis.
b) não. Os átomos de um mesmo elemento químico são idênticos em
número de prótons.
03. O sucesso do modelo atômico de Niels Bohr estava na explicação da
emissão de luz pelos átomos. A emissão de luz é provocada por uma
descarga elétrica através do gás sob investigação. Bohr desenvolveu um
modelo do átomo de Hidrogênio que lhe permitiu explicar esse fenômeno.
a) Descreva o modelo de Bohr.
b) Descreva o que ocorre, segundo o modelo do átomo de Bohr, com o
elétron do Hidrogênio quando submetido à descarga elétrica.
Gab:
a) No modelo atômico de Niels Bohr, existem elétrons circulando em órbitas
ao redor de um pequeno núcleo positivo de grande massa. É o famoso
"modelo atômico planetário" análogo ao sistema solar.
b) Submetido à descarga elétrica, o elétron passa para uma órbita mais
afastada do núcleo e mais energética. Ao retornar à órbita original, a
energia absorvida é emitida na forma de radiação eletromagnética.
00000000000
04. A fabricação de fogos de artifício requer um controle rigoroso das
variações do processo como, por exemplo, a proporção dos componentes
químicos utilizados e a temperatura de explosão. A temperatura necessária
para acionar os fogos de artifício de médio e grande porte é de cerca de
3600 ºC. É a geração desse calor que é responsável pela produção de ondas
luminosas, pois provoca a emissão atômica, ou seja, a emissão de luz que
ocorre quando o elétron sofre uma transição de um nível mais energético
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 25 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
para outro de menor energia. Considerando este assunto, responda aos
itens abaixo:
a) A qual modelo atômico esse fenômeno de emissão de luz está ligado?
b) Explique esse fenômeno de emissão de luz em termos de elétrons e
níveis de energia.
Gab:
a) Ao modelo de Böhr (Rutherford-Böhr).
b) Quando um elétron recebe energia sob a forma de quanta, ele salta para
um nível de maior conteúdo energético. Em seguida, ele retorna ao nível
de energia inicial emitindo, sob a forma de fótons, a energia absorvida
durante o salto quântico
05. Considerando-se um átomo que apresente número de massa igual ao
dobro do número atômico, é correto afirmar que
a) possui mais elétrons do que nêutrons.
b) possui a mesma quantidade de elétrons, nêutrons e prótons.
c) possui duas vezes mais prótons do que nêutrons.
d) possui duas vezes mais nêutrons do que prótons.
e) o número atômico é o dobro do número de nêutrons.
RESOLUÇÃO:
A = 2Z = Z + N
2Z – Z = N
Z=N
np = ne
00000000000
Resposta: B
06 - (UNIRIO RJ) Um átomo do elemento químico X perde 3 elétrons para
formar o cátion X3+ com 21 elétrons. O elemento químico X é isótopo do
elemento químico W que possui 32 nêutrons. Outro átomo do elemento
químico Y possui número de massa (A) igual a 55, sendo isóbaro do
elemento químico X. Com base nas informações fornecidas:
a)
determine o número de massa (A) e o número atômico (Z) do
elemento químico X;
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 26 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
b)
o número de massa (A) do elemento químico W.
Gab:
a)
A = 55; Z = 24
b)
56
07 - (UEG GO) Isótopos são átomos do mesmo elemento químico que
apresentam as mesmas propriedades químicas e diferentes propriedades
físicas. Para a caracterização de um átomo é necessário conhecer o seu
número atômico e o seu número de massa. Sobre esse assunto, considere
os elementos químicos hipotéticos
(a + 7)X
(3a)
e
(2a + 2)Y
(3a + 2).
Sabendo-se
que esses elementos são isótopos entre si, responda ao que se pede.
a)
Calcule a massa atômica e o número atômico para cada um dos
elementos químicos X e Y.
b)
Obtenha, em subníveis de energia, a distribuição eletrônica do íon
X2+.
c)
O íon X2+ deverá apresentar maior ou menor raio atômico do que o
elemento X? Explique.
Gab:
a)
massa atômica e número atômico de X.
Z = 12
A = 15
massa atômica e número atômico de Y.
Como X e Y são isótopos, então o número atômico de Y é igual a 12.
00000000000
A = 17
b)
Distribuição eletrônica do íon X2+
1s2 2s2 2p6
c)
O íon apresentará menor raio atômico em relação ao elemento X. Isso
porque, quando o átomo de determinado elemento perde elétrons, se
transformando em um íon positivo, a carga nuclear efetiva aumenta,
resultando na diminuição do raio atômico. Alia-se a isso, o fato do íon X2+
apresentar um menor número de camadas eletrônicas que o elemento X.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 27 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
08- (INATEL SP) São dados três átomos distintos A, B e C. O átomo A
tem número atômico 35 e número de massa 80. O átomo C tem 47
nêutrons, sendo isótopo de A. O átomo B é isóbaro de C e isótono de A.
Determine o número de prótons do átomo B.
Gab: 37
6. ELEMENTO QUÍMICO
Elemento químico é um conjunto de átomos de mesmo número atômico
(Z). Assim, o conjunto de todos os átomos de número atômico 11 (11
prótons) é o elemento químico sódio. Os químicos descobriram, até o
momento, 117 elementos químicos, dos quais 90 são naturais e o restante,
artificiais. Assim, o número atômico 11 define o elemento químico sódio.
Quando se fala no sódio, devemos pensar imediatamente no número atômico
11. Portanto, elemento químico é um conjunto de átomos de mesmo número
de prótons.
Simbologia
Cada elemento químico, natural ou sintetizado, é representado por um
símbolo que o identifica graficamente. Desde o tempo dos alquimistas os
elementos químicos conhecidos já eram representados por símbolos. Por
exemplo: o ouro era identificado pelo símbolo do Sol e a prata pelo símbolo da
00000000000
Lua.
Atualmente adota-se o método de J. J. Berzelius sugerido em 1811.
Os símbolos são adotados internacionalmente. Qualquer que seja a língua ou
alfabeto o símbolo é o mesmo. O símbolo é a letra inicial, maiúscula, do seu
nome
latino
seguida,
quando
necessário,
de
uma
segunda
letra
OBRIGATORIAMENTE minúscula.
Exemplos
- O átomo de Hidrogênio tem o núcleo constituído por um único próton. E
tem somente um elétron. Já os átomos do elemento Hélio (gás nobre, He)
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 28 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
apresentam dois prótons (Z=2) e dois elétrons. Observa-se que o Hélio
tem 2 nêutrons (e, portanto, neste caso número de massa A=4).
- O átomo de lítio tem o núcleo constituído por três prótons e quatro
nêutrons. Tem três elétrons.
- O átomo de neônio tem o núcleo constituído por dez prótons e nove
nêutrons. Tem dez elétrons.
Distribuição Eletrônica no Estado Fundamental
Camadas eletrônicas ou níveis de energia
00000000000
Para os elementos atuais, os elétrons estão distribuídos em sete camadas
eletrônicas (ou sete níveis de energia). As camadas são representadas
pelas letras K, L, M, N, O, P e Q ou 1º, 2º, 3º, 4º, 5º, 6º e 7º níveis de
energia. Até o momento, temos o seguinte número máximo de elétrons nas
camadas.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 29 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Subníveis de energia
Em cada camada, os elétrons estão distribuídos em subcamadas ou
subníveis de energia, representados pelas letras s, p, d e f (subníveis
usados até Z =114). O número máximo de elétrons que cabe em cada
subnível é o seguinte.
O número de subníveis conhecidos em cada camada é dado pela tabela a
seguir.
00000000000
Os elétrons preenchem sucessivamente os subníveis de energia em ordem
crescente de energia, com o número máximo de elétrons permitido em
cada subnível.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 30 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Como consequência da regra do Aufbau, somente o subnível de maior
energia preenchido poderá ter número de elétrons menor que o permitido,
ou seja, somente o subnível de maior energia preenchido poderá estar
incompleto.
A ordem de preenchimento é 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p
7s 5f 6d… A regra mnemônica a seguir ajuda bastante na compreensão do
princípio da construção, uma vez que não é muito prático desenhar o
diagrama acima cada vez que se deseja fazer a distribuição eletrônica de
um átomo. Veja abaixo o Diagrama de Linus Pauling:
Para escrever a configuração eletrônica de um elemento neutro, da forma
escrita acima, basta seguir o passo-a-passo:
a) Identificar o número total de elétrons
b) distribuir os elétrons nos subníveis de menos energia, de acordo com as
00000000000
suas respectivas capacidades máximas, até chegar à distribuição de todos
os elétrons.
c) SEMPRE seguir a ordem energética, determinada pelas diagonais do
Diagrama de Linus Pauling.
d) Lembrar também que os subníveis energéticos comportam um número
máximo de elétrons (s², p6, d10, f14).
Exemplo: Configuração do
19K
a) Número total de elétrons: 19
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 31 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Como devemos proceder?
Devemos saber que a ordem de preenchimento deve seguir a ordem
energética.
Subníveis em ordem energética: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d
6p 7s 5f 6d.
Vamos começar? Pense que cada elétron eu representei pelo esquema
abaixo:
Temos dentro deste box 19 bolinhas que representam os 19 elétrons. Cada
subnível será representado por diferentes cores e tamanhos, em função
dos diferentes valores de elétrons que cada um comporta. Veja abaixo o
box com 19 elétrons.
O primeiro subnível a receber elétrons é o s da primeira camada. Logo, o
1s só pode receber 2 elétrons. Como temos 19 eletrons não cabem todos
dentro deste subnível. O que farei? Deixo sempre o valor máximo e os
elétrons que faltarem passo para o subnível seguinte. Ao lado mostrarei o
box com os eletrons a serem ainda distribuídos.
00000000000
Veja que temos mais elétrons dentro do box e continuaremos a distribuílos.
Agora, o próximo subnível de energia será o 2s. Sabemos que este
comporta apenas dois elétrons, no máximo. Portanto, vou deixar 2 elétrons
neste subnível.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 32 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
O próximo subnível de energia será o 2p. Sabemos que este comporta
apenas seis elétrons, no máximo. Portanto, vou deixar 6 elétrons neste
subnível.
O próximo subnível de energia será o 3s. Sabemos que este comporta
apenas dois elétrons, no máximo. Portanto, vou deixar 2 elétrons neste
subnível.
O próximo subnível de energia será o 2p. Sabemos que este comporta
apenas seis elétrons, no máximo. Portanto, vou deixar 6 elétrons neste
subnível.
00000000000
Veja que agora só temos dentro do box um único elétron. Este será
distribuído no próximo subnível. O próximo subnível de energia será o 4s.
Sabemos que este comporta apenas dois elétrons, no máximo. Como só
temos um eletron, deixaremos este cara dentro deste subnível.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 33 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Terminamos, assim, a distribuição dos eletrons do potássio, em ordem
crescente de energia. Vamos usar a representação que usamos na Química
para representar os subniveis e as quantidades de energia que cada um
apresenta: 1s² 2s² 2p6 3s2 3p6 4s1. Os valores que estão acima das letras
corresponde a quantos eletrons foram colocados dentro de cada subnível.
Repare que se somarmos o número de elétrons em cada orbital, teremos o
número total (2+2+6+2+6+1=19).
Uma observação importante: quando o elemento químico tem até 20
elétrons não ocorre a mistura de camadas entre os subníveis. Porém,
elementos acima de 20 elétrons apresentarão esta mistura. Daí, surgirão
dois termos que você deve saber distinguir bem: subnível mais energético
e subnível mais externo.
O subnível mais energético é o que finaliza a distribuição eletrônica,
sempre.
Para os elementos que terminarem a distribuição eletrônica em subnível
s ou p o subnível mais energético também será o mais externo.
Porém, cuidado com os elementos que terminarem a distribuição em
subnível d ou f. Nestes casos, o subnível mais energético NÃO é o
subnível mais externo.
Vejamos uma distribuição para o elemento de número atômico 21.
00000000000
A distribuição fica assim:
1s² 2s² 2p6 3s2 3p6 4s2 3d1
Veja que a quarta camada foi atingida e aparece internamente na
distribuição.
Para átomos eletricamente carregados (íons) basta escrever a configuração
como se o átomo fosse neutro e ao final, retirar/colocar a quantidade de
elétrons do subnível mais externo e não no mais energético.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 34 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Depois que você fizer a distribuição por subnível em ordem crescente de
energia pode-se “ajustar, organizar” a distribuição obtida de acordo com
as camadas eletrônicas, chamada de ordem geométrica. Mas, cuidado:
não será feita nova distribuição, apenas um ajuste.
Distribuição eletrônica em íons
Para os íons faça a distribuição eletrônica do átomo neutro e adicione (no
caso de anions) ou retire os elétrons da camada mais externa (no caso
dos cátions)
Vou fazer um exemplo para você observar. Para o caso de cátions a chance
de erro é maior. Não se deixe levar por ser afoito. Veja, um exemplo para
o cátion
26Fe
2+.
A distribuição normal ficaria assim, para o átomo de Ferro neutro:
1s² 2s² 2p6 3s2 3p6 4s2 3d6
Para o cátion
26Fe
2+
teremos que retirar dois elétrons mais externos.
1s² 2s² 2p6 3s2 3p6 3d6
Viram que retirei os eletrons mais externo (quarta camada) e não os “de
fora”, ou seja: o que termina a distribuição, o subnível mais energético?
Para o cátion 26Fe3+ teremos que retirar três elétrons mais externos. Como
já havíamos chegadoaoresultado abaixo observe a resultado para o nosso
caso:
Fe = 1s² 2s² 2p6 3s2 3p6 4s2 3d6
Fe2+ = 1s² 2s² 2p6 3s2 3p6 3d6
00000000000
Fe2+
= 1s² 2s²
2p6
3s2
3p6
3d5
Exceções ao diagrama de Linus Pauling
Todos os elementos obedecem ao Diagrama de Linus Pauling?
Vou dizer que sim. Mas, que existem algumas exceções (que vou chamar
de ajustes a serem feitos).
Quando um elemento tiver a sua distribuição eletrônica terminando em d4
ou d9 precisamos fazer uma simples alteração.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 35 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Observe que nestes casos teremos internamente o subnível da camada
mais externa, sendo (sempre um subnível s2. Então, ficaremos com as
seguintes distribuições corrigidas:
Vamos ver para o caso de elemento que termine em d4 e isto serve para
qualquer elemento que termine assim. Vou usar o
24X.
A distribuição normal ficaria assim:
1s² 2s² 2p6 3s2 3p6 4s2 3d4
Após a correção ficaria assim:
1s² 2s² 2p6 3s2 3p6 4s1 3d5
Vamos ver para o caso de elemento que termine em d9 e isto serve para
qualquer elemento que termine assim. Vou usar o
29X.
A distribuição normal ficaria assim:
1s² 2s² 2p6 3s2 3p6 4s2 3d9
Após a correção ficaria assim:
1s² 2s² 2p6 3s2 3p6 4s1 3d10
Atualmente, utiliza-se um código para estas representações eletrônicas,
principalmente para os elementos com muitos elétrons. Observe o
exemplo: Configuração do fósforo (P), de Z = 15
Representação completa = 1s2 2s2 2p6 3s2 3p3
Representação codificada = [Ne] 3s2 3p3
00000000000
O Código [Ne] indica uma configuração igual do gás nobre neônio (Z =
10): 1s2 2s2 2p6. Assim, a representação codificada significa que o fósforo
tem uma configuração eletrônica semelhante a do neônio, acrescida de 3s2
3p3 no último nível
Questões
01. O íon Sc3+ tem l8 elétrons e é isoeletrônico do íon X3-. Qual a estrutura
eletrônica do átomo de escândio?
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 36 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
a) 1s2 2s2 2p6 3s2 3p6 4s2 3d1
02. 05. (PROFESSOR DE QUÍMICA - PM TAIAÇU – INSITUTO
SOLER/2013). Na mitologia grega havia um rei, Midas, o qual era
capaz de transformar tudo em que tocava em ouro (Au). Talvez,
acreditando nessa lenda, muitos alquimistas tentaram em vão
transformar metais comuns como ferro (26 Fe) e chumbo (82 Pb)
em ouro. Assinale a alternativa que representa a distribuição
eletrônica correta para o átomo de ferro.
a) 1s2 2s2 2p6 3s2 3p6 3d8.
b) 1s2 2s2 2p6 3s2 3p6 3d10 4s2.
c) 1s2 2s2 2p6 3s2 3p6 4s2 3d6.
d) 1s2 2s2 2p6 3s2 3p6 3d8 4s2.
RESOLUÇÃO:
A distribuição eletrônica deve seguir a ordem crescente de energia em
subníveis, de acordo com o diagrama de Linus Pauling. Seria 1s2 2s2 2p6
3s2 3p6 4s2 3d6
Resposta: “C”.
7. CLASSIFICAÇÃO PERIÓDICA DOS ELEMENTOS QUÍMICOS
00000000000
Primeiramente gostaria de dizer a vocês que várias tentativas foram feitas
para se classificar os elementos químicos conhecidos em suas diferentes
épocas. Todas elas foram baseadas na massa crescente dos elementos
químicos. A atual é baseada no número de prótons crescente.
Em 1869, Mendeleyev apresentou uma classificação, que é a base da
classificação periódica moderna, colocando os elementos em ordem
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 37 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
crescente de suas massas atômicas, distribuídos em oito faixas horizontais
(períodos) e doze colunas verticais (famílias). Verificou que as propriedades
variavam periodicamente à medida que aumentava a massa atômica.
Na tabela periódica moderna, os elementos são colocados em ordem
crescente de número atômico. Podemos dizer que Mendeleyev estabeleceu
a chamada lei da periodicidade:
“Muitas
propriedades
físicas
e
químicas
dos
elementos
variam
periodicamente na sequência de suas massas atômicas”.
Classificação Periódica Moderna
A Classificação Periódica atual, além de incluir elementos descobertos
depois de Mendeleyev, apresenta os elementos químicos dispostos em
ordem crescente de números atômicos. Henry G. J. Moseley introduziu o
conceito de número atômico (número de prótons no núcleo do átomo).
00000000000
A lei da periodicidade ganhou um novo enunciado:
“Muitas
propriedades
físicas
e
químicas
dos
elementos
periodicamente na sequência de seus números atômicos”.
Os períodos
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 38 de 66
00000000000 - DEMO
variam
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
As linhas horizontais são chamadas de períodos e reúnem elementos de
propriedades diferentes. Átomos de elementos de um mesmo período têm
o mesmo número de níveis eletrônicos. Ao todo, são 7 períodos.
O número do período indica o número de níveis eletrônicos em seu
estado fundamental.
As famílias ou grupos
As colunas são chamadas famílias ou grupos e reúnem elementos
semelhantes. Temos 18 famílias ou 18 grupos.
Alguns desses grupos recebem nomes especiais:
Grupo 1 - Metais Alcalinos
Grupo 2 - Metais Alcalinos Terrosos
Grupo 16 - Calcogênios
Grupo 17 - Halogênios
Grupo 18 - Gases Nobres
É ainda importante considerar os seguintes aspectos:
00000000000
- O Hidrogênio, embora apareça na coluna 1A, não é um metal alcalino.
Aliás, o Hidrogênio é tão diferente de todos os demais elementos químicos
que, em algumas classificações, prefere-se colocá-lo fora da Tabela
Periódica.
- Quando a família não tem nome especial, é costume chamá-la pelo nome
do primeiro elemento que nela aparece; por exemplo, os da coluna 5A são
chamados de elementos da família ou do grupo do nitrogênio.
Elementos Representativos
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 39 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Elementos representativos são os elementos localizados nos grupos 1, 2,
13, 14, 15, 16, 17 e 18. São, portanto, oito as famílias de elementos
representativos, entre os quais se encontram alguns metais, todos os nãometais e todos os gases nobres (ou gases raros). Um dado interessante,
como vimos a pouco, válido para todos os elementos representativos, está
no fato de a última camada dos seus átomos possuir um número de elétrons
igual à unidade do número que designa a família a que eles pertencem.
Então, a última camada dos átomos dos elementos da família 15 possui 5
elétrons, da família 14, 4 elétrons, e assim por diante.
- As colunas A são as mais importantes da tabela. Seus elementos são
denominados elementos típicos, ou característicos, ou representativos da
Classificação Periódica. Em cada coluna A a semelhança de propriedades
químicas entre os elementos é máxima.
Elementos de Transição
Os elementos de transição são os pertencentes aos grupos de 3 a 12. Todos
eles são metais. Os metais que constituem os elementos de transição são
classificados em elementos de transição externa e elementos de transição
interna.
Os elementos de transição interna pertencem ao grupo 3 e dividem-se em
dois grupos:
00000000000
a) Lantanídeos – são os elementos de número atômico de 57 a 71 e
situam-se no sexto período;
b) Actinídeos – são os elementos de número atômico de 89 a 103 e situamse no sétimo período
Como são 15 lantanídeos e 15 actinídeos, eles são desdobrados em duas
séries, colocadas logo abaixo da tabela. Os actinídeos, são todos
radioativos, sendo que os de números atômicos de 93 a 103 são todos
artificiais, isto é, obtidos em laboratório, não sendo encontrados na
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 40 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
natureza. Os elementos de número atômico 93 (Netúnio) e 94 (Plutônio)
são também produzidos artificialmente, mas já foram encontrados, embora
em pequena quantidade, na natureza.
Todos os outros elementos de transição, não pertencentes aos lantanídeos
e actinídeos, são elementos de transição externa ou simples.
- Note que, em particular, a coluna 8B é uma coluna tripla.
Classificação dos elementos
Metais
Apresentam-se como bons condutores de calor e de eletricidade, alta
condutividade elétrica e térmica; em geral são densos, têm a propriedade
de refletir a luz, manifestando brilho típico (brilho metálico); apresentam
altos pontos de fusão e ebulição; apresentam ductibilidade (que é a
propriedade de serem facilmente em fios), maleabilidade (que é a
propriedade de serem transformados em lâminas); perdem facilmente
elétrons dando origem a íons positivos (cátions); poucos elétrons na
00000000000
última camada (menos de 4); À exceção do mercúrio, todos os metais são
sólidos a temperatura ambiente de 25º e 1 atm.
Não-Metais: apresentam propriedades opostas às dos metais. São os
mais abundantes na natureza e, ao contrário dos metais, não são bons
condutores de calor e eletricidade, não são maleáveis e dúcteis e não
possuem brilho como os metais (em geral, são opacos). Têm tendência a
ganhar
elétrons,
transformando-se
em
íons
negativos
(ânions).
Apresentam, via de regra, muitos elétrons (mais de 4) na última camada
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 41 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Os semimetais têm propriedades intermediárias entre os metais e os nãometais. Os gases nobres, ou gases raros, têm comportamento químico
específico.
Hidrogênio: o Hidrogênio é considerado um grupo à parte, pois é um
elementos químico com propriedades diferentes de todos os outros. Ele é
inodoro, incolor, combustível e o elemento químico menos denso
conhecido. Possui a propriedade de se combinar com metais e não-metais.
Nas condições
ambientes, é um gás extremamente inflamável. É
empregado como combustível em foguetes espaciais.
Configuração
eletrônica
dos
elementos
ao
longo
da
Tabela
Periódica
Podemos relacionar a distribuição do diagrama de Pauling à tabela
periódica.
Caminhando horizontalmente ao longo dos sete períodos da Tabela, ao
passarmos de uma “casa” para a seguinte, o número atômico aumenta de
uma unidade. Esse acréscimo indica que a eletrosfera está recebendo um
novo elétron. Desse modo, teremos as distribuições eletrônicas ao longo
dos dois primeiros períodos da Tabela Periódica, de acordo com o seguinte
quadro:
00000000000
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 42 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Gostaria que você observasse muito bem a posição dos elementos químicos
e o tipo de subnível que termina a distribuição eletrônica e a localização
destes subníveis na Tabela Periódica.
É muito importante notar que:
- Os 7 períodos da Tabela Periódica correspondem às 7 camadas ou níveis
eletrônicos dos átomos. Desse modo, exemplificando, o ferro (Fe-26) está
no 4º período, e por isso já sabemos que seu átomo possui 4 camadas
00000000000
eletrônicas (K, L, M, N).
- Nas colunas A, o número de elétrons na última camada eletrônica é igual
ao próprio número da coluna. Por exemplo, o nitrogênio está na coluna 5A
e, portanto, sua última camada eletrônica tem 5 elétrons (s2 p3). É por esse
motivo que os elementos de uma mesma coluna A têm propriedades
químicas muito semelhantes, o que justifica o fato de tais elementos (em
azul ou em verde, na tabela anterior) serem chamados de elementos
típicos, característicos ou representativos da Classificação Periódica.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 43 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
- Devemos, porém, avisar que, nas colunas B, aparecem algumas
irregularidades na distribuição eletrônica dos elementos, cuja explicação
foge ao objetivo do nosso curso.
- Há um modo abreviado de representar a distribuição eletrônica de um
elemento químico: seguindo a Tabela Periódica escrevemos o símbolo do
último gás nobre que aparece antes do elemento (isto é, do gás nobre do
período “de cima”); em seguida, representamos apenas os elétrons que o
elemento tiver a mais em relação a esse gás nobre.
Símbolos de elementos mais comuns.
Nos itens anteriores trabalhamos com alguns símbolos de elementos
químicos mais comuns. Mas, o que recomendo a você é que dê uma olhada
nos símbolos e observe que alguns são bem diferentes do seu nome em
português (porque derivam do latim). Mas não se preocupe em decorá-los,
pois, a fixação destes símbolos deve vir com a leitura e exemplos aqui
abordados.
ATUALIZAÇÃO DA CLASSIFICAÇÃO PERIÓDICA EM 2016
00000000000
O sétimo período da tabela foi preenchido completamente com os novos
elementos químicos formalmente nomeados e reconhecidos pela IUPAC
agora em meados de 2016 (janeiro de 2016).
Os novos elementos (Z = 113 a 118), bem como os nomes e os símbolos
oficiais de dois deles:
Fl (fleróvio, Z = 114)
Lv (livermório, Z = 116).
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 44 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
00000000000
Caberá à equipe japonesa a nomenclatura do elemento numero 113.
Como curiosidade, este é o primeiro elemento químico descoberto pela
nação japonesa.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 45 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
PROPRIEDADES DOS ELEMENTOS QUÍMICOS
Analisando as propriedades físicas e químicas das substâncias simples e de
seus elementos, verifica-se que estas podem estar relacionadas com a
posição dos elementos na tabela periódica. A variação dessas propriedades
em função do número atômico pode ser aperiódica ou periódica.
Propriedades aperiódicas
São aquelas cujo valor aumenta ou diminui em função do número
00000000000
atômico. Colocado os valores de uma propriedade aperiódica num gráfico,
obtemos
uma
curva crescente
ou decrescente. São
exemplos
de
propriedades aperiódicas: número de nêutrons (que aumenta com o Z),
número de massa (que aumenta com o Z), massa atômica (que aumenta
com o Z) e calor específico.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 46 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Propriedades periódicas
Quando observamos uma propriedade periódica pode verificar que a
intervalos mais ou menos regulares os valores da propriedade citada são
semelhantes, à medida que o Z aumenta.
Colocando os valores de uma propriedade periódica num gráfico, obtemos
uma curva com máximos e mínimos. Verifica-se que elementos de um
mesmo grupo ficam em posições correspondentes na curva.
São exemplos de propriedades periódicas: raio atômico, densidade, ponto
de fusão e ebulição, energia (potencial) de ionização, afinidade eletrônica,
eletropositividade, eletronegatividade e volume atômico
Vejamos as principais propriedades periódicas:
Raio atômico – O raio de um átomo é uma propriedade difícil de ser
determinada, pois a eletrosfera de um átomo não tem fronteira definida. O
raio atômico de um elemento depende de dois fatores:
00000000000
a) Número de níveis eletrônicos (camadas): numa família, quanto maior o
número atômico, maior é o raio atômico.
b) Carga nuclear (número atômico): num período, quanto maior o número
atômico, menor é o raio atômico.
O raio atômico pode ser considerado como uma medida do tamanho do
átomo. É difícil medir o raio de um átomo, pois a “nuvem de elétrons” que
o circunda não tem limites bem definidos. Costuma-se então medir, com o
auxílio de raios-X, a distância d entre dois núcleos vizinhos e dizer que o
raio atômico r é a metade dessa distância.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 47 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Resumindo: o raio atômico representa a distância do núcleo à camada de
valência do átomo.
Ânion: tem raio maior que seu átomo correspondente.
Cátion: tem raio menor que seu átomo correspondente.
Vejamos alguns valores para os elementos representativos
00000000000
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 48 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Raio Iônico - Para íons isoeletrônicos (iguais números de elétrons), o de
menor número atômico será o maior, pois apresenta menor atração entre
o núcleo e os elétrons.
28O
> 9F1- >
1+
11Na
>
2+
12Mg
Potencial de ionização – É a energia necessária para remover um elétron
de um átomo isolado no estado gasoso. À medida que aumenta o tamanho
do átomo, aumenta a facilidade para a remoção de um elétron de valência.
Portanto, quanto maior o tamanho do átomo, menor o potencial de
ionização.
00000000000
Essa energia é, em geral, expressa em elétron-volt (eV), que é a energia
ou trabalho necessário para deslocar um elétron contra uma diferença de
potencial de 1 volt
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 49 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Li(g)
Li+(g) + 1e-
1ºPI = 124kcal/mol
Li+(g)
Li++(g) + 1e-
2.ºPI = 1744kcal/mol
Li++(g)
Li+++(g) + 1e- 3.ºPI = 2823kcal/mol
Resumindo:
1.º PI < 2.º PI < 3.º PI <...
Afinidade eletrônica ou eletroafinidade
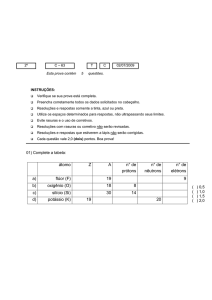
Se para afastar um elétron de um átomo é necessário fornecer energia,
para adicionar um elétron a um átomo neutro é necessário retirar-lhe
energia. Quando se adiciona um elétron a um átomo neutro, isolado
(individualizado), no estado gasoso e no mais baixo estado energético
(estado fundamental), ocorre liberação de uma certa quantidade de
energia. A essa energia dá-se o nome de Afinidade Eletrônica.
Em outras palavras, chama-se eletroafinidade ou afinidade eletrônica a
energia liberada quando um elétron é adicionado a um átomo neutro no
estado gasoso. Essa energia é também expressa, em geral, em elétronvolt (eV) e mede a intensidade com que o átomo “segura” esse elétron
adicional.
00000000000
Eletronegatividade (caráter não-metálico) – É a propriedade pela qual
o átomo apresenta maior tendência a ganhar elétrons. Esta propriedade
depende de dois fatores: número de elétrons na última camada e tamanho
do átomo.
É uma característica típica da maioria dos ametais.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 50 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
O cientista Linus Pauling propôs uma escala de valores para a
eletronegatividade, que, basicamente podemos listar abaixo os principais
elementos e suas eletronegatividades crescentes:
F O N Cl Br I S C P metais
Eletronegatividade crescente
Eletropositividade (caráter metálico)
É a capacidade que um átomo apresenta de perder elétrons. É uma
característica típica da maioria dos metais.
00000000000
Densidade
A densidade indica a massa contida em uma unidade de volume, ou seja,
densidade absoluta (d) ou massa específica de um elemento é o quociente
entre sua massa (m) e seu volume (v). No caso de sólidos e líquidos,
costuma-se representá-la em g/cm3 ou g/mL.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 51 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Veja como varia a densidade em função do número atômico:
Ponto de fusão e ebulição
As temperaturas nas quais os elementos entram em fusão (temperatura
em que uma substância passa do estado sólido para o estado líquido) ou
em ebulição (temperatura em que uma substância passa do estado líquido
00000000000
para o estado gasoso) são, também, funções periódicas de seus números
atômicos.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 52 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
A variação periódica do ponto de fusão e ebulição é a seguinte: nos
períodos, os PF e PE são máximos no centro, diminuindo em
direção às extremidades; nas famílias, crescem com o número
atômico. OBS: Constituem exceção a família dos metais alcalinos e
alcalinos terrosos, que tem seus pontos de fusão e ebulição aumentados
com a diminuição do número atômico.
00000000000
QUESTÕES RESOLVIDAS
01. O correto uso da tabela periódica permite determinar os elementos
químicos a partir de algumas de suas características. Recorra a tabela
periódica e determine:
a) O elemento que tem distribuição eletrônica s2p4 no nível mais energético,
é o mais eletronegativo de seu grupo e forma, com os metais alcalinos
terrosos, compostos do tipo XY.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 53 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
b) O número atômico do elemento que perde dois elétrons ao formar ligação
iônica e está localizado no 3º período da tabela periódica.
Gab:
a) Oxigênio
b) Nº Atômico 12
02. O íon Sc3+ tem l8 elétrons e é isoeletrônico do íon X3-. Pergunta-se:
a)qual a estrutura eletrônica do átomo de escândio?
b)a que número atômico, família e período da Classificação Periódica
pertence o elemento X?
Gab:
a) 1s2 2s2 2p6 3s2 3p6 4s2 3d1
b) 15, 5A, terceiro
03. Um elemento metálico X reage com cloro, dando um composto de
fórmula XCl. Um outro elemento Y, também metálico, reage com cloro
dando um composto de fórmula YCl2. As massas atômicas relativas de X e
Y são próximas.
a) em que grupo da Tabela Periódica estariam os elementos X e Y?
b) consulte a Tabela Periódica e dê o símbolo de dois elementos que
poderiam corresponder a X e Y.
Gab:
a) X: 1A; Y= 2A.
00000000000
b) Li e Be; Na e Mg; K e Ca etc.
04. Os elementos D, E, G e J têm números atômico, respectivamente, 7,
10, 11 e 15. Quais desses elementos são do mesmo período?
Gab:
D e E são do 2o período, enquanto que os elementos G e J são do 3o período.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 54 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
05. O diagrama de Pauling foi utilizado para ao obtenção das estruturas
eletrônicas dos elementos com números atômicos 53 e 87.
a) apresente as estruturas correspondentes a cada um dos elementos
indicados.
b) aponte, nas estruturas obtidas, detalhes estruturais que caracteriza as
famílias a que pertencem os elementos.
Gab:
a) Z=53:1s2 2s2 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p5
Z=87: 1s2 2s2 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s1
b) Z=53 – última camada: 5s25p5 (7 elétrons) – família 7A – halogênio;
Z=87 – última camada: 7s1 (1 elétrons) – família 1A – metal alcalino;
06. Sobre a posição de um determinado elemento químico na Tabela
Periódica sabe-se que:
I. Pertence a um dos dois períodos longos;
II.
Inicia a primeira série dos elementos de transição;
III.
O elemento químico que o precede é o cálcio.
Tomando como base essas informações, consulte a Tabela Periódica e
escreva o nome, o número atômico, a massa atômica e a configuração
eletrônica de um átomo e de um íon bivalente desse elemento químico.
Gab:
Nome: Escândio
Z:21
00000000000
MA: 45
Configuração do átomo: 1s22s22p63s23p64s23d1
Configuração do íon: 1s22s22p63s23p63d1
07.
O
livro
“A
Tabela
Periódica”,
de
Primo
Levi,
reúne
relatos
autobiográficos e contos que têm a química como denominador comum.
Cada um de seus 21 capítulos recebeu o nome de um dos seguintes
elementos da tabela periódica: Argônio, Hidrogênio, Zinco, Ferro, Potássio,
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 55 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Níquel, Chumbo, Mercúrio, Fósforo, Ouro, Cério, Cromo, Enxofre, Titânio,
Arsênio, Nitrogênio, Estanho, Urânio, Prata, Vanádio, Carbono.
Escreva o símbolo do elemento que dá nome a um capítulo e corresponde
a cada uma das seis descrições a seguir.
I – É metal alcalino.
II – É líquido na temperatura ambiente.
III – É o de menor potencial de ionização do grupo 15.
IV – É radioativo, usado em usinas nucleares.
V – Aparece na natureza na forma de gás monoatômico.
VI – É lantanídeo.
Gab:
I–K
II – Hg
III – As
IV – U
V – Ar
VI- Cério
08. Baseando-se nas configurações eletrônicas em ordem crescente de
energia dos elementos abaixo, assinale a alternativa correta.
A: 1s2, 2s2, 2p6, 3s2, 3p6, 4s2.
B: 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d2.
00000000000
C: 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p2.
D: 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p6, 6s2, 4f2.
a) A e C pertencem ao mesmo grupo, mas estão em períodos diferentes.
b) B é elemento de transição.
c) C e D estão no mesmo período da tabela periódica.
d) C está no grupo 2A (ou 2).
e) A, B, C, D são todos metais alcalino terrosos.
RESOLUÇÃO:
A
4 camadas
Prof. Wagner Luiz
4.º período
www.estrategiaconcursos.com.br Página 56 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Elemento representativo
Subgrupo A número do grupo = número de e–
Grupo IIA ou 2 de valência, ou seja, 2e–
Metal alcalinoterroso
B
Elemento de transição
Subgrupo B número do grupo: IIIB – IVB
Grupo: IVB ou 4 d1 d2
4.º período
C
4 camadas
Elemento representativo
4 camadas
4.º período número do grupo: 4s2 4p2 (4e–)
Subgrupo A
Grupo IVA ou 14
D
Elemento de transição interna
Grupo IIIB ou 3
6 camadas
6.º período
Resposta: B
QUESTÕES
01. (TÉCNICO(A) QUÍMICO(A) DE PETRÓLEO JÚNIOR - PETROBRÁS
-CESGRANRIO/2012). Para um mesmo período na Tabela Periódica,
os metais alcalinos, quando comparados com os metais alcalinos
terrosos, apresentam
00000000000
(A) maior dureza
(B) maiores pontos de fusão
(C) maiores pontos de ebulição
(D) menores energias de ionização
(E) menores raios iônicos
RESOLUÇÃO:
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 57 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
O assunto aborda propriedades periódicas. Quanto mais à esquerda e em
um mesmo período temos para os elementos maio raio atômico e menor
energia de ionização.
Resposta: “D”.
02. (TÉCNICO DE LABORATÓRIO – UNIPAMPA – CESPE/2013). Os
metais apresentam pequeno raio atômico, alto potencial de
ionização, baixa afinidade eletrônica e baixa eletronegatividade.
RESOLUÇÃO:
Os metais apresentam grande raio atômico, baixo potencial de ionização,
baixa afinidade eletrônica e baixa eletronegatividade.
Resposta: “ERRADO”.
03.
(PROFESSOR
I
DE
QUIMICA
–
CEPERJ/2013).
Estudos
relacionados ao azeite de oliva indicam que ele não é bom apenas
para a saúde do coração. É ainda fonte das vitaminas A, K e E, e
também dos elementos ferro, cálcio, magnésio, potássio. Portanto
o azeite faz bem para a pele, olhos, ossos e para o sistema
imunológico.
Relacionando as posições dos elementos citados na classificação
periódica com suas propriedades, é correto afirmar que:
A) o potássio possui o menor potencial de ionização
B) o cálcio e o magnésio pertencem ao mesmo período
00000000000
C) o cálcio possui o menor raio atômico
D) o ferro possui o maior raio atômico
E) o magnésio é o menos eletronegativo
RESOLUÇÃO:
Potássio é metal alcalino.
Magnésio e cálcio são metais alcalinos terrosos e não podem estar no
mesmo período.
Ferro é metal de transição.
O potencial de ionização é menor quanto mais à esquerda estiver o
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 58 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
elemento químico. Logo, será o potássio.
O raio atômico é maior quanto mais à esquerda e mais para baixo (maior
número de camadas) estiver o elemento químico.
Resposta: “A”.
04. (MINISTÉRIO DA AGRICULTURA – AUXILIAR DE LABORATÓRIO
– CONSULPLAN/2014). Qual desses elementos químicos é um
metal?
A) Flúor.
B) Cloro.
C) Sódio.
D) Oxigênio.
RESOLUÇÃO:
Assunto bastante discutido em ligações químicas e tabela periódica.
Questão fácil. Sódio. Os demais são ametais. Requer uma certa
memorização do candidato, mas, tais elementos muito frequentemente
aparecem em qualquer assunto na Química.
Resposta: “C”.
05.
(PROFESSOR
DE
QUÍMICA
-
PM
TAIAÇU
–
INSITUTO
SOLER/2013). Na mitologia grega havia um rei, Midas, o qual era
capaz de transformar tudo em que tocava em ouro (Au). Talvez,
acreditando nessa lenda, muitos alquimistas tentaram em vão
00000000000
transformar metais comuns como ferro (26 Fe) e chumbo (82 Pb)
em ouro. Assinale a alternativa que representa a distribuição
eletrônica correta para o átomo de ferro.
a) 1s2 2s2 2p6 3s2 3p6 3d8.
b) 1s2 2s2 2p6 3s2 3p6 3d10 4s2.
c) 1s2 2s2 2p6 3s2 3p6 4s2 3d6.
d) 1s2 2s2 2p6 3s2 3p6 3d8 4s2.
RESOLUÇÃO:
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 59 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
A distribuição eletrônica deve seguir a ordem crescente de energia em
subníveis, de acordo com o diagrama de Linus Pauling. Seria 1s2 2s2 2p6
3s2 3p6 4s2 3d6
Resposta: “C”.
06.
(PROFESSOR
DE
QUÍMICA
-
PM
TAIAÇU
–
INSITUTO
SOLER/2013) Marie Curie ganhou sozinha o prêmio Nobel de
Química pela descoberta dos elementos radioativos Rádio (88Ra) e
Polônio (84Po). Com base nessas informações pode-se afirmar
que
esses elementos se encontram na tabela periódica nos
seguintes períodos, respectivamente:
a) 6º e 6º.
b) 7º e 6º.
c) 6º e 7º.
d) 7º e 7º.
RESOLUÇÃO:
Para se determinar o período em que se localiza os elementos químicos
devemos fazer a distribuição eletrônica e observar qual foi o maior nível
energético atingido.
Portanto, teremos:
88Ra = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10
6p6 7s2 (atinge a sétima camada)
00000000000
84Po = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10
6p4 (atinge a sexta camada)
Resposta: “B”.
07. (TÉCNICO DE LABORATÓRIO – UFMG/2013). O alumínio é o
elemento metálico mais abundante da crosta terrestre. Seu peso
específico, condutividade elétrica, resistência à corrosão após
passivação e baixo ponto de fusão lhe conferem inúmeras
aplicações. No entanto, suas aplicações práticas apresentam-se
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 60 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
limitadas sobremaneira devido aos seguintes problemas listados
abaixo. EXCETO:
A) alto custo devido à grande quantidade de energia necessária
para o processo de produção.
B) implicações ecológicas negativas no rejeito dos subprodutos do
processo de produção
C) baixo custo do processo de coleta e tratamento de reciclagem
desse metal.
D) implicações ecológicas negativas no rejeito dos subprodutos do
processo de reciclagem.
RESOLUÇÃO:
O
alumínio
é
um dos metais mais reciclados e
a baixo
custo,
comparativamente ao seu elevado custo de produção (por eletrólise,
consumindo muita energia elétrica). Não sofre rejeição de uso pela
facilidade de coleta e reaproveitamento, mas pelos dejetos causados na
produção.
Resposta: “C”.
08.
(UFJF-MG
-
TÉCNICO
DE
LABORATÓRIO
–
2013
–
IFSULDEMINAS) A tabela, a seguir, refere-se à camada de valência
dos elementos A, B, C e D.
00000000000
De acordo com a tabela acima, é CORRETO afirmar que:
a) A e B pertencem à mesma família da tabela periódica.
b) C é metal alcalino-terroso.
c) A pertence à família dos calcogênios.
d) D possui o menor caráter metálico (eletropositividade).
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 61 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
e) A é mais denso que B, C e D.
RESOLUÇÃO:
Nenhum elemento tem terminação semelhante. Logo, não pertencem à
mesma família. O elemento A está na família 4A; B está na família 7ª
(halogêneos) e possui menor caráter metálico; C é metal alcalino (1A) e D
é metal alcalino terroso (2A). Por exclusão, chegamos à Resposta: E.
Resposta: “E”.
09.
(UFJF-MG
-
TÉCNICO
DE
LABORATÓRIO
–
2013
–
IFSULDEMINAS). Considere os elementos químicos A, B, C, D, E, F
com as seguintes posições, na tabela periódica:
De acordo com a tabela acima, marque a opção CORRETA que
contém os elementos com a maior eletronegatividade, a menor
energia de ionização e a maior densidade, respectivamente.
a) A, C, E
b) B, C, A
c) C, E, F
00000000000
d) D, B, F
e) B, E, F
RESOLUÇÃO:
De acordo com as variações das propriedades periódicas consideramos
que:
-O elemento mais eletronegativo está localizado mais acima e mais à
direita, excluindo gases nobres: C.
- O elemento menor energia de ionização é o que apresenta maior tamanho
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 62 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
atômico, ou seja, está localizado mais abaixo e mais à esquerda: B.
- O elemento maior densidade está localizado mais ao centro e mais abaixo:
F.
Sem alternativa correta. Gabarito aponta C. Não concordo, pois, gases
nobres (E) apresentam energia de ionização altíssima. Pode ter havido
anulação após recurso
Resposta: “C”.
10. Mendeleyev, observando a periodicidade de propriedades
macroscópicas dos elementos químicos e de alguns de seus
compostos, elaborou a Tabela periódica. O mesmo raciocínio pode
ser aplicado às propriedades microscópicas. Na tabela a seguir, dos
ralos iônicos, dos íons dos metais alcalinos e alcalinos-terrosos,
estão faltando os dados referentes ao Na+ e ao Sr2+. Baseando-se
nos valores da tabela, calcule, aproximadamente, os raios iônicos
desses cátions.
RAIOS IÔNICOS (pm)
Li+ 60 Be+ 31
Na+ __ Mg+ 65
K+ 133 Ca2+ 99
Rb+ 148 Sr2+ __
Cs+ 160 Ba2+ 135
00000000000
Sugestão: Devido à variação gradativa dos raios iônicos, na tabela dada
os que estão faltando são aproximadamente iguais à média aritmética dos
raios que os precedem e os sucedem na tabela.
RESOLUÇÃO:
Para o sódio, o raio atômico é aproximadamente 96 pm (real = 95 pm), e
para o estôncio, 117 pm (real = 113 pm).
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 63 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
11. Considere os íons isoeletrônicos; Li+, H-, B3+ e Be2+ (os números
atômicos; Li = 3; H = 1; B = 5; Be = 4). Coloque-os em ordem
crescente de raio iônico, justificando a resposta.
RESOLUÇÃO:
B3+ < Be2+ < Li+ < H-, pois mesmo número de elétrons (2) da camada K
estão sendo atraídos por cargas nucleares cada vez menores.
12. O gráfico abaixo relaciona os valores de eletronegatividade com
o número atômico para os elementos hipotéticos A, B e C.
Com base nessa tabela periódica, identifique o elemento A.
RESOLUÇÃO:
a) o elemento A é o oxigênio (número atômico 8 e eletronegatividade 3,5).
13. Considere a tabela abaixo, onde estão apresentados valores de
energia de ionização (E.I.).
Elemento Valores de E.I em kj.mol-1
1a 2a
11Na
491,5 4526,3
12Mg
731,6 1438,6
00000000000
Responda:
a)
Por que a 1ª E.I. do Na é menor do que a 1ª E.I. do Mg?
b)
Por que a 2ª E.I. do Na é maior do que a 2ª E.I. do Mg?
RESOLUÇÃO:
a) Do Na para o Mg, ocorre o aumento da carga nuclear, maior atração
nuclear pelos elétrons de valência, logo maior E.I.
b) O Na após a retirada de 1 elétron adquire a configuração eletrônica do
gás nobre Ne, portanto mais estável a espécie maior EI, para a retirada do
segundo elétron.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 64 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
14. Considerando os elementos químicos Be, B, F, Ca e Cs,
classifique-os em ordem crescente de acordo com as propriedades
periódicas indicadas:
a)
raio atômico;
b)
primeira energia de ionização.
RESOLUÇÃO:
a) Os elementos citados estão assim localizados na Tabela Periódica:
Be 2º período grupo 2 ou IIA
B 2º período grupo 13 ou IIIA
F 2º período grupo 17 ou VIIA
Ca 4º período grupo 2 ou IIA
Cs 6º período grupo 1 ou IA
Em um período, o raio atômico aumenta da direita para esquerda, devido
à diminuição da carga nuclear. Já nas famílias, o raio aumenta de cima para
baixo, pois aumenta o número de camadas eletrônicas. Logo:
9F
< 5B < 4Be <
20Ca
<
55Cs
b) Energia de ionização é a energia necessária para retirar 1 mol de elétrons
de um mol de átomos no estado gasoso. Na tabela periódica, a energia de
ionização aumenta de baixo para cima e da esquerda para direita. Porém,
podemos notar algumas inversões:
4Be:
1s2 2s2; 5B: 1s2 2s2 2p1
Como podemos observar, o elétron a ser arrancado do Be está ocupando
00000000000
um subnível completo, por isso é mais estável e tem menor energia do que
o elétron a ser retirado do subnível p do átomo de Boro. Logo, é necessária
uma quantidade maior de energia para ionizar o Be.
55Cs
<
20Ca
< 5B < 4Be < 9F
Então, meu caro concursando. Espero que você acredite e confie em
meu trabalho. Muitas dicas de como fazer as questões em menos
tempo; o que é muito importante, além de estudar; o que caiu nas
últimas provas e muitos exercícios para você treinar.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 65 de 66
00000000000 - DEMO
CONDUTOR BOMBEIROS DF
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
E, em caso de dúvida em algum assunto ou questão, estou sempre
à sua disposição e respondo sempre rapidamente a elas.
Aguardo você para as próximas aulas.
Sempre a seu dispor.
Prof. Wagner Bertolini
00000000000
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 66 de 66
00000000000 - DEMO