Lista de Exercícios
Aluno (a):_______________________________________Nº.____
Professor:
Disciplina:
Série: 3°
Data da prova:
FÍSICO QUÍMICA
01 - (UESPI) O sistema Ni(s) + 4CO(g ) →
← Ni(CO) 4 (g ) é um sistema químico dito em equilíbrio. O equilíbrio químico é
caracterizado por apresentar:
a) velocidade das reações direta e indireta igual a zero; e concentrações de reagentes e produtos iguais.
b) velocidade das reações direta e indireta igual a zero; e concentrações de reagentes e produtos constantes.
c) velocidade das reações direta e indireta igual a zero; e concentrações de reagentes e produtos variáveis.
d) velocidade da reação direta igual à da reação indireta; e concentrações de reagentes e produtos iguais.
e) velocidade da reação direta igual à da reação indireta; e concentrações de reagentes e produtos constantes.
02 - (Unioeste PR) Um equilíbrio químico e estabelecido quando
a)
b)
c)
d)
e)
uma reação química cessa.
somente a velocidade da reação de formação torna-se constante.
a concentração dos produtos e a dos reagentes permanecem constantes.
a concentração dos produtos e dos reagentes são iguais.
a temperatura torna-se constante.
03 - (PUC MG) A constante de equilíbrio de uma reação acontecendo numa solução aquosa numa determinada
temperatura e pressão é MODIFICADA quando:
a) um catalisador é adicionado.
b) a temperatura é alterada.
c) água é adicionada.
d) a solução é agitada.
04 - (UFAC) Uma reação atinge o equilíbrio químico:
I. Quando não há mais reagentes, somente produtos.
II. Quando as concentrações dos reagentes são iguais às concentrações dos produtos.
III. Quando a velocidade da reação direta é igual à velocidade da reação inversa.
IV. Quando as concentrações de reagentes e produtos tornam-se constantes.
V. Quando não existe mais reação química.
As afirmações corretas são:
a) I e II
b) II e III
c) III e IV
d) IV e V
e) III e V
05 - (UNIRIO RJ) "O conceito de equilíbrio é fundamental na química, mas não é exclusivo da química. Vivemos em
uma situação social e econômica que constitui equilíbrio dinâmico de forças competitivas. Na família e nos grupos
sociais, comportamo-nos de maneira a manter as relações mais cordiais possíveis. Na realidade, procuramos atingir
um equilíbrio".
(Kotz e Treichel, 1998)
Acerca do tema equilíbrio químico, podemos afirmar que:
a) Quanto menor for a constante de equilíbrio, mais favorável será a formação dos produtos.
b) A constante de equilíbrio não é alterada quando são alterados os coeficientes estequiométricos da equação.
c) A adição de um catalisador altera o valor da constante de equilíbrio.
d) O estado físico das substâncias deve ser levado em consideração na expressão da constante de equilíbrio.
e) Quanto maior for a constante de equilíbrio, mais favorável será a regeneração dos reagentes.
06 - (UESPI) A chuva ácida pode destruir estátuas, prédios ou monumentos da cidade. O principal constituinte dos
mármores, utilizados na construção de prédios e monumentos, é o calcário (carbonato de cálcio - CaCO3) que reage com
os ácidos presentes na chuva ácida.
1
Considerando a reação CaCO3(s) + H2SO4(aq)
→ CaSO4(aq) + H2CO3(aq) em um sistema fechado e o
princípio de Le Chatelier. Se for adicionado mais carbonato de cálcio à reação, a constante de equilíbrio
a)
b)
c)
d)
e)
não será afetada.
aumentará, e a reação deslocará para esquerda.
aumentará, e a reação deslocará para direita.
diminuirá, e a reação deslocará para esquerda.
diminuirá, e a reação deslocará para direita.
07 - (PUC RJ) A equação abaixo descreve a reação de formação de amônia a partir de matéria prima abundante na
natureza (gases nitrogênio e hidrogênio). Essa reação é exotérmica e catalisada por ferro.
N2(g) + 3H2(g)
←
→
2NH3(g)
Assinale a afirmativa correta.
a) A presença do catalisador faz com que a reação se torne endotérmica.
b) A equação da constante de equilíbrio da reação é K = [N2] [H2] / [NH3].
c) O rendimento da reação pode ser melhorado pela retirada de amônia na medida em que esse produto é
formado.
d) Na pressão constante, o volume ocupado pela mistura reacional tende a aumentar na medida em que o produto
se forma.
e) Trata-se de uma reação de síntese sem que haja variação dos números de oxidação dos elementos N e H.
08 - (UDESC SC) A reação abaixo descreve a combustão do etanol.
C2H6O(l) + 3O2(g)
→
←
2 CO2(g) + 3 H2O(g) + calor
A partir desta reação, é correto afirmar que:
a) a remoção de H2O não altera o deslocamento do equilíbrio.
b) o aumento na quantidade de C2H6O favorece a formação de reagentes.
c) o aumento da temperatura desloca o equilíbrio para o sentido de formação de C2H6O.
d) a diminuição da quantidade de C2H6O favorece a formação dos produtos.
e) a remoção de O2 produz mais CO2.
09 - (UFAL) A história da produção da amônia é um fato interessante que ilustra a relação entre ciência e sociedade. A
descoberta destinada a ser usada na criação de adubo químico para a produção de alimentos foi usada na produção de
explosivos.
A síntese industrial da amônia ocorre segundo a reação
3H2(g) + N2(g)
→
←
2NH3(g) ∆H = –46 kJ
De acordo com o princípio de Le Chatelier, a formação da amônia é favorecida pela
a) pressão elevada e temperatura reduzida.
b) pressão reduzida e temperatura elevada.
c) pressão e temperatura elevadas.
d) pressão e temperatura reduzidas.
e) elevação da temperatura, apenas.
10 - (UEG GO) A molécula de NO2, um dos gases responsáveis pela chuva ácida, pode ser obtida pela reação entre
nitrogênio e oxigênio, conforme a equação abaixo.
N2(g) + O2(g)
→
←
2NO2(g)
∆Hº > O
A formação do produto será favorecida quando no sistema
a) reduzir-se seu volume à metade.
b) diminuir-se a pressão do N2.
c) aumentar-se a temperatura.
d) adicionar-se um catalisador.
2
ORGÂNICA
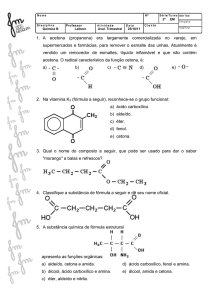
01 - (EFOA MG) As estruturas abaixo representam algumas substâncias usadas em protetores solares.
CO2H
CH
O
CHCO2CH 2CH(CH2)3CH3
CH2CH3
OH
NH2
OCH3
OCH 3
A função que NÃO está presente em nenhuma dessas estruturas é:
a) cetona.
b) éter.
c) éster.
d) amina.
e) álcool.
02 - (UEG GO) A vitamina B5 é obtida em alimentos. Ela é necessária ao desenvolvimento do sistema
nervoso central, bem como na transformação de açúcares e gorduras em energia. Regula o
funcionamento das supra-renais. A carência dessa vitamina causa dermatites, úlceras e distúrbios
degenerativos do sistema nervoso.
HO
CH2
CH3 OH
O
C
C
C
O
N
CH3 H
CH2
CH2
C
OH
H
Vitamina B5
Marque a alternativa que contém os grupos funcionais presentes na molécula da vitamina B5:
a) Ácido carboxílico, álcool e amida.
b) Álcool, amina e ácido carboxílico.
c) Álcool, amina e cetona.
d) Ácido carboxílico, amina e cetona.
e) Álcool, aldeído e amina.
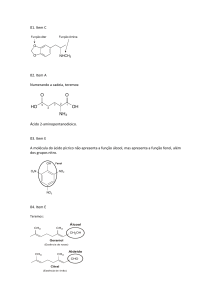
03 - (UFTM MG) Em 1998, o lançamento de um remédio para disfunção erétil causou revolução no
tratamento para impotência. O medicamento em questão era o Viagra®. O princípio ativo dessa droga é
o citrato de sildenafil, cuja estrutura é representada na figura:
O
I
CH 3CH2O
CH3
N
HN
N
N
CH 2CH2CH3
O2S
CO 2H
N
HOOC
OH
N
CH3
CO 2H
II
As funções orgânicas I e II, circuladas na estrutura do citrato de sildenafil, são:
a) cetona e amina.
b) cetona e amida.
c) éter e amina.
d) éter e amida.
3
e) éster e amida.
04 - (UFSCAR SP) O aspartame, estrutura representada a seguir, é uma substância que tem sabor doce ao
paladar. Pequenas quantidades dessa substância são suficientes para causar a doçura aos alimentos
preparados, já que esta é cerca de duzentas vezes mais doce do que a sacarose.
O
O
O
O
N
H
NH
OH
aspartame
As funções orgânicas presentes na molécula desse adoçante são, apenas,
a) éter, amida, amina e cetona.
b) éter, amida, amina e ácido carboxílico.
c) aldeído, amida, amina e ácido carboxílico.
d) éster, amida, amina e cetona.
e) éster, amida, amina e ácido carboxílico.
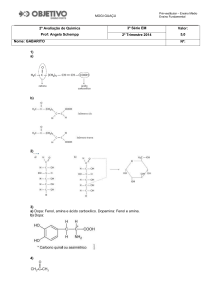
05 - (UFV MG) A aspoxicilina, abaixo representada, é uma substância utilizada no tratamento de infecções
bacterianas.
As funções 1, 2, 3 e 4 marcadas na estrutura são, respectivamente:
a) amida, fenol, amina, ácido carboxílico.
b) amida, amina, álcool, éster.
c) amina, fenol, amida, aldeído.
d) amina, álcool, nitrila, ácido carboxílico.
e) amida, nitrila, fenol, éster.
06 - (ACAFE SC) Os xampus, muito utilizados para limpar e embelezar os cabelos, de modo geral, contêm
em sua constituição, no mínimo, as seguintes substâncias: detergente, corante, bactericida, essência e
ácido cítrico (regula o pH).
O H
HOOC CH C CH COOH
2
2
COOH
As funções orgânicas, presentes na fórmula estrutural do ácido mencionado, são:
a) cetona e álcool
b) álcool e aldeído
c) ácido carboxílico e álcool
d) ácido carboxílico e aldeído
e) cetona e éster
07 - (UNIUBE MG) A capsaicina, cuja fórmula estrutural simplificada está mostrada abaixo, é uma das
responsáveis pela sensação picante provocada pelos frutos e sementes da pimenta-malagueta.
(Capsicum sp.).
4
O
H3CO
CH3
N
CH3
H
H
O
Na estrutura da capsaicina, encontram-se as seguintes funções orgânicas:
a) amina, cetona e éter.
b) amida, fenol e éter.
c) amida, álcool e éster.
d) amina, fenol e éster.
08 - (UFJF MG) A adrenalina, hormônio secretado pelas glândulas supra-renais e que promove o equilíbrio
de várias funções no organismo humano, apresenta a estrutura molecular abaixo representada:
H
C CH2 N
HO
H
OH
HO
Quais as funções orgânicas presentes neste composto:
a) álcool, amida, cetona;
b) fenol, amida, cetona;
c) fenol, álcool, amina;
d) éter, amina, álcool;
e) éter, amima, fenol.
09 - (PUC RJ) Observe as fórmulas abaixo:
C8H16
(I)
C6H6
(II)
C4H10O
(III)
Assinale a única alternativa que as correlaciona corretamente com funções orgânicas que podem ser por
elas representadas:
a) I, alcano; II, alceno; III, álcool
b) I, alcano; II, alcino; III, álcool
c) I, alceno; II, alcino; III, éter
d) I, alceno; II, composto aromático; III, éter
e) I, alcino; II, composto aromático; III, aldeído
10 - (UNIFICADO RJ) Em relação à molécula da vanilina, é correto afirmar que as funções químicas
encontradas são:
H
C=O
HO
O - CH3
a)
b)
c)
d)
e)
álcool, éter e éster
álcool, ácido e fenol
aldeído, álcool e éter
aldeído, éster e álcool
aldeído, éter e fenol
5
GERAL
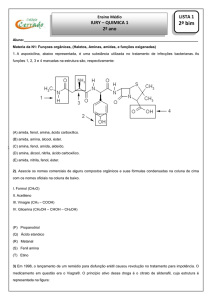
01) Na tabela abaixo estão relacionadas as estruturas de Lewis para alguns compostos:
Estão INCORRETAMENTE representadas apenas as seguintes estruturas:
a) I, II e III.
b) I, IV e V.
c) II, III e IV.
d) II, IV e V.
02) Considere as seguintes informações sobre os elementos X e O.
Elemento No de eletrons na ultima camada Periodo
O
6
2
X
4
2
A combinação de X e O pode formar substâncias não iônicas e gasosas a temperatura e pressão
ambientes.
A fórmula dessas substâncias são
Dados: números atômicos : C= 6; N=7; O=8; S=16
a) NO e CO.
b) CO e CO2.
c) CO e SO2.
d) SO3 e SO2.
e) NO2 e SO2.
03) Um composto é formado pelo cátion X e ânion Y, com fórmula química representada por X2Y3. A respeito
desse composto, assinale a alternativa correta.
a) O átomo X possui 2 elétrons na camada de valência.
b) O átomo Y possui 6 elétrons na camada de valência.
c) O átomo Y possui 2 elétrons na camada de valência.
d) O átomo X possui 6 elétrons na camada de valência.
e) O composto se estabiliza por ligação química covalente.
04) O estudo das ligações químicas é importante para a compreensão das propriedades da matéria. De um
modo geral, as ligações químicas são classificadas como covalentes, iônicas e metálicas. A ligação entre
dois átomos é definida como iônica, quando
a) um ou mais pares de elétrons são compartilhados entre os dois átomos.
b) os átomos são mantidos unidos pela força eletrostática entre os elétrons.
c) um ou mais elétrons são transferidos de um átomo para outro.
d) as nuvens eletrônicas dos átomos se superpõem.
e) os átomos são mantidos juntos por forças nucleares.
05) Na formação do composto cloreto de cálcio (CaCl2), o cálcio perde quantos elétrons?
Dados: Ca (Z=20) e Cl (Z=17).
a) nenhum
b) 1
c) 2
d) 3
e) 4
6