Leandro Bueno Bergantin
NOVO SISTEMA IN SITU PARA ANÁLISE DA
PROTEÓLISE MUSCULAR ESQUELÉTICA: PAPEL DA
VIA DO AMP CÍCLICO
São Paulo
2010
Leandro Bueno Bergantin
NOVO SISTEMA IN SITU PARA ANÁLISE DA
PROTEÓLISE MUSCULAR ESQUELÉTICA: PAPEL DA
VIA DO AMP CÍCLICO
Tese apresentada à Universidade Federal
de São Paulo para obtenção do título de
Mestre em Ciências pelo programa de
pós-graduação em Farmacologia
Orientadora: Profa. Dra. Rosely Oliveira Godinho
São Paulo
2010
IIIIII
FICHA CATALOGRÁFICA
De acordo com:
Como elaborar sua tese: Estrutura e referências
Edna Terezinha Rother e Maria Elisa Rangel Batista
São Paulo, 2005
Bergantin, Leandro Bueno
NOVO SISTEMA IN SITU PARA ANÁLISE DA PROTEÓLISE MUSCULAR
ESQUELÉTICA: PAPEL DA VIA DO AMPC
Leandro Bueno Bergantin. São Paulo, 2010.
XVI, 56f.
Tese (Mestrado) – Universidade Federal de São Paulo. Programa de
Pós-Graduação em Farmacologia.
Título em inglês: A new in situ system to analyze skeletal muscle
proteolysis: role of cAMP pathway
1. Músculo Lumbricalis. 2. Proteólise. 3. Tirosina. 4. AMP cíclico
iii
UNIVERSIDADE FEDERAL DE SÃO PAULO
DEPARTAMENTO DE FARMACOLOGIA
Pró-Reitor de Pós-Graduação:
Prof. Dr. Arnaldo Lopes Colombo
Chefe do Departamento:
Profa. Dra. Rosana de Alencar Ribeiro
Coordenadora do Curso de Pós-Graduação:
Profa. Dra. Soraya Soubhi Smaili
iv
Aos meus pais Armando e Lúcia pelo
incondicional apoio nesta etapa da
vida.
"na sua teimosia entrevejo a futura constância e
firmeza de caráter; nas suas garotices o bom humor
que lhes fará vencer facilmente os perigos deste
mundo. E tudo isso de modo tão puro, tão
incontaminado!"
Os sofrimentos do Jovem Werther
v
Ao meu irmão Lucas, à minha tia
Fátima e ao meu padrinho Élcio, e ao
meu avô (José in memorium) pelo
apoio nesta etapa da vida.
vi
À Profa. Dra. Rosely pela ótima
orientação; e à Fapesp pela bolsa
de mestrado concedida.
vii
Agradecimentos
Aos professores do Setor de Produtos Naturais, Prof. Dr. Antônio José Lapa, Profa. Dra.
Caden Souccar, Profa. Dra. Maria Teresa Riggio de Lima-Landman e Profa. Dra. Miriam
Hayashi, pelos ensinamentos e convívio no laboratório.
Aos meus amigos de grupo: Sandro (“mais que um amigo!”), Thiago Duarte (uma amizade
recente que espero que dure muito!), Marcelo (um amigo totalmente diferente de todos os
amigos que tive, e que agora está fazendo doutorado em Michigan), Ana (uma pessoa tão
boa que nem parece fazer parte deste mundo), Leonardo Bruno (por ter me ajudado a fazer
toda a morfologia dos músculos lumbricales!), Luciana, Edilaine e Gracielle.
A todas as pessoas maravilhosas que trabalham no Setor de Produtos Naturais: Maria do
Carmo, Bia, Betty, Joca, Alex, Chico, Celso, Dona Laura, Wilma e Emília.
Aos amigos do Setor de Mecanismo de Ação de Drogas, Kleber e Regiane, por toda ajuda e
compreensão.
A todos meus grandes mestres de ontem e hoje que de forma direta ou indireta contribuíram
para que este momento se tornasse real.
viii
" Que gente esta, cuja alma está inteiramente amarrada à etiqueta,
aplicando, durante anos, todos os seus pensamentos e esforços a
manter-se rigidamente à mesa! E não fazem isso porque nada mais
tenham em que ocupar-se; ao contrário, o trabalho acumula-se
precisamente porque um mundo de dificuldadezinhas impede a marcha
dos negócios sérios.(...)
Esses insensatos não veem que o cargo não tem a mínima importância,
porquanto aquele mesmo que ocupa o primeiro lugar tão raramente
desempenha o principal papel! Quantos reis são governados pelo seu
ministro e quantos ministros são governados pelo seu secretário! Quem
é então o primeiro? Ao que me parece, aquele que, vendo mais longe do
que todos nós, é bastante poderoso ou bastante fino para dirigir as
nossas faculdades e as nossas paixões no sentido da realização dos
seus desígnios."
Os sofrimentos do Jovem Werther
ix
Sumário
Dedicatórias
Agradecimentos
Lista de figuras
Lista de abreviaturas
Resumo
Abstract
Justificativa
v
viii
xii
xiii
xiv
xv
xvi
I.
Introdução
1. Fisiofarmacologia do músculo esquelético e a influência trófica
neural motora
2. Manutenção da massa muscular e a participação dos sistemas
intrínsecos de proteólise muscular
2.1.Sistema proteolítico ubiquitina-proteasoma
2.2.Sistema proteolítico dependente de Ca2+
2.3.Sistema proteolítico lisossomal
3. Métodos de avaliação da proteólise muscular
4. Papel da adenilil ciclase e do AMPc na sinalização intracelular do
músculo esquelético
5. Papel dos adrenoceptores β2 e de inibidores de fosfodiesterases na
inibição da proteólise muscular
II.
Objetivos
2
3
4
6
6
7
8
10
14
III.
1.
2.
3.
4.
Material e Métodos
Drogas e Reagentes
Soluções
Animais e procedimento cirúrgico
Mensuração da proteólise muscular
4.1. Incubação dos músculos e mensuração da proteólise muscular
5. Dosagem do aminoácido tirosina
6. Análise morfológica dos músculos
7. Análise Estatística
16
16
17
17
18
19
19
IV.
Resultados
1. Caracterização morfológica dos músculos lumbricales
1.1. Massa dos músculos lumbricales
1.2. Análise morfométrica dos músculos
21
22
2. Padronização da dosagem do aminoácido tirosina
2.1. Curva Padrão de dosagem de tirosina
24
3. Introdução e validação da metodologia de medida da proteólise
muscular
3.1. Efeito do tempo de incubação na proteólise de músculos lumbricales
controles
3.2. Relação entre a posição anatômica dos lumbricales e a proteólise
muscular
3.3. Interferência da síntese protéica na medida da proteólise
muscular
x
25
25
26
3.4. Efeito da lesão mecânica e da desnervação cirúrgica na
proteólise do músculo lumbricalis
3.5. Contribuição dos sistemas ubiquitina-proteasoma e das calpaínas na
proteólise do músculo lumbricalis
3.6. Efeitos da maturação do rato na proteólise do músculo lumbricalis
27
28
29
4. Efeito de moduladores da via do AMPc na proteólise muscular
esquelética
4.1. Efeito da ativação de adrenoceptores β na proteólise muscular
4.2. Efeitos da inibição de fosfodiesterases e da ativação da adenilil
ciclase na proteólise muscular
4.3. Efeito de moduladores da via de sinalização do AMPc na proteólise
muscular de animais impúberes
4.4. Efeito de moduladores da via de sinalização do AMPc na proteólise
de músculos EDL de animais impúberes
V.
Discussão
1. Caracterização do novo modelo de estudo da proteólise muscular
2. Padronização da técnica de dosagem do aminoácido tirosina
3. Introdução e validação da metodologia de medida da proteólise
muscular
4. Efeito do uso de moduladores da sinalização mediada pelo AMPc
na proteólise muscular esquelética em situações basais e
catabólicas
31
33
34
35
38
39
40
44
VI.
Sinopse e Conclusões
48
VII.
Referências
50
xi
Lista de figuras
Sistemas de proteólise muscular responsáveis pelo processo da atrofia
muscular resultante de desuso ou doença
Fig. 1
Sinalização intracelular mediada pelo AMPc
Fig. 2
Músculos lumbricales da pata posterior do animal
Fig. 3
Massa muscular relativa dos músculos EDL e dos músculos lumbricales de
ratos adultos
Fig. 4
Secções transversais dos músculos lumbricales e EDL
Fig. 5
Freqüência de distribuição do diâmetro das fibras dos músculos lumbricales
Fig. 6
Pad Curvas-Padrão de dosagem de tirosina
Fig. 7 A
Representação molecular da L-tirosina
Fig. 7 B
Efeito do tempo de incubação na proteólise muscular
Fig. 8
Relação entre a posição anatômica e a proteólise muscular
Fig. 9
Interferência da síntese protéica na proteólise muscular
Fig. 10
Efeito da lesão mecânica na proteólise muscular
Fig. 11
Efeito da desnervação na proteólise muscular
Fig. 12 A
Efeito da desnervação na massa muscular
Fig. 12 B
Efeito de inibidor de proteasoma e de calpaínas na proteólise muscular
Fig. 13
Efeito da maturação na proteólise muscular
Fig. 14
Efeito da depleção de ATP na proteólise de músculos lumbricales de ratos
impúberes
Fig. 15
Efeito do isoproterenol na proteólise muscular
Fig. 16
Efeito do isoproterenol na proteólise de músculos controles e desnervados
Fig. 17
Efeito do formoterol na proteólise muscular
Fig. 18
Efeito do formoterol na proteólise de músculos controles e desnervados
Fig. 19
Efeito do IBMX na proteólise muscular
Fig. 20
Efeito da forscolina na proteólise muscular
Fig. 21
Efeito de moduladores da via de sinalização do AMPc na proteólise
muscular de animais adultos e impúberes
Fig. 22
Efeito de moduladores da via de sinalização do AMPc na proteólise de
músculos EDL de animais impúberes
Fig. 23
xii
Lista de abreviaturas
AC
adenilil ciclase
ACh
acetilcolina
AChE
acetilcolinesterase
AMPc
adenosina monofosfato cíclico
ATP
adenosina trifosfato
DMSO
dimetilsulfóxido
E-64
(L-transepoxysuccinyl-leucylamido-[4-guanidino] butano)
EDL
extensor longo dos dedos
Epac
exchange protein directly activated by cAMP
FSK
forscolina
GDP
guanosina difosfato
GPCR
G-protein coupled receptor
GTP
guanosina trifosfato
HE
hematoxilina-eosina
IBMX
3-isobutil -1-metilxantina
JNM
junção neuromuscular
MG 132
Z-Leu-Leu-Leu-al
ML/MT
músculo lumbricalis associado ao seu osso metatarso
Murf-1
muscle ring-finger protein 1
nAChR
colinoceptores nicotínicos
PDE
fosfodiesterases
PKA
proteína quinase dependente de AMPc
RNAm
ácido ribonucléico mensageiro
SUP
sistema ubiquitina-proteassoma
xiii
Resumo
O
músculo esquelético de mamífero é responsável tanto pelo desencadeamento da
contração e geração de força e movimento. Por outro lado, o músculo participa do controle
da homeostase energética corporal ao disponibilizar aminoácidos gerados a partir da
proteólise muscular. A regulação fina dessa proteólise é crucial para a manutenção da
massa muscular. Até o momento, os mecanismos de regulação desse processo assim como
a triagem farmacológica de drogas que interferem com a proteólise muscular tem sido
realizadas pela medida da liberação de tirosina de músculos de ratos impúberes, devido ao
tamanho e à má perfusão tecidual de músculos de ratos adultos. Logo, o efeito da idade ou
de doenças neurodegenerativas tem sido analisado apenas com marcadores estáticos,
como atrogin-1/MAFbx ou Murf-1. Além disso, músculos de ratos impúberes diferem
daqueles do rato adulto quanto a resistência à insulina e alta taxa de crescimento, o que
pode comprometer a extrapolação direta dos resultados obtidos em animais impúberes para
adultos. No presente estudo, propusemos o estabelecimento de um novo modelo
experimental in situ – o músculo lumbricalis do rato adulto para a medida dinâmica da
proteólise muscular, através da quantificação da liberação de tirosina pelo músculo. Além
disso, adaptamos o método fluorimétrico da medida do aminoácido para microplaca de 96
fossos, o que implicou na redução de 90% da formação de rejeitos químicos. Esse estudo
foi complementado pela análise do efeito de moduladores da via da proteína Gs/ Adenilil
ciclase/ AMP cíclico, cuja participação na regulação da proteólise muscular já havia sido
demonstrada em músculos de ratos impúberes. Utilizando o músculo lumbricalis de rato
adulto, comprovamos que moduladores da via de sinalização do AMPc inibem a proteólise
muscular em situações basais ou catabólicas induzidas pela desnervação. Os agonistas de
adrenoceptores β isoproterenol (30-100 µM; não seletivo) e formoterol (1-10 nM; seletivo β2),
o ativador de adenilil ciclase forscolina (30-100 nM) e o inibidor não seletivo de
fosfodiesterases IBMX (100-1000 µM) reduziram a proteólise muscular em 12 a 20%. Além
disso, evidenciamos que a proteólise muscular de ratos impúberes (30 dias de idade) é 94%
maior que a de animais adultos, resultado que torna questionável a extrapolação de
resultados obtidos em músculos de animais impúberes para a idade adulta.
A utilização do músculo lumbricalis como modelo experimental reduz em pelo menos 4
vezes o número de animais em protocolos experimentais de medida de proteólise e em
90% a quantidade de rejeitos químicos produzidos, devido à adaptação da dosagem da
tirosina para microplaca, propiciando a realização de triagem farmacológica de drogas para
fins terapêuticos anticatabólicos.
xiv
Abstract
In vertebrates,
skeletal muscle contributes to the control of body energy homeostasis
by providing amino acids generated from protein breakdown. However, continued muscle
protein breakdown results in muscle atrophy, such as those associated with aging, muscle
wasting or neuromuscular dysfunction. The molecular mechanisms involved in regulation of
muscle proteolysis as well as the pharmacological screening of drugs that interfere in this
process have been addresses by measurement of tyrosine release from muscles of prepubertal rats, because they are thin enough to allow an adequate diffusion of oxygen and
substrates under in vitro conditions. Therefore, the effect of aging or neurodegenerative
diseases has been analyzed only with static markers, as atrogin-1/MAFbx or Murf-1. The aim
of the present study was the establishment of a new in situ experimental model for the
dynamic measurement of proteolysis in adult rat muscles, by quantifying the release of
tyrosine from the lumbricalis muscle. In addition, the fluorimetric macromethod for tyrosine
measurement was adapted for 96 wells microplate, which resulted in 90% reduction in the
formation of toxic chemical waste. The results were complemented by analyzing the effect of
modulators of Gs protein / adenylyl cyclase / cyclic AMP signaling pathway on proteolysis of
adult muscles, whose influence had already been demonstrated in muscles from prepubertal rat. Using adult rat lumbricalis muscle, we found that modulators of the cAMP
signaling pathway inhibit muscle proteolysis under basal or catabolic condition induced by
denervation. β-adrenergic agonists isoproterenol (30-100 mM; non-selective) and formoterol
(1-10 nM; selective β2), the adenylyl cyclase activator forskolin (30-100 nM) and
nonselective phosphodiesterase inhibitor IBMX (100-1000 mM) reduced by 12% to 20%
muscle proteolysis. Furthermore, our results show that muscle proteolysis in pre-pubertal
rats (30 days old) is 94% higher than in adult animals, which makes questionable the direct
extrapolation of results obtained from pre-pubertal muscles to adult or senile muscles. The
use of lumbricalis muscle as an proteolysis experimental model reduces by 75% the number
of animals in proteolysis experimental protocols and by 90% the amount of chemical waste
produced, due to the adjustment of the dosage of tyrosine to 96 well microplate, optimizing
the pharmacological screening of drugs for anticatabolic purposes.
xv
Justificativa
O processo de atrofia muscular esquelética pode ocorrer como conseqüência direta de
estados catabólicos deficientes, como por exemplo, no diabetes e em doenças
neuromusculares degenerativas (Reid et al, 2005; revisão). As abordagens farmacológicas
atuais para o tratamento da atrofia muscular ainda são bastante limitadas, especialmente
porque as vias de sinalização intracelulares envolvidas são pouco conhecidas. O uso agudo
e crônico de agonistas de adrenoceptores β2, drogas amplamente utilizadas na clínica para
o tratamento de doenças respiratórias, têm se mostrado promissor na atenuação da atrofia
muscular. Apesar de alguns estudos atribuirem os efeitos desses agonistas na atenuação da
atrofia muscular ao aumento da concentração intracelular de AMPc, o papel dessa via de
sinalização nesse processo ainda foi pouco explorado, principalmente no animal adulto. A
possível utilização terapêutica dos agonistas seletivos de adrenoceptores β2, assim como o
esclarecimento da modulação da via de sinalização do AMPc no processo de atenuação da
atrofia muscular, pode abrir um leque de opções para o desenvolvimento de ferramentas
farmacológicas que atuem em alvos específicos da cascata de sinalização intracelular,
propiciando o desenvolvimento de medicamentos que retardem o processo da atrofia
muscular em estados catabólicos. Para isso, é necessário o estabelecimento de protocolos
experimentais capazes de avaliar a proteólise muscular do animal adulto.
xvi
I.
INTRODUÇÃO
2
1. Fisiofarmacologia do músculo esquelético e a influência trófica neural
motora
O músculo esquelético de mamíferos é formado por células alongadas e
multinucleadas, as fibras musculares, responsáveis diretas pela dinâmica da
contração muscular. Nos mamíferos, cada fibra muscular é inervada por um único
axônio de neurônio motor, constituindo uma unidade motora (Mantilla e Sieck, 2008;
revisão).
A contração muscular é desencadeada pela deflagração do potencial de ação
nervoso, que induz a mudança da conformação de canais de Ca2+ dependentes de
voltagem presentes na membrana neuronal, ocasionando um aumento intracelular
de Ca2+ necessário para a liberação de acetilcolina (ACh) na fenda sináptica (Prado
et al., 2002; revisão). Assim, vesículas contendo o neurotransmissor ACh fundem-se
à membrana do terminal do neurônio motor, liberando o neurotransmissor na fenda
sináptica. A interação subseqüente da ACh com os receptores colinoceptivos
nicotínicos (nAChR) pós-sinápticos desencadeia a resposta contrátil da fibra
muscular. Na fenda sináptica, a ação da ACh é finalizada pela enzima
acetilcolinesterase (AChE), a qual hidrolisa o neurotransmissor, evitando assim o
estímulo exacerbado dos nAChR (Sanes e Lichtman, 1999).
A região de contato entre o neurônio motor e a fibra muscular, também
denominada de junção neuromuscular (JNM), é altamente especializada e
caracterizada pela alta concentração de nAChR e AChE (Duclert e Changeux, 1995;
revisão). Essa especialização é condicionada por fatores tróficos neurais que
modificam o estado transcricional dos núcleos dessa região, diferenciado-os
daqueles extrajuncionais (Jasmin et al., 1998). A influência trófica neuronal também
é em parte responsável pela modulação da massa muscular e da expressão de
proteínas sinápticas, podendo ser evidenciada através da desnervação motora que
promove atrofia muscular gradativa (Guth e Albuquerque, 1978), com redução da
AChE do músculo (Guth e Albuquerque, 1978).
Além dos nAChR, a musculatura esquelética de mamífero também apresenta
receptores acoplados à proteína G heterotrimérica, tais como os adrenoceptores β2.
A ativação desses receptores por catecolaminas possibilita, por exemplo, a redução
da degradação protéica muscular, contribuindo para a manutenção da massa do
músculo (Navegantes et al., 2000).
3
Por fim, o músculo esquelético pode ser classificado de acordo com as fibras
musculares que o constituem: tipo I ou II (A e B). A existência de diferentes tipos de
fibras musculares é devido, principalmente, à propriedade funcional inerente a cada
músculo (Zierath et al., 2004; revisão). Como exemplo, as fibras musculares do tipo I
possuem lenta velocidade de contração e baixa capacidade anaeróbia (ex.: músculo
sóleo). Já as fibras musculares do tipo II, por sua vez, possuem rápida velocidade de
contração e alta capacidade anaeróbia (ex.: músculo extensor longo dos dedos
(EDL)) (Zierath et al., 2004; revisão).
2. Manutenção da massa muscular e a participação dos sistemas
intrínsecos de proteólise muscular
A manutenção da massa muscular é dependente do balanço entre dois
processos fisiológicos antagônicos: a síntese e a degradação de proteínas
musculares (Kettelhut et al., 1988; revisão). Esses dois processos são finamente
regulados por fatores nutricionais, hormonais e neuronais (Robert et al., 2004;
revisão). A quebra da homeostase entre esses dois processos pode resultar em
condições patológicas debilitantes acompanhadas de atrofia muscular, que são
claramente evidenciadas em modelos experimentais de desnervação, ou em várias
doenças de cunho degenerativo: esclerose lateral amiotrófica, distrofia de
Duchenne, dentre outras (Robert et al., 2004; revisão).
A regulação fina da proteólise muscular é uma importante etapa no controle da
homeostase energética corporal, assim como na manutenção da massa muscular e
do crescimento corporal (Kettelhut et al., 1988; revisão). Como o músculo
esquelético é considerado o maior reservatório protéico do organismo, a hidrólise de
proteínas musculares para a geração de aminoácidos é uma etapa importante na
gliconeogênese. Como conseqüência, em situações como jejum, diabetes e sepse,
nas quais observamos um balanço protéico negativo com perda de massa muscular,
observa-se um aumento da gliconeogênese (Kettelhut et al., 1988; revisão).
Corroborando com esta teoria, recentemente foi demonstrado que aminoácidos
como a leucina promovem um efeito anti-catabólico na musculatura esquelética
(Combaret et al., 2005). Esses autores evidenciaram que a suplementação crônica
da dieta de ratos com leucina causa uma inibição da proteólise de cerca de 30%,
sugerindo então um possível efeito benéfico na suplementação da dieta com
4
aminoácidos
essenciais
(Zanchi
et
al.,
2008;
revisão).
Na
realidade,
a
suplementação da dieta com leucina em modelos animais incrementa a síntese
protéica e diminui a proteólise muscular, propiciando um expressivo efeito
antiatrófico (Zanchi et al., 2008; revisão).
A elucidação dos mecanismos de regulação da proteólise muscular avançou
mais vigorosamente somente a partir da década de 90, com enfoque em estratégias
terapêuticas para a atenuação do catabolismo muscular exacerbado associado a
doenças crônicas e degenerativas (Tawa et al., 1997). Embora saibamos que o
músculo esquelético contém múltiplos sistemas intrínsecos de degradação protéica,
é cada vez mais necessária a elucidação de como os hormônios ou as moléculas
sinalizadoras endógenas modulam esses sistemas.
O controle da degradação protéica muscular envolve classicamente três
sistemas distintos: o sistema ubiquitina-proteassoma dependente de ATP, o sistema
dependente de Ca2+ constituído pelas proteases denominadas calpaínas e o sistema
lisossomal constituído pelas proteases denominadas catepsinas (Nader et al., 2002;
revisão; figura 1). Vários autores descreveram que a proteólise das miofibrilas
musculares ocorre com a participação majoritária do sistema ubiquitina-proteassoma
(Medina et al. 1991; Price et al., 1996; Tiao et al., 1996). No entanto, como esse
sistema não possui a capacidade de degradar proteínas intactas de miofibrilas
(Soloman et al., 1998; revisão), torna-se dependente da ação prévia de proteases do
sistema de calpaínas. Proteínas envolvidas na manutenção do arcabouço da fibra
muscular, como titina, também são substratos endógenos das calpaínas (Sorimachi
et al., 2000; figura 1). Logo, essas enzimas propiciam um desarranjo da estrutura
protéica da miofibrila, possibilitando a ação proteolítica do sistema ubiquitinaproteassoma.
2.1. Sistema proteolítico ubiquitina-proteassoma
O sistema ubiquitina-proteassoma envolve a ubiquitinação de substratos, com a
cooperação de pelo menos três classes de proteínas denominadas ubiquitinas (E1),
(E2) e (E3), sendo então endereçados ao proteassoma para que a degradação
protéica ocorra. Este sistema pode ser considerado a etapa chave no processo de
degradação protéica (Robert et al., 2004; revisão; figura 1), cuja elucidação dos
principais mecanismos de regulação rendeu o prêmio Nobel de Química a Aaron
5
Ciechanover, Avram Herskho e Irwin Rose (Neefjes et al., 2004). Este sistema
possui o seguinte funcionamento bioquímico (Robert et al., 2004; revisão):
1. Ativação: A enzima E1 ativa a molécula de ubiquitina. O resíduo C-terminal da
ubiquitina é ligado covalentemente a um resíduo de sulfidril-cisteína da enzima
E1, que ocorre na presença de Mg² e com o consumo de uma molécula de ATP,
liberando AMP e pirofosfato (PPi) (figura 1).
2. Transferência: A ubiquitina é transferida para a enzima E2, liberando a enzima
E1.
3. Reconhecimento: A enzima E3 reconhece e se liga à proteína-alvo formando um
complexo não covalente.
4. Ubiquitinação: O complexo E2-ubiquitina é ligado à E3 de modo que a ubiquitina
seja transferida de E2 para o grupo amina de um resíduo de lisina da proteínaalvo. Posteriormente, a enzima E3 solta-se, liberando a enzima E2 e a proteína
ubiquitinada.
5. Poli-ubiquitinação: As etapas 3, 4 e 5 se repetem várias vezes, formando uma ou
mais cadeias de ubiquitina.
6. A cadeia de ubiquitina é reconhecida pelo proteassoma. A proteína é
desubiquitinada por enzimas denominadas desubiquitinases, a proteína é
desdobrada com consumo de ATP e hidrolisada formando pequenos peptídeos
(de 7 a 9 aminoácidos).
Como se pode notar, as ubiquitinas ligases E3 possuem papel fundamental no
reconhecimento do substrato protéico a ser devidamente degradado pelo
proteassoma. Partindo-se deste fato, duas ubiquitinas ligases E3 foram identificadas
no
músculo
esquelético:
Murf-1/Trim63
(Bodine
et
al.,
2001)
e
atrogin-
1/MAFbx/FBXO32 (Gomes et al., 2001). Por terem suas expressões aumentadas em
processos de atrofia, essas proteínas e seus transcritos são utilizadas como
marcadores estáticos da proteólise muscular. Além disso, drogas que inibem o
sistema proteassomal reduzem a proteólise de músculos esqueléticos submetido ao
desuso, atenuando, portanto, o processo de atrofia muscular (Taillandier et al.,
1996).
6
2.2. Sistema proteolítico dependente de Ca2+
A participação do sistema dependente de Ca2+ na atrofia e na proteólise
musculares foi demonstrada em músculos de rato, cuja atrofia induzida pela
imobilização foi atenuada por inibidores de calpaínas (Tischler et al., 1990). De
acordo com Tidball et al. (2002), a superexpressão de calpastatinas, inibidores
endógenos das calpaínas, atenua em 30% a atrofia de músculos sóleos submetidos
ao desuso, confirmando a relevância do sistema dependente de Ca2+ nesse
processo. A ausência de efeitos de inibidores do sistema proteolítico lisossomal (ex.:
aminoácidos de cadeia curta como leucina, isoleucina e valina), sugere que esse
sistema possui papel secundário no processo da atrofia muscular (Deval et al.,
2001).
2.3. Sistema proteolítico lisossomal
A organela responsável pela ação proteolítica neste sistema é o lisossomo,
que possui um conteúdo extremamente ácido (pH 4-5) (Bechet et al., 2005; revisão).
Estão contidas nesta organela diversas enzimas hidrolíticas, dentre as quais se
encontram as proteases denominadas catepsinas (B, D, H e L) e as hidrolases
ácidas: responsáveis por degradar proteínas extracelulares de membrana e
citoplasmáticas (Tanida et al., 2004). O acesso do substrato às enzimas lisossomais
depende de diferentes processos intracelulares, como a autofagia (Bechet et al.,
2005; revisão). A princípio, por ser o primeiro sistema proteolítico identificado, a
autofagia foi considerada o principal mecanismo proteolítico da musculatura
esquelética, tanto em situações fisiológicas quanto patológicas. Contudo, ao
contrário do que se esperava, a inibição da autofagia em animais transgênicos, os
quais possuem a deleção de um gene crucial no processo autofágico (Atg7), não
previne a atrofia, sugerindo então um papel secundário deste sistema no processo
atrófico (Masiero et al., 2009).
7
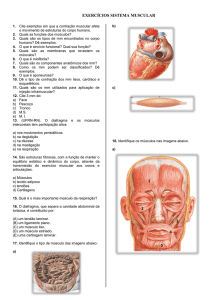
Figura 1: Sistemas de proteólise muscular responsáveis pelo processo da atrofia muscular
2+
resultante de desuso ou doença: A. Sistema dependente de Ca constituído pelas calpaínas; B.
Sistema lisossomal constituído pelas catepsinas; C. Sistema ubiquitina-proteassoma dependente
de ATP (Traduzido de Robert et al., 2004; revisão).
3. Métodos de avaliação da proteólise muscular
Atualmente, as limitações das metodologias utilizadas no estudo do
metabolismo de proteínas, mais especificamente quanto aos processos de
degradação protéica, vêm sendo revisados (Rennie et al., 2009; revisão). Devido à
limitação metodológica atual, o estudo dinâmico da modulação da proteólise
muscular em modelos animais fica restrito a animais impúberes, que diferentemente
dos animais adultos, apresentam alta taxa de crescimento. Logo, a extrapolação dos
resultados obtidos em animais impúberes para adultos pode ser equivocada. Devido
a este fato, os resultados da literatura referentes aos processos de degradação
protéica em animais adultos ou senis são restringidos apenas a marcadores
moleculares, como as ubiquitinas ligases Atrogin-1 (Gomes et al., 2001) e Murf-1
8
(Bodine et al., 2001), cuja expressão está aumentada em diversos modelos de
atrofia, incluindo: diabetes, câncer e insuficiência renal (Gomes et al., 2001), além da
privação androgênica de músculos esqueléticos alvos, recentemente demonstrada
pelo nosso grupo (Pires-Oliveira et al., 2010). Contudo, a análise exclusiva desses
marcadores de proteólise deve ser evitada, já que muitas vezes os resultados
obtidos com tais marcadores são conflitantes (Attaix et al., 2010).
Acerca do que foi exposto até aqui, conclui-se que o estudo dos mecanismos
de controle da proteólise muscular é cada vez mais necessário para o
desenvolvimento de estratégias terapêuticas visando à inibição do catabolismo
muscular exacerbado, associado ou não a doenças crônicas degenerativas. Assim,
uma nova metodologia que permita a análise direta e dinâmica da proteólise
muscular em animais adultos se faz claramente necessária.
4. Papel da adenilil ciclase e do AMPc na sinalização intracelular do
músculo esquelético
O monofosfato de adenosina cíclico (AMPc) é um segundo mensageiro que
está envolvido diretamente na regulação de enzimas chaves da cascata de
sinalização intracelular. No músculo esquelético, o AMPc participa da manutenção
da massa muscular, principalmente através da inibição do sistema proteolítico
dependente de Ca2+ (Navegantes et al., 2000), através da ativação da proteína
quinase dependente de AMPc (PKA) e consequente fosforilação de resíduos de
serina/treonina
de
calpaínas.
As
variações
fisiológicas
das
concentrações
intracelulares de AMPc dependem da atividade e regulação de duas famílias de
enzimas: as adenilil ciclases (AC) e as fosfodiesterases (PDE). Enquanto as AC
catalisam a conversão de ATP em AMPc, as fosfodiesterases degradam o AMPc em
AMP (Post et al., 1995).
Em geral, a via AC/AMPc é ativada por receptores da membrana celular, como
os adrenoceptores β2, que estão acoplados a uma classe de proteínas ligadoras de
nucleotídeos da guanina, conhecidas como proteínas G heterotriméricas, por serem
formadas pelas subunidades α, β e γ. As subunidades Gα identificam a proteína G e
podem ser agrupadas em 4 subfamílias de acordo com a homologia estrutural: a)
família das proteínas G estimulatórias (Gs), como é o caso das proteínas G
9
primariamente ativada pelos adrenoceptores β2; b) família das proteínas G inibitórias
(Gi); c) família das proteínas Gq/11 e d) família G12/13, que regula as proteínas G de
baixo peso molecular (Milligan e Kostenis, 2006; revisão). Enquanto as proteínas G
estimulatórias levam à ativação da AC, aumentando assim a síntese basal de AMPc
intracelular, as proteínas G inibitórias levam à inibição da AC, diminuindo a síntese
basal do segundo mensageiro.
Quando receptores acoplados à proteína G são estimulados por seus
agonistas, ocorre uma mudança conformacional da subunidade Gα, que por sua vez
tem a afinidade pelo GDP diminuída (Tang e Hurley, 1998; revisão). A dissociação
do GDP é seguida pela formação do complexo Gα-GTP e a dissociação da
subunidade Gα do complexo βγ, permitindo a interação da subunidade α e do
complexo βγ com sistemas efetores, como a enzima AC (Tang e Hurley, 1998;
revisão; figura 2). A duração da resposta é regulada pela própria subunidade α, que
possui atividade enzimática capaz de hidrolisar GTP em GDP, restabelecendo o
complexo inativo GDP-Gαβγ (Shmidt, 1997; revisão).
Atualmente, nove isoformas de AC associadas à membrana, numeradas de 1 a
9 estão caracterizadas, além de uma AC solúvel (Linder, 2006; revisão). Todas
compartilham a mesma estrutura primária (Linder, 2006; revisão) e, com exceção da
AC solúvel, podem ser ativadas pela proteína G estimulatória. Além disso, as AC1 a
AC8 podem ser ativadas diretamente pela forscolina, diterpeno encontrado em
plantas do gênero Coleus (Tang e Hurley, 1998; revisão).
O músculo esquelético de mamífero expressa majoritáriamente as isoformas
AC2, AC6, AC7 e AC9; sendo esta última a de maior abundância (Suzuki et al.,
1998). Estes autores demonstraram que após a desnervação do músculo
gastrocnêmico de camundongo, a quantidade de RNAm de AC2 e AC9 diminui,
enquanto os transcritos das AC6 e AC7 aumentam, demonstrando que a expressão
das AC é modulada pela inervação motora. Resultados obtidos em nosso laboratório
mostram ainda que o AMPc está envolvido em processos de manutenção de
trofismo muscular (Chiavegatti et al., 2007, Bergantin et al., 2010).
O AMPc é capaz de modular diversos processos celulares via ativação da PKA,
como a abertura de canais iônicos; a ativação e/ou dessensibilização de receptores
acoplados à proteína G, e a ativação de fatores de transcrição, como a proteína
ligadora do elemento de resposta ao AMPc (cAMP response element-binding
protein, CREB; Paradiso e Brehm, 1998, Milligan e Kostenis, 2006; revisão).
10
Além disso, a sinalização intracelular mediada pelo AMPc está envolvida na
inibição da degradação protéica, e conseqüente modulação da massa muscular,
evento também atribuído à ativação de PKA (Navegantes et al., 2006). Por outro
lado, a descoberta de Epac (Exchange protein directly activated by cAMP), uma
molécula sinalizadora também ativada pelo AMPc independentemente da ativação
de PKA, abriu uma nova via de sinalização a ser explorada. Estudo recente,
realizado por Baviera et al. (2009), demonstrou que a incubação de músculos EDL
de ratos impúberes com catecolaminas ou análogos do AMPc também ativa esta via
de sinalização, aumentando ainda mais a complexidade de regulação da proteólise
muscular pelo AMPc.
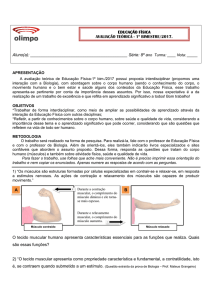
Figura 2 Sinalização intracelular mediada pelo AMPc. 1) Ativação de receptores de membrana 2)
Ativação da proteína Gs estimulatória 3) Ativação da adenilil ciclase 4) Ativação da proteína
quinase dependente de AMPc 5) Respostas celulares.
5. Papel dos adrenoceptores β2 e de inibidores de fosfodiesterases na
inibição da proteólise muscular
Dentre os fatores endógenos que regulam o metabolismo de proteínas
musculares, as catecolaminas possuem papel de destaque (Navegantes et al., 2000)
e podem ter seus efeitos mimetizados pelos inibidores de fosfodiesterases (Baviera
et al., 2006). Apesar das ações fisiológicas das catecolaminas estarem associadas a
11
processos catabólicos, promovendo tanto a degradação de glicogênio e como de
gordura (Navegantes et al., 2009; revisão), estudos demonstrando que as
catecolaminas reduzem também a proteólise muscular in vivo e in vitro podem ser
encontrados (Navegantes et al., 2000). Agonistas de adrenoceptores β2 promovem
hipertrofia muscular acentuada (Mersmann 1998; revisão; Navegantes et al., 2004) e
também retardam a atrofia induzida pela desnervação de músculos impúberes
(Zeman et al., 1987). Por outro lado, a redução da atividade adrenérgica induzida
pelo tratamento de ratos impúberes com o depletor de catecolaminas, guanetidina,
causa um aumento da taxa de degradação protéica do músculo sóleo (Navegantes
et al., 1999), sugerindo que o sistema nervoso simpático exerça um papel inibitório
na proteólise da musculatura esquelética.
A redução da proteólise muscular por catecolaminas ou por drogas que ativam
o adrenoceptor β2, como clenbuterol (agonista seletivo de adrenoceptores β2) ou
passos intermediários da sinalização intracelular, como o dibutiril-AMPc (análogo
não hidrolisável do AMPc), indica que as catecolaminas inibem o catabolismo
muscular através de mecanismos dependentes de AMPc (Navegantes et al., 2001,
2006).
O efeito inibitório das catecolaminas na proteólise muscular pode ser
mimetizado pelos inibidores de fosfodiesterases (Baviera et al., 2006). Essas drogas
são utilizadas amplamente no tratamento de várias doenças respiratórias e
cardiovasculares, por induzirem o aumento intracelular do AMPc (Albrecht et al.;
Lipworth BJ, 2005). A pentoxifilina, xantina inibidora não-seletiva de fosfodiesterases
reduz a proteólise muscular em modelo de sepse em ratos impúberes (Breuille et al.,
1993). Baviera et al. (2006) constataram também que o tratamento de ratos
impúberes diabéticos com pentoxifilina por 4 dias diminui significativamente a
degradação protéica em músculos EDL, através da redução da atividade do sistema
proteolítico dependente de Ca2+ e do sistema proteolítico dependente de ATP. Hinkle
et al. (2005) recentemente demonstraram que a inibição de fosfodiesterases previne
a perda de massa muscular em dois modelos de atrofia, desnervação e desuso por
imobilização. Esses dados confirmam a hipótese do aumento do AMPc intracelular
ser um dos principais mecanismos responsáveis pela prevenção da degradação
protéica muscular excessiva. É importante ressaltar que todos os resultados
publicados por esses autores foram obtidos utilizando músculos de animais
sexualmente imaturos (30 dias de idade), devido à necrose causada pela falta de
12
oxigenação e de perfusão tecidual adequada de músculos de animais adultos
(Baracos e Goldberg, 1986). Logo, uma metodologia que permita a análise dinâmica
da proteólise muscular em animais adultos se faz claramente necessária.
II. OBJETIVOS
14
Este trabalho teve como objetivo a validação de um novo modelo para a
avaliação dinâmica da proteólise muscular esquelética em ratos adultos, utilizando o
músculo lumbricalis de rato.
Considerando que a via da proteína Gs/AC/AMPc tem participação crucial na
manutenção da massa muscular, e que apenas músculos de animais impúberes vêm
sendo utilizados para os ensaios atuais de proteólise muscular, este trabalho teve
como objetivos específicos:
Padronizar e aprimorar em nosso laboratório a técnica de dosagem da
tirosina, aminoácido utilizado como marcador dinâmico da proteólise muscular;
Desenvolver e validar uma nova metodologia de medida da proteólise
muscular esquelética em animais adultos, abrindo a perspectiva para o uso de
animais senis ou portadores de doenças crônicas tardias e neurodegenerativas no
estudo da proteólise muscular esquelética;
Avaliar o efeito do uso de moduladores/ativadores da sinalização mediada
pelo AMPc na proteólise muscular esquelética em situações basais e catabólicas.
III. MATERIAL E MÉTODOS
16
1. Drogas e Reagentes
Soluble Startch (Amido solúvel; Reagen, Quimibrás Indústrias Químicas, Brasil);
Tissue tek, optimal critical temperature compound (Miles laboratories, USA);
Harri’s Hematoxilin (Merck, USA);
Eosin Y (Sigma-aldrich, USA);
1- Nitroso 2 – Naftol (Sima-aldrich, USA);
Nitrito de sódio (Sigma-aldrich, USA);
Ácido nítrico absoluto (Merck, USA);
Etanol absoluto (Merck, USA);
1,2 – Dicloroetano (Merck, USA);
Dimetilsulfóxido (DMSO) (Sigma-aldrich,USA);
D- Glicose anidra (Synth, Brazil);
Dinitrofenol (Sigma-aldrich, USA);
NaCl (Synth, Brazil);
KCl (Synth, Brazil);
MgCl2.6 H2O (Synth, Brazil);
NaHCO3 (Synth, Brazil);
NaH2PO4.H2O (Synth, Brazil);
CaCl2. 2 H2O (Synth, Brazil);
Ciclohexamida (Sigma-aldrich,USA);
Cloridrato de Isoproterenol (Sigma-aldrich,USA);
3-Isobutil-1-metilxantina (IBMX) (Sigma-aldrich,USA);
Forscolina (Sigma-aldrich,USA);
Fumarato de Formoterol (Sigma-aldrich,USA);
MG 132 (Tocris, USA);
E-64 (Sigma-aldrich, USA);
Leupeptina (Sigma-aldrich, USA)
2. Soluções
Tyrode (135 mM NaCl; 5 mM KCl; 1 mM MgCl2.6 H2O; 15 mM NaHCO3; 2 mM
NaH2PO4.H2O; 2 mM CaCl2. 2 H2O; 11 mM glicose, pH 7, 4);
1-nitroso 2-naftol 1% (w/v) diluído em etanol absoluto;
17
Nitrito de sódio 72.5 mM diluído em 20% de ácido nítrico.
3. Animais e procedimento cirúrgico
Foram utilizados ratos Wistar machos adultos (com 3-4 meses de idade) e
impúberes (30 dias de idade) da colônia 2 BAW, fornecidos pelo biotério do Instituto
de Farmacologia e Biologia Molecular (INFAR) da Universidade Federal de São
Paulo. Os animais foram mantidos em condições controladas de temperatura e
iluminação (ciclo de 12 h claro/escuro) com livre acesso à água e ração.
Para a desnervação dos músculos da pata posterior, os ratos foram
anestesiados com cetamina (48 mg/kg ip) e xilazina (6 mg/kg ip). Após antissepsia
local com álcool 70% e incisão na fossa poplítea do animal, o nervo tibial foi pinçado
e seccionado, retirando-se 2 mm para dificultar a reinervação. Em seguida, o corte
foi suturado com linha cirúrgica de algodão, sob condições assépticas. A secção do
nervo tibial resulta na desnervação dos músculos plantaris, sóleo, gastrocnêmio
(cabeças lateral e medial), flexor hallucis longus, tibial posterior, flexor longo dos
dedos, os digitais da pata traseira, dentre eles os 4 lumbricales (figura 3), músculos
situados na região posterior da pata do animal, e acessórios ao tendão do EDL.
Para avaliar o efeito da lesão muscular na proteólise, em outros experimentos,
imediatamente após a retirada dos músculos, os mesmos foram submetidos a cortes
concêntricos na região central, utilizando pinça dente de rato. Todos os
procedimentos foram realizados de acordo com protocolos experimentais aprovados
pelo Comitê de Ética em Pesquisa da Unifesp (processo no 1431/08).
4. Mensuração da proteólise muscular
4.1. Incubação dos músculos e mensuração da proteólise muscular
A mensuração da proteólise muscular foi realizada pela quantificação do
aminoácido tirosina liberado pelos músculos esqueléticos. Como o músculo é
incapaz de degradar ou sintetizar tirosina, a liberação deste aminoácido in vitro
reflete a velocidade de proteólise muscular in vivo (Baracos e Goldberg, 1986). A
dosagem de tirosina foi realizada por método fluorimétrico, inicialmente descrito por
Waalkes e Udenfriend (1957) e adaptado por nós para microplaca. A reação baseia-
18
se na formação de um composto fluorescente estável detectável sob excitação a 485
nm e emissão a 590 nm, após reação de L-tirosina das amostras com nitroso-naftol
na presença de ácido nítrico a 55º C. Esta reação possui alta especificidade para
compostos fenólicos, como a L-tirosina (Tina e Gregory, 2007). A dosagem da
tirosina liberada por músculos utilizando esta técnica já é largamente empregada
pela literatura, assegurando sua validade e confiabilidade (Navegantes et al., 2000;
Baviera et al., 2006; Baracos e Goldberg, 1986).
Após o sacrifício do rato por decapitação, cada músculo lumbricalis, associado
ao seu próprio osso metatarso (sistema ML/MT), foi retirado do animal e transferido
para microtubo contendo 1,0 ou 1,5 ml de meio nutritivo Tyrode, pH 7,4 equilibrado
com 95% de O2 e 5% de CO2. A temperatura foi rigorosamente mantida a 37º C, já
que altas temperaturas induzem a proteólise muscular (Hall-Angeras et al., 1990).
Após 30 min com a pré-incubação das drogas a serem testadas, o sistema ML/MT
foi incubado por 1h a 5h em meio idêntico ao anterior. Posteriormente, o sistema
ML/MT foi retirado do tubo, o músculo foi dissecado e pesado e o meio nutritivo
contendo a tirosina liberada pelo músculo foi utilizado para a determinação da
proteólise muscular.
5. Dosagem do aminoácido tirosina
O método original de dosagem do aminoácido tirosina descrito por Waalkes e
Udenfriend (1957) foi adaptado em nosso laboratório para quantificação em
microplaca. A técnica baseia-se na formação de um composto fluorescente estável,
detectável sob excitação a 485 nm e emissão a 590 nm, após reação (derivatização)
da L-tirosina das amostras com nitroso-naftol, na presença de ácido nítrico a 55º C.
Esta reação, nesta alta temperatura, possui alta especificidade para compostos
fenólicos como a L-tirosina (figura 7B) (Tina e Gregory, 2007).
Resumidamente, amostras (500 µl) foram transferidas para microtubos de 2 ml
e incubadas com 200 µl de mistura reacional, que consistiu em nitroso-naftol 1%
(w/v) diluído em etanol absoluto e nitrito de sódio 72.5 mM diluído em ácido nítrico
20% na proporção 1:1 v/v por 30 min a 55o C. Depois de arrefecimento por 10 min,
uma extração adicional do nitroso-naftol foi realizada pela adição de 1 ml de 1,2dicloroetano. Esta etapa é necessária, já que a presença do nitrosonaftol, de
coloração amarela, diminui a sensibilidade de leitura do fluoróforo formado (Waalkes
19
e Udenfriend, 1957). Logo, esta etapa de extração garante a alta sensibilidade de
leitura (≥ 0,25 µg/ml de tirosina). A seguir, as amostras foram vigorosamente
misturadas e centrifugadas por 10 min a 800 x g, a 4º C. Com este procedimento, há
a formação de 2 fases líquidas: uma orgânica e outra aquosa, que contém o
aminoácido tirosina. A tirosina foi quantificada por fluorimetria (excitação a 485 nm e
emissão a 590 nm) e expressa como nmol/ mg de tecido/ hora.
6. Análise morfológica dos músculos
Os animais foram pesados e decapitados em guilhotina. Posteriormente, os
músculos lumbricales e EDL de ambas as patas foram retirados, pesados,
desidratados em amido solúvel e envolvidos em Tissue tek (Miles laboratories,
Naperville, IL, USA). Após fixação em cortiças, os músculos foram congelados
rapidamente em nitrogênio líquido e armazenados a –80º C.
Para a determinação do diâmetro (µm) das fibras musculares, secções
transversais (5 µm) dos músculos lumbricales e EDL foram obtidas em criostato
(Carl Zeiss, USA), coradas com hematoxilina e eosina (HE) e 7 campos por secção
foram fotografados sob microscópio de luz (Nikon Eclipse E800, Melville, New York,
USA; objetiva de 40x) conectado a um sistema de captura de imagens. As imagens
foram analisadas utilizando o software HL Image 97 (Western Vision Software,
Layton, Utah, USA) e processadas utilizando o software Adobe Photoshop CS 4.0
(Adobe Systems Inc., Mountain View, CA, USA) (Eriksson, 2006 a e b).
7. Análise Estatística
Os resultados obtidos foram expressos como média ± erro padrão da média. As
diferenças estatísticas entre duas médias foram determinadas através do teste “t” de
Student e aquelas entre três ou mais médias por ANOVA de uma via com pós-teste
de Tukey, utilizando o programa computacional Graphpad Prism versão 5.01. A
probabilidade de se rejeitar falsamente a hipótese de nulidade foi fixada em 5% (p<
0,05).
IV. RESULTADOS
21
1. Caracterização morfológica dos músculos lumbricales
Na primeira parte deste trabalho, foi realizada a caracterização morfológica
dos músculos lumbricales, comparando-os com um músculo de propriedade contrátil
semelhante: o EDL. De acordo com a descrição histoquímica de Gates et al. (1991),
os músculos lumbricales possuem um padrão misto de fibras, predominantemente
de contração rápida (tipo II), com 84 % de fibras do tipo II B, 6 % de fibras do tipo II
A e 10 % de fibras do tipo I.
1.1. Massa dos músculos lumbricales do rato adulto
A figura 3 mostra os 4 músculos lumbricales, numerados de 1 a 4 conforme
a posição anatômica. Conforme indicado na figura 4, não houve diferença estatística
entre a massa dos 4 músculos (38,6 ± 0,6 a 39,5 ± 0,7 mg). Entretanto, a massa dos
músculos lumbricales representou cerca de 1/3 daquela do músculo EDL (124,3 ±
0,3 mg).
Massa Muscular (mg)
Figura 3. Fotografia da pata esquerda de rato Wistar
adulto. Os 4 músculos lumbricales foram numerados de 1
a 4, a partir da região medial da pata.
150
100
*
50
*
*
*
0
EDL
1 2 3 4
Lumbricales
Figura 4. Massa dos músculos EDL e
lumbricales, numerados a partir da região
medial da pata de ratos adultos (3 meses
de idade). Cada barra representa a média
± erro-padrão da média de 8 músculos de
4 animais. (*) significantemente diferente
do músculo EDL; P<0,05.
22
1.2. Análise morfométrica dos músculos
O diâmetro das fibras dos músculos lumbricales (26,97 ± 0,12 µm, figuras 5B-E
e 6B-F) foi cerca de 22% menor que aqueles do EDL (34,52 ± 0,42 µm; figuras 5F e
6B). De acordo com o teste de normalidade de Pearson (1931) e D'Agostino et al.,
(1990), a variação do diâmetro das fibras musculares de todos os músculos
analisados seguiu um padrão de distribuição normal (figura 6B-F).
Figura 5. (A) Fotografia da pata direita do rato adulto mostrando os 4 músculos lumbricales,
numerados de 1 a 4, segundo a posição anatômica. (B-E) secções transversais (5 µm) dos
músculos lumbricales. F - secção transversal (5 µm) do músculo EDL. Todas as secções foram
coradas com Hematoxilina e Eosina (HE). Barra= 20 µm.
23
B
40
*
*
*
*
20
10
0
EDL
1
2
3
20
15
10
5
0
4
Diâmetro das Fibras ( µm)
Lumbricales
(posição anatômica)
Lumbricalis 1
15
10
5
Lumbricalis 2
15
10
5
0
12
14
16
18
20
22
24
26
28
30
32
34
36
38
40
42
44
46
0
20
12
14
16
18
20
22
24
26
28
30
32
34
36
38
40
42
44
46
Frequência Relativa (%)
20
Frequência Relativa (%)
D
C
Diâmetro das Fibras ( µm)
Diâmetro das Fibras ( µm)
F
E
Frequência Relativa (%)
15
Lumbricalis 3
10
5
Lumbricalis 4
15
10
5
0
12
14
16
18
20
22
24
26
28
30
32
34
36
38
40
42
44
46
0
20
12
14
16
18
20
22
24
26
28
30
32
34
36
38
40
42
44
46
Frequência Relativa (%)
EDL
11
14
17
20
23
26
29
32
35
38
41
44
47
50
53
56
59
62
30
Frequência Relativa (%)
Diâmetro das fibras ( µ m)
A
Diâmetro das Fibras ( µm)
Diâmetro das Fibras ( µm)
Figura 6. (A) Diâmetro das fibras dos músculos EDL e lumbricales (numerados de 1 a 4 segundo a
posição anatômica) de ratos Wistar com 3 meses de idade. Cada barra representa a média ± erropadrão da média de músculos de 4 animais. (*) significantemente diferente do músculo EDL, P<0,05.
Freqüência de distribuição do diâmetro das fibras dos músculos EDL (B) e lumbricales (C-F),
numerados de 1 a 4 segundo a posição anatômica.
24
2. Padronização da dosagem do aminoácido tirosina
2.1. Curva Padrão de dosagem de tirosina
A liberação de tirosina pelos músculos lumbricales em função do tempo
reflete a velocidade da proteólise muscular (Baracos e Goldberg, 1986). Neste
estudo, a dosagem da tirosina foi padronizada com base no método descrito por
Waalkes e Udenfriend (1957). A figura 7A mostra curvas-padrão de tirosina obtidas,
na ausência ou presença da etapa de extração com dicloroetano. Conforme descrito
no item 5 de Materiais e Métodos, a reação é altamente específica para composto
fenólicos, como a L-tirosina (Figura 7B). Embora as duas curvas tenham se ajustado
à regressão linear (r2 = 0,99), a extração com 1,2-dicloroetano aumentou em 200
vezes a sensibilidade do método. O aumento da sensibilidade promovido por esta
etapa de extração, inicialmente descrito no macrométodo proposto por Waalkes e
Udenfriend (1957), permitiu a adaptação da dosagem para micrométodo, utilizando
microplaca de 96 fossos.
Unidade de Fluorescência
A
40
B
com dicloroetano
30
20
10
sem dicloroetano
0
0
2
4
6
8
10
Concentração de tirosina (µ
µg/ml)
Figuras 7. (A) Curvas-Padrão de tirosina obtidas na ausência ou presença da etapa de extração com
1,2-dicloroetano. Cada ponto representa a média de ensaios realizados em duplicata. (B) Estrutura
química da molecula da L-tirosina mostrando o grupo fenólico.
25
3. Introdução e validação da metodologia de medida da proteólise
muscular
3.1. Efeito do tempo de incubação na proteólise de músculos lumbricales
controles
A figura 8 ilustra a liberação basal de tirosina de músculos lumbricales
mantidos a 37ºC em Tyrode por 1 a 5 h. A proteólise basal foi aumentada
proporcionalmente ao tempo até a 3ª hora de incubação, estabilizando-se em 0,42 ±
0,03 nmol/ mg (figura 8). A partir desses dados, os experimentos subseqüentes
(nmol tirosina/ mg/ tempo)
Proteólise
foram realizados incubando-se os músculos por 2h em Tyrode.
0.6
0.5
**
**
**
0.4
*
0.3
0.2
0.1
0.0
0
1
2
3
4
5
Tempo de incubação (h)
Figura 8. Efeito do tempo de
incubação na proteólise (liberação de
tirosina) de músculos lumbricales
incubados por 2h com ciclohexamida.
Cada barra representa a média ± erropadrão da média de 3 a 9 músculos
de 3-5 animais.
(*) significantemente diferente de 1h;
(**) significantemente diferente de 2h.
P < 0,05.
3.2. Relação entre a posição anatômica dos lumbricales e a proteólise
muscular
A figura 9 representa a proteólise basal dos 4 músculos lumbricales,
numerados de acordo com a posição anatômica, a partir da região medial da pata
dos animais. Não foi detectada diferença estatística entre a proteólise basal dos
músculos, sugerindo que estes sejam metabolicamente equivalentes (figura 9).
Experimentos realizados apenas com o metatarso mostram que não há liberação
detectável de tirosina pelo osso (figura 9).
26
(nmol tirosina/ mg/ h)
Proteólise
0.20
0.15
0.10
0.05
ND
0.00
1
2
3
4
Osso
Figura 9. Proteólise (liberação de
tirosina) de músculos lumbricales,
numerados de 1 a 4 de a partir da região
medial e dos metatarsos (Osso). Cada
barra representa a média ± erro-padrão
da média de 6 músculos de 3 animais.
ND = não detectável.
Lumbricalis
3.3. Interferência da síntese protéica na medida da proteólise do músculo
lumbricalis
Para avaliar a interferência da síntese protéica na medida da proteólise
muscular, a medida da liberação de tirosina foi realizada na presença do inibidor da
síntese protéica ciclohexamida 0,5 mM, que aumentou em 30% a proteólise basal
(0,12 ± 0,01 nmol/ mg/ h) (figura 10). Com base nestes dados, em todos os
experimentos subseqüentes, adicionamos ao meio de incubação ciclohexamida 0,5
mM.
*
(nmol tirosina/ mg/ h)
Proteólise
0.16
Figura 10. Interferência da síntese
protéica na medida da proteólise
(liberação de tirosina) de músculos
lumbricales incubados por 2h com
ciclohexamida.
Cada
barra
representa a média ± erro-padrão da
média de 8 músculos de 4 animais.
(*) significantemente diferente do
grupo controle; P<0,05.
0.12
0.08
0.04
0.00
Controle
Ciclohexamida
0,5 mM
27
3.4. Efeito da lesão mecânica e da desnervação cirúrgica na proteólise do
músculo lumbricalis
Para averiguarmos se o método era capaz de detectar modificações na
liberação de tirosina, avaliamos o efeito da lesão mecânica dos músculos através
de cortes concêntricos na região medial do músculo. Conforme mostrado na
figura 11, a lesão aumentou a proteólise basal (0,14 ± 0,01 nmol/ mg/ h) em 57%.
Neste modelo, a indução de catabolismo é resultante do intenso influxo de Ca2+
na fibra muscular, que culmina no aumento da proteólise (Furuno e Goldberg,
1986).
Proteólise
(nmol tirosina/ mg/ h)
0.25
*
0.20
0.15
0.10
0.05
0.00
Controle
Lesionado
Figura 11. Efeito da lesão
mecânica na proteólise (liberação
de
tirosina)
de
músculos
lumbricales incubados por 2h com
ciclohexamida.
Cada
barra
representa a média ± erro-padrão
da média de 6 músculos de 3
animais.
(*) significantemente diferente do
grupo controle; P<0,05.
Da mesma forma, a desnervação por 3 e 7 dias, induzida pela secção do nervo
tibial, aumentou em 28% e 64% respectivamente a proteólise muscular basal (0,14 ±
0,01 nmol/ mg/ h; figura 12A). Esse efeito foi acompanhado pela redução de 10% e
25% da massa muscular (38,5 ± 1,2 mg; figura 12B), o que valida o uso de músculos
lumbricales de rato adulto como modelo experimental para o estudo do catabolismo
muscular esquelético.
28
Proteólise
(nmol tirosina/ mg/ h)
0.30
*
0.24
*
0.18
0.12
0.06
sham 1
3
7
40
(mg)
Massa Muscular
50
*
30
*
20
10
sham 1
3
7
Período de Desnervação (dias)
Figura 12. Efeito da desnervação por
1, 3 e 7 dias na proteólise (liberação
de tirosina) (A) e na massa (B) dos
músculos lumbricales. Cada barra
representa a média ± erro-padrão da
média de 8-12 músculos de 4-6
animais. (*) significantemente diferente
do grupo controle (sham); P<0,05.
3.5. Contribuição dos sistemas ubiquitina-proteassoma e das calpaínas na
proteólise do músculo lumbricalis
Em geral, os principais sistemas envolvidos na degradação protéica muscular
esquelética são aqueles dependentes de ATP (sistema ubiquitina-proteassoma) ou
de Ca2+ (sistema das calpaínas) (Nader et al., 2002; revisão; figura 1).
A contribuição desses sistemas em nosso modelo experimental foi avaliada
pela pré-incubação dos músculos lumbricales de ratos adultos com o inibidor do
sistema ubiquitina-proteassoma MG132 (20 µM) (Kadlcíková et al., 2005) ou com os
inibidores do sistema das calpaínas E64 (25 µM) e leupeptina (50 µM) (Navegantes
et al., 2001). O veículo utilizado para a diluição das drogas (DMSO 0,2%) não
modificou a liberação basal de tirosina (basal = 0,13 ± 0,01 nmol/ mg/ h; DMSO =
0,12 ± 0,01 nmol/ mg/ h). A incubação dos músculos lumbricales com MG132 ou
com E64 e leupeptina reduziu em 40% e 20%, respectivamente, a proteólise obtida
29
na presença de DMSO (Figura 13). É interessante notar que a incubação conjunta
dos inibidores de calpaínas e de proteassoma não ocasionou uma somação dos
efeitos inibitórios, o que confirma elegantemente a teoria atual de que o sistema
ubiquitina-proteassoma é a etapa limitante do processo de proteólise muscular
(Robert et al., 2004; revisão; figura 1).
(nmol tirosina/ mg/ h)
Proteólise
0.14
0.12
*
0.10
**
***
0.08
0.06
0.04
Basal
DMSO
E64 +
Leup
MG132
MG132 +
E64 + Leup
Figura 13. Efeito de inibidor de proteassoma (MG132 20 µM) e de inibidores de calpaínas (E64 25
µM e leupeptina 50 µM) na proteólise (liberação de tirosina) de músculos lumbricales incubados por
2h com ciclohexamida. Cada barra representa a média ± erro-padrão da média de 8 músculos de 4
animais. Significantemente diferente do grupo controle + veículo (DMSO): *P<0,05, **P<0,005,
***P<0,0001.
3.6. Efeitos da maturação do rato na proteólise do músculo lumbricalis
Para avaliar se o modelo experimental permite a análise direta da proteólise em
músculos de ratos em diferentes estágios do desenvolvimento pós-natal,
comparamos a proteólise basal de músculos lumbricales de animais impúberes e
adultos. Como mostrado na figura 14, a proteólise de músculos de ratos de 30 dias
(0,33 ± 0,01 nmol/ mg/h) foi 94% superior àquela de animais com 3 meses de
idade. Este dado, por si só, pode impedir a extrapolação dos resultados obtidos em
animais impúberes para adultos.
30
maturação
Proteólise
(nmol tirosina/ mg/ h)
0.4
0.3
*
0.2
Figura 14. Efeito da maturação animal na
proteólise (liberação de tirosina) de
músculos lumbricales incubados por 2h
com ciclohexamida. Cada barra representa
a média ± erro-padrão da média de
músculos de 4 animais.
(*) significantemente diferente do grupo
impúbere (zero); P<0,05.
0.1
0.0
30
90
Idade (Dias)
Para averiguarmos se a proteólise aumentada no músculo lumbricalis do
animal impúbere não era devido a algum artefato do sistema, determinamos a
proteólise na presença de dinitrofenol 0,5 mM, depletor de estoques intracelulares
de ATP, via desacoplamento do transporte de elétrons e da ATP sintase mitocondrial
(Stuart et al., 1999; revisão). Conforme mostrado na figura 15, o dinitrofenol reduziu
em 38% a proteólise do músculo lumbricalis (0,29 ± 0,01 nmol/ mg/ h), efeito
semelhante aquele obtido com MG132, em músculo de ratos adultos (figura 13).
(nmol tirosina/ mg/ h)
Proteólise
0.4
0.3
*
0.2
0.1
0.0
Controle
Dinitrofenol
Figura 15. Efeito da depleção de
ATP com dinitrofenol 0,5 mM na
proteólise (liberação de tirosina)
de músculos lumbricales de
animais impúberes incubados
por 2h com ciclohexamida. Cada
barra representa a média ± erropadrão da média de músculos
de 4 animais. (*) significantemente diferente do grupo
controle (zero); P<0,05.
31
4. Efeito de moduladores da via do AMPc na proteólise muscular
esquelética
Considerando o papel crucial da via da proteína Gs/ AC/ AMPc na manutenção
do trofismo muscular, e que apenas músculos de animais impúberes vêm sendo
utilizados para os ensaios de medida da proteólise muscular, analisamos a
viabilidade do uso de moduladores da via de sinalização do AMPc na inibição da
proteólise de músculo lumbricalis de rato adulto em situações basais e de
hipercatabolismo.
4.1. Efeito da ativação de adrenoceptores β na proteólise muscular
A ação trófica anticatabólica dos agonistas de adrenoceptores β já foi descrita
em músculos esqueléticos de ratos impúberes (Navegantes et al., 2001). Em nosso
modelo, avaliamos o efeito anticatabólico do agonista clássico não-seletivo de
adrenoceptores β, isoproterenol (10 a 100 µM). A incubação por 2 h com a droga
(30 e 100 µM) reduziu em 13 e 20 % a proteólise basal (0,15 ± 0,01 nmol/ mg/ h;
figura 16) de músculos lumbricales.
(nmol tirosina/ mg/ h)
Proteólise
0.16
*
0.12
*
0.08
0.04
0.00
0
10
30
Isoproterenol (µM)
100
Figura 16. Efeito do isoproterenol
na proteólise (liberação de tirosina)
de músculos lumbricales incubados
por 2h com ciclohexamida. Cada
barra representa a média ± erropadrão da média de 12 músculos
de 6 animais. (*) significantemente
diferente do controle (zero); P<0,05.
O efeito do isoproterenol também foi avaliado em músculos lumbricales
submetidos à desnervação por 3 dias. Conforme mostrado na figura 17, o
isoproterenol atenuou o efeito hipercatabólico do músculo desnervado (0,18 ± 0,01
32
nmol/ mg/ h), restabelecendo os valores da proteólise àqueles de músculo controle
inervado (0,14 ± 0,01 nmol/ mg/ h).
(nmol tirosina/ mg/ h)
Proteólise
0.25
Basal
ISO 100 µM
0.20
*
**
0.15
*
0.10
0.05
0.00
Controle
O
efeito
do
Desnervado
isoproterenol foi mimetizado
Figura 17. Efeito do isoproterenol
(ISO, 100 µM) na proteólise
(liberação de tirosina) de músculos
lumbricales
controles
e
desnervados incubados por 2h com
ciclohexamida.
Cada
barra
representa a média ± erro-padrão
da média de músculos de 4-6
animais.
(*)
significantemente
diferente do grupo controle não
tratado;
(**)
significantemente
diferente do grupo desnervado não
tratado; P<0,05.
pelo agonista seletivo
de
adrenoceptores β2, formoterol. A incubação dos músculos lumbricales por 2 h com
formoterol 1 a 10 nM reduziu em 12 a 20% a proteólise basal (0,16 ± 0,01 nmol/
mg/ h; figura 18). Cabe ressaltar que os efeitos antiproteolíticos do formoterol foram
observados em concentrações equivalentes àquelas plasmáticas eficazes na
profilaxia da crise asmática, o que pode evidenciar uma nova utilidade terapêutica
para este fármaco.
(nmol tirosina/ mg/ h)
Proteólise
0.20
*
0.15
*
*
3
10
0.10
0.05
0.00
0
1
Formoterol (nM)
Figura 18. Efeito do formoterol na
proteólise (liberação de tirosina)
de
músculos
lumbricales
incubados
por
2h
com
ciclohexamida.
Cada
barra
representa a média ± erro-padrão
da média de 9-13 músculos de 67 animais. (*) significantemente
diferente do grupo controle (zero);
P<0,05.
33
Conforme mostrado na figura 19, o formoterol também atenuou em 20% o
efeito hipercatabólico de músculos desnervados por 3 dias (0,23 ± 0,01 nmol/ mg/
h).
(nmol tirosina/ mg/ h)
Proteólise
0.30
0.25
Basal
Formoterol 3 nM
*
**
0.20
0.15
*
0.10
0.05
0.00
Controle
Desnervado
Figura 19. Efeito do formoterol (3 nM)
na proteólise (liberação de tirosina) de
músculos lumbricales controles ou
desnervados por 3 dias. Cada barra
representa a média ± erro-padrão da
média de músculos de 4-6 animais. (*)
significantemente diferente do grupo
controle não tratado; (**) significantemente diferente do grupo desnervado
não tratado; P<0,05.
4.2. Efeito da inibição de fosfodiesterases e da ativação da adenilil ciclase
na proteólise muscular
A incubação dos músculos lumbricales com 3-Isobutil-1-metilxantina (IBMX),
inibidor não-seletivo de fosfodiesterases, promoveu a redução de 15% da
proteólise basal (0,14 ± 0,01 nmol/ mg/ h) (figura 20), mimetizando o efeito do
Isoproterenol (figura 16).
(nmol tirosina/ mg/ h)
Proteólise
0.16
*
0.12
*
0.08
0.04
0.00
0
30 100 300 1000
IBMX (µM)
Figura 20. Efeito da 3-isobutil-1metilxantina (IBMX) na proteólise
(liberação de tirosina) de músculos
lumbricales incubados por 2h com
ciclohexamida.
Cada
barra
representa a média ± erro-padrão
da média de 8-16 músculos de 4-8
animais.
(*)
significantemente
diferente do grupo controle (zero);
P<0,05.
34
A Ativação direta da adenilil ciclase com forscolina 30 e 100 nM, diterpeno
isolado de plantas do gênero Coleus, reduziu em 12-17% a proteólise basal dos
músculos lumbricales (0,14 ± 0,01 nmol/ mg/ h; figura 21). O efeito observado
coloca a adenilil ciclase como um importante alvo farmacológico de modulação do
catabolismo muscular.
(nmol tirosina/ mg/ h)
Proteólise
0.16
*
*
0.12
Figura 21. Efeito da forscolina na
proteólise (liberação de tirosina) de
músculos lumbricales incubados por
2h com ciclohexamida. Cada barra
representa a média ± erro-padrão da
média de 4-16 músculos de 4-8
animais.
(*)
significantemente
diferente do grupo controle (zero);
P<0,05.
0.08
0.04
0.00
0
10
30
100
Forscolina (nM)
4.3. Efeito de moduladores da via de sinalização do AMPc na proteólise
muscular de animais impúberes
Além disso, o efeito dos moduladores da via de sinalização do AMPc forscolina
100 nM, IBMX 300 µM e formoterol 3 nM na proteólise muscular de animais
impúberes também foi avaliado (figura 22). Todas as drogas inibiram em 20% a
proteólise de maneira similar a de animais adultos, sugerindo que, para esta via de
sinalização, seu efeito anticatabólico permanece preservado na idade adulta.
Impúbere
Proteólise
(nmol tirosina/ mg/ h)
0.36
0.30
*
*
Adulto
*
0.24
0.18
#
*
0.12
*
*
0.06
0.00
C
Fsk IBMX Form
C
Fsk IBMX Form
Figura
22.
Efeito
dos
moduladores da via de sinalização
do AMPc (forscolina, Fsk; IBMX e
formoterol, Form) na proteólise de
músculos lumbricales de animais
adultos (3 meses) e impúberes (1
mês), incubados por 2h com
ciclohexamida.
Cada
barra
representa a média ± erro-padrão
da média de músculos de 4-6
animais. (*) significantemente
diferente do respectivo controle
(C); (#) significantemente diferente
do grupo impúbere ; P<0,05.
35
4.4. Efeito de moduladores da via de sinalização do AMPc na proteólise de
músculos EDL de animais impúberes
Por fim, comparamos o efeito de moduladores da via de sinalização do AMPc
na proteólise de músculos lumbricales adultos e impúberes com aqueles de
músculos EDL de animais impúberes (30 dias de idade), largamente utilizado para
medida de proteólise muscular na literatura atual. Tanto o formoterol (3 nM) como a
forscolina (100 nM) inibiram em 20% a proteólise basal de músculos lumbricales de
ratos adultos (0,14 ± 0,01 nmol/ mg/ h), impúberes (0,32± 0,01 nmol/ mg/ h) e EDL
de animais impúberes (0,10± 0,01 nmol/ mg/ h). A proteólise de músculos
lumbricales impúberes representou cerca de 3 vezes aquela de músculos EDL de
animais impúberes (figura 23). A proteólise de músculos EDL de animais adultos não
pôde ser medida devida à limitação metodológica já descrita anteriormente.
Lumbricales
Impúbere
#
0.3
0.2
0.1
EDL
Impúbere
*
*
Fo Ba
rm sa
l
Fo ote
rs rol
co
lin
a
0.0
*
Adulto
*
Adulto
*
*
?
Fo Ba
rm sa
l
Fo ote
rs rol
co
lin
a
Fo Ba
rm sa
l
Fo ote
rs rol
co
lin
a
(nmol tirosina/ mg/ h)
Proteólise
0.4
Figura 23. Efeito da forscolina (100 nM) e formoterol (3 nM) na proteólise (liberação de tirosina) de
músculos lumbricales e EDL de ratos adultos e impúberes incubados por 2h com ciclohexamida.
Cada barra representa a média ± erro-padrão da média de músculos de 5-6 animais. (?) A proteólise
de EDL de rato adulto não pôde ser medida devido à limitação metodológica. (*) significantemente
diferente do respectivo controle (Basal); (#) significantemente diferente do EDL impúbere; P<0,05.
V. DISCUSSÃO
37
A regulação fina da proteólise muscular é um processo fundamental no controle
da homeostase energética corporal, permitindo a manutenção adequada da massa
muscular e do crescimento corporal (Kettelhut et al., 1988; revisão). Como o músculo
esquelético é considerado o maior reservatório protéico do organismo, a hidrólise de
proteínas musculares para a geração de aminoácidos é uma etapa importante, por
exemplo, na gliconeogênese. Além disso, a manutenção da massa muscular é
freqüentemente associada ao balanço entre a proteólise e a síntese protéica
(Kettelhut at., 1988; revisão). Esses dois processos são majoritariamente regulados
por fatores nutricionais, hormonais e neuronais (Robert et al., 2004; revisão). A
quebra da homeostase entre esses dois processos pode resultar em condições
patológicas debilitantes acompanhadas de atrofia muscular, e que são claramente
evidenciadas em modelos experimentais de desnervação, ou em várias doenças de
cunho degenerativo: esclerose lateral amiotrófica, distrofia de Duchenne, dentre
outras (Robert et al., 2004; revisão).
Considerando que a via da proteína Gs/AC/AMPc tem participação crucial na
manutenção do trofismo muscular (Navegantes et al., 2000), e que apenas músculos
de animais impúberes vêm sendo utilizados para os ensaios de proteólise muscular
devido à limitação metodológica, caracterizamos neste trabalho um novo modelo de
estudo in situ da proteólise muscular no animal adulto, que foi validado pela análise
do efeito de ativadores/moduladores da via de sinalização do AMPc na proteólise
muscular em condições basais e catabólicas.
38
1. Caracterização
do
novo
modelo
de
estudo
da
proteólise muscular
Nessa primeira parte do estudo, realizamos a caracterização morfológica do
modelo de estudo proposto, o músculo lumbricalis, comparando-o com o EDL do
rato adulto, músculo geralmente utilizado em ensaios de proteólise (Baracos e
Goldberg, 1986; Navegantes et al., 2000). Nossos dados mostram que os músculos
lumbricales possuem massa 3 vezes menor que a do EDL (figura 4). Além disso, as
fibras dos músculos lumbricales apresentaram diâmetro 20% menor que aquelas do
músculo EDL (figura 5). Estes aspectos são de extrema relevância para a medida da
proteólise muscular, visto que o protocolo de medida da liberação de tirosina exige
músculos delgados com fibras de diâmetro suficientemente pequenos para uma
perfeita perfusão tecidual (Baracos e Goldberg, 1986; Baviera et al., 2006). Como se
pode destacar, a utilização do músculo EDL de animal adulto é inviável para a
realização desses protocolos, já que ao longo do experimento, as fibras musculares
mais internas inevitavelmente sofrem necrose tecidual (Navegantes et al., 2000),
além de indução de catabolismo não condizente à condição in vivo. Por fim, como se
pode notar na figura 6, o diâmetro médio das fibras foi semelhante nos 4 músculos
lumbricales de cada pata, seguindo um padrão de distribuição normal Gaussiano,
independentemente da posição anatômica de cada músculo, indicando uma
homogeneidade no tamanho das fibras.
De acordo com a descrição histoquímica de Gates et al. (1991); os músculos
lumbricales possuem um padrão de fibras de contração rápida semelhante ao EDL
(tipo II), com cerca de 90% de fibras rápidas (tipo II). Esse perfil assemelha-se muito
mais aquele de músculos de humanos, nos quais predominam as fibras rápidas
(Gates et al., 1991). Além disso, músculos constituídos majoritariamente por fibras
lentas, como o sóleo, possuem um padrão de atrofia diferente daquelas de fibras
rápidas (Rennie et al., 2009; revisão). Como exemplos, em modelo de desuso por
imobilização, o músculo sóleo perde massa muscular a uma taxa maior (3% ao dia)
que aquela do EDL, cuja perda de massa ocorre a uma taxa de 0,8% ao dia (Rennie
et al., 2009; revisão). Em humanos, a imobilização causa uma perda de massa
muscular em músculos quadríceps a uma taxa de 0,5% ao dia, isto é, mais próxima
do padrão de fibras do tipo II (De Boer et al., 2007). Considerando a limitação
39
metodológica da medida da proteólise em músculos de ratos adultos (Rennie et al.,
2009; revisão), fomos avaliar se era possível utilizar o modelo de músculos
lumbricales para a medida da proteólise muscular.
2. Padronização da técnica de dosagem do aminoácido
tirosina
A técnica atual para dosagem da tirosina, aminoácido utilizado como marcador
dinâmico da proteólise muscular, foi inicialmente descrita por Waalkes e Udenfriend
(1957) sendo realizada em volume final de 10 mL, com geração de um volume muito
grande de rejeitos tóxicos. A dosagem da tirosina liberada por músculos utilizando
esta técnica já é largamente empregada pela literatura, assegurando sua validade e
confiabilidade (Navegantes et al.; 2000; Baviera et al., 2006; Baracos e Goldberg,
1986).
Por outro lado, a adaptação do método à microplaca, proposta por Tina e
Gregory (2007), resultava na redução da sensibilidade de detecção de tirosina. No
presente trabalho, padronizamos um micrométodo de medida da tirosina, com
sensibilidade 200 vezes maior que aquela do método descrito por Tina e Gregory,
(2007). A técnica baseia-se na formação de um composto fluorescente estável,
detectável sob excitação a 485 nm e emissão a 590 nm, após reação (derivatização)
de L-tirosina das amostras com nitroso-naftol na presença de ácido nítrico a 55º C, já
que a reação é claramente endergônica. Esta reação possui alta especificidade para
compostos fenólicos, como a L-tirosina (Tina e Gregory, 2007). Contudo, no método
atual de microplaca, a baixa sensibilidade (50 µg/ml) devido à interferência de
produtos de cor amarela que suprimem a medida adequada do fluoróforo, foi
aumentada em 200 vezes pela inclusão de um passo (adição de 1,2 dicloroetano)
responsável pela extração do nitroso naftol (figura 7). Logo, aliamos a alta
sensibilidade do macrométodo proposto por Waalkes e Udenfriend, (1957) com um
baixo volume de reagentes (Tina e Gregory, 2007), o que permitiu a adaptação da
dosagem do aminoácido tirosina à microplaca de 96 poços e a mensuração
simultânea de várias amostras. Esta adaptação permite que o método seja utilizado
para realização de triagem farmacológica, na qual a dosagem de um elevado
número de amostras se faz necessária.
40
3. Introdução e validação da metodologia de medida da
proteólise muscular
Na terceira parte do presente estudo, validamos o modelo de músculo
lumbricalis para a medida dinâmica da proteólise muscular esquelética, o que pode
propiciar o estudo da regulação do catabolismo muscular em diferentes idades do
desenvolvimento pós-natal (impúbere, adulto e senil), além de doenças crônicas
degenerativas associadas, abordagem ainda não explorada pela literatura
(Navegantes et al., 2001; Baviera et al., 2006; Furuno e Goldberg, 1986). Este novo
modelo foi validado reproduzindo resultados clássicos de proteólise muscular
relatados pela literatura, como lesão muscular aguda (Figura 11) e secção no
neurônio motor (Reid, 2005; revisão; figura 12), situações nas quais a proteólise
muscular está visivelmente aumentada. Em condições basais, a velocidade de
proteólise do músculo lumbricalis manteve-se constante entre 1 a 3 horas de
incubação (Figura 8). Logo, o tempo médio de 2 h foi escolhido como tempo de
incubação para os experimentos subseqüentes. Além disso, não houve liberação
detectável de tirosina pelos ossos metatarsos incubados na ausência dos músculos
lumbricales (figura 9), demonstrando que a liberação do aminoácido neste sistema é
exclusiva dos músculos lumbricales.
A proteólise muscular basal de cada um dos 4 músculos lumbricales de cada
pata também foi avaliada, não sendo detectada diferença estatística entre os
músculos de uma mesma pata (figura 9). Estes resultados permitem a análise de
drogas na proteólise muscular em ensaios emparelhados, utilizando músculos de um
mesmo animal como controle (n=8/animal). A possibilidade de redução do número
de animais a serem utilizados nos protocolos experimentais, comparativamente à
metodologia atual que utiliza músculos Sóleo ou EDL (n=2/animal) permite inferir
que este sistema é eticamente mais vantajoso em relação àqueles descritos na
literatura (Navegantes et al., 2000; Baracos e Goldberg, 1986). Esta constatação
está em perfeita sintonia com os “Princípios Básicos do Código Internacional” de
1985, no qual se preconiza “utilizar o mínimo de animais necessário para se obterem
resultados válidos”.
Como estamos lidando com um sistema dinâmico e os processos de síntese e
degradação protéicas acontecem simultânea e continuamente (Robert et al., 2004;
41
revisão), a interferência da síntese protéica na medida da proteólise não deve ser
desconsiderada. A adição do inibidor de síntese protéica ciclohexamida no meio de
incubação aumentou a quantidade de tirosina detectada (figura 10), o que pôde ser
atribuído ao bloqueio da reutilização do aminoácido liberado pelo músculo na síntese
protéica. Assim, a inclusão da ciclohexamida ao meio de incubação garantiu que os
efeitos de drogas avaliados nos experimentos subseqüentes fossem exclusivamente
relacionados ao processo de degradação protéica (Navegantes et al.; 2000; Baviera
et al., 2006; Baracos e Goldberg, 1986).
O catabolismo muscular exacerbado devido à lesão aguda, pioneiramente
descrito por Furuno e Goldberg (1986), foi satisfatoriamente mimetizado em nosso
sistema (figura 11) assegurando a sua validação. A lesão obtida a partir de cortes
concêntricos na musculatura esquelética leva ao aumento de influxo de cálcio e
consequente ativação de proteases intracelulares, como as calpaínas, já que o uso
de inibidores específicos de proteases abole a proteólise (Furuno e Goldberg, 1986).
A secção do nervo tibial também aumentou a proteólise do músculo lumbricalis,
de forma tempo-dependente (figura 12A) e paralela à atrofia muscular (figura 12B).
Nesta condição, o aumento da atividade do sistema ubiquitina-proteassoma é
majoritariamente responsável pela atrofia muscular (Medina et al., 1995). Logo,
desde a década de 90 este sistema vem sendo considerado como alvo terapêutico
para o desenvolvimento de fármacos que atenuem o catabolismo muscular
exacerbado (Tawa et al., 1997), razão pela qual esta área de estudo foi contemplada
com um prêmio Nobel (Neefjes et al., 2004). A larga participação do sistema
ubiquitina-proteassoma nos processos de degradação protéica também foi
constatada em nosso sistema. A inibição do proteassoma pela incubação dos
músculos lumbricales com MG-132 reduziu em 40% a proteólise basal, o dobro da
redução da proteólise observada pela inibição das calpaínas com E64 e leupeptina
(figura 13). Além disso, a associação dos inibidores de calpaínas e de proteassoma
não causou uma somação de efeito inibitório, o que está de acordo com a teoria
atual de que a proteólise dependente de calpaínas converge para a via do sistema
ubiquitina proteassoma, sendo este último a etapa limitante no processo de
degradação protéica (Robert et al., 2004; revisão; figura 1). Este dado pode ser
importante para o desenvolvimento de estratégias terapêuticas, já que a associação
de inibidores dos vários sistemas proteolíticos pode ser desnecessária no tratamento
42
de doenças que resultam em atrofia muscular, sendo então mais indicado a
monoterapia.
Outra vantagem do nosso sistema refere-se à facilidade de incubação do
músculo em seu comprimento anatômico, através da fixação ao metatarso e à
eliminação do uso de hastes e suportes de fixação (Navegantes et al.; 2001; Baviera
et al., 2006; Furuno e Goldberg, 1986). De acordo Baracos e Goldberg, (1986), o
comprimento anatômico é essencial para uma correta medição da proteólise
muscular, já que a não observância desta condição pode levar à indução do
catabolismo, por exemplo, via aumento do influxo de cálcio para o sarcoplasma e
ativação de proteases.
A questão da estabilidade e resistência metabólica também é de fundamental
importância quanto ao uso e à extrapolação de resultados obtidos em modelos
animais para humanos (Demetrius, 2005; revisão). Foi demonstrado que há uma
correlação linear (y=24.09x+2.68) entre a porcentagem de atrofia e a taxa
metabólica (consumo de O2 por kg/h) (Rennie et al., 2009; revisão). Isto implica que
animais de pequeno porte como camundongos, por terem menor fração de massa
muscular em relação à massa corporal total, sejam mais susceptíveis à perda de
proteína muscular para a manutenção da gliconeogênese e do sistema imunológico
(Demetrius, 2005), e não satisfazem os requisitos bioquímicos básicos para a
obtenção de resultados experimentais válidos para a extrapolação em modelo
humano. Além disso, de acordo com a teoria proposta por Demetrius (2005),
modelos experimentais que utilizam ratos, que invariavelmente possuem maior peso
corporal em relação aos camundongos, propiciam a obtenção de resultados
experimentais mais facilmente extrapoláveis para o modelo humano.
Em nosso estudo também constatamos que a proteólise muscular do rato
impúbere está visivelmente aumentada em relação ao animal adulto (figura 14). Este
resultado foi validado através do uso de inibidores que classicamente reduzem a
proteólise muscular, como o depletor de ATP dinitrofenol (Furuno e Goldberg, 1986,
Navegantes et al., 2000; Figura 15). A depleção de ATP muscular reduz a atividade
do sistema ubiquitina-proteassoma dependente de ATP, culminando na redução
global da degradação protéica (Furuno e Goldberg, 1986, Navegantes et al., 2000,
Navegantes et al., 2009; revisão), indicando que a maior taxa de proteólise
observada em músculos lumbricales de animais impúberes, em relação a músculos
de animais adultos, não é devido a artefato do sistema.
43
Resultados anteriores de nosso laboratório já demonstravam alterações tróficas
no decorrer da maturação do músculo. Como exemplo, a atividade da AChE de
músculos EDL aumenta proporcionalmente ao crescimento do músculo até a
puberdade (Souccar et al., 1988). Contudo, após este período, observa-se um
aumento mais lento de AChE, de forma não paralela ao crescimento muscular
(Souccar et al., 1988), indicando que a maturação animal altera proteínas chave de
manutenção do trofismo muscular. A redução da proteólise muscular durante a
maturação foi descrita em uma única publicação, utilizando como modelo
experimental músculos de camundongos da linhagem B6C3F1 (Reynolds et al.,
2002). Embora esses resultados tenham sido obtidos em espécie animal cuja
extrapolação para humanos é questionável, os mesmos corroboram a hipótese da
existência de uma correlação inversa entre crescimento e proteólise musculares
(figura 14), o que poderia inviabilizar a extrapolação de resultados obtidos em
animais impúberes para adultos.
44
4. Efeito do uso de moduladores da sinalização mediada
pelo AMPc na proteólise muscular esquelética em
situações basais e catabólicas
Após a devida validação do sistema de estudo, averiguamos o efeito de
moduladores da sinalização mediada pelo AMPc na proteólise muscular esquelética
em situações basais e catabólicas, via de sinalização que vem sendo estudada há
mais de 10 anos em nosso laboratório. Vários autores demonstraram o papel desse
sistema nos processos de degradação protéica e na manutenção do trofismo
muscular, abrindo uma nova perspectiva terapêutica para doenças associadas à
atrofia muscular (Koopman et al., 2009; revisão). Navegantes et al. (2000) foram
pioneiros em demonstrar o envolvimento da cascata de sinalização na regulação da
proteólise muscular. Cabe ressaltar que os resultados descritos por seu grupo, assim
como por outros autores, foram obtidos utilizando-se apenas músculos de animais
impúberes, devido à limitação metodológica que imperava até então.
No presente estudo, a resposta do músculo lumbricalis à ativação da via
AC/AMPc foi primeiramente analisada utilizando o agonista não seletivo de
adrenoceptores β - isoproterenol. Evidenciamos que esta droga reduziu em 20% a
proteólise muscular de animais adultos controles, de forma concentraçãodependente (figura 16). Mostramos ainda que o isoproterenol atenua o
hipercatabolismo de músculos lumbricales desnervados (figura 17), reforçando
dados obtidos em músculos esqueléticos de ratos impúberes (Navegantes et al.,
2000).
Por ser um agonista de adrenoceptores β não seletivo, o isoproterenol exerce
seu efeito anticatabólico em concentrações que ativam tanto adrenoceptores β1
como β2. Assim, os efeitos cardiovasculares indesejáveis da droga inviabilizam sua
utilização terapêutica (Koopman et al., 2009; revisão). Por outro lado, o agonista
seletivo β2 formoterol, broncodilatador classicamente utilizado na reversão da crise
asmática, reduziu a proteólise muscular de forma concentração-dependente (Figura
18). A droga apresentou alta potência farmacológica (na ordem de nM) em relação
ao isoproterenol (na ordem de µM), abrindo a perspectiva de seu uso clínico para a
atenuação do catabolismo muscular exacerbado.
45
Além disso, o formoterol também atenuou o hipercatabolismo do músculo
desnervado (Figura 19), comprovando seu potencial terapêutico. Cabe ressaltar que
o formoterol é classificado como uma droga de longa duração (Anderson, 1991;
revisão), devido as suas propriedades farmacocinéticas, o que traria vantagens na
utilização crônica.
Por fim, o envolvimento da via de sinalização do AMPc no controle da
proteólise muscular no animal adulto foi confirmado pela redução da liberação de
tirosina pela forscolina (figura 21). Como esta droga consegue ativar diretamente a
AC, nossos dados demonstram que o aumento da síntese de AMPc, independente
do GPCR ou da proteína Gs, é condição suficiente para um efeito anticatabólico. Por
outro lado, a diminuição do catabolismo muscular pelo inibidor de fosfodiesterases
IBMX indica a existência de uma síntese basal de AMPc responsável pela
modulação do metabolismo de proteínas (figura 20).A demonstração que o efeito
anticatabólico da via de sinalização do AMPc pode ser alcançada na ausência da
ativação do receptor acoplado à proteína Gs estimulatória ou da inibição da
fosfodiesterase
coloca
a
adenilil
ciclase
e
fosfodiesterases
como
alvos
farmacológicos para desenvolvimento de medicamento que atenuem o catabolismo
muscular.
É interessante notar que todos os moduladores da via de sinalização do AMPc
utilizados alcançaram uma inibição máxima da proteólise da ordem de 20%. Dados
recentes obtidos em animais impúberes (Navegantes et al., 2009; revisão) mostram
que análogos do AMPc, como dibutiril-AMPc, inibem calpaínas intracelulares por um
mecanismo dependente da ativação de PKA. Devido ao tempo de incubação dos
músculos
ser
relativamente
curto
(2h),
é
possível
que
os
mecanismos
anticatabólicos sejam principalmente não-genômicos, via fosforilção de proteínas
chave. Possivelmente, os moduladores da via de sinalização do AMPc estejam
inibindo a proteólise via ativação de PKA e fosforilação de calpaínas, culminado na
redução global da degradação de proteínas (Navegantes et al., 2009; revisão). Esta
hipótese pode ainda ser suportada pelo fato de a incubação dos músculos
lumbricales com inibidores de calpaínas ter reduzido a proteólise basal também em
20% (figura 13).
De fato, formoterol, IBMX e forscolina promoveram inibição máxima de 20% da
proteólise muscular, determinada tanto em músculos de animais adultos como
impúberes, sugerindo que uma contribuição semelhante da via de sinalização do
46
AMPc na regulação do catabolismo de músculos de animais impúberes e adultos.
Comparando a proteólise basal de músculos lumbricales de animais impúberes e
adultos, observamos que a proteólise muscular do animal impúbere é quase o dobro
daquela do animal adulto (figura 22), dado que poderia impedir a extrapolação de
resultados obtidos em animais impúberes para adultos.
Por fim, testamos o efeito desses moduladores também em músculos EDL de
animais impúberes, e obtivemos resultados similares aos de animais adultos (figura
23), além daqueles obtidos por Navegantes et al. (2000), o que valida o uso do
músculo lumbricalis para o estudo da proteólise muscular, e confirma a ação
anticatabólica da via de sinalização do AMPc durante as diferentes fases do
desenvolvimento animal. Embora nossos dados demonstrem que é
possível
extrapolar as ações anticatabólicas da via do AMPc observada em músculos de
animal impúbere para o adulto, deve-se salientar que resultados de outras vias de
sinalização podem não ser igualmente extrapoláveis.
Em resumo, os resultados obtidos nesse trabalho podem abrir um leque de
opções para o estabelecimento de terapêutica medicamentosa para minimizar a
atrofia muscular inerente a estados catabólicos crônicos, colocando a via de
sinalização do AMPc como um alvo farmacológico importante para a atenuação do
catabolismo muscular. Além disso, a identificação de substâncias endógenas
sistêmicas ou secretadas pelo neurônio motor que modulem a proteólise muscular
via proteína Gs/AC/AMPc se faz necessária, o que pode aumentar nossa
compreensão atual acerca do controle neural da proteólise muscular, um tema
claramente obscuro na literatura atual.
VI. SINOPSE E CONCLUSÕES
48
Em conjunto, os resultados apresentados permitiram:
a padronização de um micrométodo para a medida do aminoácido
tirosina, diminuindo o consumo de reagentes e aumentando o rendimento de
dosagem;
a caracterização do músculo lumbricalis como um novo modelo in situ
de estudo da proteólise muscular esquelética incluindo aquela de animais
adultos
ou
portadores
de
doenças
relacionadas
ao
envelhecimento,
neurodegenerativas ou não;
demonstrar que a proteólise muscular no animal impúbere é
significantemente maior que aquela do animal adulto, sugerindo modificações
da proteólise durante a maturação do animal relacionadas ao processo de
crescimento muscular;
demonstrar que a via de sinalização do AMPc está fortemente
associada à regulação da proteólise muscular, o que pode colocar essa via de
sinalização como um potencial alvo farmacológico para modulação e a
atenuação do catabolismo muscular.
49
VII. REFERÊNCIAS
50
ALBRECHT, C.A.; GIESLER, G.M.; KAR, B.; HARIHARAN, R.; DELGADO, R.M.3RD
- Intravenous milrinone infusion improves congestive heart failure caused by
diastolic dysfunction: a brief case series. Text Heart. 32: 220-223, 2005.
ANDERSON, G.P. - Pharmacology of formoterol: an innovative bronchodilator.
Agents Actions Suppl. 34: 97-115, 1991.
ATTAIX, D.; BARACOS, V.E. - MAFbx/Atrogin-1 expression is a poor índex of
muscle proteolysis. Curr Opin Clin Nutr Metab Care. 13(3): 223-224, 2010.
BARACOS, V.E.; GOLDBERG, A.L. - Maintenance of normal length improves protein
balance and energy status in isolated rat skeletal muscles. Am J Physiol. 25: C58896, 1986.
BAVIERA, A.M.; ZANON, M.N.; NAVEGANTES, L.C.; MIGLIORINI, R.H.;
KETTELHUT, I.C. - Pentoxifylline inhibitis Ca2+ -dependent and ATP proteasomedependent proteolysis in skeletal muscle from acutely diabetic rats. Am J Physiol.
292: E702-E708, 2006.
BAVIERA, A.M.; ZANON, N.M.; NAVEGANTES, L.C.; KETTELHUT, I. C. Involvement of cAMP/Epac/PI3K-dependent pathway in the antiproteolytic effect of
epinephrine on rat skeletal muscle. Molecular and Cellular Endocrinology. 315: 104112, 2009.
BECHET, D.; TASSA, A.; TAILLANDIER, D.; COMBARET, L.; ATTAIX, D. Lysossomal proteolysis in skeletal muscle. Int J Biochem Cel Biol. 37: 2098-2114,
2005.
BERGANTIN, L.B.; ANDRADE-LOPES, A.L.; CHIAVEGATTI, T.; GODINHO, R.O. Effects of chronic denervation on adenylyl cyclase activity of fast and slow twitch
muscles. Journal of Molecular Neuroscience. 40: 236-237, 2010.
BODINE, S.C.; LATRES, E.; BAUMHUETER, S.; LAI, V.K.; NUNEZ, L.; CLARKE,
B.A.; POUEYMIROU, W.T.; PANARO, F.J.; NA, E.; DHARMARAJAN, K.; PAN, Z.Q.;
VALENZUELA, D.M.; DECHIARA, T.M.; STITT, T.N.; YANCOPOULOS, G.D.;
GLASS, D.J. - Identification of ubiquitin ligases required for skeletal muscle atrophy.
Science. 294: 1704-8, 2001.
BREUILLE, D.; FARGE, M.C.; ROSÉ, F.; ARNAL, M.; ATTAIX, D.; OBLED, C. Pentoxifylline decreases body weight loss and muscle protein wasting characteristics
of sepsis. Am J Physiol. 265: E660-E666, 1993.
CHIAVEGATTI, T.; ANDRADE-LOPES, A.L.; AVELLAR, M.C.; GODINHO, R.O. Fast- and slow- twitch rat muscles fibers express transcripts for multiple adenylyl
cyclase isoforms. Em: XXII Reunião Anual da Federação de Sociedades de Biologia
Experimental. Águas de Lindóia. Resumos, 2007.
51
COMBARET, L.; DARDEVET, D.; RIEU, I.; POUCH, M.N.; BÉCHET, D.;
TAILLANDIER, D.; GRIZARD, J.; ATTAIX, D. - A leucine-supplemented diet restores
the defective postprandial inhibition of proteasome-dependent proteolysis in aged rat
skeletal muscle. J Physiol. 569: 489-99, 2005.
D’AGOSTINO, R. B.; BELANGER, A.; RALPH, B.D. - A suggestion for using
powerful and informative tests of normality. The American Statistician. 44: 316–321,
1990.
DE BOER, M.D.; SELBY, A.; ATHERTON, P.; SMITH, K.; SEYNNES, O.R.;
MAGANARIS, C.N.; MAFFULLI, N.; MOVIN, T.; NARICI, M.V.; RENNIE, M.J. - The
temporal responses of protein synthesis, gene expression and cell signalling in
human quadriceps muscle and patellar tendon to disuse. J Physiol. 585: 241–251,
2007.
DEMETRIUS, L. - Of mice and men. When it comes to studying ageing and the
means to slow it down, mice are not just small humans. EMBO Rep. 6: S39–S44,
2005.
DEVAL, C.; MORDIER, S.; OBLED, C.; BECHET, D.; COMBARET, L.; ATTAIX, D.;
FERRARA, M. - Identification of cathepsin L as a differentially expressed message
associated with skeletal muscle wasting. Biochem J. 360: 143-150, 2001.
DUCLERT, A.; CHANGEUX, J.P. - Acetylcholine receptor gene expression at the
developing neuromuscular junction. Physiol Rev. 75: 339-368, 1995.
ERIKSSON, A. - Strength training and anabolic steroids. A comparative study of the
vastus lateralis, a thigh muscle and the trapezius, a shoulder muscle, of strengthtrained athletes. Dissertation, Umeå University, 2006a.
ERIKSSON, A.; LINDSTROM, M.; CARLSSON, L.; THORNELL, L. - Hypertrophic
muscle fibers with fissures in power-lifters; fiber splitting or defect regeneration?
Histochem Cell Biol. 126: 409–417, 2006b.
FURUNO, K.; GOLDBERG, A.L. - The activation of protein degradation in muscle by
Ca2+ or muscle injury does not involve a lysosomal mechanism. Biochem J. 237:
859-64, 1986.
GATES, H.J.; RIDGE, R.M.A.P.; ROWLERSON, A. - Motor Units of the Fourth Deep
Lumbrical Muscle of the Adult Rat: Isometric Contractions and Fiber Type
Compositions. Journal of Physiology. 443: 193-215, 1991.
GOMES, M.D.; LECKER, S.H.; JAGOE, R.T.; NAVON, A.; GOLDBERG, A.L. Atrogin-1, a muscle specific F-box protein highly expressed during muscle atrophy.
Proc Natl Acad Sci USA. 98: 14440-5, 2001.
52
GUTH, L.; ALBUQUERQUE, E.X. - The neurotrophic regulation of resting membrane
potential and extrajunctional acetylcholine sensitivity in mammalian skeletal muscle.
Physiol Bohemoslov. 27: 401-413, 1978.
HALL-ANGERAS, M.; ANGERAS, U.; HASSELGREN, P.O.; FISCHER, J.E. - Effects
of elevated temperature on protein breakdown in muscles from septic rats. Am J
Physiol. 258: C589-92, 1990.
HINKLE, R.T.; DOLAN, E.; CODY, D.B.; BAUER, M.B.; ISFORT, R.J. Phosphodiesterase 4 inhibition reduces skeletal muscle atrophy. Muscle nerve. 32:
775-781, 2005.
JASMIN, B.J.; GRAMOLINI, A.O.; ADATIA, F.A.; ANGUS, L.; BOUDREAULARIVIERE, C.; CHAN, R.Y.; KRUPA, A.M.; LUNDE, J.A.; MANKAL, F.A.; WU, J. Nerve-derived trophic factors and DNA elements controlling expression of genes
encoding synaptic proteins in skeletal muscle fibers. Can J Appl Physiol. 23: 366376, 1998.
KADLCÍKOVÁ, J.; HOLECEK, M.; SAFRÁNEK, R.; TILSER, I.; KESSLER, B.M. Effects of proteasome inhibitors MG132, ZL3VS and AdaAhx3L3VS on protein
metabolism in septic rats. Int J Exp Pathol. 85: 365-71, 2004.
KETTELHUT, I.C.; WING, S.S.; GOLDBERG, A.L. - Endocrine regulation of protein
breakdown in skeletal muscle. Diabetes Metab. Review. 4(8): 751-72, 1988.
KOOPMAN, R.; RYALL, L.G.; CHURCH, J.E.; LYNCH, J.S. - The role of betaadrenoceptors signaling in skeletal muscle: therapeutic implications for muscle
wasting disorders. Curr Opin Clin Nutr Metab Care. 12(6): 601-6, 2009.
LINDER, J.U. - Class III adenylyl cyclases: molecular mechanisms of catalysis and
regulation. Cell. Mol. Life Sci. 63: 1736-51, 2006.
LIPWORTH, B.J. - Phosphodiesterase -4 inhibitors for asthma and chronic
obstructive pulmonary disease. Lancet. 365: 167-175, 2005.
MANTILLA, C.B.; SIECK, G.C. – Trophic factor expression in phrenic motor neurons.
Respir Physiol Neurobiol. 164: 252-62, 2008.
MASIERO, E.; AGATEA, L.; MAMMUCARI, C.; BLAAUW, B.; LORO, E.; KOMATSU,
M.; METZGER, D.; REGGIANI, C.; SCHIAFFINO, S.; SANDRI, M. - Autophagy is
required to maintain muscle mass. Cell Metab. 10: 507-515, 2009.
MEDINA, R.; WING, S.S.; HASS, A.; GOLDBERG, A. L. - Activation of the ubiquitinATP-dependent proteolytic system in skeletal muscle during fasting and denervation
atrophy. Biomed Biochim Acta. 50: 347-56, 1991.
53
MEDINA, R.; WING, S.S.; GOLDBERG, A.L. - Increase in levels of polyubiquitin and
proteasome RNA in skeletal muscle during starvation and denervation atrophy.
Biochem J. 307: 631-637, 1995.
MERSMANN, H.J. - Overview of the effects of β-adrenergic receptor agonists on
animal growth incluiding mechanisms of action. J Amin Sci. 76: 160-172, 1998.
MILLIGAN, G.; KOSTENIS, E. - Heterotrimeric G-proteins: a short history. Br J
Pharmacol. 147: 46-55, 2006.
NADER, G.A.; HORNBERGER, T.A.; ESSER, K.A. -Translational control:implications
for skeletal muscle hypertrophy. Clin Orthop. S178-S187, 2002.
NAVEGANTES, L.C.; RESANO, N.M.; MIGLIORINI, R.H.; KETTELHUT, I.C. - Effect
of guanetidine-induced adrenergic blockade on the different proteolytic systems in
rat skeletal muscle. Am J Physiol Endocrinol Metab. 277: E883-E889, 1999.
NAVEGANTES, L.C.; RESANO, N.M.; MIGLIORINI, R.H.; KETTELBUT, I.C. - Role of
de adrenoceptors and cAMP on the cathecolamine-induced inhibition of proteolysis in
rat skeletal muscle. Am J Physiol Endocrinol Metab. 279: E663-E668, 2000.
NAVEGANTES, L.C.; RESANO, N.M.; MIGLIORINI, R.H.; KETTELHUT, I.C. Catecholamines inhibit Ca2+-dependet proteolysis in rat skeletal muscle through β2adrenoceptors and cAMP. Am J Physiol. 281: E449-E454, 2001.
NAVEGANTES, L.C.; RESANO, N.M.; BAVIERA, A.M.; MIGLIORINI, R.H.;
KETTELHUT, I.C. - Effect of sympathetic denervation on the rate of protein synthesis
in rat skeletal muscle. Am J Physiol. 286: E642-E647, 2004.
NAVEGANTES, L.C.; RESANO, N.M.; BAVIERA, A.M.; MIGLIORINI, R.H.;
KETTELHUT, I.C. - CL 316,243 a selective β3-adrenergic agonist, inhibits protein
break-down in rat skeletal muscle. Pflugers Arch. 451: 617-624, 2006.
NAVEGANTES, L.C.; BAVIERA, A.M.; KETTELHUT, I.C. - The inhibitory role of
sympathetic nervous system in the Ca2+-dependent proteolysis of skeletal muscle.
Braz J Med Biol Res. 42: 21-8, 2009.
NEEFJES, J.; GROOTHUIS, T.A.; DANTUMA, N.P. - The 2004 Nobel Prize in
Chemistry for the discovery of ubiquitin-mediated protein degradation. Ned Tijdschr
Geneeskd. 148: 2579-82, 2004.
PARADISO, K.; BREHM, P. - Long-term desensitization of nicotinic acetylcholine
receptors is regulated via protein kinase A-mediated phosphorylation. J. Neurosci.
18: 9227-9237, 1998.
PEARSON, E.S. - Note on tests for normality. Biometrika. 22: 423-424, 1931.
54
PIRES-OLIVEIRA,
M.;
MARAGNO,
A.L.;
PARREIRAS-E-SILVA,
L.T.;
CHIAVEGATTI, T.; GOMES, M.D.; GODINHO, R.O. - Testosterone represses
ubiquitin ligases atrogin-1 and Murf-1 expression in an androgen-sensitive rat
skeletal muscle in vivo. J Appl Physiol. 108: 266-73, 2010.
POST, S.R.; HILAL-DANDAN, R.; URASAWA, K.; BRUNTON, L.L.; INSEL, P.A. Quantification of signalling components and amplification in the beta-adrenergicreceptor-adenylate cyclase pathway in isolated adult rat ventricular myocytes.
Biochem. J. 311: 75-80, 1995.
PRADO, M. A. M.; REIS, R. A. M.; PRADO, V. F.; MELLO, M. C.; GOMES, M. V.;
MELLO, F. G. - Regulation of acetylcholine synthesis and storage. Neurochemistry
international . 41: 291-299, 2002.
PRICE, S. R.; BAILEY, J. L.; WANG, X.; JURKOVITZ, C.; ENGLAND, B. K.; DING,
X.; PHILLIPS, L. S.; MITCH, W. E. - Muscle wasting in insulinopenic rats results from
activation of the ATP-dependent, ubiquitin-proteasome proteolytic pathway by a
mechanism including gene transcription. J Clin Invest. 98: 1703-1708, 1996.
REID, M.B. - Response of the ubiquitin-proteasome pathway to changes in muscle
activity. Am J Physiol Regul Integr Comp Physiol. 288: R1423-31, 2005.
RENNIE, M.J.; SELBY, A.; ATHERTON, P.; SMITH, K.; KUMAR, V.; GLOVER, E.L.;
PHILIPS, S.M. - Facts, noise, and wishful thinking: muscle protein turnover in aging
and human disuse atrophy. Scand J Med Sci Sports 23. 20: 5-9, 2009.
REYNOLDS, T.H. 4th; KRAJEWSKI, K.M.; LARKIN, L.M.; REID, P.; HALTER, J.B.;
SUPIANO, M.A.; DENGEL, D.R. - Effect of age on skeletal muscle proteolysis in
extensor digitorum longus muscles of B6C3F1 mice. J Gerontol A Biol Sci Med Sci.
57(5): B198-201, 2002.
ROBERT, M. J. ; SUSAN, C. K. - The molecular basis of skeletal muscle atrophy. Am
J Physiol. 287: C834-C843, 2004.
SANES, J.R.; LICHTMAN, J.W. - Development of the vertebrate neuromuscular
junction. Annual Review of Neuroscience. 22: 389-442, 1999.
SHMIDT, T.J. - Biochemestry of hormones: polypeptide hormones. Textbook of
Biochemestry with clinical correlations. 4ª ed. New York - Wiley-Liss, 1997.
SOLOMAN, V.; BARACOS, V.; SARRAF, P.; GOLDBERG, A.L. - Rates of ubiquitin
conjugation increase when muscles atrophy, largely through activation of the N-end
rule pathway. Proc Natl Acad Sci. 95: 12602-12607, 1998.
55
SORIMACHI, H.; ONO, Y.; SUZUKI, K. - Skeletal muscle-specific calpain, p94, and
connectin/ titin: their physiological functions and relationship to limb-girdle muscular
dystrophy type 2A. Adv Exp Med Biol. 481: 383-395, 2000.
SOUCCAR, C.; GODINHO, R.O.; DIAS, M.A.V.; LAPA, A.J. - Early and late
influences of testosterone on acetylcholinesterase activity of skeletal muscles form
developing rats. Brazilian J Med Biol Res. 21: 263-271, 1988.
STUART, J.A.; BRINDLE K.M.; HARPER, J.A.; BRAND, M.D. - Mitochondrial Proton
Leak and the uncoupling proteins. Journal of Bioenergetics and Biomembranes. 31:
517-525, 1999.
SUZUKI, Y.; SHEN, T.; POYARD, M.; BEST-BELPOMME, M.; HANOUNE, J.;
DEFER, N. - Expression of adenylyl cyclase mRNAs in the denervated and in the
developing mouse skeletal muscle. Am. J. Physiol. 274: 1674-1685, 1998.
TAILLANDIER, D.; AUROUSSEAU, E.; MEYNIAL, DENIS-D.; BECHET, D.;
FERRARA, M.; COTTIN, P.; DUCASTAING, A.; BIGARD, X.; GUEZENNEC, C.Y.;
SCHMID, H.P.; ATTAIX. - Coordinate activation of lysossomal, Ca2+ activated and
ATP ubiquitin-dependent proteinases in the unweighted rat soleus muscle. Biochem
J. 316: 65-72, 1996.
TANG, W.J.; HURLEY, J.H. - Catalytic mechanism and regulation of mammalian
adenylyl cyclases. Mol. Pharmacol. 54: 231-240, 1998.
TANIDA, I.; UENO, T.; KOMINAMI, E. - LC3 conjugation system in mammalian
autophagy. Int. J. Biochem. Cell. Biol. 36: 2503-2518, 2004.
TAWA, N.E. Jr.; ODESSEY, R.; GOLDBERG, A.L. - Inhibitors of the proteasome
reduce the accelerated proteolysis in the atrophying rat skeletal muscles. J Clin
Invest. 100(1): 197-203, 1997.
TIAO, G.; FAGAN, J.; ROEGNER, V.; LIEBERMAN, M.; WANG, J.J.; FISCHER, J.
E.; HASSELGREN, P.O. - Energy-ubiquitin-dependent muscle proteolysis during
sepsis in rats is regulated by glucocorticoids. J Clin Invest. 97: 339-48, 1996.
TIDBALL, J.G.; SPENCER, M.J. - Expression of calpastatin transgene slows and
obviates changes in myosin isoform expression during murine muscle disuse. J.
Physiol. 545: 819-828, 2002.
TINA, L.E.; GREGORY, S. - A semi quantitative high-throughput screening method
for microbial L-tyrosine production in microtiter plates. J Ind Microbiol Biotechnol.
34:807-811, 2007.
TISCHLER, M.E.; ROSENBERG, S.; SATARUG, S.; HENRIKSEN, E.J.; KIRBY,
C.R.; TOME, M.; CHASE, P. - Different mechanisms of increased proteolysis in
56
atrophy induced by denervation or unweighting of rat soleus muscle. Metabolism. 39:
756-763, 1990.
WAALKES, T. P.; UDENFRIEND, S. - A fluorometric method for the estimation of
tyrosine in plasma and tissues. J. Lab. Clin. Med. 50: 733-736, 1957.
ZANCHI, N.E.; NICASTRO, H.; LANCHA, A.H. Jr. - Potential antiproteolytic effects of
L-Leucine: observations of in vitro and in vivo studies. Nutr Metab. 17: 5-20, 2008.
ZEMAN, R.J.; LUDEMANN, R.; ETLINGER, J.D. - Clenbuterol, a β2 – agonist, retards
atrophy in denervated muscles. Am J Physiol. 252: E-152-5, 1987.
ZIERATH, J. R.; HAWLEY, J. A. - Skeletal muscle fiber type: Influence on contractile
and metabolic properties. Plos Biol. 2: e348, 2004.