_________________________________________________Profa. Dra. Patrícia Bulegon Brondani Cetonas e Aldeídos
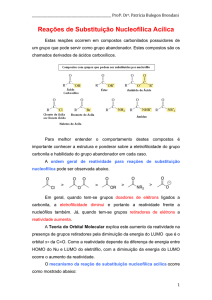
Os compostos carbonilados (que contém o grupamento carbonila),
podem ser divididos em duas principais classes quanto a reatividade. Isto
ocorre porque a natureza dos grupos ligados a grupo acila influencia
fortemente sua reatividade.
O
C
R
Grupo
Carbonila
O
C
Ar
O
C
Grupos Acila
Classe I: Geralmente, não contém grupo que pode ser substituído
Cetonas e Aldeídos
Esta classe reage preferencialmente através do mecanismo de adição
nucleofílica.
Classe II: Contém um grupo que pode ser substituído por um nucleófilo
Ác. Carboxílicos e derivados
Esta classe reage preferencialmente através do mecanismo de
substituição nucleofílica.
Nesta primeira parte do conteúdo sobre substâncias carboniladas darse-á destaque a Classe I, ou seja, Aldeídos e cetonas.
O grupo funcional carbonila em aldeídos e cetonas é trigonal planar, ou
seja, os átomos de carbono, seus substituíntes e o oxigênio são coplanares
e, os ângulos R-C-O e R-C-H são aproximadamente 120 0.
121,70 O 121,70
C
H
H
116,50
Formaldeido
O
O 118,60
121,40
121,40
123,90
C
C
H3C
CH3
H
H3C
117,50
Acetaldeido
117,20
Acetona
1 _________________________________________________Profa. Dra. Patrícia Bulegon Brondani O carbono da carbonila é eletrofílico e pode reagir com Nu, pois a ligação
é polarizada e deixa o C com carga parcial positiva.
δ+
δ−
O
ou
O
A carbonila é o grupo funcional mais importante em química orgânica,
devido a sua reatividade. Observando os orbitais da carbonila, pode-se
explicar muito de sua reatividade:
- Os pares de elétrons não compartilhados do oxigênio podem ser
protonados ou atacar um acido de Lewis. A protonação aumenta a
eletrofilicidade, pois aumenta a deficiência eletrônica.
- O LUMO da carbonila é o orbital π antiligante (que é maior no carbono o que explica sua eletrofilicidade).
2 _________________________________________________Profa. Dra. Patrícia Bulegon Brondani Além disto, o hidrogênio localizado em alfa a um grupo carbonila é
acido. Isto ocorre, pois sua remoção gera uma base conjugada estabilizada a
qual chamamos de ENOLATO.
1. Reatividade frente a nucleófilos
Aldeídos são mais reativos que cetonas por dois motivos:
- Efeito Estérico.
Aldeídos tem menor impedimento ao ataque do nucleófilo.
Intermediário e ET do ataque a um aldeído tem menor interação estérica.
3 _________________________________________________Profa. Dra. Patrícia Bulegon Brondani - Efeito eletrônico.
Através de Hiperconjugação (efeito indutivo), os grupos alquila doam elétrons
a carbonila e diminuem sua eletrofilicidade.
Somando os dois efeitos, podemos dizer que o formaldeído é o mais
reativo dos aldeídos. Após, na ordem de reatividade, vem os demais aldeídos
e depois as cetonas.
2. Mecanismo de Adição Nucleofílica
A reação de adição nucleofílica pode ocorrer em meio neutro, no
entanto, meio básico ou ácido aceleram a reação.
Reações em meio básico ou na presença de um nucleófilo carregado
negativamente.
Nucleófilo forte (negativamente carregado) – HOMO de maior energia.
ET com carga parcial negativa.
4 _________________________________________________Profa. Dra. Patrícia Bulegon Brondani Quando o nucleófilo é também um bom GA, pode haver retroadição e
a reação é um equilíbrio.
Se um solvente aprótico é usado, o alcóxido intermediário é protonado
na etapa de isolamento. Se um solvente prótico é usado o alcóxido é
protonado pelo solvente.
Reações em meio ácido ou com nucleófilos neutros.
A protonação aumenta a eletrofilicidade do carbono e diminui a
energia do LUMO, aumentando contribuição no carbono.
ET com carga parcial positiva.
Intermediário protonado está em equilíbrio com os reagentes
(equilíbrio). O nucleófilo está protonado e é um bom GA (Neutro).
3. Formação de Cianohidrinas
A reação com cianeto de sódio leva a cianohidrinas e geralmente
ocorre em meio ácido. O nucleófilo é o carbono do íon cianeto, que adicionase na carbonila.
A reação é um equilíbrio e fica mais deslocado para os produtos
quando utilizam-se aldeídos (mais reativos que cetona).
5 _________________________________________________Profa. Dra. Patrícia Bulegon Brondani Em meio básico pode-se converter toda a cianohidrina no composto
carbonílico, pois ocorre a desprotonação do álcool formado, eliminando CN,
retornando a carbonila. Por isto, esta reação é conduzida em meio ácido.
4. Transferência de hidreto a carbonila: Redução
Quando o hidrogênio é transferido com o par de elétrons da ligação à
carbonila primeiramente forma-se um alcóxido.
O alcóxido formado estabiliza o BH3, formando novamente uma
espécie tetravalente de boro. Esta reduz outro equivalente de composto
carbonílico, até os 4 hidrogênios serem transferidos.
O solvente doa o H+ para formação do álcool (produto final).
No final tem-se que: Aldeído leva a álcool primário e Cetona leva a
álcool secundário como produto.
6 _________________________________________________Profa. Dra. Patrícia Bulegon Brondani O
H
H3C
H
H
Álcool Primário
H3C
Aldeido
O
H3C
OH
NaBH4
OH
NaBH4
CH3
Cetona
H3C
CH3
H
Álcool Secundário
O NaBH4 é um doador de hidreto fraco e pode ser utilizado até
mesmo em água. Além disto, por ser fraco não reage com compostos
menos reativos como ésteres e amidas (seletivo).
Outro doador de hidreto bastante utilizado é o LiAlH4. Este é um
doador de hidreto forte e reage violentamente com água. Também reage
com compostos menos reativos como ésteres (leva ao álcool correspondente
– não é seletivo).
5. Reação com organometálicos
As ligações C-Li e C-Mg em organometálicos de lítio e magnésio, são
polarizadas na direção do carbono. Com isto, estas espécies são nucleófilos
de carbono que adicionam-se levando ao álcool e a uma nova lig. C-C.
Os compostos organolítio são muito reativos e devem ser adicionados
a baixas temperaturas (-78 ºC) na presença de solventes apróticos e anidros
7 _________________________________________________Profa. Dra. Patrícia Bulegon Brondani (sem água) o que evita sua protonação. A água ou a umidade destroem o
organometálico e levam ao alcano correspondente. Água pode somente ser
adicionada após o consumo de todo MP (material de partida). Neste caso, o
alcano formado como sub-produto geralmente é volátil ou facilmente
separável do produto principal.
Reagentes organolítios comuns e comercialmente disponíveis são
metil lítio, butil líitio ou fenil lítio.
Os organo-magnésio reagem de maneira similar. Os reagentes de
magnésio tem a fórmula geral RMgX e são chamados REAGENTES DE
GRIGNARD.
Reagentes simples como o cloreto de metil magnésio (MeMgCl) e o
brometo
de
fenil
magnésio
(PhMgBr)
podem
ser
encontrados
comercialmente.
Reações de organometálicos com compostos carbonílicos estão entre
as principais metodologias de construção de ligações C-C.
A reação com aldeídos leva a álcoois secundários e a reação com
cetonas leva a álcoois terciários.
8 _________________________________________________Profa. Dra. Patrícia Bulegon Brondani 6. Adição de água: formação de hidratos
Esta reação é um equilíbrio e, geralmente, aldeídos são hidratados em
maior estensão (são mais reativos que cetonas). O formaldeído é um
reagente muito reativo e, geralmente a solução deste reagente contém
somente o hidrato.
Fatores eletrônicos podem afetar a reação (a constante de equilíbrio
da reação). Grupos retiradores aumentam proporção de hidratação
(aumentam eletrofilicidade da carbonila).
7. Reação com álcoois: formação de hemiacetais
O produto de adição de álcoois é o hemiacetal (metade do caminho
para a formação de acetais).
9 _________________________________________________Profa. Dra. Patrícia Bulegon Brondani Os Hemiacetais formados a partir de aldeídos e cetonas são
diferentes.
Os Hemiacetais produzidos a partir de cetonas podem ser
chamados HemiCetais.
O mecanismo da reação de adição de álcoois pode ser observado
abaixo:
Um próton deve ser transferido de um oxigênio para o outro e isto
pode ser representado diretamente por prototropismo (troca de prótons
dentro da mesma molécula) ou por protonação/desprotonação de outro
equivalente do álcool, isto não é importante.
A formação de hemiacetais também é reversível e são estabilizados
pelos mesmos efeitos citados para hidratos. No entanto, hemiacetais podem
ser mais estáveis sendo cíclicos e, isto acontece quando o grupo OH e o
grupo carbonila fazem parte da mesma estrutura. A reação é, então, uma
adição intramolecular. Mesmo que o lactol (hemiacetal ciclíco) seja mais
estável, ele ainda estará em equilíbrio com a forma hidroxi-carbonílica aberta
A estabilidade e a facilidade com que é formado o lactol depende do tamanho
do anel formado. Anéis de 5 ou 6 membros, que tem baixa tensão, são
facilmente formados.
10 _________________________________________________Profa. Dra. Patrícia Bulegon Brondani 8. Formação de Acetais
Na tentativa de formar hemiacetais em meio ácido, pode ocorrer a
formação de acetais. O OH em meio ácido vira um bom GA (eliminação de
água), com isto e pode ocorrer um segundo ataque de OR, formando o
acetal.
A reação de formação de acetais é reversível. O Acetal formado é
estável em meio básico ou neutro. No entanto, pode ser hidrolisado em meio
ácido (gerando o composto carbonílico correspondente). Com isto, acetais
podem ser utilizados como grupos protetores de compostos carbonílicos.
11 _________________________________________________Profa. Dra. Patrícia Bulegon Brondani Redução de Éster na presença de Cetona ou Aldeído
OH
O
H3CO
NaBH4
H3CO
H
O
O
O
LiAlH4
H3CO
H
H
OH
H
OH
O
OH
O
HO
TsOH cat.
Remoção de água
O
H
O
H3CO
H3CO
H
O
O
Meio ácido
Desproteção
OH
O
LiAlH4
O
H
H
O
OH
9. Reação com aminas primárias: formação de iminas
A adição da amina leva a espécie tetraédrica (carbinolamina), após a
eliminação de água ocorre a formação da imina – retirada de água do meio.
As etapas de adição e eliminação são aceleradas por catálise ácida. O
pH deve ser controlado para que ocorra protonação na carbonila, mas não a
protonação de toda a amina presente para não haver redução da
nucleofilicidade da amina – pH entre 4 e 6.
12 _________________________________________________Profa. Dra. Patrícia Bulegon Brondani Iminas podem ser hidrolisadas de volta ao composto carbonílico em
meio ácido.
10. Reação com aminas secundárias: formação de enaminas
Aminas secundárias (R2NH) também adicionam-se a carbonila para
formar carbinolamina. A diferença é que pode somente ocorrer desidratação
formando uma dupla ligação C-C, porque o nitrogênio da carbinolamina não
tem próton para perder. O produto é chamado de enamina.
13 _________________________________________________Profa. Dra. Patrícia Bulegon Brondani ______________________________________________________________
OBS: Aminas terciárias não levam a produto estável, pois teriam o
nitrogênio protonado (o que é um bom GA) e levam somente a formação de
espécies transitórias.
______________________________________________________________
11. Bibliografia
Material baseado ou retirado de:
14 _________________________________________________Profa. Dra. Patrícia Bulegon Brondani 15