Vestibular1 – A melhor ajuda ao vestibulando na Internet
Acesse Agora! www.vestibular1.com.br
Água.
Composição e Ocorrência
A água é uma substância incolor, insípida e inodora, líquida à temperatura ambiente. É formada de átomos de hidrogênio e oxigênio,
agrupados em moléculas. As moléculas se agregam na superfície da água para formar uma espécie de película, devido a tensão
superficial. Elas também se agregam à moléculas de outras substâncias: é a maneira como a água molha as coisas.
As gotículas de água são redondas por causa da tensão superficial: as moléculas da superfície são "puxadas" para dentro, gerando o
formato de esferas, ou seja, as moléculas da camada superior são puxadas apenas pelas moléculas de baixo. A película superficial
de água resiste o suficiente para suportar um mosquito, que de outra maneira afundaria.
A água cobre mais de 70% da superfície terrestre e é vital para toda a vida no planeta. É a substância mais abundante da natureza,
ocorrendo:
Nos rios, lagos, oceanos, mares e nas calotas polares.
Vestibular1 – A melhor ajuda ao vestibulando na Internet
Acesse Agora! www.vestibular1.com.br
No reino vegetal, animal e mineral (água de cristalização, Al2O3 . H2O, Bauxita).
Na atmosfera, na forma de vapor de água, podendo atingir num local até 4%, em volume (é chamada umidade relativa).
Tipos de Águas Naturais
Água de chuva: é a mais pura, por resultar de um processo de destilação simples.
Água dos Rios e Fontes: Contém até 0,2% de sais dissolvidos. As águas de fontes com porcentagens maiores de sais dissolvidos
são chamadas de águas minerais ou termais.
Água do Mar: Possui aproximadamente 3,5% de sais, entre os diversos, destaca-se o Cloreto de Sódio (NaCl) e o Cloreto de
Magnésio (MgCl).
Água Dura: Contém bicarbonato ou sulfato de cálcio ou magnésio: CaSO4 ou Ca(HCO3)2. Essa água favorece a calcificação dos
ossos e dentes, porém, ela é prejudicial pelo fato de não permitir a ação de limpeza por parte de sabões e detergentes.
Observação de Água Potável
A água própria para se beber é denominada água potável. Para tanto, é nescessário que ela esteja "límpida", não conter terra e
outros materiais em suspensão; pode conter somente vestígios de sais em solução, que lhe conferem algum sabor (diferente de uma
água desrilada); precisa estar aerada, ou seja, conter um pouco de ar dissolvido, dando ao paladar uma sensação de "água leve";
não deve nela ser encontrado nenhum microorganismo que possa causar doenças. Evidentemente, essa água será também
apropriada para outros usos domésticos, como: cozer alimentos, lavar roupas e utensílios domésticos, tomar banho, etc.
Afortunada seria a cidade que dispusesse de "fontes de água pura", com todas as características da água potável. Infelizmente, para
satisfazer o enorme consumo das grandes cidades, é preciso retirar água de lagos ou de rios, que, em geral, não é potável - tendo,
por isso, de ser convenientemente tratada.
O tratamento da água para consumo público segue, em geral, os seguintes passos:
1º) A água é bombeada de um lago ou rio até um tanque, onde recebe produtos químicos, em geral uma mistura de Al 2(SO4)3 e
Ca(OH)2.
2º) A água passa por uma câmara de floculação, onde se completa a reação:
Al2(SO4)3 + 3 Ca(OH)2 2 Al(OH)3 + 3 CaSO4
O Al(OH)3 produzido forma "flocos" ou "coágulos" gelatinosos e insolúveis em água. Esse flocos vão "agarrando" as partículas (terra
em suspensão, restos de folhas, etc.), que estão sendo arrastados pela água.
3º) A água vai então para um tanque de decantação ou sedimentação, onde ela circula lentamente, dando tempo para que o Al(OH) 3
precipite, arrastando consigo as partículas em suspensão existentes na água.
4º) A seguir, a água passa por um filtro de areia, que retém as partículas menores de Al(OH)3 e outras impurezas.
5º) Finalmente, a água passa por um clorador, onde é introduzido o cloro, que mata os microorganismos.
Vestibular1 – A melhor ajuda ao vestibulando na Internet
Acesse Agora! www.vestibular1.com.br
Água para Fins Domésticos
As águas de rios e lagos são filtrados (em filtros de areia), ficando eliminadas as impurezas em suspensão. As bactérias
patogênicas, como as responsáveis pelo tifo e cólera, são eliminadas pelo tratamento com gás cloro (bactericida). Esse processo de
purificação não elimina sais dissolvidos, os quais são necessários ao organismo humano e também servem para dar gosto à água.
Água para Fins Científicos
As exigências quanto à qualidade da água a ser consumida para fins científicos devem ser mais rígidos que para a água potável,
portanto, deve ser destilada, porém, pode apresentar traços de ferro, cobre, cromo, devido o destilador ser fabricado com esses
metais.
Água para Fins Industriais
As exigências quanto à qualidade da água a ser consumida nas indústrias podem ser menos rígidas que para a água potável. No
entanto, certas precauções devem ser tomadas. Vejamos, por exemplo, o caso da chamada água dura, isto é, a água que contém
bicarbonatos de cálcio ou de magnésio (dureza temporária) e/ou sulfatos de cálcio ou de magnésio (dureza permanente). A
água dura, além de ter gosto desagradável (água salobra), não faz espuma quando em contato com sabão e é muito prejudicial
quando usada em caldeiras e outros aparelhos em que a água é fortemente aquecida, pois ocorrem reações, como por exemplo:
calor
calor
Ca(HCO3)2 CaCO3 CaO
Solúvel
Insolúvel
Insolúvel
Essas substâncias insolúveis depositam-se nas tubulações das caldeiras, obstruindo-as e podendo causar explosões. A dureza
temporária pode ser eliminada por aquecimento prévio (daí o nome temporária) ou pela adição de Ca(OH)2:
Ca(HCO3)2 + Ca(OH)2 2 CaCO3 + 2 H2O
Água Pesada
É na verdade o Óxido de Deutério, cujas propriedades diferem da água comum. Fórmula D2O de peso molecular 20. Obtém-se pela
eletrólise de uma solução aquosa diluída de hidróxido de sódio, durante a qual a percentagem de água pesada aumenta até 99%.
Tem várias aplicações científicas.
Equilibrio Iônico da Água
Heidweiller (1894) concluíram, após cuidadosas experiências, a mais pura das águas apresenta uma pequena, porém, bem definida
condutância. A água é, portanto, fracamente ionizada de acordo com o equilibrio de dissociação:
Vestibular1 – A melhor ajuda ao vestibulando na Internet
Acesse Agora! www.vestibular1.com.br
H2O H+ + OH-
Aplicando a essa dissociação a leio da ação das massas, podemos expressar a contante de equilíbrio como:
K = [H+] x [OH-]
[H2O]
Dos resultados experimentais obtidos na determinação da condutância da água, foi possível estabelecer o valor de K, como sendo
1,82 x 10-16 a 25ºC. Este baixo valor indica que o grau de dissociação é insignificante; a água, portanto, deve ser considerada como
não dissociada. Assim, a concentração da água (massa molecular relativa = 18) é constante e pode ser expressa como:
[H2O] = 1000 = 55,6 mol/l
18
Pode-se, portanto, reunir as constantes em um dos lados da equação e escrever:
Kw = [H+] x [OH-] = 1,82 x 10-10-16 x 55,6 = 1,01 x 10-14 (a 25ºC)
A nova constante Kw é denominada produto iônico da água. Seu valor depende da temperatura, para temperatura ambiente, o valor
Kw = 10-14
É geralmente usado.
Temperatura (ºC)
Kw x 1014
Temperatura (ºC)
Kw x 1014
0
0,12
35
2,09
5
0,19
40
2,92
10
0,29
45
4,02
15
0,45
50
5,48
20
0,68
55
7,30
25
1,01
60
9,62
30
1,47
-
-
Tabela do Produto Iônico da Água em várias temperaturas
A importância do produto iônico da água reside no fato de que seu valor pode ser considerado como constante, não só em água pura
como também em soluções aquosas diluídas, tais como as encontradas comumente em analise qualitativa inorgânica. Isso
significa,m por exemplo, que se um ácido for dissolvido em água (o qual, em dissociação, produz íons hidrogênio), a concentração
dos íons hidrogênio pode çaumentar às expensas, unicamente, da concentração dos íons hidroxila (oxidrila). Se, por outro lado, uma
base for dissolvida, a concentração dos íons hidroxila aumentará e a concentração de íons hidrogênio diminuirá.
Vestibular1 – A melhor ajuda ao vestibulando na Internet
Acesse Agora! www.vestibular1.com.br
Pode-se definir mais precisamente o conceito de uma solução neutra, segundo esses critérios. Uma solução é neutra, se contiver a
mesma concentração de íons hidrogênio e íons hidroxila, isto é, se
[H+] = [OH-]
Portanto, numa solução neutra, teremos:
[H+] = [OH-] = Kw = 10-7 mol/l
Numa solução ácida, a concentração de íons hidrogênio excede esse valor, enquanto que numa solução alcalina acontece o inverso.
Assim,
Numa solução ácida [H+] > [OH-] e [H+] > 10-7 mol/l
Numa solução alcalina [H+] < [OH-] e [H+] < 10-7 mol/l
Em todos os casos, a acidez ou alcalinidade de uma solução pode ser expressa quantitativamente em termos de magnitude da
concentração hidrogeniônica (ou concentração de íons hidroxila). É suficiente o uso de apenas um desses para qual quer solução,
pois conhecendo um deles sempre é possível calcular o outro pela equação:
[H+] = 10-14
[OH-]
Numa solução 1M de um ácido forte monobásico (supondo uma dissociação completa), a concentração hidrogeniônica é 1 mol/l. Por
outro lado, numa solução 1M de base monovalente, a concentração de íons hidroxila é 1 mol/l, daí a concentração hidrogeniônica ser
10-14 mol/l. A concentração hidrogeniônica da maioria das soluções aquosas encontradas na análise química (que não sejam ácidos
concentrados, empregados principalmente para dissolver amostras) situa-se entre esses valores.
Medidas de pH, pHmetro e Indicadores
Conceitos Básicos de pH e pOH
Na análise química experimental lidamos frequentemente com baixas concentrações hidrogeniônicas. Para evitar o incômodo de
escrever números com fatores de potências negativas de 10, Sörensen (1909) introduziu o uso do expoente hidrogeniônico ou pH,
definido pela relação:
pH = - log [H+] = log 1 ou [H+] = 10-pH
[H+]
Assim, o pH é o logaritmo da concentração hidrogeniônica com sinal negativo ou o logarítmo do inverso da concentração
hidrogeniônica. É muito conveniente expressar a acidez ou alcalinidade de uma solução por seu pH. Na maioria das vezes o pH das
soluções aquosas permanece entre 0 e 14. Numa solução 1M de um ácido forte monobásico:
pH = - log 1 = 0
enquanto o pH de uma solução 1M de uma base forte monovalente é:
pH = - log 10-14 = 14
Se uma solução for neutra,
Vestibular1 – A melhor ajuda ao vestibulando na Internet
Acesse Agora! www.vestibular1.com.br
pH = - log 10-7 = 7
Da definição acima, segue-se:
para uma solução ácida pH < 7
para uma solução alcalina pH > 7
O termo pOH é, às vezes, usado de maneira análoga para expressar o expoente da concentração de íons hidroxila:
pOH = - log [OH-] = log 1 ou [OH-] = 10-pOH
[OH-]
Para qualquer solução aquosa é válida a correlação:
pH + pOH = 14
pHmetro: Princípio de Funcionamento:
O método mais avançado e preciso para determinação do pH é fundamentado na medição da força eletromotriz (f.e.m.) de uma
célula eletroquímica que contém uma solução de pH desconhecido como eletrólito, e dois eletrodos. Os eletrodos são conectados
aos terminais de um voltímetro eletrônico, a maioria das vezes denominado, simplesmente, medidor de pH. Quando
convenientemente calibrado com uma solução-tampão de pH conhecido, pode-se ler diretamente na escala do aparelho o pH da
solução de teste.
A f.e.m. de uma célula eletroquímica pode ser definida como o valor absoluto da diferença de potenciais de eletrodo entre os dois
eletrodos. Os dois eletrodos utilizados na construção da célula eletroquímica tem funções diferentes na medição e devem ser
escolhidos cuidadosamente. Um dos eletrodos, denominado eletrodo indicador, adquire um potencial que depende do pH da solução.
Na prática, o eletrodo de vidro é utilizado como eletrodo indicador. O segundo eletrodo, por sua vez, deve ter um potencial constante
independente do pH da solução, com o qual, portanto, o potencial do eletrodo indicador pode ser comprarado em várias soluções;
daí este segundo eletrodo ser denominado eletrodo de referência. Na medição do pH, o eletrodo de calomelano (saturado) é utilizado
como eletrodo indicador.
A medição da f.e.m. de uma célula pode ser expressa por:
f.e.m. = |Evd - Ecal|
Ecal é o potencial de eletrodo do eletrodo de calomelano, o qual é constante.
O potencial do eletrodo de calomelano saturado é + 0,246V a 25ºC (medido contra um eletrodo padrão de hidrogênio). Evd, o
potencial do eletrodo de vidro, por sua vez, depende do pH da solução. Para a região de pH 2-11 (onde a precisão da determinação
é muito importante), a dependência do pH do potencial do eletrodo de vidro pode ser expressa por:
Evd = E0vd - 0,059 pH
onde E0vd é o potencial padrão do eletrodo de vidro. Esse valor varia para cada exemplar de instrumento, e também depende do
estado de conservação e do pré-tratamento do eletrodo. Dentro de um conjunto de medições, isso pode ser considerado constante.
Se empregarmos o processo habitual de calibração, não será necessário medir o potencial padrão e deduzir o potencial do eletrodo
de calomelano, visto que o pH pode ser lido diretamente no medidor de pH.
Vestibular1 – A melhor ajuda ao vestibulando na Internet
Acesse Agora! www.vestibular1.com.br
Indicadores
Os indicadores de pH são substâncias orgânicas que possuem a propriedade de mudar de coloração com a variação do pH do meio.
A mudança de coloração se processa de maneira gradual entre valores definidos da escala de pH.
Uma das causas de erro no uso dos indicadores é o fato da viragem dos mesmos ser gradual e se dar em um certo intervalo de pH.
Outra causa de erro é devido ao fato da mudança de cor do indicador ocorrer em um pH diferente do pH do ponto de equivalência,
fazendo com que o volume do titulante no ponto final seja diferente do volume do titulante no ponto de equivalência. Na prática
procura-se escolher um indicador de cause o menor erro possível. É necessário frisar que não há necessidade de se eliminar o erro,
isto é, não é preciso fazer com que o ponto final coincida exatamente com o ponto de equivalência.
No caso de uma titulação de um ácido forte com uma base forte esta coincidência existiria se o ponto final da ttulação ocorresse em
pH 7,0. Quando se observa num mesmo gráfico a curva de titulação e o intervalo de viragem de um dado indicador, é possível
decidir se o mesmo é ou não adequado para esta titulação. Assim, o indicador correto para uma titulação será aquele cuja mudança
de coloração ocorre em pH igual ao obtido dissolvendo-se no mesmo volume de sal formado pela neutralização, ou seja, o pH do
ponto de equivalência.
Solução Tampão
É um tipo de solução que resiste à variação de pH quando pequenas quantidades de ácido ou base são a ela adicionadas.
Como se prepara uma solução tampão no laboratório?
1º Caso: Prepara-se 1 litro de solução aquosa misturando-se:
0,1 mol de HNO2 (Ácido Fraco)
0,1 mol de NaNO2 (Sal desse ácido fraco)
A solução obtida é uma solução tampão ácida.
2º Caso: Prepara-se 1 litro de solução aquosa misturando-se:
0,1 mol de NH4OH (Base Fraca)
0,1 mol de NH4Cl (Sal dessa base fraca)
A solução obtida é uma solução tampão alcalina ou básica.
Explicando o que ocorreu nos dois casos:
1º Caso - Tampão Ácido: é uma solução preparada a partir de um ácido fraco e um sal do mesmo ácido.
HNO2 H+ + NO2NaNO2 Na+ + NO2-
Vestibular1 – A melhor ajuda ao vestibulando na Internet
Acesse Agora! www.vestibular1.com.br
2º Caso - Tampão Básico: é uma solução preparada a partir de uma base fraca e um sal da mesma base.
NH4OH NH4+ + OHNH4Cl NH4+ + Cl-
Conceito de Dureza da Água
Dá-se o nome de "água dura" às águas que levam dissolvidas grandes quantidades de sais de cálcio e de magnésio em
forma de carbonatos e também em forma de gesso; as tais podem ser determinadas por titulação complexométrica
(método usado no laboratório).
Estas águas são impróprias para a alimentação, para a lavagem de roupas e não servem para alimentar as caldeiras a
vapor, em virtude das incrustações que provocam. Para o emprego de pequenas porções de água dura, fazendo-lhe
desaparecer a dureza, basta fervê-la, precipitando então o carbonato de cálcio e de magnésio, continha dissolvido as
expensas do anidrido carbônico da água. Pode-se também adicionar-lhe de 1 a 5 g de carbonato sódico.
Para maiores porções, trata-se com suspensão de cálcio ou então se ferve com pequenas quantidades de ácido sulfúrico
ou clorídrico, formando-se sulfato de cálcio ou cloreto de cálcio. As águas duras são abrandadas, por exemplo, por
tratamento com hidróxido de cálcio e carbonato de sódio, segundo as reações:
Ca(HCO3)2 + 2CaCO3 + 2H2O
CaSO4 + Na2CO3 => CaCO3 + Na2SO4
Um outro importante processo de abrandamento é o da passagem da água através de uma camada de zeólito (mineral
constituído de alumínio-silicato de sódio - NaAlZ).
Procedimento para Determinação da Dureza da Água
1.
2.
Pipetar 100 ml de amostra de água e transferir para um erlenmeyer de 250 ml;
3.
4.
Adicionar uma pequena porção de negro de eriocromo T a 0,1% como indicador;
Juntar 2 ml de solução tampão de pH = 10 (mistura de partes iguais de solução de cloreto de amônio saturada
e hidróxido de amônio concentrado);
Titular com solução de EDTA 0,02M até alcançar uma mudança de coloração do líquido titulante (da cor
vermelha para a cor azul puro).
Vestibular1 – A melhor ajuda ao vestibulando na Internet
Acesse Agora! www.vestibular1.com.br
Por que a água é vital para os seres vivos?
P
n
v
á
b
p
f
o
T
f
q
o
A
a
q
o
t
i
t
m
c
n
c
v
c
2
m
a
a
o
g
á
a
o
u
e
l
u
r
s
p
u
s
e
n
e
a
o
e
é
e
o
0
o
r
s
l
u
s
r
r
t
r
u
e
i
s
a
a
a
c
t
a
i
t
m
r
r
t
E
c
s
o
t
m
A
á
á
h
o
l
o
e
e
p
h
ú
o
d
h
e
h
m
o
s
á
t o
t o
i d
x i
i g
x i
l é
x t
o s
i d
n i
x i
o
i d
l é
é l
a i
x i
e i
g
m
m
r
g
a
g
t
e
s
r
c
g
o
r
t
i
s
g
s
g
i
r
n
m
s o
t e
o r
s
n t
c e
l u
g e
n t
%
r t
o
d
i
a
c
i
a
o
a
u
n
e
m
e
d
a
u
r
i
a
i
s
l
t
e
p
e
f i l ó s o f o
T a l e s ,
o
e m
M i l e t o
p o r
d e
6 4 0
a . C . ,
a
e r a
a
m a t é r i a
a
o u
o
e l e m e n t o
a
r
d o
q u a l
s e
v a m
t o d o s
o s
s .
E l e
d i z i a
q u e
a
e r a
u m
d i s c o
q u e
a v a
n a
á g u a ,
s e n d o
e s t a
e s t a v a
a
m
d e
t o d a
a
v i d a .
,
o s
s e r e s
v i v o s
c e r a m
n a
T e r r a
o
o
S o l
a
s e c o u
e
r e s
l i b e r t a r a m
o s
r o s
d e
s e u
i o r .
E s t a s
a n t i g a s
a s
f o r a m
r e v i s t a s ,
i n d a
h o j e
a
á g u a
n u a
s e n d o
s á r i a
à
v i d a
d a s
a s
a n i m a i s
e
a i s .
B a s t a
q u e
o
ú d o
d e
á g u a
c a i a
a r a
p r o v o c a r
a
d o s
t e c i d o s .
r u t u
p o s i
u
o
o
o
ê
ç
ê
r
r
u
o
o
ê
c
o
r
o
a
d
s
g
n
ã
n
o
n
i
g
ê
i
o
i
n
o
ê
e
n i
t e
g ê
o n
,
p r
ê n i
p r
r
ç
é
f o
e
o x
d e
h
n i o s
o
p o
c o v
o
p o
s
e m
e
o
u m .
n i o
l é t r
o ,
c
t o
d
n i o
s ,
c
o
g á
ó x i m
o
o i
ó p r i
a
ã
r
i
i
r
a
s
Q
c
o
u
e
p
o
s
o
t
o
e
o
m a d a
p o r
u m
g ê n i o
e
d o i s
d r o g ê n i o .
O s
e s t ã o
u n i d o s
m e i o
d e
u m a
l e n t e .
O
s u i
s e i s
s e u
n í v e l
m a i
h i d r o g ê n i o
u a n d o
c a d a
o m p a r t i l h a
s e
n
c o m
u m
d o
m p r e - s e
a
r e g
L e w i s .
O
o s s u i r á
d o i s
m o
o
n o b r e
,
e
o
o ,
s e n d o
s
e
d o i s
a
o
s
u
r
a
Vestibular1 – A melhor ajuda ao vestibulando na Internet
Acesse Agora! www.vestibular1.com.br
c
h
F
o m p a r t i
i d r o g ê n
o
r
A
á
a n g
l i n
c e n
a o
á t o
o b t
a p r
m
g
u
h
t
c
m
e
o
a
r
t
ô
t
x
a
r
g
h
o
e
a
)
o
d
.
o
s
m
é
t
(
r
u
i
m
c
d
e
c
a
d
a
a
u a
p o s s u i
u m a
f o r m a
l a r .
S e
t r a ç a r m o s
u m a
a
i m a g i n á r i a
u n i n d o
o
r o
d o
á t o m o
d e
o x i g ê n i o
e n t r o
d e
c a d a
u m
d o s
o s
d e
h i d r o g ê n i o ,
r e m o s
u m
â n g u l o
d e
x i m a d a m e n t e
1 0 5 ° ,
i s t o
é ,
u m
p o u c o
m a i o r
q u e
o
â n g u l o
r e t o
( 9 0 ° ) ,
q u e
e r a
o
e s p e r a d o
p e l o s
q u í m i c o s .
M u i t a s
t e o r i a s
t e n t a m
e x p l i c a r
e s s a
d i f e r e n ç a
d e
1 5 ° .
P
c o m
h i d
e l e
f e n
e l é
p r ó
d o s
f i c
h i d
l
i
o
l
a
r
i
d
a
d
e
O
o x i g ê n i o
a t r a i
o s
e l é t r o n s
c o m p a r t i l h a d o s
m a i s
f o r ç a
q u e
o s
o g ê n i o s ,
p o i s
é
m a i s
r o n e g a t i v o .
E s s e
m e n o
f a z
c o m
q u e
o s
r o n s
f i q u e m
m a i s
i m o s
d o
o x i g ê n i o
q u e
h i d r o g ê n i o s .
O
o x i g ê n i o
m a i s
n e g a t i v o
q u e
o s
o g ê n i o s .
Diz-se que a molécula de água é polar, pois tem
um pólo positivo formado pelos hidrogênios e um
pólo negativo formado pelo oxigênio.
E s s a
r e l a c
f í s i c
d e
F u
E b u l i
q u e
o
t e o r i
d i s s o
P
f
d
r
í s
a
o
p
a r i d a d e
a d a
à s
d a
á g u a
s ã o
( P F ) ,
ç ã o
( P E ) ,
s
p r e v i s t o
a ,
e
a
c a p
l v e r
s ó l i d
i
a
o
o
s
p
i
r
c
á
l
n
i
a
g
A
á g u a ,
n a t u r a l
l í q u i d o
s a b o r
e
e
s
u
d
a
e
d
e s t á
p r o p r i e d a d e s
,
c o m o
P o n t o
P o n t o
d e
m a i s
a l t o s
d o
s
p e l a
a c i d a d e
d e
o s
i ô n i c o s .
e
q
s
u
í
m
i
c
a
s
a
e m
s e u
e s t a d o
m a i s
c o m u m ,
é
u m
t r a n s p a r e n t e ,
s e m
s e m
c h e i r o ,
m a s
q
u
e
Vestibular1 – A melhor ajuda ao vestibulando na Internet
Acesse Agora! www.vestibular1.com.br
a
e
p
s
s
r
s
v
o
u m e
e r d e
f u n d
a
c
a d a
o s .
o
d
e
n
s
d
m
a
é
e
s
4
d
p
ó l
d
i
s
f
s
l
d
p
s
r
s
d
o
c
c
d
a
m
R
e
m
ã o
o r
ã o
i q
e
r e
ã o
e s
u p
e
u t
o m
o m
e c
t é
e t
b
d
i
m
ü
f
s
p
e
f
r
p
o
a
e
e
a
+
c
p
o
a
m
r a
H
m
e
á
c
t
i
d
a
e
° C
e
s e u
e
u m a
c a
o r
g r a u .
i d o ,
s u a
N
+
i
n
u
d
a
t
á
l
é
x
z
l
s
i
u
u
u
m
a
c a l
o r i
N o
d e n
o
a
e
s
0
2
,
9
l g a r e s
i
u m a
d
r
e
1
e s
o r
a d
a d
p
s t
i d
g
/
c
p
g
e
g
/
c í
r a
c
3
m
f i c
m a
o
o
e
3,
m
m
a
s
c o n h e c i d o s
g e l o s
a d o s
s o b
p r e s s ã o
q u e
m a i s
p e s a d o s
q u e
a
á g u a
í d a .
S u a s
t e m p e r a t u r a s
u s ã o
e
e b u l i ç ã o
à
s ã o
d e
u m a
a t m o s f e r a
d e
0
e
1 0 0 ° C ,
e c t i v a m e n t e ,
m u i t o
r i o r e s
à s
t e m p e r a t u r a s
u s ã o
e
e b u l i ç ã o
d e
o s
c o m p o s t o s
p a r e c i d o s
a
á g u a .
E l a
é
u m
o s t o
e s t á v e l
q u e
n ã o
s e
m p õ e
e m
s e u s
e l e m e n t o s
1 . 3 0 0 ° .
R e a g e
c o m
o s
i s
a l c a l i n o s
( L i ,
N a ,
K ,
C s )
f o r m a n d o
u m a
b a s e
s p r e n d e n d o
h i d r o g ê n i o :
2O
H
a
l
f
2O
á
i
r
a
e m
P o s
a
O
g u n s
o r m a r
ó
C
a
(
H
)
o
s
p
a
l
i
c
o
s
,
N
O
S
O
Composto
2
H
+
2.
H
x i d o s
h i d r ó x
2,
r
+
e
a
c
f
H
o
o
r
2O
Massa
Temperatura
molecular
de fusão
R
m
i
d
t
o
m
a
2S
O
18
0
100
34
- 82,9
- 60,1
H2Se
81
- 64
- 42
- 54
- 1,8
g
l
e
i
C
s
3.
Temperatura
de ebulição
H2S
129,6
s
r
H2O
H2Te
a
á
o
m
H
e
e
A tabela mostra que tanto a temperatura de fusão como a
de ebulição de distintos compostos parecidos com a água
diminuem com a redução da massa molecular. Para a água,
cuja massa molecular é menor, essas temperaturas são
muito superiores. O fenômeno é atribuído à grande
polaridade da água, que chega à formação de ligações de
hidrogênio
n
c
a
ã
o
O
o
s
-
Vestibular1 – A melhor ajuda ao vestibulando na Internet
Acesse Agora! www.vestibular1.com.br
A
s
A
c
g
á
A
t
á
a
m
c
á
b
p
á
l
o
g
v
u a
e n
o
a
c
l
a
g
ç
a
o
g
e
á
r
s
i
g
m
u
ú
i
m
u
n
g
p
o
d
u
b
a
c
o
p
a
z
u
o
s
o
n
é
,
a
r
o
,
e
a
d
s
s
o s ,
s
e
s
c
m
s
c o
r
o
i a
s t o
c o
n o ,
e
t
r
ó
l
e
Á g u a :
s o l v e n
s u b s t â
i ô n i c a
P
a
a
í
f
c
(
p
c
a
d
s
s
á
r
e
á
d
o
p
o
o
o
s
ó
a
s
e
ó
ó
g
e
x
g
e
Á
E
d
o
q
s
t
M
p
M
p
s
7
á
s
J
r
á
r
n
r
m
ó
l
r
s
s
l
l
u
g
e
u
g
m
o
c
u
a
o
a
o
a
o
ó
7
g
a
á
c
e
a
l
d
r
r
r
r
d
%
u
b
s e r
g u a
o x i m
s
q u
m a m
p o s t
l i d o
o
d e
g a
d
i m
a
p r e n
i d o .
i d o ,
a ,
e
r e s s
m p l o
a
s o
s ó d i
u
c
e
a
n
i
o
i
a
o
o
a
c
e
t
i
ó
s
l
e
s
o m
e
m o
u
d o
s
m o
d
o
o
t e
n c
s
p
o
o
d
a
l
d
a
r
,
a
a
l
b
o
r
r
i
t o s
u i d o s
e
e n t e
n i c o s .
e
c a r b o
m
n a
l ,
o
m a s
a
v e
o
s ,
a
l
d
n
o
e m
o
d o
c
h
a
.
e
s
a - s e
d
e
u m
o
i ô n i
)
p e l o
s i n a l
o
í o n ,
n u l a r
d ê - l o
U m a
v
o
í o n
v i t a n d
e
a o
s
c l a r o
b r e
o
o ) .
s
o
s o l v e
m u
i d o s ,
l í q
s p e c i a l m
ó l i d o s
i ô
p o s t o s
d
d i s s o l v e
o
á l c o o
a
u r é i a ,
s
o u t r o s
é
i n s o l ú
é
o
c a s
a s
g r a x a
u
i
m
g
o
s
c
o
c o n t r á r
c o n s e g u
s u a
c a r g
d o
r e s t o
e z
s e p a r
é
r o d e a
o
q u e
e l
ó l i d o .
U
é
a
a ç ã
N a C l
( c l
a
d
i
o
i n
a
d
a d
d o
e
m
o
o r
à
d o
e
o
o
d o
p e l a
d
e
a
t o
a
o m p a r a ç ã o
c o m
a
á g u a
,
a
á g u a
d o s
m a r e s
e
n o s
c o n t é m
g r a n d e s
t i d a d e s
d e
s a i s .
A
n i d a d e
n ã o
é
i g u a l
e m
s
e l e s .
A
m a i o r
é
a
d o
V e r m e l h o ,
c o m
3 9
g r a m a
l i t r o ,
e
a
m e n o r ,
a
d o
B á l t i c o ,
c o m
3 0
g r a m a s
l i t r o .
O
c l o r e t o
d e
o
( N a C l )
c o r r e s p o n d e
a
d o s
s a i s
c o n t i d o s
n a
d o
m a r ,
d a n d o - l h e
r
s a l g a d o .
s
1 1 %
d e
c l o r e t o
d e
s
Vestibular1 – A melhor ajuda ao vestibulando na Internet
Acesse Agora! www.vestibular1.com.br
m
r
a
A
é
N
e
á
d
s
s
l
a
i
o
e s p o n s
m a r g o .
d e n s i
s u p e r
o
i n t e
n c o n t r
g u a
s a
e
a n t i
a l i n i d
u p e r i o
i t r o .
á
O
g
n
s
N o
p o
g r
d o
p r
g e
d e
C o
d e
à
i c
u m
e m
r e
p a
Á
é
i
s
c
e
d
i
r
a
l
g
a
r
b
v
(
M
e
i
g
C
s
p
o
a d e
d a
o r
à
d
i o r
d a
m - s e
d
g a d a ,
o s
m a r
d e
c o s
a
4 0
e
r
g
2)
l
s
r
ã
s
á
o
e
u
s
a
b
o
r
u a
d o
m a r
g u a
p u r a .
T
r r a
t a m b é m
e p ó s i t o s
d e
p r o v e n i e n t e s
e s ,
c u j a
t u m a
s e r
g r a m a s
p o r
a
g
á
e
s
s
d
a
c
o
l
s
m
n
d
e
m a r e s
p o l a r e s
e m - s e
e n c o n t r a r
n d e s
m a s s a s
d e
á g u a
e
g e l a d a
v e n i e n t e s
d e
e i r a s
q u e
e m b o c a m
n o
m a r .
o
o
g e l o
t e m
u m a
s i d a d e
u m
p o u c o
i n f e r i o r
a
á g u a
d o
m a r ,
o s
b e r g s
f l u t u a m
e
a p e n a s
n o n o
d e
s e u
v o l u m e
e r g e
d a
s u p e r f í c i e ,
o
q u e
p r e s e n t a
g r a n d e
p e r i g o
r a
a
n a v e g a ç ã o .
g
u
a
s
S
á
u
S
c
p
u
o
ã
g
m
u
h
u
m
x
o
u
a
a
u
r
a
i
a s
a s
s a
p r
v a ,
a ,
p e
g ê n
c
a
r
b
o
n
s i
t e
l i
i n
q
p o
q u
i o
o
d
o
c
m
c h
r r e s
n i d a
c i p a
u e
é
i s
c
e n a
e
d
(
C
O
e
s
m a d a
t r e s
q
d e
m u
l
f o n t
á g u a
o n t é m
q u a n t
e
d i ó x
2)
a
e
m
s
a s
u e
t ê m
i t o
b a i x a
e
é
a
q u a s e
a p e n a s
i d a d e
d e
i d o
d e
s
o
l
u
ç
ã
o
.
.
As quantidades de sal que as águas terrestres podem conter variam
muito, conforme os terrenos que tenham atravessado. Os sais mais
comuns são: sulfatos, nitratos, cloretos e bicarbonatos de sódio,
potássio, cálcio, ferro e magnésio.
A
q
s
m
á
s
c
s
s
u
a
a
g
a
h
a
a
i
g
u
i
a
b
á
n
s
n
a
s
m
õ
g
t
u a s
q u e
p o s s
i d a d e s
a p r e c
d e
c á l c i o
e
d
é s i o
r e c e b e m
s
d u r a s .
É
q u
p r o v o c a m
u m a
a d a
p r e c i p i t a
e s
e
d e t e r g e n
u
i
e
o
e
ç
t
e
á
m
v
n
e
r e
ã o
e s
e
i
s
d
e
o m e
d
s s e s
a ç ã o ,
,
n o s
,
q u e
e
Vestibular1 – A melhor ajuda ao vestibulando na Internet
Acesse Agora! www.vestibular1.com.br
f
t
f
p
t
e
l
p
a
(
F
O
i
b
b
á
d
d
t
d
d
q
T
i
i
o
r
e
l
a
r
s
t
c
v
r
o
m
e
v
a
r
o
a
e
m
v
p
t
a
t
p
a
r
c
n s
i c
a s
g u
i ó
i s
e r
e
e
u e
a l
m
s s
a ç
o c
o
r o
d o
o s
r e
t a
m
a
o
a
t
a
x
s
r
c
f
"
e
ã
a
d
d
r
,
c
m
a
ç
r
b o
l ú v
r b o
a n t
s
s
i d o
o l v
e n o
á l c
o r m
é
l
r e a
d u r
m
s
o
d
u m
e
v
o m é
a s
s e
a u ç
e n t
ã
o
a
o
a
i
s
d
s "
p ó
s
r
d a
t i
e
n ã
õ e s
o
d
o
n a
e l
n a
e
u b
d
i d
c
i o
a ç
e v
ç ã
d
t
t
s
t
e
o
o
,
ã
a
o
e
o
e
d
e m
o
o l
e r
c
,
n t
o
o
d o
é
C a C
H 2O
( c o m o
s e
l e o ) .
A
p r e c i p i t a d o
e d u ç ã o
d o
d e
c o s ,
c o m o
r o u p a s
o u
d
o
s ã o
t o m a d
a d e q u a d a s
e
á g u a ) .
d
ú
r
a
p
e
c
d
O
e
á
e
v
â
r
a
n
o
o
p
e
s
e
x
(
C
H
g
e
n
b
s
d
r
3 +
C
a
t
c á
u a
c á
l .
e a
o n
s a
o
r e
b i
l a
p r
O
C
a
l
l c
,
l c
Q
s ,
o
m
c a
a
c a
s
e s
a
c
t
i
e
a
s
t
e
s
a
s
i o
é
m a s
o
i o
é
u a n d o
c o m
p
r
o
b
r
o
u m
a t o
r e a ç ã o
r b o n a t o
á g u a s .
s a
p o r :
n
,
+
2
O
3)
2
S
t
m
l
e
r
o
e
e
e
o
v
e
r
e s s a
á g u a
g o t e j a r
d o
o
d e
u m a
c a v e r n a ,
à
d i d a
q u e
a
p r e s s ã o
n o
c a l
v a i
d i m i n u i n d o
s e
a p o r a ç ã o
e
o c o r r e
a
a ç ã o
c o n t r á r i a ,
q u e
i g i n a
o
c a r b o n a t o
d e
c
á
l
+
s
t
H
c
i
2O
d o
t
c á l c
v a i
a o
c
e s t a
g o t e
c e n t
c i r c
c á l c
c a e m
o u t r
a c h a
e s t a
c o l u
f o r m
o
.
e
i
s
h
l
j
r
u
i
a
t
l
n
a
:
C
D
e
a
p
(
H
o
s
C
i
O
t
a
3)
2
d
o
C
a
n
C
a
O
s
3
+
g
o
d
t
á
a
C
O
a
s
2
t o ,
o
c a r b o n a t o
d e
o
f o r m a
u m a
c o l u n a
q u e
e
a l o n g a n d o
e m
d i r e ç ã o
ã o ,
c h a m a d a
a c t i t e .
A
e s t a l a c t i t e
a
p o r q u e
t e m
u m
c a n a l
a l
p o r
o n d e
a
á g u a
l a .
O
c a r b o n a t o
d e
o
c o n t i d o
n a s
g o t a s
q u e
n o
s o l o
f a z
c r e s c e r
c o l u n a ,
m a i s
a d a ,
c h a m a d a
a g m i t e .
E s s a s
d u a s
a s
p o d e m
j u n t a r - s e ,
n d o
p i l a r e s .
Vestibular1 – A melhor ajuda ao vestibulando na Internet
Acesse Agora! www.vestibular1.com.br
C
O
n
c
c
a
f
i
c
l
o
v
o l u m
a
T e r r
o n s t a n
o n t í n u
ç ã o
d o
o r ç a
d
h
i
d
e
d e
a
é
t e ,
o
m o
c a l
a
g r
r
á
o
g
l
ó
g
i
c
o
u
a
e x i s t e n t e
p r a t i c a m e n t e
m a s
e s t á
e m
v i m e n t o
g r a ç a s
o r
d o
S o l
e
d a
a v i d a d e .
à
As águas evaporam com o calor. O vapor sobe às alturas onde,
por ação das baixas temperaturas, se condensa em finíssimas
gotas ou cristais de gelo, formando as nuvens.
A
v
p
f
c
p
f
g
p
r
s
f
s
e
a
r
r
o
o
r
a
e
u
o
C
ã
O
á
s
n
d
a
i
c
t
d
r
p
d
m
q
p
b
c
v
A
n
s
i
i
r
r
a
r
g
b
r
o
o
g
a
e
o
g
n
o
r
e
e
e
e
i
u
r
a
o
i
h
u
t
c
m
r
d
m
a
s
s
q
c
c
a
o
c
s
d
c
n u
t o
s a
a s
s t
a
m a
n i
t e
r e
s o
m a
v e n s
s
.
S e
e
m
p o r
,
s u a s
a i s
s e
ç ã o
d a
d e
c h
z o .
N o
d a
á g
s s a
a o
l o
o u
n d o
o s
n
t
d
o
a
m
a
a
m
i
ã
m
z
o
l e v
s e u
o n a s
g o t a s
u n e m
g r a v i
u v a ,
n
c h ã o ,
u a
c a í
m a r
p
p e l a
s
r i o s .
n
á
g
a
u
o
n
v
a
r i
e n
d e
o n
r t
t
a
i
v
c
t
s
s
a
r
e r
u l
r a
t
á v
n t
m
i
n
a
e l
s o
,
n
a
o
r
c
i
o
e
,
ç
a
e m
u s a
a
p a r a
i s f a z e r
e s s i d a d e s
é s t i c a s ,
í c o l a s
e
u s t r i a i s ,
o
m e i o
d e
n s p o r t e
e
t i n o
d e
í d u o s .
E m
q
u e n a s ,
o s
r
o m p o s t o s
p e
r o o r g a n i s m o
n t i d a d e
e x c
v o c a
u m a
d e
i a s
f l u v i a i s
t a s ,
i m p o s s
a
n e s s a s
á g
P o d e
d u p l
a
a g
c o n c
c i d a
r e s p
i m p o
a d a s
p
p e r c u r
m a i s
o u
o s
e
c a e m
d a d e ,
e v e
o u
a
m a i
d a
e l o
u p e r f í
ç
u
e
i
u
a
s
a
.
s
r
e
b
a
ã
o
l
s
e
g
n t
í d
a
A
s i
a d
d
i l i
s .
i d a d
u o s
ç ã o
v
a
a
a
t
ç
s
a
e s
s ã o
d o s
d
e
ã
o
n
d
l
e
d
o
s
a
s
a
d o
c a m p o
e m
s u a
t e n t e :
a
p e c u á r i a
t u r a .
A
g r a n d e
ç ã o
h u m a n a
n a s
a m b é m
é
e l
p o r
u m a
p a r t e
e
d a
c o n t a m i n a ç ã o
e
.
Vestibular1 – A melhor ajuda ao vestibulando na Internet
Acesse Agora! www.vestibular1.com.br
A l i
v e r
q u e
s ó l
p e r
c o n
i n d
s e u
s
u
a d
a r
i d o
i g o
t a m
ú s t
s
r
d
r
g
e
r
s
s
i
r
e
i
a
.
a
n
i
s
e m
r o
s t
A
f
a ç
a s
í d
a
c l o a c a s ,
o s
d e
e s g o t o
m
r e s í d u o s
p r i n c i p a l
e
m a i s
o n t e
d e
ã o
s ã o
a s
,
q u e
d e s p e j a m
u o s
n a s
á g u a s .
s
a
s
r i
Processo de potabilização da água
8
á
A
h
p
P
c
s
g
p
(
s
s
d
c
d
m
a
l
.
g
u
T
a
r
a
t
a
m
e
n
t
o
á g u a
d e s t i n a d a
a o
u m a n o
d e v e
p a s s a r
r o c e s s o
d e
p o t a b i l
a r a
t a l ,
é
s u b m e t i
o m p l e x a
e
d i s p e n d i
é r i e
d e
m a n i p u l a ç õ
a r a n t i r
a
a u s ê n c i a
a r t í c u l a s
s ó l i d a s
f i l t r a ç ã o ) ,
i n c l u s i
u s p e n s ã o
( a d i ç ã o
d
u b s t â n c i a s
f l o c u l a
e c a n t a ç ã o ) ,
e v i t a r
h e i r o s
e
s a b o r e s
(
e
c a r v ã o )
e
e l i m i n
i c r o o r g a n i s m o s
( c l
n t e s
d e
c h e g a r
a
n
a r e s .
d
a
c o n s u m o
p o r
u m
i z a ç ã o .
d a
a
u m a
o s a
e s
p a r a
d e
v
e
e
m
e
n
t e s
e
o s
m a u s
f i l t r o s
a r
o s
o r a ç ã o )
o s s o s
Vestibular1 – A melhor ajuda ao vestibulando na Internet
Acesse Agora! www.vestibular1.com.br
Tema do Grupo: POLUIÇÃO DAS ÁGUAS: CONSCIENTIZAÇÃO
A poluição das águas tem sido um problema para a nossa sociedade, e é tempo de por fim a todo
o custo este assunto. Nestes últimos anos o governo tem tentado sensibilizar a opinião pública
para esta situação que tem vindo a agravar-se devido há falta de fundos. Também as indústrias,
que cada vez fazem mais poluição sem qualquer medida proteccionista contribuem fortemente
para o problema sem qualquer multa por parte do Governo. Nós neste trabalho vamos falar nas
formas de poluição aquática no mundo e no Brasil. Também vamos falar dos poluentes da água e
os seus perigos para a sociedade. Durante um longo período de tempo, a introdução dos poluentes
nos oceanos poderá conduzir a uma acumulação de substâncias tóxicas, a longo prazo,
disseminando mortandade e contaminação de seres vivos do oceano. Uma vez chegado a isto,
não há hipótese de voltar atrás mas não vamos deixar que isto se alastre para causas muito piores
do que aquelas que já existem por isso contamos com a colaboração de toda a sociedade e
começar a sensibilizar a sociedade escolar, ou seja, os alunos que serão o futuro de amanha para
não continuarem a poluir como os nossos antepassados poluíram.
A maior parte dos poluentes atmosféricos reage com o vapor de água na atmosfera e volta à
superfície sob a forma de chuvas, contaminando, pela absorção do solo, os lençóis subterrâneos.
Nas cidades e regiões agrícolas são lançados diariamente cerca de 10 bilhões de litros de esgoto
que poluem rios, lagos, lençóis subterrâneos e áreas de mananciais.
Os oceanos recebem boa parte dos poluentes dissolvidos nos rios, além do lixo dos centros
industriais e urbanos localizados no litoral. O excesso de material orgânico no mar leva à
proliferação descontrolada de microrganismos, que acabam por formar as chamadas "marés
vermelhas" - que matam peixes e deixam os frutos do mar impróprios para o consumo do homem.
Anualmente 1 milhão de toneladas de óleo se espalham pela superfície dos oceanos, formando
uma camada compacta que demora para ser absorvida.
Desde há muito que os peritos marinhos e aquáticos argumentam que todos os novos compostos
introduzidos no nosso mar e rios deveriam ser considerados potencialmente letais. Eis um
testemunho desses peritos:
"No dia seguinte navegávamos sob vento fraco através de um oceano onde a água límpida estava
cheia de massas flutuantes e negras de alcatrão, aparentemente sem fim... O Atlântico já não era
azul, mas sim cinzento esverdeado e opaco, coberto de coágulos de petróleo que variavam de
tamanho, desde a cabeça de um alfinete até às dimensões de uma sanduíche. No meio do lixo,
flutuavam garrafas de plástico.
Poderíamos estar num sujo porto citadino... Tornou-se claro para nós que a humanidade estava
realmente a poluir a sua mais vital nascente, o indispensável filtro do nosso planeta, o oceano."
Parte da poluição é muito visível: rios espumosos, um brilho oleoso à superfície de um lago, cursos
de água atulhados de lixo doméstico (como é o caso do nosso rio Douro). Mas grande parte é
invisível. Lagos afectados pelas chuvas ácidas podem ainda parecer muito bonitos mas sem vida.
Vestibular1 – A melhor ajuda ao vestibulando na Internet
Acesse Agora! www.vestibular1.com.br
Infelizmente a agressão ao nosso ambiente aquático não acaba aqui. Nos mares, lagos e rios
existe uma enorme diversidade de espécies diferentes muitas das quais fornecem à humanidade
muita comida nutritiva. Não existiam ameaças a esta fonte de alimentos antes do séc. XIX. Quando
navios maiores e técnicas piscatórias mais eficientes, começaram a provocar um sério desgaste
nas populações reprodutoras. Desde a baleia de oceano até ao mais pequeno crustáceo de água
doce tem sido dizimado pelo Homem.
A difusão de lixo marítimo de pólo a pólo torna necessária uma vigilância internacional.
Os navios que derramam impunemente petróleo e poluentes químicos na água dos oceanos. Mas
embora as descargas e derrames de petróleo no alto mar tenham efeitos locais importantes, estas
águas encontram-se livres dos piores efeitos da poluição.
As principais áreas de preocupação são as que se encontram próximo de terra e de aglomerados
humanos. É aqui que a poluição se concentra, é também aqui que se encontra a maioria de vida
marinha, nas plataformas continentais.
O lixo da sociedade tornou-se uma praga para a vida marinha. As tartarugas marinhas e as baleias
ingerem sacos de plástico, que tomam por medusas, provocando-lhe a morte por asfixia. Uma vez,
encontrou-se um cachalote com 50 sacos de plásticos entalados na garganta. As aves marinhas
ingerem pequenas bolas de polietileno que flutuam à superfície do mar; as aves sentem-se fartas e
isso impede-as de se alimentarem adequadamente. Não conseguem engordar e, assim, a sua
aptidão para sobreviverem é reduzida.
Nas ilhas Aleutas, no Pacífico Norte, a população de focas tem diminuído 10%, não devido à caça
ou à diminuição das reservas de peixes, mas por serem apanhadas por precintas plásticos de
embalagem e por tiras plásticas que mantêm unidas as latas de bebidas. Anualmente, um milhão e
meio de quilómetros de redes de pesca, de "nylon" (conhecidas por "a cortina da morte"), são
lançadas ao mar e cerca de 100 quilómetros de rede acabem por perder-se. Essas "redes fantasmas" continuam a pescar, sem governo. Capturam e provocam o afogamento de tartarugas
marinhas, focas, aves marinhas, golfinhos e baleias. A partir de finais de 1988, deverá ter entrado
em vigor um tratado internacional que tornará ilegal o despejo de matérias plásticas ou redes de
"nylon" no mar.
A poluição das águas fluviais são, hoje, constantemente agredidas pelo excesso de poluentes
derramados e despejados destas águas. Os constantes despejos de esgotos das fábricas e dos
centros urbanos estão carregados de substâncias que podem constituir causa séria de poluição
como por exemplo: ovos de parasitas, fungos, bactérias, e vírus que ocasionam doenças como tifo,
tuberculose, hepatite e cólera. A poluição marinha se dá principalmente pelo derramamento de
petróleo em caso de vazamentos e acidentes com petroleiros.
As grandes formas de poluição aquática
Esgotos pluviais e escoamento urbano - Escoamento de superfícies impermeáveis incluindo ruas,
edifícios e outras áreas pavimentadas para esgotos ou tubos antes de descarregarem para águas
superficiais.
Industrial - Fábricas de polpa e de papel, fábricas de químicos, fábricas de têxteis, fábricas de
produtos alimentares...
Agrícola - Excesso de fertilizantes que vão infiltrar-se no solo e poluir os lençóis de água
subterrâneos e por sua vez os rios ou ribeiros onde estes vão dar
Vestibular1 – A melhor ajuda ao vestibulando na Internet
Acesse Agora! www.vestibular1.com.br
Extracção de recursos Minas... - Modificações hidrológicas Canalizações, construção de
barragens...
Poluição Química das águas
É um tipo de poluição de águas que atinge rios e oceanos. Dois tipos de poluentes caracterizam a
poluição química:
a) Biodegradáveis - São produtos químicos que ao final de um tempo, são decompostos pela ação
de bactérias. São exemplos de poluentes biodegradáveis o detergente, inseticidas, fertilizantes,
petróleo, etc.
b) Persistentes - São produtos químicos que se mantém por longo tempo no meio ambiente e nos
organismos vivos. Estes poluentes podem causar graves problemas como a contaminação de
alimentos, peixes e crustáceos. São exemplos de poluentes persistentes o DDT, o mercúrio, etc.
Geralmente o mercúrio é utilizado na mineração para separar o ouro nos rios. Se um peixe
contaminado por mercúrio for ingerido por pessoas, este peixe contaminado pode levar estas
pessoas até a morte se não tomarem providencias imediatas.
Os rios geralmente conseguem "diluir" uma certa quantidade de poluentes químicos, mas se estas
quantidades forem ultrapassadas desenvolve-se no rio algas verde-azuladas, que o fazem cheirar
mal. Estas bactérias se reproduzem rapidamente e vão aumentando roubando todo o oxigênio da
água. Sem oxigênio os peixes vão morrendo aos poucos, e toda vida no rio vai deixando de existir,
morrendo inclusive as bactérias.
Poluição por fosfatos e nitratos
Os adubos e fertilizantes usados na agricultura contêm grandes concentrações de nitrogênio e
fósforo. Esses poluentes orgânicos constituem nutrientes para as plantas aquáticas, especialmente
as algas, que transformam a água em algo semelhante a um caldo verde, fenômeno também
conhecido por floração das águas.
Em alguns casos, toda a superfície é recoberta por um "tapete", formado pelo entrelaçamento de
algas filamentosas. Com isso, ocorre a desoxigenação da água. Pode parecer incoerente. Afinal,
as algas são seres que produzem o oxigênio durante a fotossíntese. Assim, a quantidade de
oxigênio deveria aumentar e não diminuir. De fato, as algas liberam oxigênio, mas o tapete
superficial que elas formam faz com que boa parte desse gás seja liberado para a atmosfera, sem
se dissolver na água. Além do que, a camada superficial de algas dificulta a penetração de luz.
Isso impossibilita a fotossíntese nas zonas inferiores, reduzindo a produção de oxigênio e a morte
de vegetais. A decomposição dos vegetais mortos aumenta o consumo de oxigênio, agravando
ainda mais a desoxigenação das águas.
Eutrofização
É o aumento de nutrientes no meio aquático, acelerando a produtividade primária, ou seja,
intensificando o crescimento de algas. Esse fenômeno pode ser provocado por: lançamento de
esgotos, resíduos industriais, fertilizantes agrícolas e a erosão. É fácil de concluir que, em certas
proporções, a eutrofização pode ser benéfica ao ecossistema.
Vestibular1 – A melhor ajuda ao vestibulando na Internet
Acesse Agora! www.vestibular1.com.br
Contudo, em excesso acarretará um desequilíbrio ecológico, pois provocará o desenvolvimento
incontrolado de uma espécie em detrimento de outras. É o fenômeno conhecido como "floração da
água" e torna reservatórios de águas potáveis em lagoas e lagos imprestáveis para o uso.
Os florescimento de algas são uma consequência da eutrofização o superenriquecimento das
águas pelo excesso de nutrientes das plantas. Além do seu aspecto inestético, estas verdadeiras
explosões de algas constituem uma ameaça de toxicidade para os fornecimentos de água bem
como para as pessoas que consumirem a água afectada, uma vez que as algas produzem
venenos poderosos. Quando estas morrem, as toxinas são libertadas na água, tornando-se muito
difícil removê-las através dos processos normais de tratamento de águas.
Na Grã-Bretanha, têm morrido animais após a ingestão das algas, não se registando, contudo,
óbitos humanos. Em 1989, onze soldados foram hospitalizados depois de terem andado de canoa
em águas afectadas de um lado de Staffordshire; em outros países, houve notícia de doenças,
nomeadamente inflamações do fígado, entre pessoas que beberam água contaminada. Alguns
animais conseguem concentrar as toxinas nos tecidos; no verão de 1990, detectaram-se níveis
elevados em mariscos da costa oriental britânica, tendo sido postos a circular avisos preventivos
do consumo de tais alimentos. Na Finlândia e na União Soviética, ocorreram mortes entre pessoas
que ingeriram peixes com concentrações de toxinas no fígado.
As explosões de algas dão-se naturalmente em determinadas áreas e nem todas as espécies são
tóxicas em geral são as algas azuis e as algas verdes as que produzem veneno. A poluição deve
ser, certamente, responsável em muitos casos, e as companhias das águas podem Ter que
remover o fosfato dos efluentes descarregados em alguns dos 400 lagos e reservatórios afectados
em 1990.
Poluição por resíduos não-biodegradáveis
Todos os compostos orgânicos são biodegradáveis, ou seja, podem ser decompostos pelas
bactérias. Existem, entretanto, alguns compostos orgânicos sintetizados pela indústria que não são
biodegradáveis. Tais compostos também podem ser chamados de recalcitrantes ou biologicamente
resistentes. Não sendo degradados, tais compostos vão se acumulando na água, atingindo
concentrações tão altas que geram sérios riscos aos seres vivos. Dessas substâncias nãodegradáveis merecem destaque o DDT, o mercúrio, etc.
Os fosfatos são encontrados na maior parte dos detergentes e, como já vimos, provocam a
eutrofização. A poluição por óleo é feita, principalmente, pelos navios petroleiros, por ocasião da
lavagem de seus tanques. O óleo forma na superfície da água, uma película impermeabilizante
que impede a troca de oxigênio e gás carbônico entre a água e a atmosfera. Isso provoca a asfixia
dos animais e impede a realização da fotossíntese por parte dos vegetais do plâncton.
Outra forma de poluição através de resíduos não-degradáveis é o caso dos metais pesados
chumbo, alumínio, zinco e mercúrio, entre outros que se depositam nos seres vivos, intoxicandoos.
Milhares de peixes morrem nos rios devido à aplicação de substâncias como, por exemplo, o
sulfato de cobre. Usada como fungicida, tal substância, aplicada às lavouras, atinge os rios
intoxicando os peixes.
Os outros metais, como o mercúrio, sofrem efeito acumulativo ao longo das cadeias alimentares.
Esse metal, altamente tóxico, é usado na garimpagem de ouro. O cascalho, retirado do rio, é
misturado ao mercúrio. O ouro em pó, existente no cascalho, se aglutina ao mercúrio. A seguir, a
mistura mercúrio-ouro é aquecida, para a separação dos dois metais. Durante o processo maior
Vestibular1 – A melhor ajuda ao vestibulando na Internet
Acesse Agora! www.vestibular1.com.br
parte do mercúrio evapora; o resto acaba sendo atirado nos rios, sendo absorvido pela cadeia
alimentar.
Poluição por organismos patogênicos
A água pode ser infectada por organismos patogênicos, existentes nos esgotos. Assim, ela pode
conter:
* Bactérias - Provocam infecções intestinais epidérmicas e endêmicas (febre tifóide, cólera,
shigelose, salmonelose, leptospirose etc.).
* Vírus - provocam hepatites, infecções nos olhos etc.
* Protozoários - Responsáveis pelas amebíases e giardíases, etc.
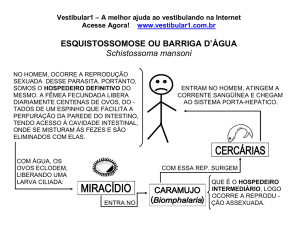
* Vermes - Esquistossomose e outras infestações.
Muitas pessoas preferem, por exemplo, beber a água cristalina de nascentes ou de poços
artesianos em lugar de água de torneira que foi CONVENIENTEMENTE tratada e distribuída.
Freqüentemente, entretanto, a água dos poços e nascentes é contaminada pela proximidade com
fossas e lançamento de esgotos. A contaminação se dá por infiltração através do solo, de tal
maneira que as partículas em suspensão (causadoras da turbiez) ficam retidas neste, enquanto
que as bactérias e vírus, por serem muito menores, atravessam o solo atingindo a água do poço ou
da nascente, que embora "cristalina" passará a transmitir doenças.
Algumas águas para consumo contêm também substâncias orgânicas, cuja presença se explica ou
porque já existem livres na origem, como é o caso de águas drenadas de turfeiras, ou
simplesmente como resultado de actividades do Homem. Entre as substâncias sintéticas incluemse os pesticidas, solventes e alguns resíduos de produtos farmacêuticos. Este tipo de
contaminação resulta da reutilização da água: os processos de tratamento de esgotos e as
unidades de purificação da água para beber nem sempre removem todos os vestígios desses
produtos químicos. Uma fuga de efluente industrial à base de fenóis no Rio Deefez com que a
água chegasse a muitas casas poluídas e com mau sabor, e solventes negligentemente
descarregados à superfície contaminaram lençóis de água subterrâneos em Hampshire,
Oxfordshire e Suffolk. A cloração da água antes do abastecimento pode resultar na presença de
compostos organoclorados na água de beber, ocorrência susceptível de levantar alguma
preocupação.
A aplicação de pesticidas constitui um outro risco de contaminação da água, quer pelo seu
escoamento para os vários veios ou filtração através do solo até à água subterrânea. Herbicidas
persistentes como a simazina e a atrazina, aplicados em unidades agrícolas, linhas férreas e
terrenos dos municípios locais, têm contaminado inúmeros meios aquíferos. Um estudo levado a
cabo pelos amigos da terra em 1987 revelou que na Inglaterra 298 redes de abastecimento de
água excediam os limites da UE quanto a um único pesticida, enquanto 76 mananciais infrigiam os
limites para a totalidade dos pesticidas. (O Valor Máximo Admissível (VMA) de concentração para
cada pesticida é de 0,1 microgramas por litro. Para os Amigos da Terra, aqueles resultados
subestimam seriamente o problema, e crêem que as entidades fornecedoras de água não
procedem a ensaios do seu produto relativamente a resíduos de pesticidas com a frequência e a
extensão que seriam desejáveis. Do mesmo modo, a British Medical Association tem expressado
as suas preocupações acerca da contaminação por pesticidas na água para consumo.
O destino de materiais persistente depende da sua forma e da natureza do rio receptor. Muitos
materiais são francamente solúveis na água dos rios mas deslocam-se sob a forma de partículas
Vestibular1 – A melhor ajuda ao vestibulando na Internet
Acesse Agora! www.vestibular1.com.br
ligados a outras partículas. Estas podem assentar ou permanecer como sedimentos nos rios e
lagos, acabando por ser removidas da biosfera. Noutros casos essas partículas podem ser
absorvidas por riscos que a água pode ter perante a saúde do homem e dos animais que se
alimentam filtrando materiais de água. Estes animais acumulam por vezes altos níveis de metais
pesados, razão pela qual os mexilhões são usados com frequência como indicadores da poluição
marinha pelos metais. Uma vez absorvidos por uma espécies, inclusive o homem. E alguns pontos
de Canal e Bristol, a poluição originada por actividades industriais, e pelo escoamento a partir de
rochas contendo metais pesados, levou um departamento de saúde ambiental a fixar limites
máximos para o consumo de mariscos localmente captados, em virtude do conteúdo de cádmio
que apresentam.
A descarga de um material num rio não significa que este tenha desaparecido de vez,
particularmente quando ao longo do rio se estendem várias cidades, cada uma das quais
descarrega efluentes de esgotos e extrai água para beber. A piada muito divulgada é de que um
copo de água consumido em Londres já passou por vários rins.
Um rio difere da atmosfera num aspecto muito importante que é o fato de conter seres vivos que
são capazes de destruir as substâncias poluentes. Todavia, estes organismos vivos são, também
eles, prejudicados com frequência por poluentes, tornando-se, pois, de todo o interesse considerar
um rio, ou outro corpo aquífero, como uma entidade viva que importa não sobrecarregar com
poluição.
Um efluente descarregado num rio relativamente calmo pode levar tempo a diluir-se: após uma
descarga, e à medida que o afluente se propaga lentamente, e muitas vezes possível observar-se,
ao sabor da corrente, uma pluma semelhante à pluma de poluição do ar. Num rio turbulento, a
mistura dá-se, obviamente, com maior rapidez e a diluição faz-se a mais breve trecho. Nos casos
de um efluente bastante mais denso, ou menos denso do que a água receptora pode acontecer a
mistura ver-se inibida pelo simples fato de uma massa de água se sobrepor a outra em particular
se houver pouca turbulência. Em tais condições, a mistura faz-se por um processo de difusão - o
movimento de moléculas e iões individuais - e esta pode ser demasiado lenta. Padrões específicos
para as descargas de efluentes tem sido frequentemente estabelecidos com vista a obter-se
rapidamente uma diluição adequada, sendo levada em linha de conta em a turbulência.
As grandes partículas de material sólido, como saibro ou areia, por exemplo, assentam em geral
com rapidez fora da corrente, a menos que haja uma turbulência considerável, caso em que
podem ser arrastadas até longas distâncias. As partículas mais finas podem ser levadas num longo
percurso, mesmo na mais calma das correntes, antes de assentarem. É evidente que os materiais
dissolvidos não assentam, mas podem ocorrer reacções químicas que provocam a sua
precipitação; alguns compostos de ferro, por exemplo, são oxidados e formam depósitos vermelhos
alaranjados no fundo da corrente. Os líquidos que não se misturam com a água irão deslocar-se
numa camada separada, em geral à superfície; o petróleo é o exemplo mais comum.
Poluição dos Rios
Como fruto da atuação do homem sobre o meio ambiente, surge o problema da poluição dos rios.
As fontes de poluição da água dos rios resultam, entre outros fatores, dos esgotos domésticos,
despejos industriais, escoamento da chuva das áreas urbanas e das águas de retorno de irrigação.
Desse modo, principalmente no atual século, o grande crescimento populacional e o
desenvolvimento industrial, além do uso, cada vez maior, de fertilizantes químicos e inseticidas nas
lavouras tem causado sérios danos aos rios e a vida de modo geral.
Vestibular1 – A melhor ajuda ao vestibulando na Internet
Acesse Agora! www.vestibular1.com.br
As grandes concentrações de nitrogênio e fósforo, usados nos adubos e fertilizantes, constituem
um tipo muito comum de poluição da água. As enxurradas transportam para os rios os fosfatos e
nitratos. Estes nutrem as plantas aquáticas, as quais, multiplicando-se (especialmente algas),
absorvem o oxigênio da água. Por sua vez, a falta de oxigênio provoca a morte de muitas plantas e
animais que, ao se decomporem, aumentam a poluição.
Além deste fato, muitos outros são causadores da poluição dos rios:
* Os inseticidas usados nas lavouras, que destroem o fictopancto existente nos rios, o qual é
responsável pela renovação de 70% do oxigênio da atmosfera.
* Os sedimentos que são transportados para os rios, pelas enxurradas, em decorrência de práticas
agrícolas que não se preocupam com a conservação do solo. Os sedimentos ou detritos não
deixam a luz do sol penetrar na água, dificultando as formas de vida subaquáticas.
* Quando é ultrapassada a capacidade de autodefesa da água em sanear os detritos, em virtude
do excesso de esgoto despejado nos rios, ocorre o aparecimento de gases nocivos à vida
aquática.
Nos últimos anos vem-se agravando a poluição nos rios, causada pela poluição industrial. Fábricas
tem despejados quantias enormes de substâncias nocivas nas águas fluviais. Entre os poluentes
industriais mais perigosos encontram-se os compostos de metais pesados (como o mercúrio e o
chumbo), os resíduos das industrias de madeira e de pasta de papel e os detritos de indústrias
petroquímicas e resíduos radiativos.
Em várias partes do mundo ocorre envenenamento de pessoas, causado pela presença de
mercúrio e cádmio nas águas fluviais. No Japão isso ocorreu de forma dramática na bacia do rio
Jintsu e em outros. Os peixes contaminados causaram a população mortes, distúrbios da fala e da
visão, além de paralisia.
No Brasil, vários rios estão poluídos: O rio Tietê, que atravessa a cidade de São Paulo, e é o
receptáculo dos esgotos dessa e de outras cidades próximas; os rios Pardo e Moji, que recebem
poluentes industriais das usinas de açúcar e álcool das regiões por eles atravessadas.
Recentemente, em abril de 1984, a população Ribeirinha do rio São Francisco, na região do
Juazeiro (BA) viu cerca de 500 mil toneladas de peixes de várias espécies mortos. A causa não foi
apurada ou divulgada, admitindo-se, entretanto, que ocorreu poluição com metal pesado,
proveniente de uma fábrica próxima, ou que o agente poluidor foi um agrotóxico.
Segundo os técnicos as conseqüências da poluição do rio São Francisco são drásticas.
Inicialmente surge o problema da alimentação de milhares de pessoas que vivem da pesca ao
longo desse rio. São pessoas pobres que não possuem condições de alterar sua alimentação.
Além desse problema imediato existem outros, como é o caso da recomposição da fauna, pois com
o desastre foi interrompido o ciclo biológico. Espera-se também que num curto espaço de tempo
deva ocorrer a morte da flora marginal afetada; com isso poderá haver a queda de barreiras ou
barrancos causando o assoreamento do rio, fato que dificultará a navegação.
Percebe-se que os rios, como fonte de alimentos, meio de transporte e fornecedores de água para
a irrigação de terras e para uso em geral do homem, encontram-se ameaçadas. Há necessidade
de serem adotadas medidas antipoluidoras ou normas rígidas do aproveitamento dos recursos
naturais. Caso isso não ocorra os rios estarão agonizando.
Vestibular1 – A melhor ajuda ao vestibulando na Internet
Acesse Agora! www.vestibular1.com.br
No Reino Unido, cerca de 1 bilião e meio de litros são descarregados todos os dias para o mar
através de condutas ao longo da costa. Além disso, aproximadamente 2 milhões de toneladas de
lixo tóxico são descarregados para o mar todos os anos. Surgem dois grandes problemas desta
descarga: os detritos visíveis derivados dos esgotos e, mais importante ainda, os riscos para a
saúde que podem ocorrer depois de usar águas poluídas por esgotos.
As baleias Belugas vivem nas águas do rio S. Lourenço, no Canadá. São as únicas baleias de
água doce do mundo. São brancas e tóxicas. Os poluentes industriais e perigosos produtos
químicos que se tem vindo a acumular no rio ao longo dos últimos 40 anos são transferidos ao
longo da cadeia alimentar para as Belugas. Os tecidos das baleias contêm tais concentrações
destes químicos que, segundo a lei canadiana, aos seus corpos tem que ser dado o destino
especial dos lixos tóxicos.
Desde 1940 os Estados Unidos acrescentaram 70.000 novas substâncias químicas ao ambiente.
Estas, encontram os seu caminho para os solos, água e eventualmente para a nossa alimentação.
Ninguém está a salvo. Todos são as vítimas da poluição.
"As indústrias dos Estados Unidos geram à volta de 40 milhões de toneladas de detritos tóxicos por
ano, 90% das quais, segundo as estimativas da E.P.A. (Environment Protection Agency), são
inadequadamente descarregadas (sem o devido tratamento)". Os EUA não são os únicos. Há
muitos países industrializados produtores de substâncias tóxicas.
Estima-se que a água potável dos EUA tem 2.100 químicos tóxicos causadores de cancro,
mutações celulares e problemas nervosos. As centrais de tratamento existentes não estão
preparadas para remover os novos químicos tóxicos, e o governo é lento a tomar medidas para
regular as altas taxas de contaminação.
Em Portugal temos vários exemplos do que a poluição é capaz de fazer: os rios, que em tempos
foram rios limpos, agora além da água estar bastante suja, o cheiro é muito desagradável; as
praias ao longo da costa portuguesa, foram também em tempos praias onde a água e a areia eram
muito limpas e agora estão bastante poluídas; o Febros, afluente do Douro, que em tempos fora
habitado por uma grande abundância e variedade de peixes chegando mesmo a haver lontras,
agora é apenas habitado por pneus de camiões, garrafas e muitas outras coisas.
Pequenos rios e condutas pluviais servem também de vazadouro, despejando diariamente
toneladas de detritos nos rio e no mar. Os efeitos são evidentes: Poluição. Certas praias
constituem mesmo um risco para a saúde pública.
Sem qualquer protecção, para as crianças ou adultos, que muita das vezes, se encontram bem
perto a brincar ou tomar banho, muitas vezes sem saberem o perigo que correm.
Nos rios, como nas praias portuguesas, a poluição existente, a concentração de coliformes
constituí mesmo uma ameaça à saúde pública. Mas não é tudo. O esgoto é composto por grandes
quantidades de matéria orgânica e organismos patogénicos e ainda sais minerais, que ao chegar,
sem tratamento a um rio, a matéria orgânica é degradada, consumindo muito oxigénio. Os
organismos patogénicos sobrevivem e os sais minerais alimentam a flora existente que se
reproduz rapidamente e em alguns casos, produz substâncias tóxicas. O tratamento dos esgotos
eliminaria os organismos patogénicos e facilitaria o controlo do desenvolvimento das plantas
fluviais, aumentando a quantidade de oxigénio existente na água.
A flora microbiana e a fauna parasitária muito abundante no esgoto é também motivo de
preocupação.
Vestibular1 – A melhor ajuda ao vestibulando na Internet
Acesse Agora! www.vestibular1.com.br
Não devemos esquecer a célebre peste negra que matou tanta gente, nem a cólera provocada por
água inquinada por esgotos.
Origem dos descarregamentos no rios
Grande parte do material descarregado nos rios é biológico na sua origem, podendo servir de
alimento a microrganismos. Quando há bastante oxigénio presente na água, a decomposição é
feita por organismos aeróbios, mas nos pontos onde o oxigénio já se exauriu, tem lugar uma
decomposição não aeróbia. Seja qual for o processo envolvido, a matéria orgânica é desintegrada
em compostos mais simples, se bem que a natureza e os efeitos ambientais desses produtos
decompostos variem bastante.
O Adubo retirado da poluição de rios
Este adubo é um produto originário do tratamento de esgotos urbanos. O processo adotado retira
os nutrientes dos esgotos, concentrando-os no material sólido, o qual, após tratamento se
transforma em um excelente condicionador de solos.
É uma importante fonte de matéria orgânica e pode ser utilizado para reduzir as quantidades de
fertilizantes químicos, melhorar as características físicas do solo, acrescentar micronutrientes
essenciais ao desenvolvimento das plantas, melhorando a produtividade do agricultor, e o melhor é
que evita intoxicação de rios próximos.
Atualmente, o adubo, embora tratado, não é completamente higienizado, portanto, não é
recomendado seu uso na produção de hortaliças. A utilização deve ficar limitada ao plantio de
árvores frutíferas, forrageiras, milho, café, plantas ornamentais e outros produtos agrícolas que não
sejam ingeridos crus. No final de 1998, o produto foi higienizado, e teve a aplicação irrestrita.
Cuidados também devem ser tomados no manuseio do adubo, como o uso de luvas, botas de
borracha, máscaras e outros necessários à segurança do trabalhador. Não esquecer de lavar as
mãos sempre que acabar o serviço, preferencialmente com álcool.
A Poluição Térmica
A poluição térmica decorre do lançamento, nos rios, da água aquecida usada no processo de
refrigeração de refinarias, siderúrgicas e usinas termoelétricas. Para os seres vivos, os efeitos da
temperatura dizem respeito à aceleração do metabolismo, ou seja, das atividades químicas que
ocorrem nas células. A aceleração do metabolismo provoca aumento da necessidade de oxigênio
e, por conseguinte, na aceleração do ritmo respiratório. Por outro lado, tais necessidades
respiratórias ficam comprometidas, porque a hemoglobina tem pouca afinidade com o oxigênio
aquecido. Combinada e reforçada com outras formas de poluição ela pode empobrecer o ambiente
de forma imprevisível.
Poluição do Litoral
Outrora, pensava-se que as substâncias residuais despejadas no mar se diluiriam e
desapareceriam para sempre. Porém, essas substâncias permanecem, em movimento, no mar. As
correntes deslocam os desperdícios de um lado para o outro, concentrado-os aqui e diluindo-os ali.
As correntes ascendentes, nas áreas onde a água fria das profundezas sobe à superfície, podem
trazer à luz resíduos perigosos, enterrados em locais que se pensava serem seguros.
O litoral brasileiro nos últimos anos, vem sendo constantemente agredido pelo homem. Um dos
maiores problemas é a poluição pelo derramamento de petróleo a partir de navios petroleiros ou,
mesmo, devido a acidente com estes navios ou com oleodutos litorâneos.
Vestibular1 – A melhor ajuda ao vestibulando na Internet
Acesse Agora! www.vestibular1.com.br
Os litorais de São Paulo e Rio de Janeiro são os mais agredidos por esse tipo de poluição, dada a
grande concentração demográfica e industrial nestes estados, exigindo-se grandes desembarques
de petróleo nesta área, principalmente no terminal marítimo da Petrobrás em São Sebastião (SP).
O vazamento de petróleo no mar implica no aparecimento da chamada "maré negra", que mata os
peixes de toda a região poluída e escurece toda a areia da praia afetada. Além do petróleo,
algumas indústrias químicas localizadas no litoral costumam despejar seus detritos no mar,
poluindo as praias e causando grande mortalidade da fauna marinha.
Outro sério problema enfrentado pelo litoral brasileiro é o despejo de dejetos, fazendo com que
muitas praias se tornem um grande esgoto a céu aberto.
Poluição no Litoral Brasileiro: Os pontos críticos da costa do país
* No Amapá há problemas de poluição no distrito industrial onde está a Alunorte, produtora de
Alumínio, e também na zona portuária com o embarque de minérios de manganês.
* No Maranhão, as atividades de mineração da Alunorte também geram problemas. A Alcoa vem
atacando os sistemas estuarinos e os manguezais da região sul de São Luís.
* Em Pernambuco, o catastrófico ciclo das enchentes provoca forte desequilíbrios ecológico.
Apenas 22% das áreas de Recife dispõem de esgotos. Os estuários transformaram-se numa fonte
de doenças transmissíveis. Existe uma plataforma marítima de prospecção de petróleo.
* Em Sergipe a exploração de petróleo e os constantes vazamentos no Terminal de Carmópulis
elevam as incidências de vazamentos no litoral. Dejetos químicos em grande quantidade são
lançados pelas industrias Nitrogenadose e Petromisa.
* Na Bahia, o polo petroquímico de Camaçari, o centro industrial de Aratu e centenas de outras
industrias colocam o litoral baiano entre os cinco mais poluídos da costa brasileira.
* Vitoria do Espirito Santo é outro ponto negro do litoral brasileiro, com mais de 760 industrias,
entre elas a Aracruz Celulose, Companhia Siderúrgica de Tubarão e as usinas de pallets da
companhia Vale do Rio Doce.
* O Rio de Janeiro, sofre com a ação de mais de 10 mil industrias, que através de vários canais
drenam seus dejetos para a Baía de Guanabara e Lagoa Rodrigo de Freitas. Na Ilha bela, a
Petrobrás realiza uma recuperação do fundo do mar, duramente atingida por uma série de
vazamentos de petróleo. Em Campos existem plataformas marítimas de prospecção de petróleo.
* A baixada Santista tem mais de mil industrias poluidoras, como a Rodhia, Union Carbide e
Casipa. A região ainda sofre freqüentes acidentes com derramamento de petróleo.
* O litoral do Paraná e de Santa Catarina são mais castigados pelos dejetos fecais, comuns a toda
costa brasileira e responsáveis por 70% da poluição do mar. Em Santa Catarina existe uma
plataforma marítima de prospecção de petróleo.
Ponto crítico de destaque, a Lagoa dos Patos deságua no atlântico na altura da cidade de
Rio Grande. O polo petroquímico do sul já encontrou as praias da região declaradas
impróprias para o banho.
Vestibular1 – A melhor ajuda ao vestibulando na Internet
Acesse Agora! www.vestibular1.com.br
Observe a seguir como se comporta a água no subsolo
Existem no subsolo materiais porosos e materiais impermeáveis
que têm funções de armazenamento e condução de água.
Explicando melhor:
Dentre os materiais porosos
existem aqueles que absorvem e
liberam a água com facilidade,
e outros que absorvem a água
mas a retém nos seus poros.
Os materiais impermeáveis
não absorvem a água e servem
de condutores do seu fluxo.