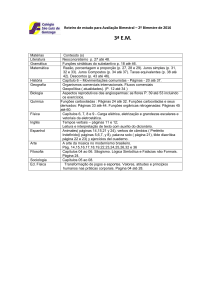
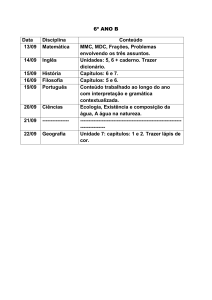
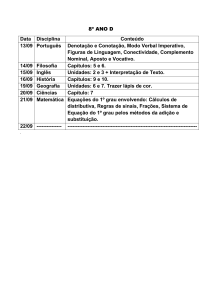
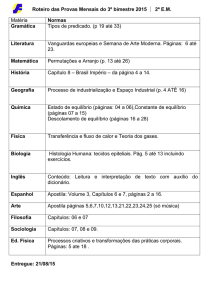
PROGRAMAÇÃO DA 2ª ETAPA
MATÉRIA: QUÍMICA
SÉRIE: 2ª - Ensino Médio
PROFESSORES: Adjalma e Manoel
“A RAZÃO E A SABEDORIA FALAM. O ERRO E A IGNORÂNCIA GRITAM.”
Sto. Agostinho
CONTEÚDOS:
Professor Manoel
Unidade I – Soluções – ( livro-texto – Tito e Canto – Capítulos 1 a 6 e 33)
• Capítulo 1 – Dispersões e Misturas.
• Capítulo 33 – Gráficos de solubilidade e classificação de misturas.
• Capítulos 2 a 4 – Concentração de soluções.
• Capítulo 5 – Diluição e mistura de soluções.
• Capítulo 6 – Estequiometria envolvendo soluções aquosas.
Unidade II – Propriedades Coligativas livro-texto – Tito e Canto – Capítulos 7 a 10)
• Capítulo 7 - Pressão de vapor de um líquido.
• Capítulos 8 a 10 – Propriedades coligativas.
Unidade III (Introdução) - Equilíbrio Químico (livro-texto – Tito e Canto – Capítulos 26, 27, 32 e 34)
• Capítulos 26 a 32 – Equilíbrio Químico e Constante de Equilíbrio.
Professor Adjalma
Unidade I – Termoquímica – (livro-texto – Tito e Canto – Capítulos 20 a 22)
• Capítulo 20 – Entalpia e Variação de Entalpia.
• Capítulo 21 – Lei de Hess, calores de combustão e formação.
• Capítulo 22 – Energia de ligação.
• Capítulos 21 e 22 – Aspectos estequiométricos e ambientais da Termoquímica.
• Capítulo Extra – Hidrocarbonetos (Introdução à Química Orgânica)
Unidade II – Cinética Química (livro-texto – Tito e Canto – Capítulos 23 a 25)
• Capítulo 23 – Rapidez de reações.
• Capítulo 24 – Fatores que afetam a rapidez das reações.
• Capítulo 25 – Lei cinética e teoria das colisões.
HABILIDADES:
Soluções e Propriedades Coligativas – Professor Manoel
• Classificar as soluções em: diluída, concentrada, saturada e não saturada, eletrolítica ou não
eletrolítica.
• Caracterizar o estado coloidal em termos de propriedades e estados físicos.
• Prever a solubilidade de uma substância a partir da interpretação de gráficos de curva de
solubilidade.
• Interpretar dados sobre a concentração de soluções expressas nas unidades: g/L, mol/L,
porcentagem em massa (%) e ppm.
• Determinar a concentração de soluções através de titulações ácido-base.
• Reconhecer a dependência entre as propriedades coligativas e a concentração do soluto em
solução.
• Descrever, utilizando a linguagem discursiva, esquemas ou gráficos, as propriedades coligativas:
abaixamento de pressão de vapor, abaixamento de temperatura de congelamento, elevação da
temperatura de ebulição e pressão osmótica.
Equilíbrio Químico – (Introdução) – Professor Manoel
• Correlacionar, como característica do estado de equilíbrio, a constância das propriedades
macroscópicas aos aspectos dinâmicos das reações no nível microscópico.
• Identificar o estado de equilíbrio através da análise de gráficos de concentração de reagentes e
produtos, em função do tempo.
PE 127-2012
1
•
•
Calcular os valores de constantes de equilíbrio, a partir de dados de concentração e vice-versa.
Correlacionar o significado do valor da constante de equilíbrio, a determinação da posição do
equilíbrio químico (deslocado para a esquerda, deslocado para a direita) ou ao rendimento da
reação.
Termoquímica – Professor Adjalma
• Reconhecer e diferenciar os conceitos de calor e temperatura.
• Reconhecer processos que alteram a temperatura das substâncias sem envolver fluxo de calor –
trabalho mecânico, trabalho elétrico e absorção de radiação eletromagnética.
• Entender a produção de energia pela queima de combustíveis: carvão, álcool e hidrocarbonetos.
• Classificar as reações em exotérmicas e endotérmicas, de acordo com a energia absorvida ou
liberada.
• Reconhecer calores de reações, notadamente calores de formação, ligação e combustão.
• Calcular a variação de entalpia (∆H) de reações, a partir de gráficos de energia e tabelas.
• Calcular a variação de entalpia (∆H) de uma reação, a partir de dados de energia de ligação e viceversa.
• Utilizar a Lei de Hess para calcular ∆H de reações.
• Reconhecer processos radioativos, radioisótopos, partículas alfa, beta e raios gama.
• Descrever processos de produção de energia, a partir da fissão e fusão nucleares.
• Reconhecer, no cotidiano, aplicações e implicações sociais importantes acerca do uso da energia
nuclear.
Cinética Química – Professor Adjalma
• Representar graficamente dados da concentração de reagentes e/ou produtos de uma reação em
função do tempo, tendo sido fornecidos valores tabelados destas grandezas.
• Reconhecer os principais fatores que modificam a rapidez de reações, através da descrição de
experimentos não hipotéticos.
• Explicar, pela teoria de colisões moleculares, os fatores que influem na rapidez de uma reação:
temperatura, superfície de contato e concentração.
• Identificar num diagrama de energia de uma reação química aspectos como a presença ou não de
catalisadores, energia de ativação e complexo ativado.
• Analisar a influência das concentrações iniciais dos reagentes na rapidez de uma reação, a partir da
expressão matemática da lei da rapidez de reação.
• Avaliar a influência da temperatura, pressão, catalisador, concentração de reagentes e produtos e
superfície de contato, na otimização de processos na indústria química, a partir da análise de dados
pertinentes, em forma de tabelas ou figuras.
DISTRIBUIÇÃO DE PONTOS:
• PROVAS ................................. 18,0 pontos
• SIMULADOS ENEM ................ 8,0 pontos
• LABORATÓRIO ..................... 3,0 pontos
• PROJETO LEITURA ..................1,0 ponto
DICAS DE APROFUNDAMENTO:
Livros:
• MORTIMER, Eduardo Fleury & MACHADO, Andréa Horta. Química para o Ensino Médio. São
Paulo: Scipione, 2005.
• SARDELLA, Antônio & MATEUS, Edegar. Dicionário escolar de Química. São Paulo: Ática, 1981.
Sites:
• www.cdcc.sc.usp.br/quimica/index.html
• http://www.sbq.org.br/ensino/
• http://allchemy.iq.usp.br/
• http://www.chem.qmw.ac.uk/iupac/index.html
• http://dicasdequimica.vila.bol.com.br
• http://educar.sc.usp.br
PE 127-2012
2
•
•
http://sbqensino.foco.fae.ufmg.br
http://www.mundodoquimico.hpg.ig.com.br/
ROTEIRO DE TRABALHO (TRABALHO VINCULADO AO PROJETO LEITURA DA 2ª SÉRIE)
Tema: Introdução às Funções Orgânicas
Objetivos:
• Conhecer as principais maneiras de se representar compostos orgânicos.
• Descobrir, a partir da estrutura, a fórmula molecular e mínima de um composto orgânico.
• Reconhecer as principais funções orgânicas.
Desenvolvimento: as orientações estão disponíveis no Magnum-SOL.
Cronograma: Data de disponibilização do trabalho no Magnum-SOL: 1º de junho.
Último dia para envio do trabalho: 15 de junho.
Critérios de avaliação: Disponíveis no Magnum-SOL.
Valor: 1,0 ponto.
Referências: Canto, Tito e. Química na Abordagem do Cotidiano. Volume III ou Volume Único; São
Paulo: Editora Moderna.
• http://www.colegioweb.com.br/quimica/introducao-a-quimica-organica.html
• http://www.brasilescola.com/quimica/formulas-estruturais-carbono.htm
• http://www.profjoaoneto.com/quimicag/sdeterminacao_formulas.htm
PE 127-2012
3