Plano de Recuperação Ensino Médio – 1° ANO UNIDADE PARQUE
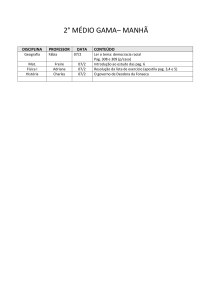
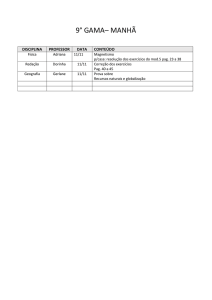
1º Médio
NOME DO
CONTEÚDO:
DISCIPLINA PROFESSOR
Surrealismo
Características
Eliane
Artistas
Artes
Ciscato
Obras principais
1.1 – Trabalho segundo as normas da ABNT sobre o movimento artístico
surrealista.
1.2 – Releitura de uma obra surrealista.
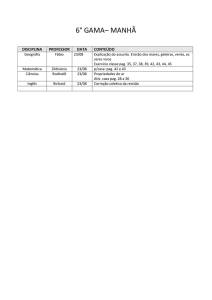
Plano de Recuperação Ensino Médio – 1° ANO UNIDADE PARQUE
Série
Disciplina
Professor
1
ano
Biologia
Wildner
Conteúdos da
prova
00 a 8,0
pontos
Organelas
celulares
básicas
síntese
proteica
fisiologia
celular
fisiologia
estrutura
vegetal
Trabalho 00 a 2,0 pontos
Pesquise as funções das organelas celulares e os tecidos
vegetais básicos. O trabalho deverá ser digitado, norma
ABNT, índice, capa, referencia bibliográfica, conclusão.
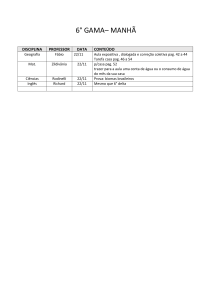
Plano de Recuperação Ensino Médio – 1° ANO UNIDADE PARQUE
1A1AP
Espanhol
Conteúdo da prova:
Texto e interpretación;
Artículos, Contracciones y
combinaciones,
Verbos en presente de indicativo:
ir,ser,estar, tener e regulares;
Adjetivos posesivos;
Heterosemánticos;
Confección de una muestra
cultural
Pesquisar as principais festas
nacionais de dez países
hispanohablantes.O trabalho
deve conter informações,
fotos, ilustrações, vestuário,
comidas típicas e canções.
Entregar o trabalho de acordo
com as normas da ABNTem
espanhol no dia da prova de
recuperação.
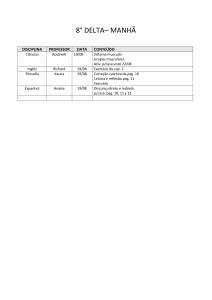
Plano de Recuperação Ensino Médio – 1° ANO UNIDADE PARQUE
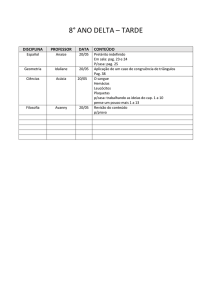
DISCIPLINA
NOME DO
PROFESSOR
CONTEÚDO A SER ESTUDADO PARA AVALIAÇÃO
Valor da avaliação: de 00 a 8.0 pontos.
• Senso Comum, Bom senso e Paradigmas
• Metafísica e Felicidade
Filosofia
DISCIPLINA
Nilson
NOME DO
PROFESSOR
TRABALHO DE RECUPERAÇÃO
Valor do Trabalho: de 00 a 2.0 pontos.
PESQUISA:
Filosofia
Nilson
• Ética e Moral a partir de Platão e Aristóteles
• Relação da fé e razão – São Tomás de Aquino
Plano de Recuperação Ensino Médio – 1° ANO UNIDADE PARQUE
DISCIPLINA
NOME DO
PROFESSOR
Física
Fernanda
DISCIPLINA
NOME DO
PROFESSOR
Física
Fernanda
CONTEÚDO A SER ESTUDADO PARA AVALIAÇÃO
Valor da avaliação: de 00 a 8.0 pontos.
Apostila 1: Aulas 1 a 5, 7 a 10, 16 a 18
Apostila 2: Aulas 27 a 30
Apostila 3: Aulas 39 a 42
TRABALHO DE RECUPERAÇÃO
Valor do Trabalho: de 00 a 2.0 pontos.
Fazer resumo dos conteúdos:
Apostila 1: Aulas 1 a 5, 7 a 10, 16 a 18
Apostila 2: Aulas 27 a 30
Apostila 3: Aulas 39 a 42
O trabalho deverá ser manuscrito
Plano de Recuperação Ensino Médio – 1° ANO UNIDADE PARQUE
DISCIPLINA
Geografia
NOME DO
PROFESSOR
Danilo
DISCIPLINA
NOME DO
PROFESSOR
Geografia
Danilo Rocha
CONTEÚDO:
- Conflito Norte(Rico) x Sul(Pobre)
- Brasil; país urbano, industrial e não desenvolvido
- Coordenadas geográficas
- Fusos
- Camadas da Terra, tipos de rochas e estrutura geológica
TRABALHO DE RECUPERAÇÃO:
- Agentes erosivos externos e internos
Aplicar normas da ABNT
Plano de Recuperação Ensino Médio – 1° ANO UNIDADE PARQUE
DISCIPLINA
NOME DO
PROFESSOR
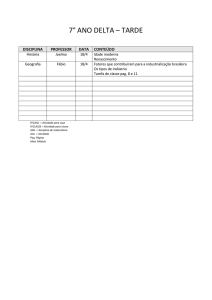
CONTEÚDO A SER ESTUDADO PARA AVALIAÇÃO
Valor da avaliação: de 00 a 8.0 pontos.
Ap.1 – Roma (República e Império)
História
Nilson
Ap.2 – Os Árabes;
Civilização Medieval (Feudalismo);
Transição para Idade Moderna
Ap.3 – Formação das Monarquias Nacionais;
Expansão Marítimo-comercial (Mercantilismo;
Absolutismo monárquico e seus teóricos;
Reforma Religiosa (Calvinist)
DISCIPLINA
TRABALHO DE RECUPERAÇÃO
NOME DO
Valor do Trabalho: de 00 a 2.0 pontos.
PROFESSOR
PESQUISA:
História
Nilson
• Renascimento e seus expoentes para a filosofia e
literatura
Plano de Recuperação Ensino Médio – 1° ANO UNIDADE PARQUE
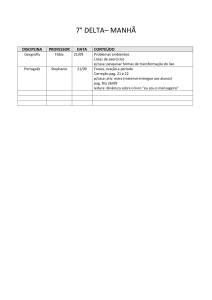
DISCIPLINA
Inglês
NOME DO
PROFESSOR
Klésia
CONTEÚDO A SER ESTUDADO PARA AVALIAÇÃO
Valor da avaliação: de 00 a 8.0 pontos.
Personal Pronouns
Plural of Nouns
Simple Present
Imperative
TRABALHO DE RECUPERAÇÃO
NOME DO
DISCIPLINA
Valor do Trabalho: de 00 a 2.0 pontos.
PROFESSOR
Inglês
Klésia
Fazer uma pesquisa manuscrita do conteúdo acima.
Contendo, capa impressa e conteúdo totalmente
manuscrito com a bibliografia.
Plano de Recuperação Ensino Médio – 1° ANO UNIDADE PARQUE
DISCIPLINA
Português
DISCIPLINA
NOME DO
PROFESSOR
Marcia
NOME DO
PROFESSOR
CONTEÚDO:
Trovadorismo;
Humanismo;
Classicismo.
Quinhentismo;
Barroco.
TRABALHO DE RECUPERAÇÃO:
Copiar e resolver exercícios adicionais das apostilas 1, 2,3 e 4 (
parte A – Literatura )
Português
Marcia
MANUSCRITO com , capa ( em papel almaço )
Plano de Recuperação Ensino Médio – 1° ANO UNIDADE PARQUE
Série Disciplina Professor Conteúdos da prova:00 a 8,0 pontos
Módulo 1:
1º
ano
Química
Wanderlei
A. Pirolo
Aula 5: Eletrosfera; Pag: 256
Aula 6: Distribuição Eletrônica Linus
Pauling;Pag:257
Aula 7: Distribuição Eletrônica de
íons;Pag:258
Aula 8: Elementos químicos e tabela
Periódica;Pag:273
Aula 9: Classificação Periódica dos
Elementos;Pag: 275
Aula 10 e 11: Propriedades
Periódicas;Pag:276
Aula 12: Metais, Ametais e
Semimetais;Pag:278
Aula 16: Classificação de Sistemas;Pag:302
Aula 17: Classificação de subst.. Puras;Pag:
304
Aula 18: Gráficos de mudanças de estado
físicos;305
Módulo 2:
Aula 19: Classificação dos compostos
Inorgânicos;Pag:173
Aula 20: Compostos Binários iônicos;Pag:
175
Aula 21: Compostos Binários
moleculares;Pag:176
Aula 22: Oxiácidos: Tabela de ácidos
padrões;Pag:177
Aula 23 e 24: Oxissais Fórmulas e
nomenclaturas; Pag:179
Aula 25 e 26: Bases e casos
especiais;Pag:183
Módulo 3:
Aula 31: Cálculo de Massa atômica do
Elemento;Pag:215
Aula 32: Cálculo de massa
molecular;Pag:217
Aula 33: Conversão dimensional de
unidades;Pag:218
Aula 34: Mol, Const. Avogadro e massa
molar;Pag:219
Aula 35 e 36: Cálculo Mol e Const.
Avogadro;Pag:220
Aula 37 e 38: Exercíciosgerais de
Cáculos;Pag: 222
Aula 39 e 40: Leis: Lavoisier, Proust e
Dalton;Pag:232
Aula 41 e 12: Equações e reações Químicas Balanceamento de Equações;Pag:239
Trabalho 00 a 2,0
pontos
Trabalho será lista de
exercícios do conteúdo
selecionado.
Anexo
TRABALHO DE RECUPERAÇÃO SEMESTRAL DE QUÍMICA
Lista de exercícios de Química 1º ano E.M.
NOME: ______________________________________________________________________
TURMA: 1 Ano E.M.
Nº___________
TRABALHO DE: _Química
PROFESSOR: _Wanderlei A. Pirolo_
1º SEMESTRE
NOTA: ________
LEIA ATENTAMENTE AS INSTRUÇÕES:
1.
2.
3.
4.
5.
6.
Preencha corretamente o cabeçalho com caneta. Na falta do mesmo a prova será cancelada.
Este trabalho tem o valor de zero até dois pontos.
A resposta final deverá ser à tinta esferográfica azul ou preta.
Resolução obrigatória das questões dissertativas.
Registro obrigatório do raciocínio lógico matemático nos testes que apresentam cálculos para chegar à alternativa correta.
Esta lista de exercícios traz a base para elaboração da prova de recuperação semestral.
Módulo -1
1) Dentre os seguintes elementos, qual apresenta 16 elétrons no terceiro nível energético?
(Dados: números atômicos S = 16, Ni = 28, Zn = 30, Br = 35, Zr = 40.) a) S
b) Ni
c) Zn
d) Br
e) Zr
2) Dentre os números atômicos 23, 31, 34, 38, 54, os que correspondem a elementos
químicos com dois elétrons de valência são:
a) 23 e 38
b) 31 e 34
c) 31 e 38
d) 34 e 54
e) 38 e 54
3) A configuração eletrônica do elemento de número atômico 21, no estado fundamental, é:
____________________________________________
____________________________________________
4) O íon monoatômico A2– apresenta a configuração eletrônica 3s2 3p6 para o último nível. O
número atômico do elemento A é:
a) 8
b) 10
c) 14
d) 16
e) 18
5) Quantos prótons há no íon X 3+? Registre a configuração eletrônica do íon e assinale a
alternativa correta.
a) 25
b) 28
c) 31
d) 51
e) 56
6) Dadas as duas afirmativas abaixo, verifique se estão certas ou erradas, justificando sua
resposta.
a) Quando um átomo perde dois elétrons, seu número atômico decai de duas unidades.
__________________________________________________________________________
__________________________________________________________________________
_________________________________________________________________________
b) A classificação periódica atual foi estabelecida a partir da constatação de que as
propriedades dos elementos variam periodicamente com as massas atômicas crescentes.
_________________________________________________________________________
__________________________________________________________________________
__________________________________________________________________________
__________________________________________________________________________
7) Qual dentre as séries abaixo é composta, respectivamente, de halogênio, metal alcalino,
metal alcalino terroso e gás nobre?
a) As, Fe, Ra e Rn
b) F, Li, Fe e Xe
c) C , Rb, A e He
d) Br, Na, Ba e Co
e) I, Cs, Ca e Rn
8) Entre os pares de elementos químicos, o par que reúne elementos com propriedades
químicas mais semelhantes é:
a) Na e K.
b) Cl e Ar.
c) Ca e Cu. d) F e Ba. e) H e I.
9) O bromato de potássio, produto de aplicação controvertida na fabricação de pães, tem
por fórmula KBrO3. Os elementos que o constituem, na ordem indicada na fórmula, são das
famílias dos:
a) alcalinos, halogênios e calcogênios.
b) halogênios, calcogênios, alcalinos.
c) calcogênios, halogênios, alcalinos.
d) alcalino terrosos, calcogênios, halogênios.
e) alcalino terrosos, halogênios, calcogênios.
10) O elemento que termina em 4d1 está assim localizado na tabela periódica:
a) período 4 e grupo 3B.
b) período 5 e grupo 4B.
c) período 5 e grupo 3B.
d) período 6 e grupo 4B.
e) período 1 e grupo 1A.
11) Explique, comparando os subníveis, como podemos diferenciar os elementos
representativos (típicos) dos elementos de transição.
__________________________________________________________________________
__________________________________________________________________________
__________________________________________________________________________
__________________________________________________________________________
__________________________________________________________________________
12) Analisando a classificação periódica dos elementos químicos, pode-se afirmar que:
a) o raio atômico do nitrogênio é maior que o do fósforo.
b) a afinidade eletrônica do cloro é menor que a do fósforo.
c) o raio atômico do sódio é menor que o do magnésio.
d) a energia de ionização do alumínio é maior que a do enxofre.
e) a energia de ionização do sódio é maior que a do potássio.
13) Considerando um grupo ou família na Tabela Periódica, podemos afirmar em relação ao
raio atômico que:
a) aumenta com o aumento do número atômico, devido ao aumento do número de camadas.
b) Aumenta à medida que aumenta a eletronegatividade.
c) Não sofre influência da variação do número atômico.
d) Diminui à medida que aumenta o número atômico, devido ao aumento da força de
atração do núcleo.
e) Diminui com o aumento do número atômico, devido ao aumento do número de elétrons.
14) Na classificação periódica, a energia de ionização e a eletronegatividade (exceto gases
nobres) dos elementos químicos aumenta:
a) das extremidades para o centro, nos períodos.
b) das extremidades para o centro, nas famílias.
c) da direita para a esquerda, nos períodos.
d) de cima para baixo, nas famílias.
e) de baixo para cima, nas famílias.
15) A água mineral filtrada (sem gás) é:
a) uma substância pura.
b) uma mistura heterogênea.
c) uma mistura homogênea.
d) uma substância composta.
e) um elemento.
16) Observe a representação dos sistemas I, II e III e seus componentes.
O número de fases em cada um é, respectivamente:
a) 3, 2 e 4.
b) 3, 3 e 4.
c) 2, 2 e 4.
d) 3, 2 e 5.
e) 3, 3 e 6.
17) Em um laboratório, foi encontrado um frasco, sem identificação, contendo um pó branco
cristalino.
Aquecendo este pó com taxa constante de fornecimento de calor, foi obtida a seguinte curva
de aquecimento. Pode-se afirmar que o pó branco encontrado é:
a) uma substância simples.
b) uma substância composta.
c) um mistura de cristais com tamanhos diferentes.
d) uma mistura de duas substâncias.
e) uma mistura de três substâncias.
18) I e II são dois líquidos incolores e transparentes. Os dois foram aquecidos,
separadamente, e mantidos em ebulição. Os valores das temperaturas (T) dos líquidos em
função do tempo (t) de aquecimento são mostrados na figura a seguir.
Com base nessas informações, pode-se afirmar que:
a) I é um líquido puro e II é uma solução.
b) I é uma solução e II é um líquido puro.
c) I é um líquido puro e II é um azeótropo.
d) I e II são líquidos puros com diferentes composições químicas.
e) I e II são soluções com mesmos solvente e soluto, mas I é uma solução mais concentrada
do que II.
19) Classifique as afirmações como verdadeiras (V) ou falsas (F), relativa à curva de
resfriamento apresentada a seguir.
( ) A curva pode representar o resfriamento de uma mistura eutética.
( ) A curva pode representar o resfriamento de uma substância sólida, que apresenta uma
única forma cristalina.
( ) A curva pode representar o resfriamento de uma mistura azeotrópica.
( ) A curva pode representar o resfriamento de um líquido constituído por uma substância
pura.
( ) A curva pode representar o resfriamento de uma mistura líquida de duas substâncias
que são completamente miscíveis no estado sólido.
20) Identifique a alternativa que apresenta, na sequência, os termos corretos que
preenchem as lacunas da seguinte afirmativa: "Uma substância ....... é formada por .......
contendo apenas ....... de um mesmo ......."
a) Composta; moléculas; elementos; átomo.
b) Composta; moléculas; átomos; elemento.
c) Química; elementos; moléculas; átomo.
d) Simples; átomos; moléculas; elemento.
e) Simples; moléculas; átomos; elemento.
Módulo -2
21) Escreva o nome oficial dos seguintes ácidos:
22) Os nomes dos ácidos abaixo são respectivamente: HNO3; HClO; H2SO3, H3PO3:
a) nitroso, clórico, sulfuroso, metafosfórico.
b) nítrico, clorídrico, sulfúrico, fosfórico.
c) nítrico, hipocloroso, sulfuroso, fosforoso.
d) nitroso, perclórico, sulfúrico, fosfórico.
e) nítrico, cloroso, sulfúrico, hipofosforoso.
23) Dê a fórmula dos seguintes ácidos:
a) Ácido sulfídrico: ______________________
b) Ácido periódico: ______________________
c) Ácido bórico: _________________________
d) Ácido permangânico: ___________________
e) Ácido hipobromoso: ____________________
24) Dar o nome oficial ou a fórmula das seguintes bases:
25) Aos frascos A, B e C, contendo soluções aquosas incolores de substâncias diferentes,
foram adicionadas gotas de fenolftaleína. Observou-se que só o frasco A passou a
apresentar colaboração vermelha. Identifique a alternativa que indica substâncias que
podem estar presentes em B e C.
a) NaOH e NaCl
b) H2SO4 e HCl
c) NaOH e Ca(OH)2
d) H2SO4 e NaOH
e) NaCl e Mg(OH)
26) Nomear os seguintes óxidos.
a) Na2O ______________________________________
b) MgO ______________________________________
c) Al2O3 ______________________________________
d) FeO ______________________________________
e) Fe2O3 ______________________________________
f) SO2 ______________________________________
g) N2O5 ______________________________________
27) Escreva a fórmula dos seguintes óxidos:
a) óxido cuproso ________________________________
b) óxido cúprico _________________________________
c) óxido de prata _________________________________
d) peróxido de zinco _____________________________
e) monóxido de carbono __________________________
f) heptóxido de dicloro ____________________________
28) As fórmulas dos óxidos normais obtidos na combinação do oxigênio com magnésio e do
oxigênio com silício são respectivamente:
a) MgO e Si3O2
b) Mg2O3 e SiO
c) MgO e SiO2
d) MgO2 e SiO2
e) Mg2O e SiO4
29) A alternativa que apresenta, respectivamente, óxido ácido, óxido básico, óxido neutro e
óxido misto:
a) CO; CaO; SO3; Na2O4
b) N2O5; BaO; NO; Pb3O4
c) CO2; Al2O3; Fe3O4; Cl2O
d) N2O; MgO; CO2; Mn3O4
e) SO2; K2O; CO; K2O2
30) Os nomes oficiais das substâncias de fórmulas abaixo são:
NaHCO3 _______________________________________
NH4NO3 _______________________________________
Ca3(PO4)2 ______________________________________
MgSO4 _______________________________________
Na2SO3 _______________________________________
NaCℓ ________________________________________
Mg(NO2)2 _____________________________________
31) O leite de magnésia nada mais é do que uma suspensão de hidróxido de magnésio em
água e é utilizado como antiácido estomacal, nas azias, e como laxante intestinal. Se uma
pessoa tomar essa solução, ocorrerá qual das reações químicas abaixo no estômago?
a) Mg(OH)2 + 2 HNO3 → Mg(NO3)2 + 2 H2O
b) Mg(OH)2 + HCOOH → MgHCOOH + H2O
c) MgO + 2 HCl → MgCl2 + H2O
d) Mg(OH)2 + 2 HCl → MgCl2 + 2 H2O
e) MgO + 2 HClO → Mg(ClO)2 + H2O
32) Complete as equações:
HCl + KOH __________________________________.
H2SO4 + Ca(OH)2 _____________________________.
HNO3 + NaOH _______________________________ .
Módulo -3
33) A massa atômica de um elemento químico é dada pela média ponderada dos isótopos.
Por exemplo, a massa do oxigênio que aparece na tabela é 15,99, isto porque na natureza
encontramos: O-16: 99,76%, O-17: 0,04% e
O-18: O,20%.
Sabendo-se que, na natureza, existem B-10: 20% e B-11: 80%, calcule a massa do boro
que aparece na tabela periódica e indique a alternativa correta.
a) 10,5 u
b) 10 u
c) 10,8 u
d) 11 u
e) 10,2 u
34) Um elemento M apresenta os isótopos 79-M (85,5%) e 81-M (14,5%). Calcule a massa
atômica do elemento M?
35) O carbono ocorre na natureza como uma mistura de átomos dos quais 98,90% são 12C
e 1,10% são 13C.
a) Explique o significado das representações 12C e 13C.
__________________________________________________________________________
__________________________________________________________________________
________________________________________
b) Com esses dados, calcule a massa atômica do carbono natural. Dados: massas
atômicas: 12C = 12u ; 13C = 13u.
36) Consultando a tabela periódica determine a massa molecular das substâncias:
MM: CO(NH2)2 ________________________________
MM: H2S2O3 __________________________________
MM: Na2B4O7·10H2O ___________________________
MM: H3PO4 ___________________________________
MM: CaCO3 __________________________________
MM: Al2(SO4)3 ________________________________
MM: CaCl2·5H2O ______________________________
37) A palavra “mol” foi introduzida em Química, por volta de 1896, pelo químico alemão
Wilhelm Ostwald, que tirou o termo do latim, moles. O mol, que tem como símbolo a palavra
mol, classifique como verdadeira(V) ou Falsa(F) as afirmações:
( ) a unidade no SI de quantidade de substância.
( ) a quantidade de substâncias que contém tantas entidades elementares (átomos,
moléculas ou outras partículas) quantos forem os átomos contidos em exatamente 12 g do
isótopo 12 do carbono.
( ) a quantidade que contém sempre o mesmo número de partículas, qualquer que seja a
substância.
( ) o número atômico expresso em gramas.
38) Um mol de ácido clorídrico (HCl) contém:
(Dado: constante de Avogadro = 6 . 1023)
a) 6,0 . 1023 átomos de hidrogênio
b) 1 mol de átomos
c) 6,0 . 1023 átomos
d) 2 mols de cloro
e) 24 . 1023 moléculas
39) Considere a adição de água em meio litro de vinagre, contendo 0,3 mol de ácido acético,
até um volume final de 2,0 litros. Qual o número de moléculas de ácido acético na amostra
inicial de vinagre?
Dado: constante de Avogadro = 6 . 1023.
40) Quantas moléculas de butano (C4H10) existem num isqueiro contendo 5,8 g desta
substância? (Número de Avogadro: 6,0.1023 moléculas em um mol)
41) Um medicamento contém 90 mg de ácido acetilsalicílico (C9H8O4) por comprimido.
Quantas moléculas dessa substância há em cada comprimido? Dados: Número de
Avogadro = 6,0.1023 mol-1; Massas atômicas relativas: C = 12; O = 16; H = 1,0
42) Em uma pessoa adulta com massa de 70,0 kg., há 1,6 kg de cálcio. Qual seria a massa
dessa pessoa, em kg, se a Natureza houvesse, ao longo do processo evolutivo, escolhido o
bário em lugar do cálcio? Dados: massas atômicas relativas: Ca = 10, Ba = 137
43) Calcule a massa de carbonato de amônio (NH4)2CO3, em gramas, que contém 1,5.1020
moléculas dessa substância. (Dados: N = 14; H = 1; C = 12; O = 16)
44) Calcule qual é a massa, em gramas, de uma única molécula de açúcar comum
(sacarose - C12H22O11)?
Dados: Massas atômicas: H = 1; C = 12; O = 16, Número de Avogadro: 6,02.1023 .
Leis Ponderais
45) A queima de uma amostra de palha de aço produz um composto pulverulento de massa:
a) menor que a massa original de palha de aço.
b) igual à massa original da palha de aço.
c) maior que a massa original da palha de aço.
d) igual à massa de oxigênio do ar que participa da reação. e) menor que a massa de
oxigênio do ar que participa da reação.
46) Provoca-se reação da mistura formada por 10,0 g de hidrogênio e 500 g de cloro. Após
a reação, constata-se a presença de 145 g de cloro remanescente, junto com o produto
obtido. Calcule a massa, em gramas, da substância formada e assinale a alternativa correta:
a) 155
b) 290
c) 365
d) 490
e) 510
47) Provoca-se reação da mistura formada por 46,0 g de sódio reagem com 32,0 g de
oxigênio formando peróxido de sódio. Quantos gramas de sódio são necessários para se
obter 156 g de peróxido de sódio?
a) 23,0
b) 32,0
c) 69,0
d) 78,0
e) 92,0
48) Os pratos A e B de uma balança foram equilibrados com um pedaço de papel em cada
prato e efetuou-se a combustão apenas do material contido no prato A. Esse procedimento
foi repetido com palha de aço em lugar de papel. Após cada combustão observou-se:
49) Acertar os coeficientes das equações abaixo pelo método das tentativas, considerando
os menores inteiros possíveis.
a)__SO2 + __O2 → __SO3
b) __N2 + __ H2 → __NH3
c) ___HNO3 + __Ca(OH)2 →__ Ca(NO3)2 + __ H2O
d) __Mg + __H3PO4 → __Mg3(PO4)2 + __H2
e) __Fe(OH)3 + __H2SO3 → __Fe2(SO3)3 + __H2O
f) __CO + __O2 → __CO2
g) __Ca(HCO3)2 + __HCℓ → __CaCℓ 2+ __CO2 + __H2O
h) __C2H5OH + __O2 → __CO2 + __ H2O
50) Em relação à equação abaixo:
__H2SO4 + __Aℓ(OH)3 → __Aℓ2(SO4)3 +__H2O
Marque a opção que apresenta a soma dos coeficientes que satisfazem o balanceamento
da equação anterior:
a) 6;
b) 8;
c) 10;
d) 12;
e) 15.
Bom Trabalho!
Prof.: Wanderlei A. Pirol
Plano de Recuperação Ensino Médio – 1° ANO UNIDADE PARQUE
DISCIPLINA
TÉCNICA
DE
REDAÇÃO
NOME DO
PROFESSOR
CONTEÚDO DA PROVA
(8,0)
Leitura e interpretação de textos em gêneros diversos;
Usos e funções de linguagem-variação linguística:
apostila 2
Fátima Rex
A construção do texto – narração e dissertação:
apostila 4
DISCIPLINA
TRABALHO DE RECUPERAÇÃO: (2,0)
NOME DO
PROFESSOR
TÉCNICA
DE
REDAÇÃO
Fátima Rex
Atividade de “ Atualidades”- capa, atualidade grifada e
produção de parágrafos com resumo das ideias principais
e opinativos.
Uma pesquisa com funções de linguagem: definição e
dois exemplos de cada uma delas.
Plano de Recuperação Ensino Médio – 1° ANO UNIDADE PARQUE
DISCIPLINA
NOME DO
PROFESSOR
Matemática Rodrigo
DISCIPLINA
Matemática
CONTEÚDO A SER ESTUDADO PARA AVALIAÇÃO
Valor da avaliação: de 00 a 8.0 pontos.
Conjuntos, funções de 1º e 2º grau
TRABALHO DE RECUPERAÇÃO
NOME DO
Valor do Trabalho: de 00 a 2.0 pontos.
PROFESSOR
Rodrigo
Anexo
Atividade de Recuperação de Matemática
Nome: ________________________________________ Turma: _________________
1) Escreva com símbolos:
a) 4 pertence ao conjunto dos números naturais pares.
b) 9 não pertence ao conjunto dos números primos.
2) Escreva o conjunto expresso pela propriedade:
a) x é um conjunto natural menor que 8.
b) x é um número natural múltiplo de 5 e menor que 31.
3) Escreva uma propriedade que define o conjunto:
a) {0, 1, 2, 3, 4, 5, 6, 7, 8, 9}
b) {11, 13, 15, 17}.
4) Classifique os conjuntos abaixo em vazio, unitário, finito ou infinito:
a) A é o conjunto das soluções da equação 2x + 5 = 19.
b) B = {x / x é número natural maior que 10 e menor que 11}.
c) C = {1, 4, 9, 16, 25, 36, ... }.
d) D = {0, 10, 20, 30, ..., 90}
5) Dados os conjuntos A = {1, 2}, B = {1, 2, 3, 4, 5}, C = {3, 4, 5} e D = {0, 1, 2, 3, 4,
5}, classifique em verdadeiro (V) ou falso (F):
a) A B
b) C A
c) B D
d) D B
f) A D
g) B C
6) Dados os conjuntos A = {a, b, c}, B = {b, c, d} e C = {a, c, d, e}, o conjunto
(A - C) U (C - B) U (A ∩ B ∩ C) é:
a) {a, b, c, e}
b) {a, c, e}
c) A
d) {b, d, e}
e) {b, c, d, e}
7) Dados os conjuntos A = {1, 2, -1, 0, 4, 3, 5} e B = {-1, 4, 2, 0, 5, 7} assinale a
afirmação verdadeira:
a) A U B = {2, 4, 0, -1}
b) A ∩ (B - A) = Ø
c) A ∩ B = {-1, 4, 2, 0, 5, 7, 3}
d) (A U B) ∩ A = {-1, 0}
e) Nenhuma das respostas anteriores
8) Seja f: IR*→ IR a função dada por f ( x)
x2 1
1
. Qual é o valor de f (3) f ?
x
3
x 5, se x é par
9)Dada f: IN → IN tal que
, calcule:
2 x, se x é impar
f 4
a) f (5)
b) f (2) f (7)
c) f (1)
f (3)
f ( x) 14
d) x tal que
Plano de Recuperação Ensino Médio – 1° ANO UNIDADE PARQUE
DISCIPLINA
Educação
Física
NOME DO
PROFESSOR
Jorge Keinti
Fugita
TRABALHO DE RECUPERAÇÃO
Valor do Trabalho: de 0 a 10.0 pontos
Os trabalhos podem ser digitados ou manuscritos.
O trabalho que não tiver uma fonte de pesquisa confiável
(exemplo WIKIPÉDIA) ou trabalhos iguais, serão
desconsiderados.
O TRABALHO DEVE CONTER: CAPA,INTRODUÇÃO,
ÍNDICE,BIBLIOGRAFIA,CONCLUSÃO.
Temas :
Benefícios e Importância da Atividade Física Durante a
Vida (Infância,Adolescência,Fase Adulta e Melhor Idade).
Doping no Esporte.