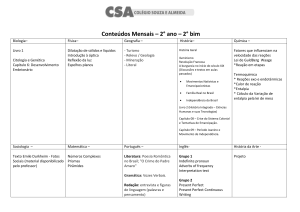
TERMOQUÍMICA- 3C13
As transformações físicas e as reações químicas quase sempre estão envolvidas em perda ou
ganho de calor. O calor é uma das formas de energia mais comum que se conhece.
A Termoquimica é uma parte da Química que faz o estudo das quantidades de calor liberadas
ou absorvidas durante as reações químicas. A maioria das reações químicas envolve perda
ou ganho de calor (energia).
Veja no quadro abaixo os tipos de reações com perda ou ganho de calor:
REAÇÕES QUE LIBERAM ENERGIA
Queima do carvão
REAÇÕES QUE ABSORVEM ENERGIA
Cozimento de alimentos
Queima da vela
Fotossíntese das plantas, o sol fornece
energia
Reação química em uma pilha
Pancada violenta inicia a detonação de um
explosivo
Queima da gasolina no carro
Cromagem em para-choque de carro, com
energia elétrica
As transformações físicas também são acompanhadas de calor, como ocorre na mudanda de
estados físicos da matéria.
absorção de calor
SÓLIDO LÍQUIDO GASOSO
liberação de calor
Quando a substância passa do estado físico sólido para liquido e em seguida para gasoso,
ocorre absorção de calor.
Quando a substância passa do estado gasoso para líquido e em seguida para sólido, ocorre
liberação de calor.
Essa energia que vem das reações químicas é decorrente de rearranjo das ligações químicas
dos reagentes transformando-se em produtos. Essa energia armazenada é a ENTALPIA (H). É a
energia que vem de dentro da molécula.
Nas reações químicas não é necessário calcular a entalpia. Devemos calcular, geralmente, a
variação de entalpia (ΔH).
A variação de entalpia é a diferença entre a entalpia dos produtos e a entalpia dos reagentes.
UNIDADE DE CALOR
Tipos de Reações
As reações químicas podem ser de dois tipos:
- ENDOTÉRMICA: absorvem calor (+)
- EXOTÉRMICA: liberam calor (-)
REAÇÃO ENDOTÉRMICA
Se o valor for positivo (+) a reação é endotérmica.
A reação absorveu energia para acontecer.
REAÇÃO EXOTÉRMICA
Se o valor for negativo (-) a reação é exotérmica.
A reação perdeu energia para acontecer.
ENTALPIA
Tipos de Entalpias
Através de algumas reações, é possível calcular o valor da variação de entalpia.
- Entalpia de Formação
- Entalpia de Combustão
- Entalpia de Ligação
- Entalpia de Neutralização
- Entalpia de Dissolução
Entalpia de Formação ou Calor de Reação
A Entalpia de formação é a energia da reação quando forma 1 mol de substância, a partir
das substâncias químicas (elemento no seu estado padrão).
Estado Padrão: é a forma mais estável de uma substância a 25°C e a 1atm de pressão. São as
substâncias simples.
As substâncias que participam da reação de formação devem ser simples. Devem informar o
estado físico. Sua variação de entalpia de formação padrão é zero.
Exemplo de substância simples:
C(grafite), O2(g), N2(g), H2(g), Na(s), S(s).
Exemplo de reação de formação:
Isto quer dizer que para formar 1 mol de NH3 a reção produz 11 kcal de energia.
Este cálculo pode ser feito utilizando a fórmula da variação de entalpia e utilizando alguns
dados tabelados.
Tabela com valores de Entalpia de Formação Padrão de Algumas Substâncias
SUBSTÂNCIA
H°f kJ/mol
SUBSTÂNCIA
H°f kJ/mol
C2H2(g)
226,8
C diamante
+2,1
CH4(g)
-74,8
NH3 (g)
-45,9
CO(g)
-110,3
NaCl (s)
-412,1
CO2(g)
-393,3
O3 (g)
+143
H2O(v)
-242
SO2 (g)
-297
H2O(l)
-286
SO3 (g)
-396
Exemplo:
Escreva a reação de formação para cada substância abaixo, indicando o valor da entalpia de
formação de SO3(g):
1°) montar a reação de formação:
2°) Aplicar a fórmula:
Entalpia de Combustão
É sempre uma reação exotérmica. É o calor liberado na reação de combustão de 1 mol de
uma substância em presença de gás oxigênio O2(g)
COMBUSTÃO COMPLETA: mais quantidade de oxigênio. Forma gás carbônico e água.
COMBUSTÃO INCOMPLETA: menos quantidade de oxigênio. Produz menos quantidade de
energia. Forma mais resíduos como monóxido de carbono (CO) e água (H2O).
Exemplo:
Qual o valor da entalpia de combustão do benzeno (C6H6)?
Dados:
Tabela de ∆H°comb de algumas substâncias
SUBSTÂNCIA
FÓRMULA
∆H°comb (kcal/mol)
Hidrogênio
H2(g)
-68,3
Carbono Grafite
C(grafite)
-94,1
Monóxido de Carbono
CO(g)
-67,6
Metano
CH4(g)
-212,8
Etano
C2H6(g)
-372,8
Propano
C3H8(g)
-530,6
Butano
C4H10(g)
-688,0
Benzeno
C6H6(g)
-781,0
Etanol
H3C – CH2 – OH(l)
-326,5
Ácido Acético
H3C – COOH(l)
-208,5
Glicose
C6H12O6(S)
-673,0
Sacarose
C12H22O11(S)
-1348,9
Entalpia de Ligação
Durante as reações químicas, as ligações químicas dos reagentes e produtos são alteradas.
Podemos calcular o ∆H pela análise desses novos rearranjos.
A entalpia de ligação é a variação de entalpia verificada na quebra de 1mol de uma
determinada ligação química, sendo que todas as substâncias estejam no estado gasoso, a
25° C e 1atm.
Reagentes = sempre são quebradas as ligações = ENDOTÉRMICA (+)
Produtos = sempre são formadas as ligações = EXOTÉRMICA (-)
Exemplo:
A ∆H do processo é a soma desses calores. Calcula-se utilizando dados tabelados.
ENTALPIA DE LIGAÇÃO (EM kJ/MOL)
LIGAÇÃO
H°(kJ/MOL)
LIGAÇÃO
H°(kJ/MOL)
LIGAÇÃO
H°(kJ/MOL)
H–H
436
H – Br
366
N–C
305
H–O
463
H–I
299
C≡C
837
N–N
163
H–N
388
C=C
612
N=N
409
H–C
412
C–C
348
N≡N
944
O=O
496
C – Cl
338
H–F
565
O–C
360
Br – Br
193
H – Cl
431
O=C
743
Cl – Cl
242
A partir desta tabela com dados das ligações de alguns elementos é possível calcular
também outras entalpias, como por exemplo a de combustão e a de formação.
Entalpia de Neutralização
É a entalpia de uma reação de neutralização (entre um ácido e uma base formando sal e água).
A reação é exotérmica.
É a variação de entalpia verificada na neutralização de 1mol de H+ do ácido por 1mol de OH-da
base, sendo todas as substâncias em diluição total ou infinita, a 25°C e 1atm.
Exemplos:
Entalpia de Dissolução
É a variação de entalpia envolvida na dissolução de 1mol de determinada substância numa
quantidade de água suficiente para que a solução obtida seja diluída.
Quando um sólido é colocado em um copo com água acontece uma dissolução. Nesta ordem
acontece:
LEI DE HESS
O químico e médico Germain Henry Hess (1802-1850) desenvolveu importantes trabalhos na
área de Termoquímica.
A Lei de Hess é uma lei experimental e estabelece que a variação de entalpia de uma reação
química depende apenas dos estados inicial e final da reação.
A Lei de Hess também pode ser chamada de Lei da Soma dos Calores de Reação. É uma
forma de calcular a variação de entalpia através dos calores das reações intermediárias.
Podem ser infinitas variações de entalpia.
Exemplo:
Qual o valor da variação de entalpia da reação a seguir?
Dados (equações intermediárias):
Resolução:
______________________________________
Observe que a ∆H1e ∆H2 são somadas, obtendo-se o valor da variação de entalpia. As
equações químicas também são somadas, obtendo-se a reação global.
Para montar as equações e aplicar a Lei de Hess, podemos fazer algumas alterações
matemáticas, seguindo as seguintes regras:
1°) as equações intermediárias devem estar de acordo com a reação global. Coloca-se as
equações (dados) na ordem que reagem ou são produzidas. Se não estiverem de acordo,
troca-se o sinal da ΔH;
2°) acertar os coeficientes também de acordo com a reação global. Se a equação for
multiplicada, a ΔH também deve ser multiplicada pelo mesmo número.
3°) realizar o somatório para montar a reação global;
4°) somar os valores das ΔH das equações intermediárias para achar a ΔH da reação global.
Exemplo:
Calcule
a
variação
de
entalpia
da
seguinte
reação
pela
Lei
de
Hess:
Dados:
Resolução:
Deve-se escrever todas as equações intermediárias (dados) de acordo com a reação global. Na
primeira equação, o que há em comum é o C(grafite). Então ele deve ser escrito da mesma
forma (como reagente e 1mol).
A segunda equação tem em comum com a reação global o H2(g). Nos dados, esta esécie
química não está exatamente igual como na global. Deve-se multiplicar toda a equação por 2,
inclusive a ΔH2
A terceira equação tem em comum com a reação global o CH4(g). deve-se inverter a posição
desta equação e portanto trocar o sinal da ΔH3
Veja como deve ser feito: