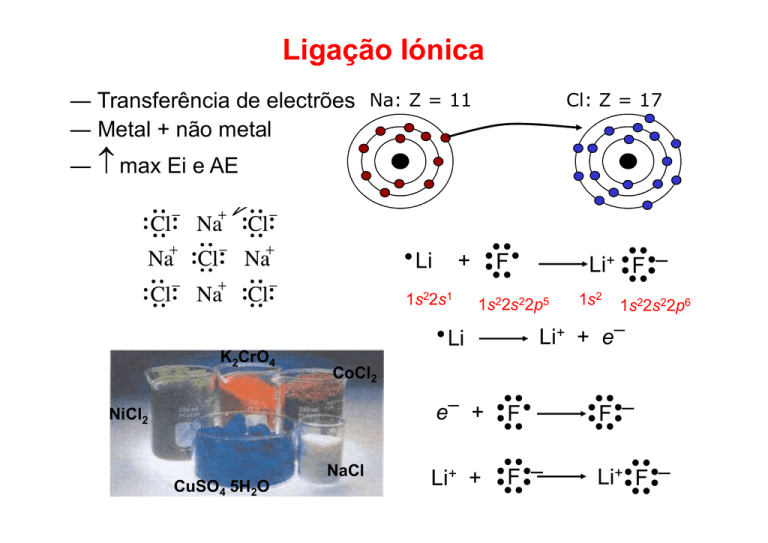
Ligação Iónica
― Transferência de electrões Na: Z = 11
― Metal + não metal
Cl: Z = 17
― ≠ max Ei e AE
Li
+
1s22s1
1s22s22p5
1s22s22p6
CoCl2
NiCl2
NaCl
CuSO4 5H2O
1s2
Li+ + e–
Li
K2CrO4
Li+ F –
F
e– +
F
F –
Li+ +
F –
Li+ F –
― Duros e quebradiços (indeformáveis e frágeis)
Dureza depende:
Distância internuclear
(estrutura cristalina)
Força da ligação
― Atracções electrostáticas fortes
― Ligação não direccional
― Isolantes eléctricos e térmicos –estrutura rígida
― Electrólitos fortes (iões conduzem corrente
em solução)
― Compostos com pf. elevado.
KCl
RbCl
771ºC CaCl2 782ºC
718ºC BaCl2 874ºC
MgF2 2957ºC
MgCl2 2526ºC
Ligação Iónica
― Estrutura cristalina de sólidos iónicos (pto. fusão, dureza
depende da estrutura)
Compostos AB
CsCl
Nc= 8
NaCl
ZnS
Nc= 4
Blenda
Nc= 6
Cúbica simples
rc
= 0,414
ra
CCC
rc
= 0,732
ra
Energia de rede (E) ― energia necessária para separar
completamente uma mole de um composto iónico sólido nos
seus iões no estado gasoso (medida da estabilidade do
composto iónico).
+
AB(s)
A
(g)
+ B (g)
Lei de Coulomb
Energia entre dois iões
E=k
Q+Q–
r
Q+ é a carga do catião
Q– é a carga do anião
r é a distância entre os iões
Composto
A energia de rede (E)
aumenta à medida que
Q aumenta e/ou
à medida que r diminui.
Energia de rede
MgF2
2957
Q = +2, –1
MgO
3938
Q = +2, –2
LiF
1036
LiCl
853
r F < r Cl
Ciclo de Born-Haber (determinação de Erede)
Εrede= − ∆Hº5
ΑΕ= − ∆Hº4
Energia de ionização
−ΑΕ
∆Hº5 = ?
Εrede
Entalpia de sublimação
Entalpia de dissociação ou atomização
Entalpia de formação padrão
Lei de Hess
o
∆Htotal
= ∆H1o + ∆H2o + ∆H3o + ∆H4o + ∆H5o
∆Hfº = ∆H1 + ∆H2 + ΕΙ −ΑΕ −Εrede
Energia de rede (E)
Simétrico afinidade electrónica
MA(s)
M+(g) + A-(g)
Energia de ionização
Energia de rede maior
Entalpia de dissociação ou atomização
Temp. fusão maior
- Energia de rede
Entalpia de sublimação
Entalpia de formação padrão
Dureza maior
Energia de rede (E)
Simétrico afinidade electrónica
MA2(s)
M+(g) + 2A-(g)
2ª Energia de ionização
1ª Energia de ionização
Entalpia de dissociação ou atomização
− Energia de rede
Entalpia de sublimação
Entalpia de formação padrão
Ligação Iónica:
- Elementos metálico + não metal
Classificação das Ligações pela
Diferença na Electronegatividade (EN)
Diferença
Tipo de Ligação
0
Covalente pura
0 < EN ≤ 2
Covalente polar
>2
Iónico
% de carácter iónico
Aumento da diferença na electronegatividade
Covalente
Covalente polar
Iónica
partilha e–
Partilha desigual de
e–
transferência e–
0% carácter iónico
100% carácter iónico
Química em Acção:
Cloreto de Sódio
150 *106 t/ano
Exploração de sal-gema
Evaporação solar