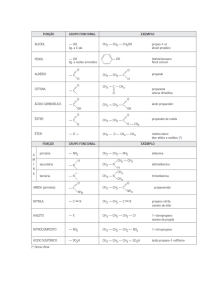
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
CAP. 5 – ISOMERIA ESPACIAL GEOMÉTRICA (PAG. 98)
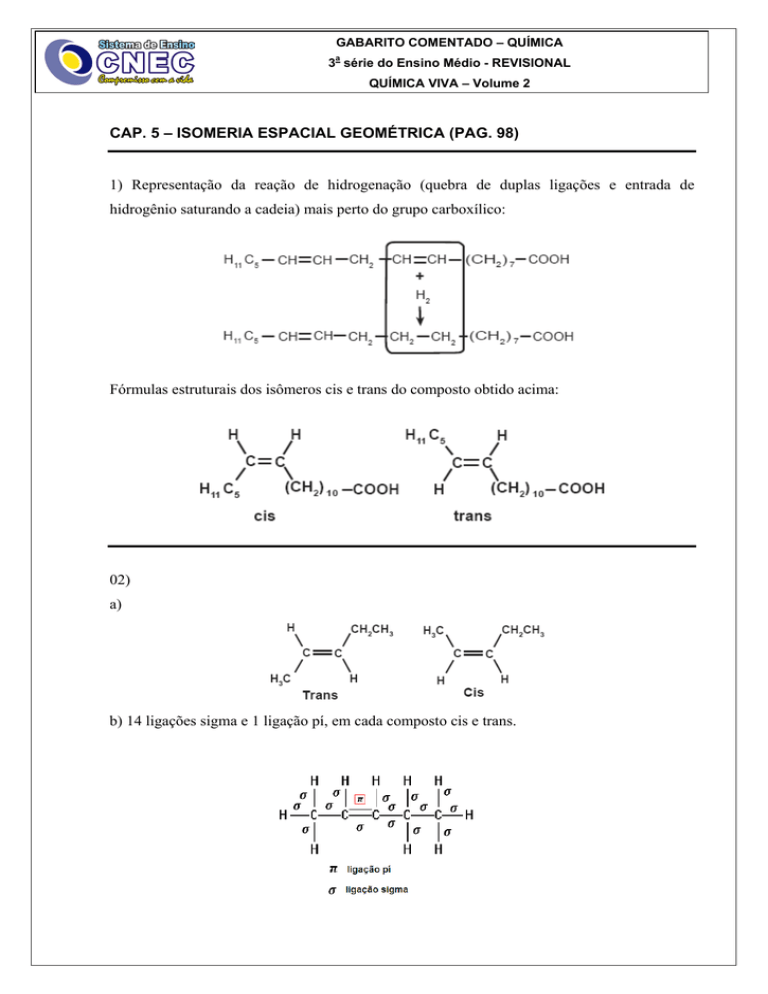
1) Representação da reação de hidrogenação (quebra de duplas ligações e entrada de
hidrogênio saturando a cadeia) mais perto do grupo carboxílico:
Fórmulas estruturais dos isômeros cis e trans do composto obtido acima:
02)
a)
b) 14 ligações sigma e 1 ligação pí, em cada composto cis e trans.
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
03) Alternativa – A
Observe que o composto A encontra-se invertido em relação a B, e a dupla ligação que
evidencia a isomeria cis e trans é a terceira a partir da cadeia fechada, observe:
(Obs.: O ciclo representado nessa cadeia apresenta apenas uma dupla ligação, e não duas
como no exercício).
04) Alternativa – C
A – F. I e II não são isômeros geométricos, pois representam o mesmo composto com
estrutura cis, apenas estão invertidos.
B – V. Como III apresenta a função ácido carboxílico, é um ácido fraco que quando reage
com bicarbonato de sódio ocorre liberação de gás carbônico.
C – V. Como II apresenta a função ácido carboxílico, quando reage com álcool (metanol)
ocorre uma reação de esterificação formando o composto IV que é um éster.
D – V. Como IV é um éster a reação com água promove a reação inversa á esterificação, ou
seja, uma hidrólise, formando novamente um álcool e um ácido carboxílico (composto I).
05) Alternativa – A
I) Correta. Podemos observar que a diferença do reagente e do produto, é a ausência da dupla
ligação na estrutura do produto, indicando a reação de adição de hidrogênio, com
representado abaixo.
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
OH
+
H
2H2
H
OH
H
H
II) Incorreta. O nome correto é 3,7-dimetiloctan-1-ol.
III) Incorreta. As duplas ligações com dois ligantes diferentes e cada carbono dessas duplas
indicam a isomeria geométrica.
06)
Cl
H
Cl
Cl
H
Cl
TRANS
H
H
CIS
1,2-dichloroethene
O composto cis por apresentar os dois cloros do mesmo lado da molécula apresenta momento
dipolar resultante diferente de zero, enquanto o composto trans por apresentar os dois cloros
em posições transversais, os momentos das ligações devem se anular, molécula apolar. Esse
pólo formado na molécula cis justifica o seu maior ponto de ebulição em relação ao isômero
Trans.
Cl
H
Cl
Cl
H
Cl
TRANS
H
H
CIS
1,2-dichloroethene
µ=0
µ≠0
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
08)
a) Isomeria geométrica Z – E
CH3
CH2
7
C
H
CH3
C
CH2
12
CH3
H
Z
H
CH2
7
C
C
H
E
CH2
12
CH3
b) Massa Molar do feromonio = 322g/mol
6,02.1023 moléculas de feromonio----------------------------------- 322g
X ----------------------------------10-12g
X = 1,87.109 moléculas de feromonio.
1molécula de feromonio --------------------------------- 23 átomos de C
1,87.109 moléculas de feromonio --------------------- X
X = 4,3.1010 átomos de carbono.
08) Alternativa – D
1 e 2 são, respectivamente, os isômeros trans e cis do dibromo-eteno. Como os momentos das
forças de atração do isômero representado em 1 são opostas, então essas se anulam, portanto,
molécula polar. Isso não ocorre na estrutura cis, molécula polar.
Em 3 não há isomeria geométrica ou cis-trans.
09) Alternativa – E
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
O cinamaldeido não possui isomeria geométrica.
Apenas um mol de H2 adicionado na molécula de citral não satura sua estrutura pois ele
apresenta duas ligações duplas.
O citral apresenta cadeia carbônica ramificada.
As duas moléculas apresentam carboxila, as duas são aldeídos.
Como são aldeídos na presença de catalisadores apropriados são oxidados até ácido
carboxílico.
10) Alternativa – Sem resposta.
Nenhuma das substâncias presentes nas alternativas apresenta isomeria geométrica. Apesar de
ser comumente conhecida como isomeria geométrica, atualmente é considerada como
isomeria conformacional. A isomeria conformacional resulta da rotação das ligações simples
e à adaptação dos orbitais de menor energia dos carbonos.
Essa questão é da prova de química 2002 do ITA e está nula.
11) Alternativa – B
Apenas os itens II e III apresentam carbono quiral.
II
III
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
12) Alternativa – C
A propanona não apresenta carbono quiral, portanto não há isomeria óptica.
O
CH3
H3C
acetone
13) Alternativa – D
Nenhum dos medicamentos apresenta a função amina.
Apenas a anfetamina apresenta carbono quiral.
14) Alternativa – E
As
duas imagens mostradas são estruturas especulares, ou também conhecidas como
antípodas ópticos, caracterizando um par de isômeros óticos.
15) Alternativa – B
1- V. A Hernandulcina apresenta um carbono quiral, não apresentando um plano de simetria
(molécula assimétrica).
2 – F. Não apresenta isomeria geométrica cis-trans pois uma das insaturações apresenta
carbono com dois ligantes iguais e a outra insaturação é feita com o oxigênio.
3 – F. A fração cíclica apresenta uma carbonila e não uma carboxila.
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
O
O
R
R2
R1
OH
Carbonila
Carboxila
4 – V. A fenilalanina apresenta um carbono quiral possuindo um par de enantiômeros, um
destrógiro e um levógiro.
5 – F. A fenilalanina não apresenta isomeria geométrica por não apresentar, na parte aberta
da estrutura insaturações entre carbonos com ligantes diferentes. E essa isomeria não irá
ocorrer no anel aromático.
16) Alternativa – A
Por hidrólise ácida, os ésteres formam ácido carboxílico e alcoóis. No caso, o ácido formado é
o ácido 2,2-dimetilpropanóico.
HIDRÓLISE
CH3
H3C
CH3
O
OH
OH
H
O
N
O
CH3
CH3
CH3
O
CH3
+2H2O
CH3
O
CH3
OH
2 H3C
HO
H
+
N
HO
CH3
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
Funções Orgânicas e Carbono Quiral
17) Alternativa – A
Utilizando a fórmula para determinar o número de carbonos oticamente ativos (IOA = 2n, em
que n, é o número de carbonos quirais) e a presença de apenas um carbono quiral na estrutura,
temos:
IOA = 2n , IOA = 21= 2 isômeros oticamente ativos
18) Alternativa – D
Na estrutura apresentada, apenas a I apresenta carbono
com quatro ligantes diferentes (carbono quiral) é a
única que apresenta isomeria óptica e por apresentar –
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
OH faz ligações de hidrogênio, enquanto II não faz. I e II não são isômeros funcionais, pois
apesar de apresentarem funções diferentes não apresentam a mesma fórmula molecular.
___________________________________________________________________________
19) Alternativa – D
Carbono Quiral
CH3
H
H3C
CH3
CH3
Apenas o 2,3 – dimetilpentano.
20) Não, a estrutura apresentada não apresenta nenhum carbono assimétrico.
21) A prova original apresentou um erro, que foi reproduzido nesse volume. A estrutura IV
deve apresentar mais um carbono em sua cadeia principal para apresentar isomeria de função
com a estrutura I, senão existirão duas respostas incorretas; a alternativa A e a alternativa D.
A estrutura IV corretamente representada é encontrada abaixo:
H3C
CH3
O
Então, a alternativa D é a incorreta, pois I e III não apresentam isomeria geométrica, pois não
apresentam dupla ligação em sua cadeia linear, com carbonos com ligantes diferentes.
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
22)
a)
b)
Nas duas estruturas apresentadas há carbonos com quatro ligantes diferentes (carbono
assimétrico).
23) Alternativa – A
O único composto que apresenta dupla ligação entre carbonos e esses apresentam ligantes
diferentes é o 2 – penteno.
H3C
H
H
H3C
CH3
(2E)-pent-2-ene
CH3
H
H
(2Z)-pent-2-ene
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
24) Alternativa – D
25) Alternativa – B
A glicose apresenta quatro carbonos assimétricos.
26) Alternativa – B
O ciclo impede a rotação dos carbonos que apresentam ligantes diferentes, possibilitando a
existência de duas formas, uma cis e outra trans.
H
Cl
H3C
H
H3C
Cl
H
H
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
27) Alternativa – A
H3C
CH3
H3C
Cl
2-chloropropane
Molecular Formula = C3 H7 Cl
Cl
1-chloropropane
Molecular Formula = C3 H7 Cl
28) Alternativa – D
Existe apenas um átomo de carbono secundário, apresentado na estrutura acima.
29)
a) ácido 2 - amino - 4 – metilpentanóico
b) A leucina, pois apresenta carbono assimétrico.
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
30)
Fórmula molecular do acidulante H. IV; C4H4O4.
O acidulante H.II está representado abaixo, possui dois carbonos quirais iguais.
OH
OH
H
O
O
H
OH
OH
Carbono Quiral
Carbono Quiral
Portanto possui 2 isômeros opticamente ativo, um destrógiro e um levógiro, e um isômero
meso. O isômero meso é opticamente inativo por compensação interna. Esses dois carbonos
assimétricos iguais apresentam ângulos iguais de desvio do plano de vibração da luz
polarizada, porém em sentidos contrários.
31) Alternativa – C
Apresenta apenas um carbono quiral.
32) Alternativa – E
O ácido benzóico não possui isomeria geométrica cis – trans , nem apresenta isomeria óptica
para obter diasteroisômeros.
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
33) Alternativa – B Obs. A estrutura abaixo, representa corretamente o composto citado no
exercício. Na estrutura apresentada no exercício não há duplas ligações
34)
a)
b)
35)
a) X = -3 Y = +2 Z= +3
b)
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
36) Alternativa – C
O
O
H2 N
H3 C
OH
Glycine (Gly)
OH
NH2
Carbono Quiral
Alanine (Ala)
Tanto na alanina como na glicina não há isomeria geométrica. Apresentam os grupos
funcionais ácido carboxílico e amina.
A alanina apresenta um carbono quiral. A quantidade de carbonos opticamente ativo é dada
por 2n, em que n é o número de carbonos quirais, então; 21 = 2 isômeros opticamente ativos.
37) Alternativa – A
Não há nenhuma estrutura com carbono quiral, determinando isomeria espacial óptica.
Apenas a estrutura mostrada em a apresenta uma dupla ligação entre carbonos, na qual os
carbonos estão ligados a diferentes ligantes, configurando isomeria espacial geométrica (cis –
Trans).
38) Alternativa – B
Esses dois isômeros ópticos são imagens simétricas, portanto podem ser nomeados de
enantiômeros. Caso fossem isômeros ópticos mas não fossem simétricos seriam diastero
isômeros.
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
CAP. 6 – MECANISMO DAS REAÇÕES ORGÂNICAS (PAG. 110)
1)
Em vermelho e itálico está o elemento ou grupamento com maior eletronegatividade.
a) H eterolítica: H 3C --- Br → H 3C + + Br--b) H omolítica: I --- I → 2 I (eletronegatividades iguais)
c) H eterolítica: H 3C --- M gBr → H 3C + + M gBr--d) H eterolítica: H 3C O --- H → H 3C O --- + H +
e) H omolítica: O = O → 2 O (eletronegatividades iguais)
2) Alternativa – E
Dos elementos que estão ligados no carbono, nas moléculas apresentadas, o flúor é o que
apresenta maior eletronegatividade, portanto, é o composto com maior tendência de sofrer
uma ruptura heterolítica.
3)
O efeito mesomérico ou mesômero é característico de compostos que possuem cadeia
insaturada. Ele decorre da atração ou repulsão dos elétrons de uma ligação pi causados por
grupos substituintes ligados a cadeia carbônica.
a) - OH ; positivo, (o radical empurra o par de elétrons para a cadeia carbônica), o oxigênio
da hidroxila possui pares de elétrons livres que podem deslocar-se em direção a cadeia
carbônica.
b) – CN ; negativo (o radical atrai para perto de si os elétrons de uma ligação pi), o
grupamento ciano puxa para si os elétrons da ligação pi, causando uma deficiência eletrônica
nesse carbono, que irá se propagar pela molécula.
c) – Cl ; positivo, (o radical empurra o par de elétrons para a cadeia carbônica), o cloro possui
pares de elétrons livres que podem deslocar-se em direção a cadeia carbônica.
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
d) – NO2 ; negativo, (o radical atrai para perto de si os elétrons de uma ligação pi), o
grupamento nitro puxa para si os elétrons da ligação pi, causando uma deficiência eletrônica
nesse carbono, que irá se propagar pela molécula.
4) Alternativa – A
O flúor é o elemento mais eletronegativo que está ligado ao carbono, portanto, causa um
efeito indutivo mais acentuado.
5)
Quanto maior o efeito indutivo positivo, mais difícil é a liberação de H+, portanto mais fraco é
o ácido. Quanto maior o efeito indutivo negativo, mais fácil é a liberação H+, portanto mais
forte é o ácido. Já os compostos orgânicos que apresentam a capacidade de receber H+ (bases
de Bronsted-Lowry) apresentam comportamento de base, como as aminas e amidas.
Então a ordem crescente de acidez dos compostos apresentados será:
C<D<A<E<B
6) Alternativa – D
Quanto maior o efeito indutivo positivo, mais difícil é a liberação de H+, portanto mais fraco é
o ácido. Quanto maior o efeito indutivo negativo, mais fácil é a liberação H+, portanto mais
forte é o ácido. Já os compostos orgânicos que apresentam a capacidade de receber H+
apresentam comportamento de base, como as aminas e amidas.
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
CAP. 7 – REAÇÕES ORGÂNICAS (PAG. 112)
1) Alternativa – A
Na margarina a quantidade de insaturações é menor devido a reações de adição com H2.
2) Alternativa – C
Compostos que fazem reações de adição com apenas um mol de H2, formando alcanos de
fórmula molecular C4H10, devem apresentar apenas uma dupla ligação e cadeia aberta. A
única alternativa que é encontrado dois compostos que satisfaz essas condições é a alternativa
C, 2-buteno e 2-metilpropano.
3) Alternativa – C
A estrutura que deu origem ao 2-metil-2-pentenol pode ser o 2-metil-2-penteno ou 2-metil-1penteno, como é mostrado na figura 1. Já 1-etilciclopentenol pode ser formado apenas pelo 1etilciclopenteno, como mostrado na figura 2.
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
2-methylpent-2-ene
H
OH
CH3
H3C
+
H2O
H3C
CH3
CH3
2-methylpent-1-ene
CH3
H2C
CH3
OH
+
H2O
H3C
CH3
CH3
CH3
Figura 1
OH
1-ethylcyclopentene
CH3
+
H
OH
CH3
Figura 2
4) Alternativa – A
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
Br
HC
CH3
+
2 Br
Br
Br
Br
Br
CH3
5) Alternativa – E
Há a adição de hidrogênio no cicloalcano, quebra a cadeia fechada, tornando-a linear.
6)
A explicação para o aumento da temperatura necessária à ruptura do ciclo é dada pela Teoria
da Tensão dos Ciclos de Bayer. No ciclopropano, a tensão no ciclo é muito grande, e a
facilidade da ruptura é grande. Por isso a temperatura necessária nessa reação é a menor. À
medida que aumenta o número de C no ciclo, o ângulo entre as ligações C — C se aproxima
do valor 109º28’, e com isso a tensão no ciclo diminui, ou seja, o ciclo fica mais estável,
exigindo temperatura mais alta para ser rompido. Quando se trata de um ciclo com 6 ou mais
C, estes não estão no mesmo plano e o ângulo entre as ligações C — C é praticamente
109º28’, não havendo tensão no ciclo.
7) Alternativa – A
Segundo a regra de Markovwnikoff o hidrogênio vai para o carbono mais hidrogenado.
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
CH3
CH3
+
H2C
H
Cl
H3C
CH3
CH3
Cl
8) Alternativa – C
A adição de água no acetileno (etino) leva a formação de um enol, que sofre tautomerização
dando origem ao aldeído, no caso ao acetaldeido (etanal)
H
HC
CH
+
H
OH
H2C
Acetileno
OH
Enol
H
H
OH
H2C
Enol
H3C
O
Aldeído
9) Alternativa – E
A hidratação (adição de água) da molécula do propino leva a formação de um enol. Esse sofre
tautomerização formando cetona, no caso a propanona.
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
OH
+
HC
H
H2C
OH
CH3
Enol
CH3
O
OH
H3C
H2C
Enol
CH3
Cetona
CH3
10) Alternativa – A
O bromo é um radical que orienta a substituição em carbonos orto – para, como na estrutura
apresentada existe apenas a posição orto disponível, só formará um tipo de produto
monoclorado.
Posição Orto
Br
H
Br
H
+
H
NO 2
H
HO-NO 2
H
+
H
Br
HO-H
H
Br
11) Alternativa – E
I – F, X é uma reação de substituição, caracterizada como acilação de Friedel-Crafts.
II – F, Y é uma reação de substituição, e não de adição.
III – V, em Z há substituição de um hidrogênio do benzeno por um cloro, formando como
produtos finais o cloro-benzeno e o HCl.
12) Alternativa – C
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
A hidroxila presente no fenol é um radical orto-para dirigentes, determinando a entrada do
grupamento nitro (-NO2) nas posições orto-para disponíveis na estrutura do fenol, obtendo
então o composto apresentado na alternativa c.
13) Alternativa – B
Apenas duas estruturas possíveis, 1-cloro-2-metilpropano e o 2-cloro-2-metilpropano, todas
as outras possibilidades de substituição resultará em uma das estruturas já apresentadas.
CH3
Cl
H3C
H
CH3
H3C
1-chloro-2-methylpropane
CH3
+
Cl
Cl
H
CH3
H3C
CH3
Cl
2-chloro-2-methylpropane
14) Alternativa – A
A reação apresentada é uma reação de adição, há a entrada na, molécula do reagente, tanto do
cloro como de hidrogênio resultando em uma cadeia saturada com 3 átomos de carbono.
Portanto a cadeia carbônica do reagente deve conter uma dupla ligação e três átomos de
carbono, propeno.
H2C
CH3
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
15)
a)
b)
I) d - 1 - cloro - 2 – metilbutano e l- 1 - cloro - 2 - metilbutano
II) d - 3 - cloro - 2 – metilbutano e l - 3 - cloro - 2 - metilbutano
Pois em ambas as fórmulas há átomo de carbono assimétrico.
16)
a) 2 --- butanol
O corre a substituição do iodo ligado a cadeia carbônica pela uma hidroxila proveniente do
hidróxido de sódio resultando no 2-butanol.
b) ácido carboxílico
O 2-butanol é um álcool primário, que na presença de catalisado (KMnO4) e meio ácido é
oxidado até acido carboxílico.
17)
(V) Há a substituição de um hidrogênio do anel aromático por um bromo.
(F) Os carbonos que apresentam ligações duplas apresentam energias de ligações diferentes.
(F) O 1-buteno apesar de apresentar dupla ligação, tem um de seus carbonos com dois ligantes
iguais, assim, não há isomeria geométrica ou cis trans.
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
(V) Olefinas são hidrocarbonetos de cadeia aberta que apresentam dupla ligação (também
conhecidos como alcenos), e sofrem reação de adição com bromo na posição que existiam as
duplas.
(F) Uma mistura racêmica, e uma mistura equimolar de destrógiros e levógiros de
determinada substância, dessa maneira não desvia o plano de luz.
18) Alternativa – C
No caso apresentado ocorrerá a substituição do hidrogênio por um radical etil obtendo o
etilbenzeno.
19) Alternativa – A
Cl
+
2 H3C
2 Na
NaCl
CH3
H3C
CH3
H3C
CH3
+
20) Alternativa – B
H
OH
OH
H
H
H
H
OH
H
H
+
H
2 H2O
O
H
Ocorre a eliminação de duas hidroxilas e a oxidação de outra hidroxila até aldeído.
21)
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
22) Alternativa – A
A desidratação intermolecular do etanol leva a formação do éter dietílico (etóxi-etano) já a
desidratação intramolecular do etanol leva a formação do eteno.
Desidratação intermolecular
Desidratação intramolecular
23) Alternativa – A
Na desidratação intramolecular do 1-propanol ocorre à saída da hidroxila ligada ao carbono
um e de um hidrogênio ligado ao carbono dois, formando então uma dupla ligação entre esse
dois carbonos. Portanto os produtos formados são água e propileno.
24)
a)
I – Eliminação, há a diminuição de átomos na molécula e aumento das insaturações.
II – Substituição, há a substituição de um hidrogênio do anel aromático pelo grupamento
nitro.
III – Substituição, há a substituição de um hidrogênio da cadeia carbônica por um cloro.
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
IV – Adição, há a adição de átomos na molécula, eliminando a insaturação. (obs.: nesse
exercício há um erro, desconsidere a dupla ligação do carbono com a hidroxila no produto
formado, o correto é existir nesse local uma ligação simples.)
b) I – Etanol, II – Benzeno, III – Etano, IV – Propanona.
25) Alternativa – C
OH
H3C
H
CH3
CH3 +
H2C
H2O
H
26) Alternativa – A
Desidratação intermolecular, produzindo éter sulfúrico (éter dietilico).
Desidratação intramolecular, produzindo alceno, no caso o eteno.
27) Alternativa – A
I – A função aldeído presente na estrutura A sofre oxidação até ácido carboxílico.
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
II – O éster presente na estrutura B sofre hidrólise formando ácido carboxílico.
28) Nesse exercício, o dieno apresentado tem um carbono a mais em sua cadeia principal,
não existindo nenhuma alternativa correta que represente os compostos formados nessa
reação.
A estrutura correta desse dieno é apresentada abaixo;
A sua ozonólise é apresentada a seguir
Então, considerando essa reação temos como correta a Alternativa – E
29) Alternativa – E
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
30) Alternativa – E
A oxidação de um álcool primário, no caso o etanol, leva a formação de ácido acético (ácido
etanóico).
Como no meio aquoso, além do etanol e há também ácido carboxílico (ácido acético), a
reação entre os dois leva a formação de éster (reação de esterificação), nesse caso, acetato de
etila.
31) Alternativa – B
Quando os carbonos que fazem ligação dupla forem primários ou secundários, obteremos
apenas aldeídos.
Exemplo:
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
Q uando os carbonos que fazem a dupla ligação forem terciários, obteremos apenas cetonas.
Exemplo:
32) Alternativa – D
Nas gorduras e óleos vegetais são encontrados os ésteres de ácidos graxos. E o hidróxido de
sódio (NaOH) pode ser obtido através da eletrólise aquosa do cloreto de sódio (NaCl).
33) Alternativa – C
34) Alternativa – A
O gás metano é a matéria prima que fornece o hidrogênio, de acordo com a seguinte reação;
CH4(g) + H2O(g) → CO(g) + 3H2(g)
Já os triglicerídeos poli-insaturados são encontrados nos óleos vegetais.
35) Alternativa – B
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
36) Alternativa – C
I – Verdadeiro. A dupla ligação presente na parte aberta dessa cadeia pode sofrer reação de
adição, com entrada, por exemplo, de hidrogênio.
II – Verdadeira. A presença de hidroxila nessa estrutura pode sofrer reação de esterificação na
presença de um ácido carboxílico.
III – Falsa. A reação de saponificação deve ocorrer entre um éster e uma base forte, na
estrutura apresentada não há a função éster.
37)
H3C
CH3
Segundo a reação apresentada abaixo;
H3C
CH3
H3C
+
H3C
Cl
CH3
Cl
Mg
MgCl 2
+
H3C
CH3
38) O 1-butanal é um álcool primário, portanto o composto utilizado na sua preparação é um
aldeído.
Já o 2-butanol é um álcool secundário, portanto na sua preparação é utilizado uma cetona.
39)
a)
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
b)
São formados a partir da reação abaixo;
40) Alternativa – D
O butanoato de etila é apresenta a função orgânica éster e é obtido através da reação química
de um álcool (etanol) com um ácido carboxílico (ácido butanóico).
Éster
O
H3C
O
CH3
OH
CH3
HO
H3C
O
Etanol
Ácido butanóico
41) Alternativa – E
A reação que ocorre em X é uma hidrogenação, formando o produto (I);
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
A reação Y é uma esterificação, formando o produto (II) que apresenta a função orgânica
éster;
A reação Z é uma saponificação, formando o produto (III);
42) 02 + 04 + 32 = 38
01) I ncorreta. Possui 6 elétrons que são compartilhados aos pares formando 3 ligações pí.
02) C orreta. A aquilação consiste na reação entre derivados halogenados ou haletos orgânicos e
hidrocarbonetos aromáticos para formar hidrocarbonetos aromáticos ramificados.
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
04) C orreta. A reação pode ser observada na primeira parte do esquema apresentado pelo
exercício.
08) I ncorreta. O ciclo hexano é produzindo na redução do benzeno.
16) I ncorreta. I rá produzir o fenol como mostrado na terceira reação do sistema.
32) C orreta. A segunda reação apresentada pelo esquema descreve essa reação;
43)
44)
a)
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
b)
45) Alternativa – D
Em I ocorre hidratação do alceno, ocorrendo à entrada de uma hidroxila e hidrogênio na
posição que existe uma dupla ligação, formando um álcool secundário.
CH3
R
CH3
A
+ H-OH
R
OH
Em I ocorre à oxidação do álcool secundário, formando uma cetona.
CH3
R
CH3
B
R
OH
O
46) Alternativa – D
Analisando as afirmativas podemos concluir;
I – A propanona é polar
II – A combustão completa da propanona produz quantidades iguais de H2O e CO2.
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
O
CH3
H3C
+
4 O2
3 H2O
+
3 CO 2
III – A redução da propanona produz um álcool secundário.
OH
O
[H]
H3C
CH3
H3C
CH3
IV – A propanona não sofre oxidação, não é possível a entrada de mais oxigênio em sua
estrutura.
47) Alternativa – B
Em I ocorre uma adição eletrofílica, em que a molécula de alceno perde uma ligação pi
permitindo a formação de duas novas ligações sigmas com o cloro. O cloro é um eletrófilo,
apresenta elevada atração por regiões que apresenta elétrons, no caso, a dupla ligação.
Em II ocorre a eliminação de um cloro e de um hidrogênio formando ácido clorídrico.
48) Alternativa – C
I – Sabões e detergentes diminuem a tensão superficial da água.
II – Ó leos e gorduras são triésteres de cadeias grandes (ácidos graxos), quando estes reagem com
uma base forte, como hidróxido de sódio, forma-se um sal de ácido graxo, o qual utilizamos como
sabão.
I I I --- O sal de ácido graxo apresenta uma longa cadeia carbônica apolar, e uma extremidade polar
formada por uma ligação iônica entre o oxigênio e o metal proveniente da base.
I V --- Formam sabões quando reagem com bases fortes e não com aminoácidos.
49) Alternativa – A
50) Alternativa – A
Nessa saponificação são obtidos um sal de ácido carboxílico e um álcool.
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
51) Alternativa – D
O alcino que forma apenas ácido acético é o 2-butino.
52) Alternativa – A
Em I, ocorre a substituição do átomo de cloro pelo grupamento ciano (-CN).
Em II, ocorre a eliminação dos dois cloros que estão presentes nas extremidades da cadeia
carbônica que reagem com o óxido de zinco (óxido anfótero) formando cloreto de zinco e o
dieno apresentado.
53) Alternativa – D
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
54) Alternativa – B
A reação que ocorre é uma oxidação, como houve a produção do ácido propanóico no balão A
(ácido carboxílico) o composto de origem só pode ser um álcool primário ou um aldeído,
como nas alternativas não há a opção por um álcool concluímos que o reagente é um aldeído,
no caso o propanol.
No balão B ocorreu a formação de propanona a partir da reação de oxidação, portanto o
reagente de origem só pode ser um álcool secundário no caso o 2-propanol.
55) Alternativa – E
Etanol, um álcool primário que ao reagir com oxigênio em excesso é oxidado à aldeído e
depois à ácido carboxílico.
56) Alternativa – D
O
Ác. Butanóico (Ác. Carboxílico)
H3C
O
+
OH
57) Alternativa – B
Desidratação intramolecular
Desidratação intermolecular
O
HO
CH3
+
H2O
Butanoato de pentila (Éster)
CH3
1-Pentanol (álcool)
H3C
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
58) Alternativa – D
Observação;
Para resolução desse exercício considerar a estrutura correta apresentada abaixo;
O produto formado em A vem de uma reação de hidrogenação catalítica, em que há a entrada
de 1mol de hidrogênio nas ligações pi, existentes entre um carbono e outro, formando um
alceno. Já em B, ocorre a reação de oxidação de alcinos que leva a formação de aldeído.
59) Alternativa – E
O biodiesel é obtido através da transesterificação de tríesteres de cadeia longa, esses triésteres
de cadeia longa são encontrados formando as gorduras animais e os óleos vegetais.
60) Alternativa – C
Para a formação da glicose cíclica deve existir a reação entre o grupamento aldeído do
carbono 1 com o grupamento hidroxila presente no carbono 5.
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
61) Alternativa – B
62) Alternativa – B
I – Ocorre a eliminação de um hidrogênio e um bromo (forma HBr) levando a formação da
dupla ligação entre carbonos.
II – O corre a adição de água na estrutura (reação de hidratação). A hidroxila proveniente da
água entra no carbono menos hidrogenado enquanto o hidrogênio faz ligação com o carbono
maios hidrogenado segundo a regra de Markovnikov.
III – Ocorre a oxidação do álcool secundário formando uma cetona.
63) Alternativa – C
Na reação que leva a formação do produto I ocorre uma reação de hidrogenação catalítica
com 1mol de hidrogênio, levando a quebra de uma das triplas ligações onde são adicionados
os dois hidrogênios formando um alceno, no caso o eteno.
Para formar o produto II, o etino reage com dois mol de Cl2, ocorrendo a quebra de duas das
triplas ligações, ocorrendo a adição de dois cloros em cada carbono originando o 1,1,2,2tetracloroetano.
Por fim, para formar o produto III, o etino em meio aquoso com catalisador apropriado é
oxidado formando aldeído, nesse caso o etanal.
64)
a) Pela reação de desidratação intermolecular do etanol há a formação do etoxietano, um éter
mais conhecido como éter sulfúrico ou éter dietílico.
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
Como sua oxidação leva à formação de uma cetona, a substância B é um álcool secundário,
como é mostrado na reação a seguir;
b)
Substância A: etóxi-etano ou éter dietílico ou dietil-éter.
Substância B: etan-2-ol ou 2-etanol ou álcool sec-butílico.
c)
65) Alternativa – C
Como o grupamento metil é um grupo orto para dirigente, ele promove a entrada do cloro
nessa reação de adição entre tolueno e Cl2 nas posições orto e para, produzindo os compostos
apresentados na alternativa C.
GABARITO COMENTADO – QUÍMICA
a
3 série do Ensino Médio - REVISIONAL
QUÍMICA VIVA – Volume 2
66) Alternativa – D
Como a morfina apresenta nos grupamento R e R1 a função álcool e a heroína, nessas
mesmas posições, apresentam a função éster, então para sua produção basta submeter a
morfina à uma reação de esterificação utilizando ácido etanóico (ác. Carboxílico).
67) Alternativa – C