UNIVERSIDADE FEDERAL DE GOIÁS
ESCOLA DE VETERINÁRIA E ZOOTECNIA
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIA ANIMAL
DISCIPLINA: SEMINÁRIOS APLICADOS
MECANISMOS DE ADESÃO E INVASÃO POR MICRORGANISMOS
PATOGÊNICOS
Gisely Lázara Prado Santos
Orientador: Prof. Dr. Albenones José de Mesquita
GOIÂNIA
2011
ii
GISELY LÁZARA PRADO SANTOS
Mecanismos de Adesão e Invasão por Microrganismos Patogênicos
Seminário apresentado junto à Disciplina
Seminários Aplicados do Programa de PósGraduação em Ciência Animal da Escola de
Veterinária e Zootecnia da Universidade
Federal de Goiás.
Nível:Mestrado
Área de Concentração:
Sanidade, Higiene e Tecnologia de Alimentos
Linha de Pesquisa:
Higiene, ciência, tecnologia e inspeção de alimentos
Orientador:
Prof. Dr. Albenones José de Mesquita - EVZ/UFG
Comitê de Orientação:
Profª. Drª. Cíntia Silva Minafra e Rezende-EVZ/UF
Prof. Dr. Francisco de Carvalho Dias Filho- EVZ/UFG
GOIÂNIA
2011
iii
SUMÁRIO
1 INTRODUÇÃO ..........................................................................................................5
2 REVISÃO DE LITERATURA .....................................................................................7
2.1 Mecanismos de aderência .....................................................................................7
2.2 Estruturas associadas à adesão ............................................................................7
2.2.1 Cápsula bacteriana .............................................................................................7
2.2.2 Pili ou Fímbrias ...................................................................................................8
2.2.3 Pili Chaperone-Usher ..........................................................................................9
2.2.4 Pili tipo IV .......................................................................................................... 10
2.2.5 Curli .................................................................................................................. 12
2.2.6 Adesinas Timéricas Autotransportadoras .......................................................... 12
2.2.7 Pili em bactérias Gram-positivas ....................................................................... 13
2.2.8 Adesinas ........................................................................................................... 13
2.2.9 Tir: Receptor celular codificado EPEC e EHEC ................................................. 14
2.3 Mecanismos gerais de invasão ............................................................................ 14
2.3.1 Mecanismo de zíper .......................................................................................... 16
2.3.2 Mecanismo de gatilho ....................................................................................... 16
2.4 Estratégias invasivas Moleculares de Salmonella, Shigella, Yersinia e Listeria .... 17
2.4.1 Yersinia ............................................................................................................. 17
2.4.2 Salmonella ........................................................................................................ 17
2.4.3 Shigella ............................................................................................................. 18
2.4.4 Listeria .............................................................................................................. 18
3 CONSIDERAÇÕES FINAIS .................................................................................... 20
REFERÊNCIAS ......................................................................................................... 21
iv
LISTA DE FIGURAS
FIGURA 1 Estruturas celulares da bactéria.............................................................8
FIGURA 2 Pili bacteriano ou estruturas adesivas Pilus-like e alvos do hospedeiro
...............................................................................................................................11
FIGURA 3 Mecanismos usados por bactérias para invasão em células...............15
FIGURA 4. Mecanismo de entrada do patógeno no interior das células
eucarióticas, mecanismo de gatilho ―trigger‖..........................................................17
FIGURA 5. Mecanismo de invasão celular de Listeria monocytogenes................19
5
1 INTRODUÇÃO
A capacidade das bactérias de aderirem, invadirem, estabelecerem e
multiplicarem nos tecidos é um aspecto essencial da patogenicidade bacteriana
e, para que isto ocorra, muitos patógenos invasores exploram mecanismos do
hospedeiro com a intenção de induzir sua própria internalização (LUCK &
BENNET-WOOD,2005; USMAN et. al, 2008). Quando o patógeno invasor
encontra pela primeira vez o hospedeiro, sua capacidade de estabelecer
rapidamente uma interação de alta afinidade com as células eucarióticas é
decisiva para o destino da infecção (COSSART & SANSONETTI, 2004). Para o
estabelecimento e a manutenção de uma infecção, as bactérias patogênicas
têm procurado estratégias variadas com fim de penetrar nas células do
hospedeiro. Assim a adesão inicial à célula do hospedeiro é um dos passos
mais importantes na patogênese bacteriana (KRACHLER & ORTH, 2011).
O
termo
adesão
celular abrange
muitos
mecanismos que
são
conservados a partir de eucariontes unicelulares para os mamíferos superiores.
Organismos unicelulares dependem de adesão às superfícies extracelulares
para a movimentação. Organismos multicelulares fazem uso da adesão celular
para
mover,
comunicar,
diferenciar
ou
formar
epitélios
e
órgãos
(CITI & CORDENONSI, 1998).
Adesão celular pode ditar o destino de uma determinada população de
células e, portanto, é essencial para a vida. Vários tipos de adesão celular têm
sido caracterizadas e podem ser agrupados em duas classes principais:
adesão célula-matriz e adesão célula-célula. Adesão célula-matriz é mediada
principalmente por proteínas pertencentes à família das integrinas, que são
transdutores mecânicos da membrana, cuja especificidade para o dado ligante
é devido a sua capacidade de heterozimerização (CITI & CORDENONSI, 1988;
CAMPBELL & HUMPHRIES, 2011).
Adesão célula-célula representa um
mecanismo mais complexo que pode ser dividido em diferentes tipos de
interações, todas caracterizadas por proteínas específicas com diferentes
finalidades (CAVALLARO & CHRISTOFORI, 2004; HARTSCOK & NELSON,
2008).
6
COSSART & SANSONETTI (2004) descreveram que a internalização
microbiana em células fagocíticas, assim como células epiteliais e endoteliais.
O processo ocorre através de dois mecanismos diferentes, o primeiro
envolvendo rearranjos no citoesqueleto de actina das células hospedeiras
como um mecanismo de zíper, sendo responsável pela formação de saliências
nas células em contato com o patógeno, como por exemplo a Escherichia coli
EPEC. O outro é um mecanismo de gatilho envolvendo a formação de uma
irritação na membrana em volta dos patógenos.
A complexidade das ferramentas usadas pelas bactérias para adesão
celular e invasão e sua grande diversidade torna a tarefa de análise e
comparação mais difícil. Assim, o conhecimento detalhado dos mecanismos
de adesão e invasão de microrganismos patogênicos proporciona uma maior
compreensão da colonização bacteriana das superfícies e múltiplos pontos de
intervenção na infecção bacteriana. Diante do exposto tem a presente revisão
o propósito de mostrar como desenvolvem os mecanismos e as principais
diferenças e particularidades entre as diferentes categorias de microrganismos.
7
2 REVISÃO DE LITERATURA
2.1 Mecanismos de aderência
Vírus, bactérias e parasitas aderem às células hospedeiras para evitar
sua depuração e a maioria destes são posteriormente internalizados para
encontrar um ambiente adequado para sobrevivência e replicação, longe das
defesas imunológicas do hospedeiro (PIZARRO-CERDÁ & COSSART, 2006).
A adesão bacteriana tem sido descrita como o balanço de interações
físico-químicas atrativas e repulsivas entre as bactérias e superfícies.
A
natureza adesiva das bactérias é devida à vários recursos de sua membrana
externa, como pili, flagelos, proteínas e lipopolissacarídeos (LPS) em razão
disto a respostas das células do hospedeiro ao processo de adesão é variável
de acordo com o tipo de bactéria e a célula (CAMESANO & LOGAN, 2000;
WALKER et al.,2004;TRABULSI & ALTERTHUM, 2008).
Todos os tipos de adesão celular são mediados por adesinas, proteínas
de transmembrana com um domínio extracelular envolvido no reconhecimento
e interação ligante, e um domínio intracelular que traduz sinais após para a
reorganização do citoesqueleto da célula e outros eventos. Adesinas são
transdutores mecânicos e sua ativação desencadeia rearranjos de actina
importantes, geralmente mediados pelas famílias Rho e Ras de pequenas
GTPases. Existem vários tipos de adesinas, de acordo com o tipo de bactéria
(PEREZ-MORENO et. al, 2003; TRABULSI & ALTERTHUM, 2008). No entanto
a adesão das bactérias não é somente governada por forças de longo alcance,
tais como interações eletrostáticas, mas também por forças de curto alcance
como Van de Waals, ligações ácido-base, ligações de hidrogênio e interações
bioespecíficas (FLETCHER, 1996).
2.2 Estruturas associadas à adesão
2.2.1 Cápsula bacteriana
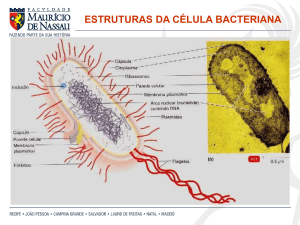
8
A cápsula de polissacarídeos (FIGURA 1) representa a camada mais
externa da célula que media as interações entre a bactéria e seu ambiente de
contato. No caso de superfícies abióticas, tem sido demonstrado que a camada
de polissacarído extracelular (EPS) pode promover a formação de biofilmes e
estimular a agregração inter-espécies e na superfície reforçando assim a
colonização de uma variadade de nichos ecológicos (WILSON, 2002).
FIGURA 1. Estruturas celulares da bactéria
FONTE: http://flachciencias.blogspot.com/2011/03/celula-bacteriana.html
2.2.2 Pili ou Fímbrias
Os termos ―fímbria‖ e pili são utilizados indistintamente, sendo o primeiro
o mais comumente usado. São organelas parecidas com pêlo (Figura 1), cuja
função é conectar as bactérias a uma superfície. Podem ser usados como
apêndices para a transferência de material genético durante a conjugação
bacteriana. Identificadas inicialmente em microrganismos Gram-negativos tais
como Escherichia coli, estas estruturas filamentosas compreendem uma haste
ancorada na membrana bacteriana exterior e um fator de aderência bacteriano
ou, adesina, localizado na sua extremidade. Este fator confere especificidade
de ligação (PIZARRO-CERDÁ & COSSART, 2006).
Estruturas bacterianas de adesão à superfície, especialmente adesinas
bacterianas, pili, ou fímbria, em Gram-negativos têm sido, historicamente, as
predominantemente estudadas. No entanto, ao longo dos anos, um grande
9
número de proteínas monoméricas ligadas à adesão da superfície também
foram identificadas (FRIBERG et. al, 2008).
Mais recentemente bactérias Gram-positivas têm mostrado que também
possuem pili, e os mecanismos pelos quais essas organelas são montadas,
bem como sua contribuição para adesão, invasão e estabelecimento da doença
são assuntos novos e que necessitam de investigação.
2.2.3 Pili Chaperone-Usher
A biogênese e a regulação de adesinas bacterianas têm sido estudadas
em detalhe para vários patógenos (KLINE et al, 2009). Umas das primeiras
caracterizadas e melhor fímbria foi a (P) pilus, expressada pelas cepas de E.
coli que colonizam o trato urinário a subsequentemente infectam os
rins,causando pielonefrite, também conhecida como E. coli uropatogênica ou
UPEC. P pili são codificados pelo agrupamento de genes pap, que contem
reguladores, bem como de genes biosintéticos para subunidades da fímbria,
acompanhantes de proteína e âncoras da membrana externa. P pilibiogênense
é o modelo do caminho ―chaperone/Usher‖ (Figura 2), em que o acompanhante
PapD periplásmico
transporta cada uma das subunidades pilus para o
conjunto plataforma/usher da membrana exterior PapC,
que por sua vez
facilita a translocação bacteriana para a subunidade da superfície (THANASSI
et al., 1998).
A PapD liga subunidades pilus para impedir a sua agregação no espaço
periplásmico na hora errada e catalisa subunidades para prepará-las para a
montagem (BANN et al. 2004). P pili liga-se através da adesina PapG à porção
α-D-galactopiranosil-(1-4)-β-D galactopiranosídeo de glicolipídeos das células
do trato urinário superior. Variantes PapG reconhecem diferentes Galα-(1-4)Gal relacionadas a receptores distribuídos de forma diferente dentro dos
tecidos do hospedeiro e dentro da população do hospedeiro, então a expressão
diferencial das adesinas do PapG direciona a especificidade do tecido e do
hospedeiro (HULTGREN et al..1991)
O conjunto ordenado de pili tipo 1 e P-pili têm sido descrito em detalhe
molecular e forma o modelo para a via chaperone-usher de formação do pilus.
10
Este caminho envolve a secreção de subunidades estruturalmente incompletas
de pilin através da membrana citoplasmática via SecA/Y, a conclusão da dobra
pilin pela interação com um acompanhante periplásmico, e a polimerização de
subunidades pilin através de uma membrana externa Usher ou translocador
através de um processo no qual o pilin de entrada substitui o acompanhante
para completar
a dobra por complementação da vertente do doador. A
menbrana externa Usher (portadora) existe como uma estrutura de poros
gêmeos em que um deles é utilizado para secreção da subunidade e o outro é
ligado para a secreção (REMAUT et al., 2008). Propõe-se que dois ushers
(portadores) facilitam a ligação reiterativa dos complexos subunidade/
acompanhante
em
um
Usher.
As
atuais
adesinas
FimH
e
PapG,
respectivamente, acabam na extremidade distal pois o complexo chaperonaadesina tem maior afinidade com a membrana externa Usher (REMAUT et al.,
2006; REMAUT et al., 2008). Um grande número de adesinas e pilus de
organismos entéricos são montados através da via chaperone-usher, incluindo
o fator de colonização e antígenos expressados por E. coli enterotoxigênica
(ETEC) (POOLE et al., 2007) e adesina Dr fimbrial da uropatogênica (UPEC)
(PIATEK et al., 2005).
2.2.4 Pili tipo IV
CRAIG et al. (2004) relataram que há muito interesse focado no estudo
do Pili tipo
IV (Figura 2), que constitui uma outra categoria de estrutura
polimérica de superfície adesiva expressa por muitas bactérias Gramnegativas, incluindo patógenos como E. coli EPEC, E. coli EHEC, Salmonella
enterica sorovar Typhi, Pseudomonas aeruginosa, Legionella pneumophila,
Neisseria gonorrhoeae, Neisseria meningitis e Vibrio cholerae. Segundo KLINE
et al. (2009) o Pili tipo IV também é expreso em patógenos Gram-positivos tais
como Clostridium perfringens e Streptococcus sanguis.
RAMBOARINA et al. (2005) é descreveram que o Pili tipo IV é
essencialmente composto de um homopolímero e uma subunidade pilin, como
a PilA em P. aeruginosa e PilE em Neisseria spp., bundlin na EPEC ou TcpA
11
em V. cholerae. Compõe também de uma subunidade adesiva localizada na
ponta de alguns pili, por exemplo no PilC em Neisseria spp.
Proteínas do pili tipo IV são constantemente translocadas através da
membrana interna como pré-pilins, quando esta membrana pré-pili peptidase
reconhece e cliva uma sequência líder N-terminal conservada, liberando um pili
peptídeo maduro. Avaliações do protótipo neisserial pili tipo IV indicam que,
depois dos monômeros pilin serem liberados da membrana interna, o pilus é
montada no periplasma por um mecanismo desconhecido que requer uma
ATPase e quatro proteínas adicionais de função também desconhecida
(CARBONNELLE et al., 2005; CARBONELLE et al. 2006).
Uma poro secretina extra-membrana é necessária para a translocação
do pilus à superfície da célula. Pili de Neisseria gonorrhoeae tem duas
modificações
pós-translacionais
na
superfície
exposta
e
regiões
antigenicamente variáveis da estrutura pili: uma fosfocolina O-ligado ou
fosfoetanolamina em uma glicolisação o-ligado (HANSEN & FLORESTA,
2006). Estudos primários em células epiteliais cervicais mostram que o domínio
I das integrinas interage com pili da N. gonorrhoeae, e essa interação é
necessária para a adesão e invasão (EDWARDS & APICELLA, 2005).
Neste sentido, VIK et al.(2009) apontaram que a presença e as
características de adesinas bacterianas glicosiladas estão se tornando cada
vez mais aceitas.
12
FIGURA 2. Pili bacteriano ou estruturas adesivas Pilus-like e alvos do
hospedeiro
FONTE: Adaptado de KLINE et al., 2009.
2.2.5 Curli
KLINE et al. (2009) relataram que alguns patógenos e microrganismos
comensais entéricos tais como E. coli e Salmonella spp expressam substâncias
amilóides adesivas. Estas estruturas, chamadas fímbrias curli ou fímbrias finas
agregadoras, são formadas em um processo de nucleação dependente em que
a proteína da subunidade principal, CsgA, é secretada através da membrana
interna via Sec. É secretada também através da membrana externa via um
poro multimérico da membrana externa CsgG em forma solúvel, mas sofrem
uma mudança conformacional quando interagem com uma subunidade da
superfície ligada relacionada CsgB para formar fibra amilóides insolúveis
(Figura 2).
2.2.6 Adesinas Timéricas Autotransportadoras
Segundo HOICZYK et al. (2000) e SERUTO et al. (2009) um número
crescente de adesinas de proteobactérias Gram-negativas como Yersinia
enterocolitica, Neisseria meningitidis e Haemophilus influenzae pertencem à
família de adesinas timéricas autotransportadoras (TAA). A secreção de cada
autotransportador se inicia com a translocação Sec dependente através da
membrana interna. Posteriormente o domínio transportador de cada uma das
três subunidades se insere na membrana externa para formar um translocador,
que permite autotransporte de domínios passageiros ligados através da
membrana externa (Figura 2).
O TAAs mediam a interação bacteriana com as células do hospedeiro
ou com as proteínas da matriz extracelular, em alguns casos, podem induzir
a invasão de células-alvo (GIRARD & MOUREZ, 2006; SCARSELLI et al.,
2006).
13
2.2.7 Pili em bactérias Gram-positivas
Pili em bactérias Gram-positivas foram descritos pela primeira vez em
Corynebacterium renale por YANAGAWA et al., (1968), mas recentemente foi
observado em
muitos
microrganismos
Gram-positivos
potencialmente
patogênicos tais como, Corynebacterium diphtheriae, Streptococcus agalactiae,
Streptococcus pneumoniae, Streptococcus pyogenes, Enterococcus faecalis,
e Actinomyces naeslundii, entre outros. Ao contrário dos pili em bactérias
Gram-negativas, os pili em Gram-positivos são compostos
de subunidades
ligadas covalentemente. Depois da secreção mediada por Sec das pili, as
transpeptidases chamadas de
outros e,
sortases ligam os monômeros pilin uns aos
eventualmente, transferem
peptidoglicano da
da
célula
o pilus para
(Figura
2)
a
camada
(MANDLIK et
al.,
de
2008;
PROFT & BAKER, 2009; SCOTT & ZAHNER, 2006).
Assim como em bactérias patogênicas gram-negativas, o pili das grampositivas parece desempenhar um papel importante na adesão à superfície do
hospedeiro. No caso do patógeno bucal Strepotococcus parasanguis, a
subunidade distal FlimA promove adesão. O Actinomyces spp, outro patógeno
bucal, liga moléculas salivares ricas em prolina e tecidos da mucosa através da
fimbria tipo 1 e tipo 2, respectivamente (TON-THAT & SCHNEEWIND, 2004).
2.2.8 Adesinas
Além de pili e fímbrias, existe uma infinidade de diferentes adesinas
bacterianas não poliméricas e que reconhecem diferentes elementos da
superfície da célula hospedeira, incluindo componentes da matriz extracelular,
como colágenos, lamininas, elastina, proteoglicanos e ácido hialurônico.
Glicoproteínas adesivas como vitronectina, fibrinogênio e, especialmente
fibronectina também são reconhecidos por muitas espécies diferentes de
bactérias. Receptores de membrana de adesão integral do hospedeiro, como
integrinas, caderinas, selectinas e CEACAMs, são receptores de muitos
patógenos para adesão, e, algumas vezes, para invasão das células (KLINE et
al. 2009).
14
2.2.9 Tir: Receptor celular codificado EPEC e EHEC
Além de pili e fimbrias, as EPEC e EHEC desenvolveram um sistema
original de adesão bacteriana em que a bactéria proporciona tanto o ligante
quanto o receptor. Elas induzem uma lesão característica conhecida como
―attaching and effacing‖ (ligando e apagando) ou A/E. Após a ligação íntima
com células epiteliais do intestino através de suas adesinas e formando pili, as
bactérias induzem o ―apagamento‖ das microvilosidades de absorção e
acumulação locais do citoesqueleto do hospedeiro, levando à formação de
estruturas semelhantes à um pedestal sobre o qual estas ficam. As moléculas
necessárias para induções das lesões A/E são codificadas em uma região
conhecida como lócus de apagamento do enterócito (LEE), que a codifica para
um sistema de secreção do tipo III (TTSS) (PIZARRO-CERDÁ & COSSART,
2006).
Uma das proteínas efetoras do TTSS
das EPEC / EHEC é o Tir
(Receptor de intimina translocado), que é injetado nas células do hospedeiro e,
em seguida, é inserido na sua membrana, onde funciona como um receptor
para outra molécula LEE codificada, a proteína intimina da membrana externa
(KENNY et al., 2002). Tir é até agora o único exemplo de um receptor
bacteriana que é codificado pela bactéria em si (DENG et al., 2001).
2.3 Mecanismos gerais de invasão
O meio extracelular pode ser um ambiente hostil a que os patógenos são
submetidos além do estresse físico (como pH baixo, tensão de cisalhamento
imposta pelo fluxo de secreções mucosas ou sangue), aos vários mecanismos
de defesa do hospedeiro, sendo que as suas células podem responder de
diversas formas à invasão. Normalmente produzem citocinas e prostaglandinas
causando a morte celular por necrose ou apoptose (TRABULSI &
ALTERTHUM, 2008; KLINE et al., 2009).
Muitas espécies de bactérias evoluíram suas estratégias moleculares
para induzir efetivamente a entrada em células-alvo para sua replicação e/ou
disseminação para os tecidos de outro hospedeiro. A invasão pode prosseguir
pelo envolvimento direto dos receptores da superfície da célula hospedeira ou
15
por translocação direta de proteínas bacterianas no citosol da célula, que ira
promover rearranjos na estrutura da membrana plasmática, induzindo o
engolfamento do patógeno (KLINE et al., 2009).
A invasão envolve a entrada direta das células epiteliais de uma
membrana mucosa ou passagem entre elas resultando na invasão dos tecidos
mais profundos. Porém é importante ressaltar que nem todos os patógenos
invadem; Vibrio cholerae, por exemplo, causa a doença por meio da produção
de toxinas no lúmen intestinal (USMAN et. al, 2008).
O processo de invasão ocorre principalmente por duas estratégias: Uma
por meio de fagocitose por células especializadas ou pela interação com
receptores na superfície das células não-fagocíticas. A fagocitose é um
processo normal do organismo, mediada pelo sistema de defesa. Para invasão
nas células não fagocíticas tais como células epiteliais do intestino, alguns
patógenos microbianos expressam
proteínas de superfície,
chamadas
invasinas, capazes de ligar aos receptores eucarióticos de superfície
frequentemente envolvidos em adesão célula-matriz e célula-célula (COSSART
& SANSONETTI, 2004; PIZARRO-CERDÁ & COSSART, 2006; TRABULSI &
ALTERTHUM, 2008).
Existem duas estratégias de invasão diferentes as quais são o
mecanismo de zíper e o mecanismo de gatilho ―trigger‖.
16
FIGURA 3. Mecanismos usados por bactérias para invasão em células.
(A) Mecanismo de zíper usado por Yersinia e Listeria. (B) Mecanismo de
gatilho usado por Salmonella e Shigella.
FONTE: Adaptado de COSSART & SANSONETTI, 2004
2.3.1 Mecanismo de zíper
Ireton & Cossart (1998) descreveram o mecanismo conhecido como
―zíper‖ no pelo qual a bactéria progressivamente vai penetrando na célula até
que seja totalmente internalizada.
Yersinia pseudotuberculosis e Listeria monocytogenes aproveitam a
proteína de adesão celular como receptores para invasão de células de
mamíferos (Figura 3A). Assim, segundo COSSART & SANSONETTI, (2004) a
invasão pode ser dividida em três etapas sucessivas:
Contato e aderência. Etapa independente do citoesqueleto de actina que
envolve apenas a ligante bacteriana e o seu receptor. Isso leva à
aglomeração do receptor.
Formação de corpo fagocíticos. Etapa desencadeada pelos sinais
transitórios que ocorrem após formação dos primeiros complexos liganterecepetor e propagação em todo microrganismo invasor. Estes sinais
induzem a polimerização de actina e extensão da membrana
Encerramento do corpo fagocítico, e retração e despolimerização da actina.
2.3.2 Mecanismo de gatilho
O mecanismo de gatilho ou ―trigger‖ (Figura 4) é caracterizado por um
plissado massivo ou ―ruffling‖ da membrana e rearranjos de actina nos locais
de invasão, ele envolve a formação de uma irritação na membrana em volta
dos patógenos(COSSART & SANSONETTI, 2004). No caso da Salmonella,
usando um sistema de secreção tipo III (TTSS) codificado por um lócus
cromossomal da ilha de patogenicidade 1 (SP-1) (COLLAZO & GALAN, 1997),
um conjunto de proteínas efetoras bacterianas é translocado para o interior das
células hospedeiras, manipulando a dinâmica da actina do hospedeiro e das
17
vias de sinalização intracelular, para promover ampla reorganização do
citoesqueleto de actina que culmina na entrada da bactéria (PATEL & GALAN.
2005)
FIGURA 4. Mecanismo de entrada do patógeno no interior das células
eucarióticas, mecanismo de gatilho ―trigger‖.
FONTE: Adaptado de ALONSO & PORTILLO, 2004
2.4 Estratégias Moleculares Invasivas de Salmonella, Shigella, Yersinia e
Listeria
2.4.1 Yersinia
O mecanismo de invasão da Yersinia é do tipo zíper. A invasina da
membrana externa da Yersinia interage com os receptores β1 (proteína
transmembrana pertencente à família integrina) e promove a ativação do
RhoGTPase
Rac1,
o
que
indiretamente
modula
o
metabolismo
do
fosfatidilinositol para induzir rearranjos de actina no local de entrada de
bactérias, promovendo a invasão. Kinases do hospedeiro, como FAK ou Src
também participam do processo (PIZARRO-CERDA & COSSART, 2006).
2.4.2 Salmonella
A Salmonella é um exemplo de bactéria que utiliza o mecanismo de
invasão de gatilho, ela transloca diversos efetores para dentro das células-alvo,
alguns deles permitindo a captação inicial da bactéria: SIPC é parte do TTSS e
direciona a polimerização de unidades de actina e actina-filamento de
18
agregação. SopE ativa Rho GTPases, promovendo a polimerização de actina e
formação de membrana ruffle ; SopB modula o metabolismo inositol-polifosfato,
ativando indiretamente o mesmo s Rho GTPase ,como SopE; blocos SipA, um
fator de despolimerização da cofilina da actina, favorecendo também a
formação de plissado de membrana. SptP desempenha seu papel uma vez que
a internalização ocorreu, inativando as Rho GTPases, inibindo a polimerização
de actina, e ajudando o fechamento da membrana plasmática das bactérias
internalizadas
(COSSART
&
SANSONETTI,
2004;PIZARRO-CERDA
&
COSSART, 2006).
2.4.3 Shigella
Shigella assim como a Salmonella utiliza o mecanismo de invasão de
gatilho e também transloca efetores TTSS de diversas em células-alvo para
induzir a invasão: o componente de translocação IpaC nucleia a formação de
filamentos de actina; VirA estimula indiretamente a Rac1 RhoGTPase
favorecendo polimerização de actina (a tirosina quinase do hospedeiro Abl /
Arg também ativa indiretamente Cdc42 e Rac1 ) e inibe a polimerização dos
microtúbulos. IpgD afeta o metabolismo do fosfatidilinositol e promove a
extensão da membrana, diminuindo as interações entre a membrana
plasmática e o citoesqueleto de actina; IpaA ativa a proteína do hospedeiro
vinculina, induzindo despolimerização de actina e de recuperação da estrutura
da membrana plasmática, uma vez que as bactérias são internalizadas
COSSART & SANSONETTI, 2004;PIZARRO-CERDA & COSSART, 2006).
2.4.4 Listeria
A invasão da Listeria ocorre pelo mecanismo zíper, durante este
processo, a membrana da célula eucariótica vai envolvendo a bactéria,
provocando alterações leves no citoesqueleto do hospedeiro.
Estudos indicam que L. monocytogenes pode reconhecer receptores
diferentes nas células eucarióticas, incluindo glicoproteínas transmembrânicas
como a E-caderina, receptor de molécula complemento (gC1qR), receptor de
19
fator de crescimento de hepatócitos (Met), além de componentes da matriz
extracelular, como as proteoglicanas. (BRAUN et al. 2000; COSSART, 2001;
PIZZARRO-CERDA & COSSART, 2006). Os ligantes de L. monocytogenes são
principalmente as internalinas A e B (InlA e InlB), que são proteínas de
superfície caracterizadas por possuir repetições ricas em leucina (LRR),
responsáveis por intermediar a ligação com a célula do hospedeiro (Figura 5)
(CABANES et al., 2004).
Listeria invade as células-alvo combinando duas vias. Na via InlAdependente, a proteína bacteriana sortase-ancoradas InlA interage com a
molécula de adesão celular E-caderina e promove a subversão mecanismos de
junção e aderência da célula (incluindo β-e α-cateninas), o que culmina com o
rearranjo do citoesqueleto da célula do hospedeiro, resultando na fagocitose da
bactéria. A miosina VIIA provavelmente gera a força contrátil necessária para
engolfamento bacteriano (COSSART, 2000; SOUSA et al., 2005).
Na via InlB da Listeria, a proteína bacteriana que liga a célula à parede
InlB interage com o a molécula gC1qR e com o receptor de sinalização Met,
que recruta vários adaptadores molecular, e que realizam várias funções,
incluindo o recrutamento de um fosfoinositídeo 3- Kinase (PI3K) ,envolvidas na
ativação do Rac1 RhoGTPase e a polimerização de actina (SEVEAU et al.,
2004). Este processo junto com proteínas Rac e Ccd42, WASP e WAVE
(proteínas da síndrome Wiskott-Aldrich) promove a formação e rearranjo de
filamentos de actina e conseqüente internalização da bactéria (HAMON et al.,
2006) .
FIGURA 5. Mecanismo de invasão celular de Listeria monocytogenes
FONTE: Adaptado de Pizarro-Cerda & Cossart, 2006.
20
3 CONSIDERAÇÕES FINAIS
Bactérias patogênicas possuem uma variedade grande e diversificada
de mecanismos de adesão e invasão celular que conseqüentemente permite
explorar uma grande quantidade de componentes da superfície da célula
hospedeira e possibilitam a ocupação de nichos diferentes dentro do corpo
humano.Recentemente, grandes avanços têm sido observados na biogênese,
montagem e estrutura do pili, fímbrias, invasinas, e sistemas de secreção do
tipo III. Estruturas adesivas novas têm sido descobertas em bactérias Grampositivas, como estreptococos, destacando a diversidade cada vez maior das
estratégias utilizadas por bactérias patogênicas para aderir e colonizar os seus
hospedeiros.
O conhecimento detalhado dos diversos mecanismos de adesão e invasão
proporciona uma maior compreensão da
colonização bacteriana das
superfícies e múltiplos pontos de intervenção na infecção bacteriana. Além
disso a compreensão de como as células se comportam frente a um patógeno
também pode fornecer respostas a perguntas-chave em biologia celular, tais
como a sinalização durante a adesão ou durante uma variedade de outras
condições de estresse.
Diante do exposto, destaca-se que a as estratégias de adesão e invasão
desempenham um papel crucial na fisiopatologia bacteriana e que bactérias
encontradas em diferentes habitats têm necessidade de possuir sistemas
adaptados ao seu ambiente particular.
21
REFERÊNCIAS
1. BANN, J.G.; PINKNER, J.S.; FRIEDEN, C.; HULTGREN, S.J. Catalysis of
protein folding by chaperones in pathogenic bacteria. Proceedings of the
National
Academy of Sciences of the USA. St. Louis. v.101,n. 50
p.17389–17393, Dez. 2004.
2. CAMESANO, T. A.; LOGAN, B. Probing bacterial electrosteric interactions
using atomic force microscopy. Environmental Science and Technology.
Pensilvania v. 34, n.16, p. 3354-3362, Jun. 2000.
3. CAMPBELL, I.D.; HUMPHRIES, M.J. Integrin structure, activation, and
interactions. Cold Spring Harbor Perspectives in Biology Oxford. v. 3,
p.4994, Jan. 2011.
4. CARBONNELLE, E.; HELAINE, S.; PROUVENSIER, L.; NASSIF, X.;
PELICIC, V. Type IV pilus biogenesis in Neisseria meningitidis: PilW is
involved in a step occurring after pilus assembly, essential for fibre stability
and function. Mollecular Microbiology. Paris. v.55, n.1 p.54–64,Jan 2005
5. CARBONNELLE, E.; HELAINE, S.; NASSIF, X.; PELICIC, V. A systematic
genetic analysis in Neisseria meningitidis defines the Pil proteins required
for assembly, functionality, stabilization and export of type IV pili.
Mollecular Microbiology. Paris v.61 n.1, p.1510–1522, 2006.
6. CAVALLARO, U.; CHRISTOFORI, G. Cell adhesion and signalling by
cadherins and Ig-CAMs in cancer. National Review Cancer. Suíça. v.4
p.118–132, Fev. 2004.
7. CITI, S.; CORDENONSI, M. Tight junction proteins. Biochemcal.
Biophysical Acta. v. 1448 p. 1–11. Mar.1998.
22
8. COLLAZO, C. M, GALAN, J.L. The invasion-associated type-III protein
secretion system in Salmonella - a review. Gene. v. 192 p.51-9. 1997.
9. COSSART, P.; SANSONETTI, P.J. Bacterial invasion: the paradigms of
enteroinvasive pathogens. Science. p. 304, 242–248, 2004.
10. CRAIG, L.; PIQUE, M.E.; TAINER, J.A. Type IV pilus structure and bacterial
pathogenicity. Natural Review Microbiology. v.2, p.363–378, 2004.
11. DENG, W.; LI, Y.; VALLANCE, B.A.; FINLAY, B.B. Locus of enterocyte
efffacement from Citrobacter rodentium: sequence analysis and evidence
for horizontal transfer among attaching and effacing pathogens. Infection
Immunology. V.69, p6323–6335, 2001.
12. EDWARDS, J.L.; APICELLA, M.A. I-domain-containing integrins serve as
pilus receptors for Neisseria gonorrhoeae adherence to human epithelial
cells. Cellular Microbiology. v.7, p.1197–1211, 2005.
13. FLETCHER, M. Bacterial adhesion: molecular and ecological diversity.
Wiley, New York, 1996.
14. FRIBERG, N.; CARLSON, P.; KENTALA, E.; MATTILA, P.S.; KUUSELA,
P.; MERI, S.; JARVA, H. Factor H binding as a complement evasion
mechanism for an anaerobic pathogen, Fusobacterium necrophorum.
Journal of Immunology. V.181, p.8624–8632, 2008.
15. GIRARD, V.; MOUREZ, M. Adhesion mediated by autotransporters of
Gram-negative bacteria: structural and functional features. Research in
Microbiol. Saint Hyacinthe, v.157, p.407–416, Fev.2006.
16. HANSEN, J.K.; FOREST, K.T. Type IV pilin structures: insights on shared
architecture, fiber assembly, receptor binding and type II secretion. Journal
of Mollecular Microbiology Biotechnology. V.11, p.192–207, 2006.
23
17. HARTSOCK, A.; NELSON, W.J. Adherens and tight junctions: structure,
function
and
connections
to
the
actin
cytoskeleton
Biochemcal.
Biophysical Acta. v. 1778 p.660–669, 2008.
18. HOICZYK, E.; ROGGENKAMP, A.; REICHENBECHER, M.; LUPAS, A.;
HEESEMANN,
J.
YadA and Moraxella
Structure and sequence
UspAs
reveal a novel
analysis of Yersinia
class of adhesins. EMBO
Journal. v.19,p.5989-5999, 2000.
19. HULTGREN, S.J.; NORMARK, S.; ABRAHAM, S.N. Chaperoneassisted
assembly and molecular architecture of adhesive pili. Annual Review
Microbiology. v.45, p383–415, 1991.
20. IRETON, K.; COSSART, P. Interaction of invasive
bacteria with host
signaling pathways. Current Opinion in Cell Biology. v.10, n.2, p.276283, Abr. 1998.
21. KENNY, B.; ELLIS, S.; LEARD, A.D.; WARAWA, J.; MELLOR, H.;
JEPSON, M.A. Co-ordinate regulation of distinct host cell signalling
pathways by multifunctional enteropathogenic Escherichia coli effector
molecules. Mollecular. Microbiolgy. V.44, p.1095–1107, 2002
22. KLINE, K.A.; KAU, A.L.; CHEN, S.L.; LIM, A.; PINKNER, J.S.; ROSCH, J.;
NALLAPAREDDY, S.R.; MURRAY, B.E.; HENRIQUES-NORMARK, B.;
BEATTY, W., Mechanism for sortase localization and the role of sortase
localization in efficient pilus assembly in Enterococcus faecalis. Journal of
Bacteriology. V.191, n.10 p3237-47, Mar. 2009.
23. KRACHLER, A. M.; ORTH, K. Functional Characterization of the Interaction
between Bacterial Adhesin Multivalent Adhesion Molecule 7 (MAM7)
Protein and Its Host Cell Ligands. The Journal of Biological Chemistry.
Dallas, USA. v. 286, n. 45, p. 38939–38947, Set. 2011
24
24. LUCK, S.M.; BENNETT-WOOD, V. Invasin of Epithelial Cells by Locus of
Enterocyte
Effacement-Negative
Enterohemorragic
Escherichia
coli,
Infection Immunology, p.3063-3071, May, 2005.
25. MANDLIK, A.; DAS, A.; TON-THAT, H. The molecular switch that activates
the cell wall anchoring step of pilus assembly in gram-positive bacteria.
Proceedings of the National Academy of Sciences of the USA Dallas.
v.105, p.14147–14152, 2008.
26. PEREZ-MORENO, M.; JAMORA, C.; FUCHS, E. Sticky business:
orchestrating cellular signals at adherens junctions. Cell. v.112, p.535–548,
2003.
27. PATEL J.C.; GALAN, J.E. Manipulation of the host acti cytoskeleton by
Salmonella – all in the name of entry. Current Opinion in Cell Biology.;
v.8 p.10-15, 2005
28. PIATEK, R.; ZALEWSKA, B.; KOLAJ, O.; FERENS, M.; NOWICKI, B.; KUR,
J. Molecular aspects of biogenesis of Escherichia coli Dr Fimbriae:
characterization of DraB-DraE complexes. Infection Immunology. V.73, p.
135–145, 2005.
29. PIZARRO-CERDÁ, J.,COSSART, P. Bacterial adhesion and entry into host
cells. Cell. n.124, p. 715–727, 2006.
30. POOLE, S.T.; McVEIGH, A.L.; ANANTHA, R.P.; LEE, L.H.; AKAY, Y.M.;
PONTZER, E.A.; SCOTT, D.A.; BULLITT, E.; SAVARINO, S.J. Donor
strand complementation governs intersubunit interaction of fimbriae of the
alternate chaperone pathway. Mollecular. Microbiology.v 63, p.1372–
1384, 2007.
25
31. PROFT, T.; BAKER, E.N. Pili in Gram-negative and Gram-positive
bacteria—structure, assembly and their role in disease. Cellular Mollecular
Life Science. V.66, p.613–635, 2009.
32. RAMBOARINA, S.; FERNANDES, P.J.; DANIELL, S.; ISLAM, S.;
SIMPSON,
P.;
MATTHEWS,
FRANKEL,
S.
Structure
G.;
of
BOOY,
the
F.;
DONNENBERG,
bundle-forming
pilus
M.S.;
from
enteropathogenic Escherichia coli. Journal of Biological Chemical. V.
280, p.40252–40260, 2005.
33. REMAUT, H.; ROSE, R.J.; HANNAN, T.J.; HULTGREN, S.J.; RADFORD,
S.E.; ASHCROFT, A.E.; WAKSMAN, G. Donor-strand exchange in
chaperone-assisted pilus assembly proceeds through a concerted beta
strand displacement mechanism. Mollecular Cell. v.22, p.831–842, 2006.
34. REMAUT, H.; TANG, C.; HENDERSON, N.S.; PINKNER, J.S.; WANG, T.;
HULTGREN, S.J.; THANASSI, D.G.; WAKSMAN, G.; LI, H. Fiber formation
across the bacterial outer membrane by the chaperone/usher pathway. Cell
v. 133, p. 640– 652, 2008.
35. SCARSELLI, M.; SERRUTO, D.; MONTANARI, P.; CAPECCHI, B.; ADUBOBIE, J.; VEGGI, D.; RAPPUOLI, R.; PIZZA, M.; AND ARICO, B.
Neisseria meningitidis NhhA is a multifunctional trimeric autotransporter
adhesin. Mollecular Microbiology.v. 61,p.631–644,
36. SCOTT, J.R.; ZAHNER, D. Pili with strong attachments: Gram-positive
bacteria do it differently. Mollecular Microbiology. v.62, p.320–330, 2006.
37. THANASSI, D.G.; SAULINO, E.T.; HULTGREN, S.J. The chaperone/usher
pathway: a major terminal branch of the general secretory pathway.
Current Opinion in Microbiology. v.1, p.223–231, 1998.
26
38. TON-THAT, H.; SCHNEEWIND, OAssembly of pili in Grampositive bacteria.
Trends in Microbiology. v. 12, p.228–234, 2004.
39. TRABULSI, L. R.; ALTHERTUM, F. Microbiologia, 5ª Ed. São Paulo: Ed.
Atheneu, 2008.
40. USMAN, A.D.; ARZAI, A.H.; SULAIMAN, S.K. The Genetic and Molecular
Basis of Bacterial Invasion of Epithelial Cells – A Review. Bayero Journal
of Pure Applied Sciences. p. 25-28, v. 1, n.1, Bajopas. Dez 2008.
41. VIK, A., AAS, F.E., ANONSEN, J.H., BILSBOROUGH, S., SCHNEIDER, A.,
EGGE-JACOBSEN, W., AND KOOMEY, M. Broad spectrum O-linked
protein glycosylation in the human pathogen Neisseria gonorrhoeae.
Proceedings of the National Academy of Sciences of the USA v.106,
p.4447–4452, 2009.
42. WALKER, S. L.; REDMAN, J. A.; ELIMELECH, M. Role of Cell Surface
Lipopolysaccharides in Escherichia coli K12 adhesion and transport.
Langmuir 20, p.7736-46 , 2004.
43. WILSON, M. Bacterial Adhesion to Host Tissues Mechanisms and
Consequences. Cambridge University Press, Londres, 2002.
44. YANAGAWA, R., OTSUKI, K.; AND TOKUI, T. Electron microscopy of fine
structure of Corynebacterium renale with special reference to pili.. Journal
of Veterinay Research. V.16, p.31–37, 1968.