MINISTÉRIO DA SAÚDE
Secretaria de Ciência, Tecnologia e Insumos Estratégicos.
Departamento de Assistência Farmacêutica e Insumos Estratégicos
GUIA TÉCNICO ORIENTATIVO PARA ELABORAÇÃO DE ESTUDOS
ORIENTADOS DE REVISÃO, ANÁLISE E SISTEMATIZAÇÃO DAS
INFORMAÇÕES CIENTÍFICAS (MONOGRAFIAS) PARA PLANTAS
MEDICINAIS.
Brasília
2014
1
© 2008 Ministério da Saúde
Todos os direitos reservados. É permitida a reprodução parcial ou total desta obra, desde
que citada a fonte e que não seja para venda ou qualquer fim comercial.
A responsabilidade pelos direitos autorais de textos e imagens desta obra é da área
técnica.
A coleção interinstitucional do Ministério da Saúde pode ser acessada, na íntegra, na
Biblioteca virtual em Saúde do Ministério da Saúde: http://www.saude.gov.br/bvs
O conteúdo desta obra e de outras obras da Editora do Ministério da Saúde pode ser
acessado na página: http://www.saude.gov.br/editora
Série B. Textos Básicos da Saúde
Tiragem: 1ª edição – 2012 – X exemplares – Indicar número de exemplares
Elaboração, distribuição e informações
Ministério da Saúde
Secretaria de Ciência, tecnologia e Insumos Estratégicos
Departamento de Assistência Farmacêutica e Insumos Estratégicos
Esplanada dos Ministérios, Bloco G, 8º andar, gabinete
CEP 70058-900, Brasília – DF
Tels (61) 3410 – 4191 / 3410 – 4173
e-mails: [email protected] / [email protected]
Revisão técnica do Texto:
Revisor(es) – Indicar nomes do(s) revisor(es)
Impresso no Brasil / Printed in Brazil
Ficha catalográfica
Deve conter a ficha catalográfica, conforme o Código de catalogação Anglo-Americano
-AACR2 vigente (consultar o bibliotecário para elaboração desta ficha).
Catalogação na fonte – Coordenação-Geral de Documentação e Informação – Editora
MS - XXXXX
Títulos para indexação:
Em Inglês: indicar
Em espanhol: indicar
Editoração
Incluir dados da editora
2
SUMÁRIO
APRESENTAÇÃO ....................................................................................................................... 5
1. CONDIÇÕES NECESSÁRIAS PARA DESENVOLVIMENTO DO TRABALHO ............... 7
2. ESTRUTURA E FORMATO DAS MONOGRAFIAS ............................................................ 7
2.1 Elementos pré-textuais ........................................................................................................... 7
2.1.1 Capa ...................................................................................................................... 7
2.1.2 Ficha de catalogação ........................................................................................... 11
2.1.3 Lista(s) ................................................................................................................ 13
2.1.3.1 Lista de ilustrações .......................................................................................... 13
2.1.3.2 Lista de tabelas................................................................................................ 15
2.1.4 Abreviaturas ........................................................................................................ 17
2.1.5 Sumário ............................................................................................................... 17
2.2 Elementos textuais ................................................................................................................ 19
2.2.1 Conteúdo das Monografias ................................................................................. 19
2.2.2 Formatação do Texto ......................................................................................................... 21
2.2.2.1 Formatação da Página...................................................................................... 21
2.2.2.2 Formatação do texto ........................................................................................ 22
2.2.2.3 Títulos .............................................................................................................. 22
2.2.2.3.1 Títulos sem indicação numérica ................................................................................... 23
2.2.2.4 Paginação ........................................................................................................ 23
2.3 Elementos pós-textuais.......................................................................................................... 24
2.3.1 Referências .......................................................................................................... 24
2.3.2 Glossário ............................................................................................................. 24
2.3.3 Apêndice ............................................................................................................. 24
2.3.4 Anexos ................................................................................................................. 24
3. APRESENTAÇÃO, AVALIAÇÃO E APROVAÇÃO .......................................................... 25
APRESENTAÇÃO ..................................................................................................................... 25
AVALIAÇÃO ............................................................................................................................. 25
APROVAÇÃO ................................................................................................................................ 25
4. DESENVOLVIMENTO DO TRABALHO ............................................................................ 26
FASE 1 – Levantamento de literatura científica em banco de dados .......................................... 26
I - Definição das estratégias e realização das buscas nas bases de dados. ................... 26
II - Análise dos resultados de busca ............................................................................. 27
III - Relatório inicial .................................................................................................... 33
FASE 2 – Sistematização das informações em planilhas ............................................................ 33
FASES 3 - Elaboração da versão preliminar das monografias para a(s) espécie(s) vegetal(is),
conforme roteiro padronizado ..................................................................................................... 35
FASE 4 - Consulta Pública ............................................................................................................ 35
FASE 5 - Elaboração da versão final das monografias para a(s) espécie(s) vegetal(is), conforme
roteiro padronizado ..................................................................................................................... 35
5. CONTEÚDO/ORIENTAÇÕES GERAIS ............................................................................... 35
5.1 Capítulo I – Identificação ...................................................................................................... 35
5.1.1 Identificação da espécie vegetal .......................................................................... 35
3
5.1.2 Identificação da droga vegetal ............................................................................ 37
5.2 Capítulo II – Informações botânicas ..................................................................................... 38
5.3 Capítulo III – Informações sobre controle de qualidade, segurança e eficácia ..................... 38
5.3.1 Controle de qualidade......................................................................................... 38
5.3.2 Segurança e eficácia ............................................................................................ 42
5.3.2.1 Usos populares/tradicionais ........................................................................ 43
5.3.2.2 Estudos pré-clínicos e clínicos ...................................................................... 44
5.3.2.2.1 Ensaios pré-clínicos ....................................................................................... 44
5.3.2.2.2 Ensaios clínicos .............................................................................................. 46
5.3.3 Revisões .............................................................................................................. 49
5.4 Capítulo IV – Resumo das ações e indicações por derivado de droga estudado .................. 49
5.5 Capítulo V – Informações gerais............................................................................................ 50
5.6 Considerações finais .............................................................................................................. 52
5.7 Referências ............................................................................................................................ 53
6. REDAÇÃO E LINGUAGEM DOS TEXTOS ........................................................................ 53
REFERÊNCIAS ............................................................................................................................... 57
GLOSSÁRIO .................................................................................................................................. 60
ANEXOS ....................................................................................................................................... 62
4
APRESENTAÇÃO
Em 2006, duas importantes políticas que dizem respeito a Plantas Medicinais e
Fitoterápicos foram publicadas - Política Nacional de Práticas Integrativas e
Complementares no SUS (1), que prevê a inserção de serviços relacionados às Plantas
Medicinais e Fitoterapia, Medicina Tradicional Chinesa/Acupuntura, Homeopatia, e
Termalismo Social, e a Política Nacional de Plantas Medicinais e Fitoterápicos (2), cujo
objetivo é garantir à população brasileira o acesso seguro e o uso racional de plantas
medicinais e fitoterápicos, promovendo o uso sustentável da biodiversidade, o
desenvolvimento da cadeia produtiva e da indústria nacional.
Com a finalidade de definir as ações, os prazos, os recursos e os respectivos
ministérios e órgãos gestores e envolvidos, previstos na Política Nacional de Plantas
Medicinais e Fitoterápicos, foi elaborado o Programa Nacional de Plantas Medicinais e
Fitoterápicos, aprovado em 10 de dezembro de 2008, por meio da Portaria
Interministerial nº 2.960 (3).
Dentre as responsabilidades do Gestor Federal, inseridas nessas políticas, tem-se:
Elaboração e revisão periódica da Relação Nacional de Plantas Medicinais com
Potencial de Utilização no SUS
Elaboração e revisão de monografias de plantas medicinais, priorizando as
espécies medicinais nativas, e
Inserção do uso de plantas medicinais e fitoterápicos no SUS, em consonância
com a Política Nacional de Saúde, a Política Nacional de Plantas Medicinais e
Fitoterápicos, Política Nacional de Assistência Farmacêutica e a Política Nacional
de Práticas Integrativas e Complementares no SUS.
Em 2009 o Ministério da Saúde por meio do DAF divulgou uma relação 71
espécies vegetais, que apresentam potencial de avançar nas etapas da cadeia produtiva e
de gerar produtos de interesse ao SUS. Essa relação passou a constituir a Relação
Nacional de Plantas Medicinais de Interesse ao SUS – RENISUS (anexo 1).
A finalidade da RENISUS é subsidiar o desenvolvimento de toda cadeia
produtiva, inclusive nas ações que serão desenvolvidas também pelos outros ministérios
participantes do Programa, relacionadas à regulamentação, cultivo/manejo, produção,
5
comercialização e dispensação de plantas medicinais e fitoterápicos. Terá também a
função de orientar estudos e pesquisas que possam subsidiar o desenvolvimento e a
inovação na área de plantas medicinais e fitoterápicos.
Considerando que a RENISUS apresenta espécies vegetais medicinais de interesse
ao SUS, que são amplamente utilizadas pela população para os mais variados fins e
estão em estágios diferentes de estudos, a elaboração de estudos orientados tem como
objetivo identificar todas as publicações relativas à espécie de interesse, como artigos,
teses, dissertações, monografias, livros e compêndios oficiais e não-oficiais, de modo a
conhecer o que se tem pesquisado e direcionar futuras pesquisas para estabelecer a sua
seleção,
cultivo-coleta-colheita,
desenvolvimento
farmacotécnico,
controle
de
qualidade, pesquisa e regulação tanto como planta fresca, produtos intermediários,
quanto como produto acabado.
A publicação de monografias das espécies vegetais de interesse ao SUS facilitará
o registro e fortalecerá pesquisas com plantas nativas brasileiras, como também
contribuirá com a assistência farmacêutica em plantas medicinais, atuando na promoção
da segurança e eficácia das espécies vegetais usadas na atenção básica em saúde.
O presente guia é de caráter informativo e busca orientar os profissionais
envolvidos no trabalho de elaboração de estudos orientados de revisão, análise e
sistematização das informações científicas (monografias) para plantas medicinais. A
proposta deste guia é padronizar informações e procedimentos, de forma que os
resultados possam ser homogêneos e facilmente comparáveis.
6
1. CONDIÇÕES NECESSÁRIAS PARA DESENVOLVIMENTO DO
TRABALHO
- conhecer as etapas de desenvolvimento de um fitoterápico;
- conhecer as normas para regulação de medicamentos fitoterápicos;
- avaliar publicações – realizar análises críticas/ relatar limitações dos estudos;
- seguir a metodologia proposta;
- contar com equipe multidisciplinar para execução do trabalho;
- comprometimento com o trabalho, visando alcançar a meta diária de leitura e revisão
(4 horas a 8 horas diárias).
2. ESTRUTURA E FORMATO DAS MONOGRAFIAS
A estrutura para monografias está dividida por três elementos fundamentais: prétextuais, textuais e pós-textuais.
2.1 Elementos pré-textuais
Os elementos pré-textuais são os que antecedem o texto, contendo as
informações que identificam o trabalho.
2.1.1 Capa
Elemento obrigatório. Considerando as margens das normas da ABNT - 3 cm
esquerda e superior e 2 cm direita e inferior. O texto deve ser digitado na cor preta com
fonte Times New Roman, espaçamento entre linhas de 1,5 e alinhamento centralizado
em toda a página. O título do trabalho e nome dos autores devem estar em caixa alta. Os
tamanhos da fonte variam conforme especificado abaixo.
Esta folha não é contada para fins de paginação e deve conter as seguintes
informações:
Ministério da Saúde (tamanho 14)
Título do trabalho, contendo o nome da espécie e o principal nome
popular (tamanho 16);
7
Organização (tamanho 12);
Fonte do Recurso (tamanho 12);
Elaboração: grupo responsável pela elaboração dos estudos (autores)
bem como as instituições as quais os mesmos representam (tamanho 12);
Local (cidade) da instituição onde deve ser apresentado (tamanho 14), e
Ano da entrega do trabalho (tamanho 14).
O nome Ministério da Saúde deve ficar a dois espaços entre linhas de 1,5 cm da
borda da página. O título do trabalho deve ficar a sete espaços entre linhas de 1,5 cm do
nome do texto que o precede e sucede.
O ano deve ficar a dois espaços entre linhas de 1,5 cm da borda da página.
A borda da página deve ter a seguinte formatação:
8
9
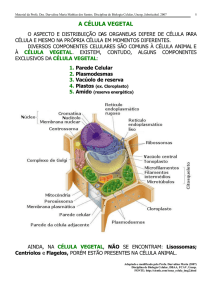
MINISTÉRIO DA SAÚDE
MONOGRAFIA DA ESPÉCIE YYYYY (NOME POPULAR)
Organização: Ministério da Saúde e Anvisa
Fonte do Recurso: Ação 20K5 (DAF/ SCTIE/ MS)/2012
Elaboração: ___________1,___________2
1,2 Universidade Federal de XX
Brasília
2013
Figura 1 – Formato da Capa
10
2.1.2 Ficha de catalogação
Elemento obrigatório. As monografias deverão conter linha de referência
bibliográfica, perfil do autor (com formação e função na instituição) e palavras-chave de
acordo com os termos DeCS/MeSH (até seis palavras, separadas por hífens, e iniciadas
em letra maiúscula).
O texto deve ser digitado na cor preta com fonte Times New Roman, tamanho
12, espaçamento entre linhas de 1,5 e alinhamento justificado.
Os nomes dos autores, título, ano e número de folhas deve ficar no final da
página a dois espaços entre linhas de 1,5 cm do perfil dos autores e a três espaços entre
linhas de 1,5 cm das palavras chaves que devem ficar a dois espaços entre linhas de 1,5
cm da margem inferior da página.
11
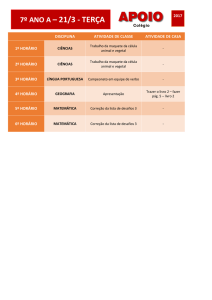
Autores, título, ano, n° folhas.
Perfil dos Autores: pós-graduação, graduação. Função na instituição
PALAVRAS
CHAVES:
XXXXX – XXXXX – XXXXX
XXXXX
–
XXXXX
–
XXXXX
Figura 2 – Formato da Ficha de Catalogação
12
2.1.3 Lista(s)
As listas de tabelas e ilustrações são elaboradas de acordo com a sequência com
que se apresentam no texto, acompanhadas do respectivo número da página. As folhas
referentes às listas não devem ser contadas, mas devem ser numeradas em romanos.
O sumário das listas deve ser digitado na cor preta com fonte Times New
Roman, tamanho 12, espaçamento entre linhas de 1,5 e alinhamento justificado. O título
deve estar a um espaço entre linhas de 1,5 cm da margem superior da página e separado
do texto que o sucede por um espaço entre linhas de 1,5 cm, em caixa alta, centralizado.
2.1.3.1 Lista de ilustrações
A identificação das ilustrações (imagens, desenhos, fluxogramas, fotografias,
gráficos, mapas, organogramas, planos, quadros e outros) deverá aparecer na parte
inferior, precedida da palavra designativa (ex.: Figura) e seguida de seu número de
ordem, de travessão, do título e/ou legenda explicativa e da fonte, se necessário.
Separar em quadros, figuras (esquemas, organogramas, fotografias) e gráficos.
Entretanto, deve constar no sumário apenas a expressão “Lista de ilustrações”
relacionadas de acordo com a ordem apresentada no texto, com cada item designado por
seu nome, acompanhadas do seu respectivo número da página.
A ilustração deve ser inserida o mais próximo possível do trecho a que se refere
e ficar centralizada na página.
A legenda deve aparecer na parte inferior da ilustração, o texto deve ter tamanho
10, negrito, centralizado, espaço simples entre linhas.
13
LISTA DE ILUSTRAÇÕES
Figura 1 – Xxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxx
10
Figura 2 – Xxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxx
10
Figura 3 – Xxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxx
10
Figura 4 – Xxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxx
10
Quadro 1 – Xxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxx
10
Quadro 2 – Xxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxx
10
Quadro 3 – Xxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxx
10
Figura 3 – Formato de Lista de ilustrações
14
2.1.3.2 Lista de tabelas
A tabela é a forma não discursiva de apresentar informações, das quais o dado
numérico se destaca como informação central, ou seja, apresentam informações tratadas
estatisticamente. A identificação/ título das tabelas deverá ser colocada na parte
superior, seguido de seu número de ordem.
Cabe salientar a diferença entre QUADRO e TABELA. O quadro é um elemento
que contém informações textuais agrupadas em colunas, seguindo as regras da
ilustração. A estrutura da tabela, constituída de traços, é delimitada por linhas.
Diferentemente do quadro, não se deve delimitar (ou fechar) por traços verticais os
extremos da tabela, à direita e à esquerda. Deve-se separar o cabeçalho do conteúdo por
linhas simples.
O título ‘’Tabela’’ é colocado na parte superior, seguido de seu número de
ordem. Para quadros, por tratar-se de ilustração, o título ‘’Quadro’’ é colocado na parte
inferior, também seguido de seu número de ordem.
Tabelas e quadros devem ser centrados na página e, caso não caibam em uma
página, devem ser continuados na página seguinte, sendo o título e o cabeçalho sempre
repetidos na folha seguinte e considerando-se que, nesse caso, não devem ser
delimitados por traço horizontal na parte inferior, a não ser na última página.
15
LISTA DE TABELAS
Tabela 1 – Xxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxx
10
Tabela 2 – Xxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxx
10
Tabela 3 – Xxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxx
10
Tabela 4 – Xxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxx
10
Tabela 5 – Xxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxx
10
Tabela 6 – Xxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxx
10
Tabela 7 – Xxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxx
10
Figura 4 – Formato de Lista de Tabelas
16
2.1.4 Abreviaturas
Deverá ser incluída uma lista de abreviaturas utilizadas na monografia. Ao longo
do texto, as mesmas quando citadas pela primeira vez deverão ser inseridas por extenso
com a abreviação entre parênteses.
2.1.5 Sumário
Elemento obrigatório. Deve ser o último elemento pré-textual.
É a enumeração das divisões, seções e outras partes do trabalho, na mesma
ordem e grafia em que a matéria nele se sucede.
Os elementos pré-textuais não devem constar no sumário (resumos, listas, etc.)
O texto do sumário deve ser digitado na cor preta com fonte Times New Roman,
tamanho 12, espaçamento simples entre linhas e alinhamento esquerdo.
O título deve estar a um espaço simples entre linhas da margem superior da
página e separado do texto que o sucede por dois espaços simples entre linhas, em caixa
alta, sem numeração, negrito e centralizado na página.
Não utilizar ponto ao final da numeração dos tópicos (nem no sumário, nem ao
longo do texto). Exemplo: o certo é 5.3.1 e não 5.3.1. (4).
17
SUMÁRIO
Figura 5 – Modelo de Sumário
18
2.2 Elementos textuais
2.2.1 Conteúdo das Monografias
A sistematização das informações científicas (monografias) consiste de 5 (cinco)
seções conforme abaixo.
1 IDENTIFICAÇÃO
1.1 NOMENCLATURA BOTÂNICA
1.2 SINONÍMIA BOTÂNICA
1.3 FAMÍLIA
1.4 FOTO DA PLANTA
1.5 NOMENCLATURA POPULAR
1.6 DISTRIBUIÇÃO GEOGRÁFICA
1.7 OUTRAS ESPÉCIES CORRELATAS DO GÊNERO, NATIVAS OU EXÓTICAS
ADAPTADAS
2 INFORMAÇOES BOTÂNICAS
2.1 PARTE UTILIZADA / ÓRGÃO VEGETAL
2.2 DESCRIÇÃO MACROSCÓPICA DA PARTE DA PLANTA UTILIZADA
2.3 DESCRIÇÃO MICROSCÓPICA DA PARTE DA PLANTA UTILIZADA
2.4 INFORMAÇÕES SOBRE POSSÍVEIS ESPÉCIES VEGETAIS SIMILARES QUE
POSSAM SER UTILIZADAS COMO ADULTERANTES
3 INFORMAÇÕES DE CONTROLE DE QUALIDADE
3.1 ESPÉCIE VEGETAL / DROGA VEGETAL
3.1.1 Caracteres organolépticos
3.1.2 Requisitos de pureza
3.1.2.1 Perfil de contaminantes comuns
3.1.2.2 Microbiológico
3.1.2.3 Teor de umidade
3.1.2.4 Metal pesado
3.1.2.5 Resíduos químicos
3.1.2.6 Cinzas
3.1.3 Granulometria
3.1.4 Prospecção fitoquímica
3.1.5 Testes físico-químicos
3.1.6 Testes de identificação
3.1.7 Testes de quantificação
3.1.7.1 Componentes químicos e suas concentrações: descritos e majoritários, ativos ou
não
3.1.8 Outras informações úteis para o controle de qualidade
3.2 DERIVADO VEGETAL
3.2.1 Descrição
3.2.2 Método de obtenção
3.2.3 Caracteres organolépticos
3.2.4 Requisitos de pureza
19
3.2.4.1 Perfil de contaminantes comuns
3.2.4.2 Microbiológico
3.2.4.3 Teor de umidade
3.2.4.4 Metal pesado
3.2.4.5 Resíduos químicos
3.2.5 Testes físico-químicos
3.2.6 Prospecção fitoquímica
3.2.7 Testes de identificação
3.2.8 Testes de quantificação
3.2.8.1 Componentes químicos e suas concentrações: descritos e majoritários, ativos ou
não
3.3 PRODUTO FINAL
3.3.1 Forma farmacêutica
3.3.2 Testes específicos por forma farmacêutica
3.3.3 Requisitos de pureza
3.3.4 Resíduos químicos
3.3.5 Prospecção fitoquímica
3.3.6 Testes de identificação
3.3.7 Testes de quantificação
3.3.7.1 Componentes químicos e suas concentrações: descritos e majoritários, ativos ou
não
4 INFORMAÇÕES DE SEGURANÇA E EFICÁCIA
4.1 USOS POPULARES / TRADICIONAIS
4.2 PRESENÇA NA NOTIFICAÇÃO DE DROGAS VEGETAIS
4.3 ESTUDOS NÃO-CLÍNICOS
4.3.1 Estudos toxicológicos
4.3.1.1 Toxicidade aguda
4.3.1.2 Toxicidade subcrônica
4.3.1.3 Toxicidade crônica
4.3.1.4 Genotoxicidade
4.3.1.5 Sensibilização dérmica
4.3.1.6 Irritação cutânea
4.3.1.7 Irritação ocular
4.3.2 Estudos farmacológicos
4.3.2.1 Ensaios in vitro
4.3.2.2 Ensaios in vivo
4.3.2.3 Ensaios ex vivo
4.4 ESTUDOS CLÍNICOS
4.4.1 Fase I
4.4.2 Fase II
4.4.3 Fase III
4.4.4 Fase IV
4.4.5 Estudos observacionais
20
4.5 RESUMO DAS AÇÕES E INDICAÇÕES POR DERIVADO DE DROGA
ESTUDADO
4.5.1 Vias de Administração
4.5.2 Dose Diária
4.5.3 Posologia (Dose e Intervalo)
4.5.4 Período de Utilização
4.5.5 Contra Indicações
4.5.6 Grupos de Risco
4.5.7 Precauções de Uso
4.5.8 Efeitos Adversos Relatados
4.5.9 Interações Medicamentosas
4.5.9.1 Descritas
4.5.9.2 Potenciais
4.5.10 Informações de Superdosagem
4.5.10.1 Descrição do quadro clínico
4.5.10.2 Ações a serem tomadas
5 INFORMAÇÕES GERAIS
5.1 FORMAS FARMACÊUTICAS /FORMULAÇÕES DESCRITAS NA
LITERATURA
5.2 PRODUTOS REGISTRADOS NA ANVISA E OUTRAS AGÊNCIAS
REGULADORAS
5.3 EMBALAGEM E ARMAZENAMENTO
5.4 ROTULAGEM
5.5 MONOGRAFIAS EM COMPÊNDIOS OFICIAIS E NÃO OFICIAIS
5.6 PATENTES SOLICITADAS PARA A ESPÉCIE VEGETAL
5.7 DIVERSOS
2.2.2 Formatação do Texto
2.2.2.1 Formatação da Página
Recomenda-se papel branco ou reciclado A4 (210 x 297 mm), texto digitado na
cor preta com fonte 12, e tamanho menor para citações de mais linhas, notas de rodapé,
paginação e legendas das ilustrações e tabelas.
Para citações de mais de três linhas, observar ainda o recuo de 4 cm da margem
esquerda.
Para que as margens permitam a encadernação adequada, devem apresentar as
seguintes medidas:
Esquerda e superior: 3 cm
Direita e inferior: 2 cm
21
Se o texto for digitado frente e verso da folha, as margens devem ser para o
verso da folha, direita superior de 3 cm e esquerda e inferior de 2 cm, sendo que os
elementos pré-textuais deverão iniciar somente no anverso da folha.
2.2.2.2 Formatação do texto
O texto deve ser digitado com fonte na cor preta, podendo-se utilizar outras
cores somente para as ilustrações. A fonte a ser utilizada em todo o trabalho deve ser
Times New Roman, tamanho da fonte para todo o texto é 12, alinhamento justificado,
com margem de início de parágrafo com 1,25 da margem esquerda e espaçamento entre
linhas de 1,5.
As citações de mais de três linhas, notas de rodapé, paginação e legenda das
ilustrações e das tabelas devem ser digitadas em tamanho menor e uniforme, tamanho
10, justificado. Para citações com mais de três linhas, deve-se observar também um
recuo de 4 cm da margem esquerda, com espaçamento simples entre linhas.
Os títulos das seções primárias devem começar na margem superior da folha
separados do texto que os sucede por um espaço entre linhas de 1,5 cm e, da mesma
forma, os títulos das subseções devem ser separados do texto que os precede, ou que os
sucede, por um espaço de 1,5 cm.
2.2.2.3 Títulos
O conteúdo do trabalho deve receber numeração progressiva para as seções do
texto.
1 SEÇÃO PRIMÁRIA (CAPÍTULO)
1.1 SEÇÃO SECUNDÁRIA
1.1.1 Seção Terciária
1.1.1.1 Seção Quaternária
1.1.1.1.1 Seção Quinária
As seções devem ser digitadas com fonte Times New Roman, tamanho 12,
alinhamento esquerdo, espaçamento entre linhas de 1,5 e destacadas conforme abaixo:
22
Seção Primária – letras todas em maiúsculo e negrito.
Seção Secundária – letras todas em maiúsculo
Seção Terciária – letras em minúsculo e negrito
Seção Quaternária – letras em minúsculo e itálico
Seção Quinária – letras em minúsculo
O título das seções (primarias, secundárias, etc.) deve ser colocado após sua
numeração e dele separado por um espaço. O texto deve iniciar-se em outra linha.
Os títulos das seções primárias (capítulos) devem iniciar em uma nova folha
(topo da folha) e ser separados dos textos que os sucedem por dois espaços 1,5 entre as
linhas.
Todas as seções devem conter um texto relacionado com elas.
2.2.2.3.1 Títulos sem indicação numérica
De acordo com a ABNT NBR 6024-2013, os títulos sem indicativo numérico
devem ser centralizados, em caixa alta e negrito, com tamanho de fonte 12. São eles
a) lista de ilustrações
b) lista de abreviaturas e siglas
c) lista de símbolos
d) resumos
e) sumário
f) referências
g) glossário
h) apêndice(s)
i) anexo(s)
2.2.2.4 Paginação
A numeração é colocada em algarismos arábicos, com exceção dos elementos
pré-textuais, no canto superiro direito da folha, a 2 cm da borda superior, ficando o
último algarismo a 2 cm da borda direita da folha.
23
2.3 Elementos pós-textuais
São elementos que devem constar para complementar o trabalho. Incluem-se as
referências bibliográficas por ordem alfabética, a bibliografia, o glossário de termos
(opcional) e os apêndices.
2.3.1 Referências
Elemento obrigatório. Devem ser elaboradas conforme as normas de Vancouver.
O título é todo em caixa alta, sem numeração, centralizado na página, negrito e
deve começar na margem superior da folha separados do texto que os sucede por dois
espaços entre linhas de 1,5 cm.
Para o texto deve ser utilizado tamanho 12, espaço simples entre linhas e
separadas entre si por dois espaços simples e alinhamento à esquerda.
2.3.2 Glossário
Lista de expressões e termos em ordem alfabética, que ajudem o leitor no
entendimento do trabalho.
Para o texto, deve-se utilizar tamanho 12, espaço simples entre linhas e
separadas entre si por dois espaços simples e alinhamento à esquerda.
2.3.3 Apêndice
Este item serve apenas para complementar a argumentação. Deve ser
identificado por letras maiúsculas consecutivas destacadas em negrito, seguido por
travessão e pelo respectivo título. Ex: APÊNDICE A - Protocolo de pesquisa.
2.3.4 Anexos
Este item serve para anexar um texto ou um documento, não elaborado pelo
autor, que serve de fundamentação, ilustração ou comprovação de argumentos
utilizados. Devem ser identificados da mesma forma descrita para apêndices.
24
3. APRESENTAÇÃO, AVALIAÇÃO E APROVAÇÃO
APRESENTAÇÃO
O trabalho deverá obedecer à estruturação, conforme item 2, em consonância
com as orientações contidas neste guia.
AVALIAÇÃO
Todo o trabalho (relatório, planilhas e versões da monografia) deverá ser encaminhado
via e-mail ([email protected] ou [email protected]) para análise.
Caso seja recomendado/solicitado alterações ou ajustes ao trabalho, o mesmo retornará
ao autor, via e-mail, para atendimento às recomendações/solicitações.
Após atendimento às recomendações/solicitações, o autor reenviará o trabalho
modificado via e-mail ([email protected] ou [email protected]) para
uma nova avaliação. A aprovação do trabalho será informada ao autor por e-mail
([email protected] ou [email protected]) pela equipe técnica
responsável.
APROVAÇÃO
O produto aprovado deverá ser enviado via correio (preferencialmente como SEDEX)
ou entregue pessoalmente pelo autor na forma impressa em 02 (duas) vias e em CD,
juntamente com uma carta de encaminhamento contendo data e assinatura, para o
seguinte endereço:
Política e Programa Nacional de Plantas Medicinais e Fitoterápicos
Esplanada dos Ministérios, bloco G, Edifício Sede, sala 859
Brasília/DF, CEP: 70058-900
25
4. DESENVOLVIMENTO DO TRABALHO
Para o desenvolvimento dos estudos orientados de revisão, análise e
sistematização das informações científicas (monografias), recomenda-se que seja
seguida a metodologia proposta para cada fase. As planilhas e tabelas referenciadas ao
longo do texto, que servem de exemplo, estão em anexo.
FASE 1 – Levantamento de literatura científica em banco de dados
Consiste na definição das estratégias de buscas, execução das buscas, seleção
dos resumos, e relatório contendo todo o processo de trabalho e as planilhas referentes
às estratégias de busca (Planilha 1) e as referências selecionadas (Planilha 2).
I - Definição das estratégias e realização das buscas nas bases de dados.
Ia) Identificar/ Definir as palavras-chaves para a busca dos artigos relacionados à espécie
vegetal
O desenvolvimento de um trabalho com qualidade compatível ao esperado requer a
confirmação dos nomes científicos, nomes populares, famílias e sinonímias botânicas
aceitas.
Para confirmação dos dados acima, deve-se utilizar o banco de dados Flora do Brasil
(http://floradobrasil.jbrj.gov.br/2012/), MOBOT (http://www.tropicos.org/) ou The
International Plant Names Index (IPNI). Os dois primeiros bancos de dados citados
também servem para confirmar a distribuição geográfica e ocorrência da espécie
vegetal.
Estes dados são importantes para definição ou confirmação dos descritores que serão
utilizados na elaboração das estratégias de buscas e que, posteriormente, também serão
utilizados na seleção dos resumos, uma vez que nas buscas poderão aparecer estudos
referenciando sinonímias. Ex.: São sinônimos: Apuleia ferrea e Caesalpinia ferrea. Ao
analisar os resultados da busca na base de dados Lilacs, observou-se que dos 30
26
resumos, 5 constavam o termo Apuleia ferrea e 2 Caesalpinia ferrea. Esse dado
também é importante para definir/confirmar a espécie devido aos vários nomes
populares nas diversas regiões.
Uma vez realizada a confirmação do nome científico, é necessária a definição da
estratégia de busca. Uma das formas de se definir a estratégia de busca é através da
utilização dos descritores DECS e MeSH. Acesse: http://decs.bvs.br/ (página de busca
de descritores DeCS) e http://www.ncbi.nlm.nih.gov/mesh (página de busca de
descritores MeSH).
A busca dos descritores deverá ser realizada pelos nomes aceitos ou sinonímias
encontradas nos bancos de dados botânicos, ou ainda pelo gênero da planta.
Ib) Levantar informações científicas, relativas à espécie de interesse, em artigos, teses,
dissertações, monografias, livros e compêndios oficiais e não-oficiais.
Deverão ser consultadas as seguintes bases de dados:
- COCHRANE
- DARE
- MEDLINE via PUBMED
- EMBASE
- SCIELO
- LILACS
- SCOPUS
- PERIODICOS CAPES
- Depósito de patentes
- Outros (citar)
Os resultados deverão ser salvos em arquivo word (extensão .doc ou docx) e, após a
análise dos resultados, deverá ser preenchida a planilha 1 (anexo 2).
II - Análise dos resultados de busca
Deverão ser analisados os arquivos word (extensão .doc ou docx) contendo as buscas.
Para esta análise, sugere-se a seguinte sinalização:
Fonte vermelha – ao identificar as espécies vegetais citadas nos resumos
27
Realce amarelo – resumos selecionados para leitura do artigo completo
Tachado duplo – resumos não selecionados
Identificação da área – inserida à frente do título
Ao final, para facilitar o andamento do trabalho, sugere-se colocar na parte superior dos
arquivos o número total de artigos resultantes da busca para aquele banco de dados,
livro ou compêndio oficial e não-oficial e o número de artigos, teses, dissertações e
monografias selecionados. Isso facilitará o preenchimento da planilha 1.
IIa) Critérios de inclusão e exclusão de estudos.
Para a identificação da espécie vegetal, após confirmação dos nomes científicos,
famílias e sinonímias botânicas da espécie vegetal, deverão ser incluídos apenas os
estudos que se referem à espécie selecionada e a suas sinonímias botânicas. Ex.: Após a
confirmação nas bases de dados específicas (Missouri Botanical Garden (MOBOT), The
International Plant Names Index (IPNI) e Lista de Espécies – Flora Brasil 2010)
verificou-se que Apuleia ferrea e Caesalpinia ferrea são sinonímias, portanto todos os
estudos que citarem um ou ambos os termos serão incluídos.
Em relação às informações botânicas, deverão ser selecionados todos os estudos que
descrevem a espécie vegetal e/ou a parte utilizada. A parte do vegetal de interesse
deverá ser descrita conforme os artigos avaliados, sendo a mesma utilizada na
elaboração dos fitoterápicos. Assim, esse item deverá ser preenchido após a análise de
todas as referências.
Para o controle da qualidade, deverão ser selecionados todos os estudos encontrados
para a espécie vegetal, incluindo a droga vegetal, derivado vegetal e medicamento
fitoterápico obtidos de qualquer parte da planta, que contenham informações sobre
constituintes químicos, requisitos de pureza, técnicas de identificação e metodologias de
análise.
Dentre os artigos de segurança e eficácia, deverão ser selecionadas as referências que
incluam todos os derivados vegetais obtidos de qualquer parte da planta. Deverão ser
selecionados todos os ensaios encontrados, pré-clínicos (in vitro, in vivo e ex vivo) e
28
clínicos, que avaliem os efeitos de qualquer estágio de desenvolvimento de
fitoterápicos: droga vegetal, derivado e produto final, o fitoterápico, em qualquer
atividade terapêutica.
Os estudos em duplicata deverão ser excluídos, enquanto que os estudos que não
deixem claro qual a espécie vegetal utilizada devem ser referenciados, porém informar
nas limitações essa informação.
Estudos com associação de espécies vegetais e estudos com composto químico isolado
devem ser incluídos quando trouxerem informações importantes sobre a espécie vegetal
de interesse, por exemplo, um estudo que demonstrou que determinada substância
isolada da espécie que está sendo estudada possui a mesma atividade terapêutica do
fitocomplexo, devendo ter relação com a atividade terapêutica da espécie. Da mesma
forma, um trabalho que demonstre que determinada substância isolada não apresenta o
mesmo efeito do fitocomplexo. No caso de associações, devem ser inseridos dados de
sinergismo, antagonismo ou reações adversas advindas do uso concomitante da espécie
vegetal com medicamentos sintéticos ou outros produtos naturais. Porém, cuidados
devem ser tomados em relação a dados correlacionados com o uso isolado da espécie.
Ainda, se houverem estudos de interação com alimentos, estes também devem ser
incluídos.
IIb) Classificação de acordo com as áreas de aplicação
Os trabalhos devem ser selecionados e classificados de acordo com o foco/ resultado
principal do trabalho. Abaixo segue uma relação das áreas:
Biotecnologia
Segundo a ONU, define-se biotecnologia como ‘’qualquer aplicação tecnológica que
utilize sistemas biológicos, organismos vivos, ou seus derivados, a fim de fabricar ou
modificar produtos ou processos para utilização específica’’. Portanto, serão
classificados e inclusos os artigos cuja tecnologia descrita seja baseada na biologia,
especialmente quando usada na agricultura, ciência dos alimentos e medicina,
referenciando a produção/ utilização de um produto tecnológico originado a partir da
espécie vegetal em estudo (5).
29
Farmacotécnica
Devem ser classificados como artigos de farmacotécnica todo estudo que descrever
formulações desenvolvidas e características de produtos derivados de plantas do ponto
de vista tecnológico e físico-químico (6).
Etnofarmacologia/ Etnobotânica
O termo etnofarmacologia está inserido no contexto de etnobotânica. Assim, todos os
artigos que relatam o estudo do conhecimento popular das ações, usos ou aplicações
tradicionais da espécie/droga vegetal por determinado grupo étnico ou social devem ser
classificados e selecionados como etnofarmacologia (7, 8, 9).
Agronomia
Sabendo-se que o termo agronomia é um conjunto de conhecimentos de diversas áreas
(10) aplicado na agricultura, serão classificados e selecionados os artigos cujo foco do
estudo
seja
o
manejo
da
cultura,
a
influência
das
condições
metereológicas/ambientais/de cultivo nos produtos do metabolismo da espécie vegetal,
pestes comuns que atingem a espécie em estudo durante o seu cultivo, efeitos
simbióticos com outras espécies vegetais, aplicação de agrotóxicos ou produtos
fitossanitários, entre outros.
Botânica
No contexto do projeto de estudos orientados sobre plantas medicinais, pode-se definir a
botânica como sendo um ramo da biologia que consiste no estudo científico da vida das
plantas (9). Portanto, serão classificados e inclusos neste item todos os estudos de
taxonomia e morfologia vegetal, incluindo caracterizações macro e microscópicas que
possam contribuir para a identificação da espécie vegetal.
Controle de qualidade
Serão classificados e selecionados todos os artigos cujo tema central da pesquisa seja o
controle de qualidade da matéria-prima vegetal, da droga vegetal ou produto
fitoterápico, demonstrando-se técnicas/ procedimentos com objetivo de verificar a
conformidade das preparações com as especificações estabelecidas. Assim, esse
30
conjunto de operações é necessário para a melhoria e controle das diversas atividadeschave e processos desenvolvidos (10,11).
Química/ Fitoquímica
Neste item, serão classificados e selecionados como fitoquímica todos os artigos
relacionados à química dos produtos naturais, ou seja, preparo do material vegetal,
processos de extração e fracionamentos bioguiados, identificação de constituintes
químicos/ grupos de constituintes presentes na espécie vegetal, isolamento e purificação
de substâncias, elucidação estrutural, caracterização das propriedades físico-químicas,
ou síntese de análogos a partir de determinado constituinte vegetal (9).
Epidemiologia/ Farmacoepidemiologia
Os artigos cujo foco do estudo seja a distribuição dos fenômenos de saúde/doença e
seus fatores condicionantes e determinantes na população humana, assim como a
avaliação da eficácia das intervenções realizadas no âmbito da saúde pública, estudo do
uso e dos efeitos adversos da droga vegetal/produto fitoterápico nos indivíduos serão
classificados e selecionados.
Farmacologia pré-clínica
Serão classificados e selecionados como tal todos os estudos relacionados aos ensaios
farmacodinâmicos (estudos que evidenciem a atividade biológica e estudem o
mecanismo de ação através de ensaios in vitro, in vivo e ex vivo) em animais de
laboratório, correlacionando os efeitos às doses, e que ao final determinem a eficácia do
fármaco/produto (12). De preferência, os estudos selecionados devem apresentar a
aprovação do comitê de ética animal ou, caso não apresente essa informação, este dado
deve ser informado no item limitações do estudo.
Farmacocinética
Serão classificados e selecionados todas as publicações que avaliem as etapas que a
droga vegetal/fitoterápico sofre desde a administração até a sua excreção, ou seja, as
etapas
de
absorção,
distribuição,
metabolismo
e
eliminação
da
droga
vegetal/fitoterápico (9, 12)
Farmacologia clínica
31
A fim de comprovar o potencial terapêutico da espécie vegetal/ fitoterápico na espécie
humana, serão classificados e selecionados os estudos que envolvam testes de
mecanismo de ação e que comprovem os efeitos do fármaco/produto na prática clínica
(em seres humanos) (12). Assim, são inclusos os estudos de fase I, fase II, fase III e fase
IV. Estudos publicados após a Resolução 196/96 devem apresentar a aprovação do
comitê de ética. Em casos que não houver a aprovação do comitê, relatar o estudo e
informar esta falta de informação em limitações do estudo.
Toxicologia pré-clínica
Serão classificados e selecionados os trabalhos baseados em estudos dos medicamentos
fitoterápicos/ produtos através de testes in vivo e testes in vitro para avaliação do
potencial risco à saúde humana, além da avaliação de risco ambiental (9). Inclui-se a
avaliação da toxicidade aguda, a toxicidade crônica, a toxicidade sub-crônica, a
genotoxicidade, a sensibilização dérmica, a irritação cutânea e a irritação ocular. Estes
estudos necessitam a apresentação da aprovação do comitê de ética.
Toxicologia clínica
Estudos que considerem o efeito da droga vegetal/fitoterápico no organismo, cujo
objetivo seja a investigação de efeitos adversos e tóxicos (13), fornecendo informações
a respeito da segurança desta espécie vegetal.
Interações
Serão classificados e selecionados todos os estudos que relatam um evento clínico em
que os efeitos da droga vegetal/fitoterápico são alterados pela presença de outro
fármaco, alimento ou algum agente químico, e ocasiona efeitos adversos indesejáveis ou
efeitos benéficos (12).
Farmacologia molecular/ Biologia molecular
Estudos da sequência de eventos químicos e biológicos resultantes da interação
fármaco-receptor, procurando explicar os efeitos farmacológicos de compostos
biologicamente ativos ao nível molecular, isto é, baseado nas interações moleculares e
em termos de estruturas moleculares e propriedades físico-químicas.
Revisão
32
São estudos que fazem uma revisão de tudo que já há publicado sobre o assunto/ espécie
vegetal.
Caso um artigo tenha mais de uma classificação (área de aplicação), todas as áreas
devem ser relacionadas. Ex: Botânica/ Agronomia
III - Relatório inicial
O relatório deverá descrever de forma mais esclarecedora e detalhada possível todo o
trabalho realizado, pensando-se em pessoas que poderão repetir o que está relatado e
chegarão aos mesmos resultados. Deve possuir uma linguagem objetiva e de perfeita
compreensão.
Considerando a importância do trabalho a ser realizado e o fato de que todos os estudos
disponíveis sobre a espécie vegetal devem constar do documento final (monografia), é
necessário constar no relatório:
1 – Os nomes científicos (completos) e famílias botânicas;
2 – As bases de dados e o período consultado para levantamento dos resumos;
3 – Os termos utilizados (estratégia de busca) e o número de referências encontradas em
cada base;
4 – Os critérios de inclusão e exclusão utilizados na seleção dos artigos;
5-– Preenchimento das planilhas 1 e 2
6 – Observações sobre análises e resultados;
7 – Considerações finais.
FASE 2 – Sistematização das informações em planilhas
Visando criar um banco de dados das informações encontradas na literatura científica, e
disponibiliza-lo posteriormente a toda sociedade, foi criada uma planilha, a qual
contempla todas as áreas de interesse do projeto. A planilha é dividida ao todo em 20
abas. São elas:
33
1) Geral
2) CQ droga vegetal
3) CQ derivado
4) CQ fitoterápico
5) Usos populares tradicionais
6) Tóxico aguda
7) Tóxico subcrônica
8) Tóxico crônica
9) Genotoxicidade
10) Sensibilidade dérmica
11) Irritação cutânea
12) Irritação ocular
13) Toxicologia in vitro
14) Farmacologia in vitro
15) Farmacologia in vivo
16) Farmacologia ex vivo
17) Ensaios clínicos fase I
18) Ensaios clínicos fase II
19) Ensaios clínicos fase III
20) Ensaios clínicos fase IV
Este modelo procura reunir as informações necessárias para produção, controle de
qualidade e comprovação de segurança e eficácia/efetividade de fitoterápicos. Sendo
assim, todas as informações solicitadas no roteiro e não encontradas na literatura
científica consultada devem ser informadas, como N.D., de modo que se verifiquem
facilmente quais estudos ainda precisam ser realizados.
Ainda, para complementar a planilha, deve ser inserida na parte inicial, como primeira
aba, a planilha 2 da fase I, dando-se a ela o nome ‘’referências’’. Essa aba servirá de
monitoramento dos artigos trabalhados na fase 2 do projeto.
Orienta-se também a inclusão de hiperlinks nas planilhas para haver conecção das
informações apresentadas.
34
FASES 3 - Elaboração da versão preliminar das monografias para a(s) espécie(s)
vegetal(is), conforme roteiro padronizado
Como já informado previamente, essa parte consiste na elaboração e entrega de
uma versão preliminar da monografia da espécie vegetal selecionada. Deve-se seguir o
guia orientativo.
FASE 4 - Consulta Pública
Nesta fase, as monografias preliminares elaboradas serão avaliadas e validadas
por meio de consultas públicas, a fim de disponibiliza-las posteriormente para toda a
sociedade.
FASE 5 - Elaboração da versão final das monografias para a(s) espécie(s) vegetal(is),
conforme roteiro padronizado
As contribuições, sugestões e críticas obtidas por meio de consulta pública serão
avaliadas e deverão ser aceitas ou rejeitadas por meio de justificativa técnica. Assim, as
alterações necessárias na versão preliminar da monografia deverão ser realizadas nesta
etapa, finalizando a monografia.
5. CONTEÚDO/ORIENTAÇÕES GERAIS
5.1 Capítulo I – Identificação
5.1.1 Identificação da espécie vegetal
Consiste em informações de identificação da espécie, como a nomenclatura
botânica completa, sinonímias botânicas conhecidas, família, nomenclatura popular,
distribuição geográfica, foto da planta e, ainda, outras espécies do gênero nativas ou
exóticas adaptadas.
35
A) Nomenclatura botânica: Item importante na garantia da qualidade, considerando
que os nomes populares podem variar dependendo da região em que a espécie vegetal é
utilizada. Deve ser informada a nomenclatura botânica completa da espécie estudada
com o gênero, epíteto específico, descritor e variedades, atualizados de acordo com as
revisões mais recentes. (14) FBRAS
Para confirmação dos dados acima, deve-se utilizar o banco de dados Flora do Brasil
(http://floradobrasil.jbrj.gov.br/2012/), MOBOT (http://www.tropicos.org/). Em caso de
dúvida, especialistas nas famílias botânicas deverão ser consultados - (14) FBRAS
Informações com relação a atualizações na nomenclatura da espécie, quando houver,
também deverão ser apresentadas.
B) Família: Deve ser informada a família a que pertence a espécie estudada.
C) Sinonímia botânica: Todas as sinonímias botânicas encontradas nos sites sugeridos
e literatura pesquisada devem ser informadas, desde que tenham importância, seja pelo
amplo uso ou por constarem em monografias farmacopeicas (14).
Exemplo:
Conforme pesquisa realizada no site Flora do Brasil, o nome científico aceito e correto
para JUCÁ é Libidibia ferrea (Mart. ex Tul.) L. P. Queiroz e tem como sinônimo
relevante Caesalpinia ferrea Mart. ex Tul.
D) Nomenclatura popular: Devem ser informados todos os nomes populares pelos
quais a espécie é conhecida, se possível, o local onde esse nome é utilizado.
E) Distribuição geográfica: Deve ser informada a distribuição geográfica da espécie
vegetal. Essa informação é importante, em âmbito nacional, na medida em que deverão
ser selecionados prioritariamente medicamentos obtidos de espécies nativas ou exóticas
adaptadas. Essa medida se dá no sentido de diminuir a importação de matérias-primas e,
ao mesmo tempo, por favorecer a produção nacional.
36
F) Foto da planta: deve incluir uma foto da espécie vegetal, com referência a fonte da
mesma, para auxiliar na sua identificação.
G) Outras espécies do gênero nativas ou exóticas adaptadas: Devem ser dadas
informações sobre espécies correlatas, ou seja, diferentes espécies que sejam similares à
estudada. Deve-se informar a existência de outras espécies do gênero utilizadas
popularmente como sendo a mesma espécie e estudos sobre as mesmas que abarquem
essa informação, como, por exemplo, a Maytenus ilicifolia e a aquifolium, que são
usadas popularmente de forma indistinta, inclusive em alguns estudos científicos.
Essa é uma informação importante a ser buscada, pois a população utiliza
indistintamente diversas espécies vegetais conhecidas popularmente pelo mesmo nome,
porém, a legislação sanitária brasileira não permite essa variação, exigindo que todos os
estudos sejam apresentados para a espécie específica que vai ser utilizada na produção
do fitoterápico (16).
5.1.2 Identificação da droga vegetal
Deve descrever e/ou estabelecer a parte da planta utilizada como matéria-prima
na produção do fitoterápico e sua apresentação (inteira, dessecada, fresca, etc.), assim
como os teores percentuais para os marcadores químicos (substância ou grupo de
substâncias). Caso existam estudos de interesse sobre diferentes partes da mesma
espécie, estes também devem ser buscados.
Dados sobre espécies conhecidas como contaminantes da matéria-prima vegetal
de interesse devem ser informados, uma vez que são importantes no controle da
qualidade por auxiliarem na identificação de inconformidades e na rejeição de matériasprimas que não atendem às especificações.
Exemplo:
A droga vegetal é constituída dos folíolos dessecados contendo, no mínimo, 2,5% de
derivados hidroxiantracênicos expressos em senosídeo B, e 0,6% de senosídeo B
(C42H38O20; 862,74) e 0,5% de senosídeo A (C42H38O20; 862,74). Não deve ser utilizada
antes de um ano após a colheita (14).
37
5.2 Capítulo II – Informações botânicas
As informações botânicas estão presentes em monografias existentes na
Farmacopeia Brasileira (FB) (http://www.anvisa.gov.br/hotsite/farmacopeia/index.htm)
e nas farmacopeias internacionais reconhecidas, descritas na Resolução de Diretoria
Colegiada (RDC) 37/09, que são: Alemã, Americana e seu Formulário nacional,
Argentina, Britânica, Europeia, Francesa, Internacional, Japonesa, Mexicana e
Portuguesa. Além das descrições farmacopeicas, encontram-se artigos científicos das
espécies vegetais que devem ser citados nas monografias (14,15).
Devem ser incluídas as informações de:
Parte utilizada/órgão vegetal
Descrição macroscópica da parte da planta utilizada
Descrição microscópica da parte da planta utilizada
Informações sobre possíveis espécies vegetais similares que possam ser
utilizadas como adulterantes
5.3 Capítulo III – Informações sobre controle de qualidade, segurança e eficácia
Refere-se a informações sobre controle de qualidade, assim como todas as
possibilidades de comprovação de segurança e eficácia da espécie vegetal.
5.3.1 Controle de qualidade
A maioria dessas informações encontram-se descritas nas monografias da FB e
nas farmacopeias internacionais reconhecidas (15) (RDC 37/2009). As farmacopeias
internacionais reconhecidas devem ser consultadas sobre a presença de monografia para
a espécie vegetal, devendo ser descritos os testes e especificações, caso existam.
Considerando que a FB encontra-se disponível on line, esta deve ser obrigatoriamente
consultada (http://www.anvisa.gov.br/hotsite/farmacopeia/index.htm).
Além das metodologias farmacopeicas, diversos estudos científicos propõem
metodologias de controle de qualidade para espécies vegetais. Ainda que estas
metodologias apresentem validade científica, não são consideradas oficiais. Assim,
devem ser descritas em detalhes para que garantam uma reprodutibilidade do método
38
em questão. Todas as metodologias e especificações encontradas, em farmacopeias ou
artigos da literatura científica, devem ser citadas na monografia.
Na FB constam métodos gerais aplicados a formas farmacêuticas e monografias
de plantas medicinais específicas. Nos métodos gerais constam as metodologias para
realização de testes microbiológicos, determinação de metais pesados, com os
respectivos limites permitidos, além dos testes a serem exigidos para cada fórmula
farmacêutica.
Monografias específicas para espécies vegetais contêm metodologias para
determinação de caracteres organolépticos, testes de identificação, material estranho,
umidade, cinzas e testes de quantificação (16).
Informações sobre contaminantes como praguicidas, inseticidas e formicidas
devem ser fornecidas caso existam na literatura. No Brasil, praguicidas, inseticidas e
formicidas não têm sua utilização permitida em plantas medicinais. Assim, as
legislações exigem a avaliação desses contaminantes e a informação dos limites
permitidos deve estar disponível. Deve ser fornecida a informação de limites específicos
para a espécie, caso existam na literatura, ou, se não, limites inespecíficos estabelecidos
internacionalmente.
Grande auxílio nesse sentido pode ser obtido nos guias da Organização Mundial
da Saúde (OMS) sobre controle de qualidade que trazem metodologias e especificações
para alguns testes, principalmente para contaminantes. As mesmas podem ser obtidas
através dos seguintes links: Geral para todas as publicações de fitoterápicos:
http://apps.who.int/medicinedocs/en/cl/CL6.1.1.8.32/clmd,50.html#hlCL6_1_1_8_32;
Guia sobre contaminantes: http://apps.who.int/medicinedocs/en/m/abstract/Js14878e/.
Todas as informações devem ser coletadas para a espécie vegetal, esteja ela seca,
na forma de droga vegetal, ou fresca, para os derivados e para o produto final (o
fitoterápico), conforme determinam as normas para registro de medicamentos
fitoterápicos, ou seja, RDC 14/2010 (17). Para diferenciar essas etapas, têm-se os
exemplos:
Droga vegetal - caso o estudo se refira a uma metodologia de controle de folhas secas
de boldo.
Derivado vegetal – caso o estudo se refira a uma metodologia de controle de extrato de
boldo.
39
Produto final (fitoterápico) - estudos sobre formulações farmacêuticas prontas, como
xaropes, comprimidos.
Para essas três formas devem ser informadas, caso haja na literatura, os seguintes dados:
ESPÉCIE VEGETAL / DROGA VEGETAL
Granulometria
Caracteres organolépticos
Requisitos de pureza:
Perfil de contaminantes comuns (Materiais estranhos)
Cinzas
Umidade
Metal pesado
Resíduos químicos
Microbiológicos
Prospecção fitoquímica
Testes de identificação
Análise quantitativa (Testes de quantificação – componentes químicos e suas
concentrações) Descritos / Majoritários ou ativos*
*Devem ser fornecidas informações sobre os componentes químicos já descritos,
separando por grupo fitoquímico, incluindo os característicos da espécie e aqueles
considerados marcadores.
Para desenhar as estruturas químicas, pode-se utilizar o software ChemSketch 12.0
ou versão superior disponível em:
http://www.acdlabs.com/resources/freeware/chemsketch/ (é necessário registrar-se).
DERIVADO VEGETAL
Descrição
Métodos de obtenção
Caracteres organolépticos
Resíduo seco
pH
Extratos
fluidos
Teor alcóolico
Densidade
Umidade/perda por dessecação
Extratos secos
Solubilidade
Densidade aparente
Densidade
Óleos essenciais Índice de refração
Rotação óptica
Índice de acidez
Óleos fixos
Éster
Iodo
Testes de identificação
40
Testes de quantificação
Prospecção fitoquímica
Outras considerações relacionadas ao Controle de qualidade
Devem ser informados os métodos de obtenção do derivado de droga vegetal, ou
seja, o tipo de solvente utilizado, relação matéria-prima: derivado (quantidade de
matéria-prima utilizada para a obtenção dos extratos) e forma de extração, caso haja
esses dados na literatura.
Se for utilizado mais de um derivado da espécie vegetal, ou seja, um extrato
aquoso e outro etanólico da raiz, ou até mesmo dois extratos aquosos da mesma espécie
vegetal obtidos de partes diferentes da planta (um da raiz e outro das folhas, por
exemplo), os mesmos devem ser especificados como diferentes derivados vegetais.
Devem ser dadas as informações referentes aos principais derivados estudados na
literatura.
PRODUTO FINAL (FITOTERÁPICO)
Formas farmacêuticas
Testes específicos para cada forma farmacêutica
Devem ser informadas as metodologias e especificações dos testes para a(s)
forma(s) farmacêutica(s) específica(s) disponível na literatura (18) (RE nº 1/05).
Para toda a forma farmacêutica sólida, a empresa deve acrescentar as seguintes
informações ou justificativa técnica de ausência:
- Aparência (cor, odor, forma, tamanho e textura);
- Dissolução;
- Dureza.
Para as formas farmacêuticas líquidas e semi-sólidas, a empresa deve acrescentar
as seguintes informações ou justificativa técnica de ausência:
- Aparência;
- pH;
- Sedimentação pós-agitação em suspensões;
- Claridade em soluções;
- Separação de fase em emulsões e cremes;
41
- Perda de peso em produtos de base aquosa.
Segundo os testes descritos pela Farmacopeia Brasileira 5 ed., há ainda os
seguintes testes:
Para sólidos: dureza, desintegração, uniformidade de peso, dissolução, conteúdo de
água, friabilidade;
Para líquidos e semi-sólidos: viscosidade.
5.3.2 Segurança e eficácia
As informações sobre segurança e eficácia de medicamentos fitoterápicos podem ser
comprovadas por meio de:
Tradicionalidade do uso;
Ensaios pré-clínicos e clínicos;
Presença na lista de medicamentos fitoterápicos de registro simplificado
conforme IN 5/08 (17), ou sua atualização;
Sistema de pontuação conforme a IN 5/10 (18), ou sua atualização.
Recentemente, a Anvisa criou uma nova classe de fitoterápicos: os produtos
tradicionais fitoterápicos. Dessa forma, várias legislações aqui citadas estão em
processo de mudança e tendem a ser revogadas.
Hoje existem no Brasil duas principais categorias de fitoterápicos: os
medicamentos fitoterápicos e os produtos tradicionais fitoterápicos.
Para medicamentos fitoterápicos, as informações sobre segurança e eficácia
passarão a ser comprovadas por meio de ensaios não-clínicos e clínicos de segurança e
eficácia ou registro simplificado. Este último deverá ser comprovado por presença na
lista de medicamentos fitoterápicos de registro simplificado (a ser publicado pela
Anvisa) ou presença nas monografias de fitoterápicos de uso bem estabelecido da
Comunidade Europeia (EMA).
42
Para produtos tradicionais fitoterápicos, as informações de segurança e
efetividade passarão a ser comprovadas por meio da tradicionalidade do uso ou por
registro simplificado. Este último deverá ser comprovado por presença na lista de
produtos tradicionais fitoterápicos de registro simplificado (a ser publicado pela Anvisa)
ou presença nas monografias de fitoterápicos de uso tradicional da Comunidade
Europeia (EMA).
5.3.2.1 Usos populares/tradicionais
A possibilidade de comprovação de segurança e eficácia da espécie vegetal pelo uso
popular e/ou tradicional prevê a apresentação dos seguintes itens:
Ausência de grupos ou substâncias químicas tóxicas, ou presentes dentro de
limites comprovadamente seguros;
Comprovação de continuidade de uso seguro por período igual ou superior a 20
anos.
Comprovação de uso tradicional na padronização indicada, ou seja, a dosagem, a
via de administração recomendada e o método de preparação sejam semelhantes
àquela tradicionalmente utilizada;
Indicação de uso esporádico;
Indicação de uso isenta de prescrição médica;
Indicado para tratamento sintomático de doenças de baixa gravidade.
Não oferecer risco tóxico ao usuário na posologia recomendada.
Caso seja necessária alguma alteração no extrato, deve ser apresentada uma correlação,
química ou farmacológica, do perfil do produto obtido pelo uso tradicional e do extrato
que se quer registrar/renovar.
Se houver comprovação de segurança e eficácia da espécie vegetal pelo uso popular
e/ou tradicional, pode-se sugerir que a espécie vegetal seja incluída, caso ainda não
esteja presente, na lista de drogas vegetais notificadas (19). Nesse caso, deve-se
preencher o quadro 1 (anexo 4) extraído da RDC 10/10 (20), ou sua atualização.
43
5.3.2.2 Estudos pré-clínicos e clínicos
Devem ser preenchidas informações conforme modelo prevalente utilizado no
desenvolvimento de medicamentos, a partir de estudos pré-clínicos e clínicos.
As informações quanto aos testes realizados com os derivados das espécies e produtos
finais estão organizadas conforme as diferentes etapas de estudos exigidos pela
legislação (21,17,22,23,24):
Resolução Específica (RE) 90/04 (Guia de estudos pré-clínicos de medicamentos
fitoterápicos),
RDC 14/10 (registro de medicamentos fitoterápicos),
RDC 39/08 (Guia de Boas Práticas Clínicas)
Resolução 196/96 (Pesquisa clínica), e
Resolução 251/97 (Normas de pesquisa envolvendo seres humanos).
5.3.2.2.1 Ensaios pré-clínicos
Os ensaios pré-clínicos para fitoterápicos compreendem estudos farmacológicos
(farmacodinâmica e farmacocinética) e toxicológicos, realizados em animais de
laboratório. O objetivo dos estudos farmacológicos é mostrar a eficácia do fitoterápico.
Os estudos toxicológicos somente se justificam quando a efetividade é comprovada
(12).
Estudos de toxicologia pré-clínica
Atualmente, são exigidos ensaios de acordo com o guia de estudos não clínicos
(25), que é complementar a RE 90/04. Os estudos de toxicidade devem ser
conduzidos com amostras padronizadas do medicamento fitoterápico ou do
derivado vegetal a partir do qual é produzido, sendo exigidos os seguintes
estudos:
Medicamentos fitoterápicos de uso oral:
44
Toxicidade aguda
Toxicidade de doses repetidas (longa duração)
o Subcrônica
o Crônica
Genotoxicidade– realizado quando houver indicação de uso contínuo ou
prolongado do medicamento em humanos.
Medicamentos fitoterápicos de uso tópico:
Informar dados de toxicidade de dose única e doses repetidas, caso existam,
na via de administração proposta do produto. Além desses, os estudos de:
Sensibilização dérmica:
Irritação cutânea
Irritação ocular
Orientações sobre testes de farmacologia pré-clínica podem ser obtidas na RE
90/2004 (21) e, de forma complementar a este, no guia de estudos não clínicos
de segurança de medicamentos (25) publicado pela Anvisa que engloba todos os
medicamentos a serem registrados (o Guia não revogou a RE 90/04, sendo essa
prioritária para fitoterápicos). O Guia pode ser obtido por meio do link:
http://portal.anvisa.gov.br/wps/wcm/connect/820d0800419dc0279534bf8b4fca6
d11/GUIA+PARA+A+CONDU%C3%87%C3%83O+DE+ESTUDOS+N%C3%
83O+CL%C3%8DNICOS+DE+SEGURAN%C3%87A+NECESS%C3%81RIO
S+AO+DESENVOLVIMENTO+DE+MEDICAMENTOS.pdf?MOD=AJPERE
S
Estudos de Farmacologia pré-clínica
Devem ser informados os estudos de farmacologia pré-clínica realizados com a
espécie vegetal, separados em diferentes quadros, por tipo de teste realizado (por
exemplo, atividade antioxidante, antiinflamatória, broncodilatadora).
Estudos de farmacodinâmica
Busca-se evidenciar, através dos trabalhos, a comprovação do(s) efeito(s)
farmacológico(s), correlacionando o(s) efeito(s) com diferentes doses (relação
45
dose-efeito) e a um mecanismo de ação. Ao selecionar os trabalhos verificar se
há utilização controles/padrões nos testes (agonistas ou antagonistas bem
conhecidos). Caso não haja controles/padrões, esta informação deve ser inserida
na coluna “limitações do estudo”. Ex.: Não foram utilizados nos testes
experimentais os controles/padrões.
Estudos de farmacocinética
Devem ser buscadas informações sobre velocidade e intensidade de absorção,
distribuição, metabolização e excreção do produto.
5.3.2.2.2 Ensaios clínicos
Define-se como estudo clínico ‘’qualquer investigação em seres humanos,
objetivando verificar os efeitos farmacodinâmicos, farmacológicos, clínicos e/ou
outros efeitos de produto(s) e/ou identificar reações adversas ao produto(s) em
investigação, com o objetivo de averiguar sua segurança e/ou eficácia” (26).
Sendo assim, a finalidade de uma pesquisa clínica é avaliar determinada
intervenção em condição clínica específica (na espécie humana). Caso existam,
para a espécie vegetal, as informações são dadas por fase de estudo, I a IV,
incluindo informações sobre farmacocinética e farmacodinâmica, conforme
descrito anteriormente.
Com o objetivo de entender e ter condições de realizar análise crítica desses
estudos deverão ser estudadas, além da legislação, o guia da OMS para
condução de estudos clínicos de fitoterápicos (27), disponível por meio do link:
http://bvsms.saude.gov.br/bvs/publicacoes/fitoterapicos.pdf.
De forma simplificada, a ANVISA classifica os estudos clínicos como:
Fase I: Quando o estudo foi realizado com um número pequeno de voluntários
sadios, respondendo a questões de farmacologia, posologia e alterações no local
da aplicação, além de comprovação da toxicidade prevista em testes pré-clínicos.
46
Fase II: É o estudo terapêutico piloto. Também realizado com um número
reduzido, porém com pacientes em tratamento de curta duração, visando
estabelecer a segurança a curto prazo de uso e a efetividade do produto.
Fase III: É o estudo terapêutico ampliado. Quando o estudo é realizado em larga
escala com diferentes populações de pacientes e em tratamentos mais
prolongados, visando estabelecer o perfil terapêutico e respondendo a questões
de segurança a longo prazo do produto.
Fase IV: São pesquisas realizadas após o início da comercialização do produto.
São estudos cruzados e duplo-cegos, realizados com um grande número de
pacientes, comparando o produto em teste com placebo e controle positivo.
Para facilitar a sistematização das informações, foram elaborados quadros para o
preenchimento das informações referentes ao uso popular/tradicional (anexo 4),
Toxicologia pré-clínica (anexo 5), Farmacologia pré-clínica (anexo 6) e Ensaios clínicos
(anexo 7). Sendo assim, após análise dos artigos, o autor deverá preencher as
informações obtidas de acordo conforme orientações abaixo:
Referência: deve-se informar o documento consultado (Ex: Beltrano et al., 2012).
Parte da planta utilizada: planta medicinal, ou suas partes, que contenham as
substâncias, ou classes de substâncias, responsáveis pela ação terapêutica.
Tipo e padronização do extrato: informar o tipo de extrato, por exemplo, fluido, mole
ou seco; o tipo de solvente utilizado; se foi avaliado com relação à sua padronização em
marcadores ou se foi avaliada a composição fitoquímica que possa auxiliar em sua
reprodução e avaliação.
Atividade: Item necessário ser apresentado para os estudos de farmacologia (in vitro, in
vivo e ex vivo), onde deverá constar para qual atividade farmacológica foi voltado o
estudo. Ex: atividade anti-inflamatória.
47
Tipo e padronização da forma farmacêutica: informar a forma farmacêutica do
produto administrado (comprimidos, cápsulas, pomada, gel, xarope, etc) e a
concentração da forma farmacêutica (Ex: pomada com 250 mg de extrato seco de XX).
Posologia: deve ser informada a via de administração, dose e frequência de
administração.
Metodologia: nesse item deve ser descrito o tipo de pesquisa (Ex: duplo cego,
randomizado; observacional, transversal, descritivo); o modelo (se in vitro, ex vivo ou in
vivo); o método utilizado (Ex: método de difusão em Agar Muller Hinton); os animais
utilizados (espécie animal e quantidade); o tratamento dos dados. Enfim, é a explicação
do estudo desenvolvido.
Amostras/ Participantes: relatar o grupo utilizado para o estudo (espécie animal ou
população de referência), a idade do grupo e a quantidade por sexo. Ex: 60
camundongos (30 machos e 30 fêmeas).
Resultados: devem constar nesse item os parâmetros observados, o período de
observação e o que foi observado (efeitos/consequências obtidos com a aplicação da
metodologia).
Limitações do estudo: nesse item, deve-se descrever se houve limitações ao estudo.
Ex: não houve a descrição das condições de armazenamento do produto durante o
período de ensaio; não houve avaliação de um grupo controle.
O objetivo de utilizar quadros é facilitar a visualização das principais informações sobre
a planta medicinal e, portanto, devem ser inseridos os dados importantes de forma
resumida.
Ao final de cada quadro, deverá ser descrita uma conclusão geral daquela fase de estudo
para a espécie.
Ex.: Estudos de toxicidade aguda, incluindo DL50
48
Três estudos de toxicologia pré-clínica aguda foram encontrados na literatura
pesquisada. Dois foram realizados com abafados liofilizados utilizando tanto M.
officinalis como M. aquifolium e um com extrato liofilizado do qual não são
dadas maiores informações, por ser objeto de patente de uma indústria
farmacêutica. Os estudos apontam aparente atoxicidade do extrato, mesmo em
doses bem mais altas do que as utilizadas pelo homem. Os dois primeiros
estudos testaram doses progressivas a partir da usualmente utilizada pelo
homem, tentando a extração mais próxima possível da usual.
Realizando-se uma análise crítica desses estudos avaliados, pode-se constatar
que o único que se refere apenas à utilização de extratos de M. officinalis não
informa maiores detalhes da obtenção do extrato, não sendo possível avaliá-lo
em detalhes. Assim, não se conseguiu nesse levantamento uma boa informação
específica sobre toxicidade aguda de M. officinalis, embora em associação com
M. aquifolium, não se observou sinais de toxicidade (16).
5.3.3 Revisões
As informações obtidas a partir de revisões sistemáticas ou de revisões de qualquer
abordagem científica da planta medicinal deverão ser apresentadas no item em que se
julgar mais específico para tal. Caso não haja tal especificidade, o mesmo deverá ser
apresentado no capítulo V ‘’Informações Gerais’’.
5.4 Capítulo IV – Resumo das ações e indicações por derivado de droga estudado
Após a avaliação dos estudos, devem ser inseridas as informações abaixo, caso existam.
1. Vias de administração
2. Dose diária
3. Posologia (dose e intervalo)
4. Período de utilização
5. Contra indicações
6. Grupos de risco
49
7. Precauções de uso
8. Efeitos adversos relatados
9. Interações medicamentosas
i) Descritas
ii) Potenciais
10. Informações de superdosagem
11. Descrição do quadro clínico
12. Ações a serem tomadas
Essas informações são importantes para o uso do fitoterápico, devendo constar na bula
do produto, determinada pela RDC 47/09 (28), ou do folheto informativo da droga
vegetal, descrito na RDC 10/10 (20).
Com base na análise dos dados obtidos e havendo comprovação de segurança e eficácia
por meio de estudos pré-clínicos e clínicos pode-se sugerir que a espécie vegetal seja
incluída, caso já não esteja presente, na lista de espécies vegetais de registro
simplificado.
Os dados apresentados nos estudos devem referir-se à padronização recomendada.
Nesse caso, deve-se preencher o quadro abaixo extraído da IN 5/08 (15).
Nomenclatura botânica
Nome popular
Parte usada
Padronização/Marcador
Derivado de droga vegetal
Indicações/Ações terapêuticas
Dose Diária (somente para produtos de uso
oral/interno)
Concentração da forma farmacêutica (somente
para produtos de uso tópico)
Via de Administração
Restrição de uso
5.5 Capítulo V – Informações gerais
Outras informações relevantes como as citadas abaixo, caso sejam encontradas na
literatura, devem ser relatadas nessa parte.
50
Formas farmacêuticas/formulações e descritas na literatura.
Informar as formas farmacêuticas/formulações descritas na literatura.
Produtos registrados na Anvisa e outras agências reguladoras
Informar a situação regulatória da espécie vegetal nos diferentes países e se há liberação
para uso (registro) na Anvisa e outras agências reguladoras.
Informações sobre registro de medicamentos fitoterápicos no Brasil podem ser obtidas
no
sítio
eletrônico
da
Anvisa,
por
meio
do
link:
http://www7.anvisa.gov.br/datavisa/consulta_produto/Medicamentos/frmConsultaMedi
camentos.asp. Podem ser acessados os dados: nome comercial do produto; do princípio
ativo (no caso de plantas medicinais, a nomenclatura botânica); CNPJ da empresa;
número de registro do medicamento procurado; ou o número do seu processo de registro
na Anvisa.
O número de produtos registrados no Brasil para a mesma espécie é um requisito
importante na avaliação de quais espécies prioritariamente devem receber
financiamento público de compra, de modo que sejam selecionadas espécies que
possuam fitoterápicos registrados por mais de uma empresa.
Informações de embalagem, rotulagem e armazenamento:
Relatar se o fitoterápico precisa de condições especiais de armazenamento e transporte,
como, por exemplo, se deve ser mantido protegido da luz, ou ainda em condições
controladas de temperatura, e informações importantes que devem constar da rotulagem
alegando ou informando alguma particularidade do produto.
Monografias em compêndios oficiais/ não oficiais:
Devem ser relatadas nesse item, tanto monografias farmacopeicas de controle da
qualidade, quanto monografias que abordem informações sobre segurança e eficácia de
fitoterápicos. Exemplos de livro que podem ser avaliados para preencher esse item são
os presentes na IN 5/10. Monografias da Comunidade Europeia podem ser obtidas no
site:
http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/landing/herbal_search.j
51
sp&murl=menus/medicines/medicines.jsp&mid=WC0b01ac058001fa1d. As do Health
Canadá
por
meio
do
link:
http://webprod.hc-sc.gc.ca/nhpid-
bdipsn/monosReq.do?lang=eng
Patentes solicitadas para a espécie vegetal, derivado vegetal ou fitoterápico:
Informar, casos existam, patentes relacionadas à espécie vegetal, derivado vegetal ou
fitoterápico.
As buscas de depósito de pedidos de patentes devem ser feitas nas bases de dados online
dos escritórios, no âmbito:
Nacional:
Instituto
Nacional
de
Propriedade
Industrial
(INPI):
http://pesquisa.inpi.gov.br/MarcaPatente/jsp/servimg/servimg.jsp?BasePesquisa
=Patentes
Internacional, nos principais escritórios de patentes, como:
World
international
property
organization:
http://www.wipo.int/portal/index.html.en
European patent Office: http://www.epo.org/
Japan patent information organization: http://www.japio.or.jp/english/
Diversos
Devem ser inseridas informações que julgar importante tais como curiosidades a
respeito da espécie vegetal.
5.6 Considerações finais
Todas as normas de fitoterápicos citadas nesse documento podem ser obtidas no
Consolidado de Normas da COFID:
http://portal.anvisa.gov.br/wps/portal/anvisa/home/medicamentos?cat=Medicamentos+f
itoterapicos&cat1=com.ibm.workplace.wcm.api.WCM_Category%2FMedicamentos+fit
oterapicos%2F688d6f804f6be547af47bfc894994279%2FPUBLISHED&con=com.ibm.
workplace.wcm.api.WCM_Content%2FMedicamentos+fitoterapicos%2F47930180402c
a29db76fb754e035b7cb%2FPUBLISHED&showForm=no&siteArea=Medicamentos&
WCM_GLOBAL_CONTEXT=/wps/wcm/connect/anvisa/Anvisa/Inicio/Medicamentos/
Publicacao+Medicamentos/Medicamentos+fitoterapicos
52
5.7 Referências
São todos os documentos lidos e citados no texto dos estudos orientados
(monografias), assim como outras fontes citadas (vídeo, áudio, internet, etc).
As referências devem ser numeradas e no texto figurar o número correspondente.
Deverão ser apresentadas em Estilo Vancouver.
6. REDAÇÃO E LINGUAGEM DOS TEXTOS
Os textos a serem apresentados devem ter caráter objetivo e impessoal (redigidos em
terceira pessoa). Dessa forma, o texto deve neutralizar a presença do enunciador,
abolindo o emprego de verbos em primeira pessoa (e.g. suponho, achamos). Os
resultados das observações e experiências devem ser expostos no passado, e as
generalidades ou as referências, expostas no presente.
Use adequadamente os termos técnicos e não abuse da linguagem técnica a ponto de
tornar seu texto confuso.
As citações de todas as documentações que servem de base para a pesquisa, assim como
ideias e sugestões alheias inseridas no texto devem ser expressamente indicadas e
documentadas no corpo do trabalho.
Citação Direta
Transcrição textual de parte da obra do autor consultado. Indicar a data e a página.
Ex.: "Deve-se indicar sempre, com método e precisão, toda documentação que serve de
base para a pesquisa, assim como ideias e sugestões alheias inseridas no trabalho."
(CERVO; BERVIAN, 1978, p. 97).
Citação Indireta
53
Texto baseado na obra do autor consultado, consistindo em transcrição não textual da(s)
idéia(s) do autor consultado. Indicar apenas a data, não havendo necessidade de
indicação da página.
Ex.: Barras (1979) ressalta que, apesar da importância da arte de escrever para a ciência,
inúmeros cientistas não têm recebido treinamento neste sentido.
Citação de Citação
Transcrição direta ou indireta de um texto em que não se teve acesso ao original, ou
seja, retirada de fonte citada pelo autor da obra consultada.
Indicar o autor da citação, seguido da data da obra original, a expressão latina "apud", o
nome do autor consultado, a data da obra consultada e a página onde consta a citação.
Ex.:
"0 homem é precisamente o que ainda não é. O homem não se define pelo que é, mas
pelo que deseja ser." (ORTEGA Y GASSET, 1963, apud SALVADOR, 1977, p. 160).
Segundo Silva (1983 apud ABREU, 1999, p. 3) diz ser [ . . . ]
APRESENTAÇÃO GRÁFICA
Configurações
Papel: formato A4 (21,0 cm x 29,7 cm), branco.
Margens: superior – 3 cm, inferior – 2 cm, esquerda – 3 cm e direita – 2 cm.
Orientação: retrato
Fonte: Times New Roman, tamanho 12 para o texto e 10 para citações longas e notas de
rodapé.
Parágrafo
Alinhamento: Justificado
Nível de tópico: corpo de texto
Recuo: Nenhum
Espaçamento antes e após as linhas: 6
Espaçamento entrelinhas: 1,5
54
OBS.:
1) As citações longas, notas de rodapé, referências e os resumos em vernáculo e em
língua estrangeira deverão ser digitados em espaço simples e centralizado.
2) O título em negrito deve ser separado do texto que o precede, ou que o sucede, por
uma entrelinha dupla.
Paginação
Todas as folhas do trabalho, a partir da folha de rosto, devem ser contadas, mas não
numeradas. A numeração deverá ser colocada a partir da primeira folha da parte textual
em algarismos arábicos, no canto superior direito da folha, a 2 cm da borda superior. Os
apêndices e anexos devem ter suas folhas numeradas de maneira contínua, seguindo a
paginação do texto principal (conforme as normas da ABNT).
Indicativos de Seção
O indicativo numérico de uma seção precede o título do mesmo, devendo estes serem
alinhados à esquerda e separados um espaço de caractere.
Títulos sem indicativo numérico
Não devem ser apresentados títulos precedidos de indicativo numérico nos seguintes
casos: lista de ilustração, lista tabelas, lista de abreviaturas e siglas, resumos, sumário,
referências, bibliografia, apêndice(s) e anexo(s). Os títulos, em letra maiúscula, devem
ser centralizados e, juntamente com o texto, deve ser apresentado em uma nova folha.
Abreviaturas e siglas
Quando aparece a primeira vez no texto, deve-se colocar todo o nome por extenso e a
abreviatura/ sigla entre parênteses. Posteriormente, utiliza-se apenas a abreviatura/ sigla.
55
Orientações gerais
Os textos devem ser construídos a partir de informações atuais, isentas e cientificamente
fidedignas, provenientes de estudos de grande porte e adequada metodologia, nacionais
e internacionais.
Deverão ser identificadas palavras para compor o índice remissivo. Também, deverá ser
colocado o nome dos autores ao final de cada texto.
56
REFERÊNCIAS
1.
BRASIL. Ministério da Saúde. Portaria 971, de 03 de maio de 2006. Aprova a
Política Nacional de Práticas Integrativas e Complementares no SUS. 2006.
2.
______. Presidência da República. Decreto 5.813, de 22 de junho de 2006; Aprova
a Política Nacional de Plantas Medicinais e Fitoterápicos e dá outras providências.
2006.
3.
______. Portaria interministerial 2.960, de 09 de dezembro de 2008. Aprova o
Programa Nacional de Plantas Medicinais e Fitoterápicos e cria o Comitê Nacional de
Plantas Medicinais e Fitoterápicos. 2008.
4.
Forte, SHAC. Manual de elaboração de tese, dissertação e monografia Fortaleza:
Universidade
de
Fortaleza,
2004.
49p.
Disponível
em:
http://www.servcor.com/npg/NORMAS_Manual_de_elaboracao_de_tese_e_monografi
a.pdf
5.
Nações Unidas. Convenção sobre Diversidade Biológica. Artigo 2, utilização de
termos. 1992.
6.
Beringhs AO, Souza FM, Campos AM, Ferraz HG, Sonaglio, D. Technological
development of Cecropia glaziovi extract pellets by extrusion-spheronization. Revista
Brasileira de Farmacognosia 23(1): 160-168, 2013.
7.
Diegues, 1996 apud: HAVERROTH, M. Etnobotânica: uma revisão teórica. NESSI
– UFSC. Antropologia em Primeira Mão n. 22, 2011.
8.
Elisabetsky E. Etnofarmacologia. Cienc. Cult. [online]. 2003, vol.55, n.3, pp. 35-
36.
9.
Simões CMO, Schenkel EP, Gosmann G, de Mello JCP, Mentz LA, Petrovick PR.
Farmacognosia: da planta ao medicamento. 2. ed. 2000.
10. Goulart LHSD.
Dicionário do Agrônomo. Editora Rigel, 1991 apud:
http://www.suapesquisa.com/o_que_e/agronomia.htm
11. Cardoso, CMZ. Manual de Controle de Qualidade de matérias-primas vegetais para
farmácia magistral. Pharmabooks. São Paulo, SP, 2009.
12. Hardman JG, Limbird LE, Gilman AG. Goodman & Gilman's: As bases
farmacológicas da Terapêutica. 10. ed. 2001.
13. Oga S, Camargo MMA, Batistuzzo JAO. Fundamentos de toxicologia. 3. ed. 2008.
57
14. BRASIL. Farmacopeia Brasileira. Brasília: Ministério da Saúde. Agência Nacional
de Vigilância Sanitária; 2009 [acesso em 17 dez. 2012]. Disponível em:
http://www.anvisa.gov.br/hotsite/cd_farmacopeia/pdf/volume2.pdf
15. ______. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. IN 05 de
11 de dezembro de 2008. Trata da admissibilidade das Farmacopeias estrangeiras. 2008.
16. Carvalho ACB. Plantas medicinais e fitoterápicos: regulamentação sanitária e
proposta de modelo de monografia para espécies vegetais oficializadas no Brasil. Tese.
Brasília
(DF):
Universidade
de
Brasília;
2011.
Disponível
em:
http://repositorio.bce.unb.br/bitstream/10482/8720/1/2011_AnaCec%C3%ADliaBezerra
Carvalho.pdf
17. BRASIL. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. RDC 14
de 31 de março de 2010. Dispõe sobre o registro de medicamentos fitoterápicos. 2010.
18. ______.______.______. RE 01 de 29 de julho de 2005. Determina guia para a
realização de estudos de estabilidade. 2005.
19. ______. ______. ______. RDC 37 de 06 de julho de 2009. Dispõe sobre a
notificação de drogas vegetais junto à Agência Nacional de Vigilância Sanitária
(ANVISA) e dá outras providências. 2009.
20. ______. ______. ______. RDC 10 de 09 de março de 2010. Dispõe sobre a
notificação de drogas vegetais junto à Agência Nacional de Vigilância Sanitária
(ANVISA) e dá outras providências. 2010.
21. ______. ______. ______. RE 90 de 16 de março de 2004. Dispõe sobre o "Guia
para a realização de estudos de toxicidade pré-clínica de fitoterápicos”. 2004.
22. ______. ______. ______. RDC 39 de 05 de junho de 2008. Aprova o regulamento
para a realização de pesquisa clínica. 2008.
23. ______.______. Resolução 196 de 10 de outubro de 1996. Dispõe sobre Diretrizes
e Normas Regulamentadoras da Pesquisa envolvendo seres humanos. 1996.
24. ______. ______. Conselho Nacional de Saúde. Resolução 251 de 07 de agosto de
1997. Aprova normas de pesquisa envolvendo seres humanos para a área temática de
pesquisa com novos fármacos, medicamentos, vacinas e testes diagnósticos. 1997.
25. ______. Agência Nacional de Vigilância Sanitária (ANVISA). Guia para a
condução de estudos não clínicos de segurança necessários ao desenvolvimento de
medicamentos. 2010. 37p.
58
26. EUROPEAN MEDICINES AGENCY (EMEA), 1997 apud: Agência Nacional de
Vigilância Sanitária (ANVISA). Considerações e definições para Pesquisa Clínica.
Disponível em: http://anvisa.gov.br/medicamentos/pesquisa/def.htm
27. Organização Mundial da Saúde. Instruções operacionais: informações necessárias
para a condução de ensaios clínicos com Fitoterápicos. Brasília, DF, 2008.
28. BRASIL. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. RDC 47
de 08 de setembro de 2009. Estabelece regras para elaboração, harmonização,
atualização, publicação e disponibilização de bulas de medicamentos para pacientes e
para profissionais de saúde. 2009.
29. ______. ______. ______. Resolução RDC nº 14, de 31 de março de 2010. Dispõe
sobre o registro de medicamentos fitoterápicos. Diário Oficial da União, Poder
Executivo, Brasília, DF, 5 abr. 2010. Seção 1, p. 85. 2010b.
30. ______. ______. Agência Nacional de Vigilância Sanitária (Anvisa). Resolução
RDC nº 13, de 13 de março de 2013. Dispõe sobre as boas práticas de fabricação de
produtos tradicionais fitoterápicos. Diário Oficial da União, Brasília, DF, 15 mar.
2013. Seção 1, p. 50. 2013a.
31. ______. ______. Portaria nº. 1.555, de 30 de julho de 2013. Dispõe sobre as normas
de financiamento e de execução do Componente Básico da Assistência Farmacêutica no
âmbito do Sistema Único de Saúde. Diário Oficial da União, Brasília, DF, 31 jul.
2013. Seção 1, p. 71. 2013c.
59
GLOSSÁRIO
contaminação: a introdução não desejada de impurezas de natureza química ou
microbiológica, ou de matéria estranha, em matéria-prima, produto intermediário e/ou
produto terminado durante as etapas de amostragem, produção, embalagem ou
reembalagem, armazenamento ou transporte (RDC 17/10);
critério de aceitação: critério que estabelece os limites de aceitação de
especificações de matérias-primas, produtos ou processos/sistemas (RDC 17/10);
derivado vegetal: produto da extração da planta medicinal in natura ou da droga
vegetal, podendo ocorrer na forma de extrato, tintura, alcoolatura, óleo fixo e volátil,
cera, exsudato e outros (RDC 14/10);
desvio de qualidade: afastamento dos parâmetros de qualidade estabelecidos para
um produto ou processo (RDC 17/10);
droga vegetal notificada: drogas vegetais na forma final de comercialização ao
consumidor, notificadas na Anvisa e reguladas conforme o uso tradicional;
droga vegetal: planta medicinal, ou suas partes, que contenham as substâncias, ou
classes de substâncias, responsáveis pela ação terapêutica, após processos de coleta,
estabilização, quando aplicável, e secagem, podendo estar na forma íntegra, rasurada,
triturada ou pulverizada (RDC 14/10);
espécie: Gênero + epíteto específico (RDC 14/10);
especificação: documento que descreve em detalhes os requisitos que os materiais
utilizados durante a fabricação, produtos intermediários ou produtos terminados devem
cumprir. As especificações servem como base para a avaliação da qualidade (RDC
17/10);
excipiente: substância adicionada ao medicamento com a finalidade de prevenir
alterações, corrigir e/ou melhorar as características organolépticas, biofarmacotécnicas e
tecnológicas do medicamento (RDC 14/10);
fitoterápico: produto obtido de planta medicinal, ou de seus derivados, exceto
substâncias isoladas, com finalidade profilática, curativa ou paliativa (Brasil, 2009).
fitoterápico manipulado: preparação magistral e oficinal de fitoterápico em
farmácia de manipulação e em Farmácia Viva (Portaria 1.555/13).
marcador: composto ou classe de compostos químicos (ex: alcalóides, flavonóides,
ácidos graxos etc.) presentes na matéria-prima vegetal, preferencialmente tendo
correlação com o efeito terapêutico, que é utilizado como referência no controle de
60
qualidade da matéria-prima vegetal e dos medicamentos fitoterápicos (RDC 14/10 e
RDC 17/10);
matéria-prima vegetal: compreende a planta medicinal, a droga vegetal ou o
derivado vegetal (RDC 14/10);
matéria-prima: qualquer substância, seja ela ativa ou inativa, com especificação
definida, utilizada na produção de medicamentos. Exclui-se dessa definição os materiais
de embalagem (RDC 17/10);
medicamento
fitoterápico:
todo
medicamento
obtido
empregando-se
exclusivamente matérias-primas ativas vegetais. É caracterizado pelo conhecimento da
eficácia e dos riscos de seu uso, assim como pela reprodutibilidade e constância de sua
qualidade (adaptado da RDC 14/10).
medicamento: produto farmacêutico, tecnicamente obtido ou elaborado, com
finalidade profilática, curativa, paliativa ou para fins de diagnóstico (RDC 17/10);
nomenclatura botânica completa: espécie, autor do binômio, variedade, quando
aplicável, e família (RDC 14/10);
perfil cromatográfico: padrão cromatográfico de constituintes característicos,
obtido em condições definidas, que possibilite a identificação da espécie vegetal em
estudo e a diferenciação de outras espécies (RDC 14/10);
planta medicinal: espécie vegetal, cultivada ou não, utilizada com propósitos
terapêuticos (RDC 10/10 e RDC 14/10));
produto tradicional fitoterápico: aquele obtido com emprego exclusivo de
matérias-primas ativas vegetais, cuja segurança seja baseada por meio da
tradicionalidade de uso e que seja caracterizado pela reprodutibilidade e constância de
sua qualidade (RDC 13/13)
prospecção fitoquímica: testes de triagem, qualitativos ou semi quantitativos, que
utilizam reagentes de detecção específicos para evidenciar a presença de grupos
funcionais característicos na matéria-prima vegetal e que auxiliam na identificação da
espécie vegetal e a diferenciação de outras espécies (RDC 14/10);
relação "droga vegetal: derivado vegetal": expressão que define a relação entre
uma quantidade de droga vegetal e a respectiva quantidade de derivado vegetal obtida.
O valor é dado como um primeiro número fixo ou na forma de um intervalo,
correspondente à quantidade de droga utilizada, seguido de dois pontos (:) e, depois
desses, o número correspondente à quantidade obtida de derivado vegetal (RDC 14/10).
61
ANEXOS
ANEXO 1 – Relação Nacional de Plantas de Interesse ao SUS
ANEXO 2 – Planilha 1, referente a estratégias de busca a serem apresentadas para cada
espécie vegetal (modelo exemplificativo)
ANEXO 3 – Planilha 2, referente a resumos selecionados
ANEXO 4 - Quadro 1, referente a informações de uso popular
ANEXO 5 - Quadro 2, referente a informações sobre toxicologia pré-clínica
ANEXO 6 - Quadro 3, referente a informações sobre farmacologia pré-clínica
ANEXO 7 - Quadro 4, referente a informações sobre ensaios clínicos
62
ANEXO 1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
RENISUS – Relação Nacional de Plantas Medicinais de Interesse ao SUS
Achillea millefolium
37 Lippia sidoides
Allium sativum
38 Malva sylvestris
Aloe spp* (A. vera ou A. barbadensis)
39 Maytenus spp* (M. aquifolium ou M. ilicifolia)
Alpinia spp* (A. zerumbet ou A. speciosa)
40 Mentha pulegium
Anacardium occidentale
41 Mentha spp* (M. crispa, M. piperita ou M. villosa)
Ananas comosus
42 Mikania spp* (M. glomerata ou M. laevigata)
Apuleia ferrea = Caesalpinia ferrea *
43 Momordica charantia
Arrabidaea chica
44 Morus sp*
Artemisia absinthium
45 Ocimum gratissimum
Baccharis trimera
46 Orbignya speciosa
Bauhinia spp* (B. affinis, B. forficata ou B.
47 Passiflora spp* (P. alata, P. edulis ou P. incarnata)
variegata)
Bidens pilosa
48 Persea spp* (P. gratissima ou P. americana)
Calendula officinalis
49 Petroselinum sativum
Phyllanthus spp* (P. amarus, P.niruri, P. tenellus e
Carapa guianensis
50
P. urinaria)
Casearia sylvestris
51 Plantago major
Chamomilla recutita = Matricaria chamomilla =
52 Plectranthus barbatus = Coleus barbatus
Matricaria recutita
Chenopodium ambrosioides
53 Polygonum spp* (P. acre ou P. hydropiperoides)
Copaifera spp*
54 Portulaca pilosa
Cordia spp* (C. curassavica ou C. verbenacea)*
55 Psidium guajava
Costus spp* (C. scaber ou C. spicatus)
56 Punica granatum
Croton spp (C. cajucara ou C. zehntneri)
57 Rhamnus purshiana
Curcuma longa
58 Ruta graveolens
Cynara scolymus
59 Salix alba
Dalbergia subcymosa
60 Schinus terebinthifolius = Schinus aroeira
Eleutherine plicata
61 Solanum paniculatum
Equisetum arvense
62 Solidago microglossa
Stryphnodendron adstringens = Stryphnodendron
Erythrina mulungu
63
barbatimam
Eucalyptus globulus
64 Syzygium spp* (S. jambolanum ou S. cumini)
Eugenia uniflora ou Myrtus brasiliana*
65 Tabebuia avellanedeae
Foeniculum vulgare
66 Tagetes minuta
Glycine max
67 Trifolium pratense
Harpagophytum procumbens
68 Uncaria tomentosa
Jatropha gossypiifolia
69 Vernonia condensata
Justicia pectoralis
70 Vernonia spp* (V. ruficoma ou V. polyanthes)
Kalanchoe pinnata = Bryophyllum calycinum*
71 Zingiber officinale
Lamium álbum
* definir a(s) espécie(s) com cultivo, estudos e indicação de uso
63
ANEXO 2
Planilha 1 – Estratégias de busca a serem apresentadas para cada espécie vegetal (modelo exemplificativo).
Achillea millefolium
Base de
dados
(1)
Termos (2)
LILACS(port)
(Millefolium) or (Achillea millefolium) or (Ex
HP4.018.499.625)
Lilacs
LILACS(Ingl)
("Achillea"[Mesh]) OR (Achillea) OR (Yarrow) OR
(Achillea millefolium)
From 1 [(Millefolium or Achillea millefolium or
Achillea or Yarrow or Achillea millefolium).mp.
IPA
[mp=title, subject heading word, registry word, abstract,
trade name/generic name]] keep 1-129
TOTAL
Resultados (3)
Resumos
selecionados
(4)
11
8
15
8
129
125
155
141
Na primeira coluna, deve ser inserida a base de dados na qual foi feita determinada pesquisa. Cada linha se destina a uma base de dados.
Na segunda coluna, devem ser inseridos os termos ou descritores utilizados para a busca das referências para a referida base de dados.
Na terceira coluna, deve ser inserido o número total de referências encontradas para a referida espécie vegetal, usando-se aqueles descritores.
Na quarta coluna, deverá ser inserido o número de referências selecionadas, dentro do resultado total de referências, de acordo com critérios de
seleção e exclusão pré-definidos.
64
ANEXO 3
Planilha 2 – Resumos selecionados.
Resumos selecionados
Ordem
(1)
Título do trabalho
(2)
Autor(es)
(3)
Revista (4)
Ano de
publicação
(5)
Área (6)
Artigo
disponível
(Sim ou não)
(7)
Deverá ser preenchida corretamente, evitando mesclagem de células como forma de possibilitar a aplicação de filtros.
1 - Inserir a ordem sequencial;
2 - Inserir o título do trabalho;
3 – Inserir o(s) autor(es) do trabalho;
4 – Inserir o título da revista onde o trabalho foi publicado;
5 - Inserir o ano de publicação do artigo;
6 - Inserir a área de aplicação a que se refere o resumo;
7 – Informar a disponibilidade do artigo (sim ou não).
65
ANEXO 4
Quadro 1 – Informações referentes ao uso popular.
Nomenclat
ura
botânica
Nomenclat
ura popular
Parte
utilizada
Forma de
utilização
Posolo
gia
Modo
de usar
Via de
administração
Uso (A=
adulto, I=
infantil)
Alegações
*
Contraindicações
Efeitos
adversos
Informações
adicionais em
embalagem
Referência
s
*As alegações deverão completar a frase: Usado tradicionalmente no tratamento sintomático de ...
66
ANEXO 5
Quadro 2 – Informações sobre toxicologia pré-clínica.
Ref.
Parte
da
planta
Tipo/Padr
onização
do extrato
Tipo/
Padroniza
ção da
forma
farmacêuti
ca
Posologia
Via
Dose
Frequência
Metodologia
Amostra
Espécie
animal
Machos
Fêmeas
Resultados
Idade
Parâmetros
observados
Período de
observação
Limitações
do estudo
Observado
67
ANEXO 6
Quadro 3 – Informações sobre farmacologia pré-clínica.
Ref
.
Ativida
de
Parte
da
planta
Tipo/Pad
ronizaçã
o do
extrato
Tipo/
Padronizaçã
o da forma
farmacêutic
a
Posologia
Via
Dose
Frequênci
a
Metodologia
Amostra
Espécie
animal
Macho
s
Fêmeas
Resultados
Idade
Parâmet
ros
observad
os
Períod
o de
observ
ação
Limitações
do estudo
Observado
68
ANEXO 7
Quadro 4 – Informações referentes a ensaios clínicos.
Ref
.
Parte
da
planta
Tipo/
Padronização
do extrato
Tipo/
Padronização
da forma
farmacêutica
Intervenção:
Intervenção:
Controle:
Controle:
Posologia
Metodologi
a
via
dose
frequência
Interven
ção:
Controle
:
Intervenção
:
Controle:
Intervenção
:
Controle:
Participantes
Aleatorizaçã
o
Quantidad
e
Resultados
Parâmetro
s
observados
Período de
observaçã
o
Limitaçõ
es do
estudo
Observado
OBS.: É importante que sejam mantidas as planilhas em excel e que estas sejam preenchidas corretamente, evitando mesclagem de células, a fim
de possibilitar a aplicação de filtros.
69