Estrutura Atômica
meia-vida de 8 dias) no tratamento de câncer da tireoide.
Para realização de imagens da tireoide, por outro lado, o
123
53 Ι
Parte I
é frequentemente empregado. Com base nessas
informações, analise as proposições a seguir.
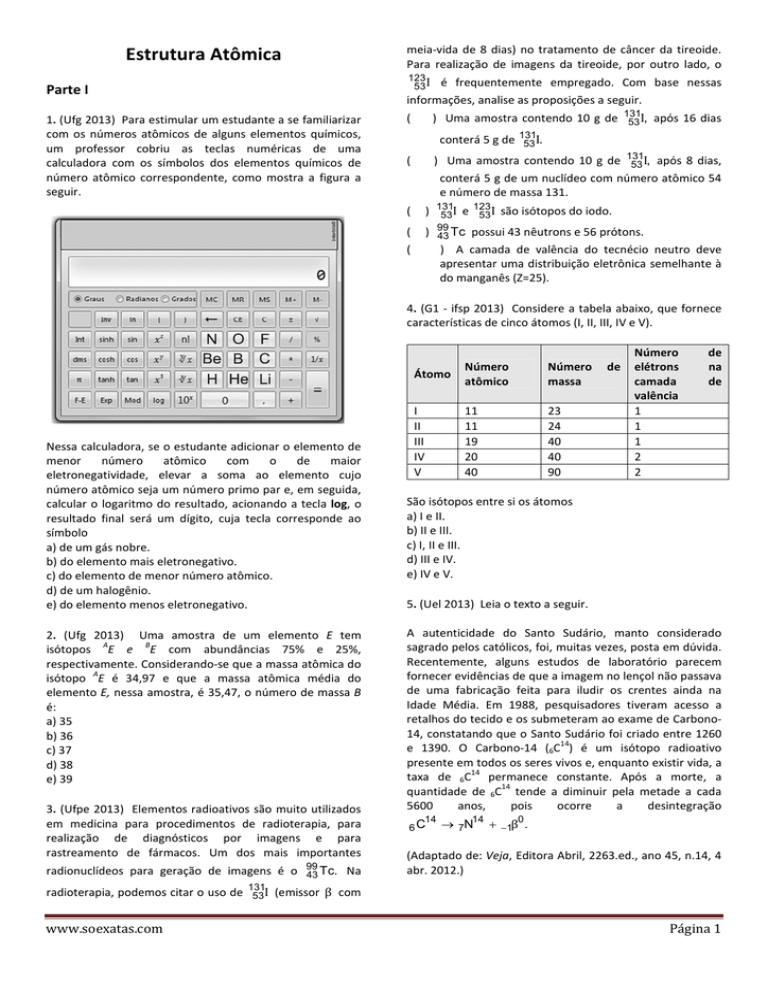
1. (Ufg 2013) Para estimular um estudante a se familiarizar
com os números atômicos de alguns elementos químicos,
um professor cobriu as teclas numéricas de uma
calculadora com os símbolos dos elementos químicos de
número atômico correspondente, como mostra a figura a
seguir.
(
) Uma amostra contendo 10 g de 131
53 Ι, após 16 dias
conterá 5 g de 131
53 Ι.
) Uma amostra contendo 10 g de 131
53 Ι, após 8 dias,
conterá 5 g de um nuclídeo com número atômico 54
e número de massa 131.
(
(
123
) 131
53 Ι e 53 Ι são isótopos do iodo.
(
(
) 99
43 Tc possui 43 nêutrons e 56 prótons.
) A camada de valência do tecnécio neutro deve
apresentar uma distribuição eletrônica semelhante à
do manganês (Z=25).
4. (G1 - ifsp 2013) Considere a tabela abaixo, que fornece
características de cinco átomos (I, II, III, IV e V).
Nessa calculadora, se o estudante adicionar o elemento de
menor
número
atômico
com
o
de
maior
eletronegatividade, elevar a soma ao elemento cujo
número atômico seja um número primo par e, em seguida,
calcular o logaritmo do resultado, acionando a tecla log, o
resultado final será um dígito, cuja tecla corresponde ao
símbolo
a) de um gás nobre.
b) do elemento mais eletronegativo.
c) do elemento de menor número atômico.
d) de um halogênio.
e) do elemento menos eletronegativo.
2. (Ufg 2013) Uma amostra de um elemento E tem
A
B
isótopos E e E com abundâncias 75% e 25%,
respectivamente. Considerando-se que a massa atômica do
A
isótopo E é 34,97 e que a massa atômica média do
elemento E, nessa amostra, é 35,47, o número de massa B
é:
a) 35
b) 36
c) 37
d) 38
e) 39
3. (Ufpe 2013) Elementos radioativos são muito utilizados
em medicina para procedimentos de radioterapia, para
realização de diagnósticos por imagens e para
rastreamento de fármacos. Um dos mais importantes
radionuclídeos para geração de imagens é o 99
43 Tc. Na
Átomo
Número
atômico
Número
massa
I
II
III
IV
V
11
11
19
20
40
23
24
40
40
90
de
Número
elétrons
camada
valência
1
1
1
2
2
de
na
de
São isótopos entre si os átomos
a) I e II.
b) II e III.
c) I, II e III.
d) III e IV.
e) IV e V.
5. (Uel 2013) Leia o texto a seguir.
A autenticidade do Santo Sudário, manto considerado
sagrado pelos católicos, foi, muitas vezes, posta em dúvida.
Recentemente, alguns estudos de laboratório parecem
fornecer evidências de que a imagem no lençol não passava
de uma fabricação feita para iludir os crentes ainda na
Idade Média. Em 1988, pesquisadores tiveram acesso a
retalhos do tecido e os submeteram ao exame de Carbono14, constatando que o Santo Sudário foi criado entre 1260
14
e 1390. O Carbono-14 (6C ) é um isótopo radioativo
presente em todos os seres vivos e, enquanto existir vida, a
14
taxa de 6C permanece constante. Após a morte, a
14
quantidade de 6C tende a diminuir pela metade a cada
5600
anos,
pois
ocorre
a
desintegração
14
6C
→ 7N14 +
0
−1β .
(Adaptado de: Veja, Editora Abril, 2263.ed., ano 45, n.14, 4
abr. 2012.)
radioterapia, podemos citar o uso de 131
53 Ι (emissor β com
www.soexatas.com
Página 1
Em relação ao processo de datação por meio do exame de
Carbono-14, assinale a alternativa correta.
14
14
a) O nitrogênio 7N proveniente da desintegração do 6C ,
14
presente no tecido, é um isóbaro do 6C e possui 7
prótons e 7 nêutrons.
b) Na emissão de partículas −1β0 após 10 ciclos de meia
14
vida, a massa de 6C permanece a mesma, portanto é
inútil medir a massa do tecido como prova da sua idade.
14
12
c) A massa atômica do 6C é a mesma do 6C , no entanto o
14
átomo de 6C faz duas ligações covalentes simples com
átomos de hidrogênio, o que permite sua identificação
no tecido.
14
d) Decorridos 750 anos, a amostra radioativa de 6C no
tecido teve sua massa reduzida a 25% da inicial. Logo,
transcorreram-se 4 períodos de meia vida.
e) Se um contador Geiger acusa 12% do segundo período
14
de meia vida do 6C presente no tecido, conclui-se que
sua idade é de aproximadamente 660 anos.
2
6. (Ufsj 2013) Considerando a configuração eletrônica 1s
2
6
2
6
1
2s 2p 3s 3p 4s , é CORRETO afirmar que:
a) dois isótopos do mesmo elemento não podem ter essa
configuração.
b) somente íons positivos podem apresentar essa
configuração.
c) um átomo neutro que tem essa configuração é um metal
alcalino.
d) há cinco orbitais totalmente preenchidos e um
parcialmente preenchido.
7. (G1 - utfpr 2013) Um elemento químico é formado por
átomos:
a) isóbaros entre si.
b) com números atômicos diferentes.
c) isótonos entre si.
d) com o mesmo nśmero de nźutrons.
e) com o mesmo número de prótons.
8. (Uem 2013) Tendo como base a reação química entre o
+
átomo de sódio e o átomo de cloro para formar os íons Na
e Cℓ – , assinale a(s) alternativa(s) correta(s).
01) Supondo que o raio atômico do sódio seja X e o raio
atômico do cloro seja Y, a distância da ligação química
entre Na e Cℓ – no cloreto de sódio será
obrigatoriamente X+Y.
02) O átomo de sódio é maior do que o átomo de cloro, no
entanto o íon sódio é menor do que o íon cloro.
04) A regra do octeto é respeitada nos íons sódio e cloro do
NaCℓ, mas não é respeitada para o boro no BF3.
08) Sais formados entre metais alcalinos e halogênios
apresentarão, para ambos os íons, uma camada de
2 6
+
valência do tipo s p , exceto o Li .
16) A quantidade de energia envolvida na segunda
ionização do sódio é de valor aproximadamente igual
ao envolvido na primeira ionização.
+
9. (Ufsc 2013) O Transtorno Bipolar do Humor é uma
doença caracterizada por rápidas oscilações ou mudanças
www.soexatas.com
cíclicas de humor, as quais vão desde oscilações normais,
como nos estados de alegria e tristeza, até mudanças
patológicas acentuadas e diferentes do normal, como
episódios de mania, irritação e depressão. E relativamente
comum, acometendo aproximadamente 8 a cada 100
indivíduos, e manifesta-se igualmente em mulheres e
homens. Medicamentos à base de lítio, geralmente
carbonato de lítio, são indicados para diminuir a frequência
e a intensidade das crises, bem como para prevenir a fase
depressiva. O carbonato de lítio é um pó cristalino branco,
inodoro, de sabor levemente alcalino.
Assinale a(s) proposição(ões) CORRETA(S).
01) O raio atômico do lítio é maior que o raio do respectivo
cátion.
02) O carbonato de lítio apresenta duas ligações iônicas.
04) O átomo de lítio possui dois elétrons na camada de
valência.
08) A ordem crescente de eletronegatividade dos
elementos químicos presentes no carbonato de lítio é:
lítio < carbono < oxigênio.
16) As ligações formadas entre os átomos que constituem o
íon carbonato possuem caráter predominantemente
iônico.
32) O número de oxidação do carbono no íon carbonato é
+4.
+
2+
64) Embora o íon lítio (Li ) e o íon berílio (Be ) sejam íons
2+
isoeletrônicos, o íon Be possui maior raio que o íon
+
Li .
10. (Uem 2013) Considere os quatro elementos químicos
seguintes e as configurações eletrônicas de seus dois níveis
mais energéticos.
2
6
2
5
I. 2s 2p 3s 3p
2
6
2
6
II. 3s 3p 4s 3d
2
6
2
8
III. 3s 3p 4s 3d
2
6
1
IV. 4s 4p 5s
Com base nessas informações, assinale o que for correto.
01) O elemento I é um halogênio.
02) Os elementos II e III pertencem a uma mesma família.
04) O elemento IV possui número atômico 37.
08) O elemento I é mais eletronegativo do que o átomo de
oxigênio.
16) Quando o elemento II ganha dois elétrons, o íon
formado passa a ter a distribuição eletrônica do
elemento III. No entanto, quando III perde dois
elétrons, o íon formado não possui a mesma
distribuição eletrônica de II.
11. (Ufrgs 2013) Considere as seguintes situações químicas.
1. Nanotubos de carbono são organizados na forma de
tubos de dimensão nanométrica. No fulereno, a
estrutura assemelha-se a uma “bola de futebol”, e o
grafeno apresenta uma estrutura planar. Todos eles são
constituídos exclusivamente por carbono, mas as
diferenças nas suas estruturas propiciam aplicações
tecnológicas diferentes.
Página 2
2. O urânio encontrado na natureza é uma forma
combinada, em que a espécie mais abundante é o
urânio-238, o qual não é adequado para ser usado como
combustível nas usinas nucleares. Assim, para um
melhor aproveitamento, o urânio é submetido a um
processo de enriquecimento, que consiste em aumentar
o teor de urânio-235, o qual possui alto poder de fissão.
As espécies químicas citadas nas situações 1 e 2 são,
respectivamente, exemplos de
a) alótropos e isótopos.
b) enantiômeros e isóbaros.
c) isômeros e antípodas.
d) isomorfos e alótropos.
e) isótopos e isômeros.
12. (Uepg 2013) Na natureza podem-se encontrar três
variedades isotópicas do elemento químico urânio,
representadas abaixo. Com relação a esses isótopos, no
estado fundamental, assinale o que for correto.
234
U92 235U92 238U92
01) O urânio-234 possui 92 prótons e 92 elétrons.
02) O urânio-235 possui 92 prótons e 143 nêutrons.
04) Os três átomos possuem o mesmo número de massa.
08) O urânio-238 possui 92 elétrons e 146 nêutrons.
13. (G1 - cftmg 2013) O ânion de um átomo desconhecido
–
2
(X ) apresenta distribuição eletrônica finalizada em 4s . Esse
átomo é o
a) hélio.
b) sódio.
c) cálcio.
d) potássio.
14. (G1 - cftrj 2013) Considere as informações, mostradas
abaixo, a respeito de três elementos genericamente
representados pelas letras A, B e C. Com base nas
informações, identifique a alternativa que apresenta a
distribuição eletrônica, em subníveis de energia, do átomo
C.
- O elemento A apresenta número atômico 26 e número de
massa 56.
- O elemento A é isótono do elemento B.
- O elemento B é isóbaro do elemento C e isoeletrônico do
íon C2+ . O elemento B apresenta número de massa 58.
2
2
6
2
6
2
6
a) 1s 2s 2p 3s 3p 4s 3d
2
2
6
2
6
2
8
b) 1s 2s 2p 3s 3p 4s 3d
2
2
6
2
6
2
10
c) 1s 2s 2p 3s 3p 4s 3d
2
2
6
2
6
2
10
6
2
10
6
2
d) 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s
15. (Uerj 2013) A descoberta dos isótopos foi de grande
importância para o conhecimento da estrutura atômica da
matéria.
Sabe-se, hoje, que os isótopos 54 Fe e 56 Fe têm,
respectivamente, 28 e 30 nêutrons.
A razão entre as cargas elétricas dos núcleos dos isótopos
54
Fe e
a) 0,5
b) 1,0
c) 1,5
d) 2,0
56
Fe é igual a:
16. (Ufg 2013) Em um determinado momento histórico, o
modelo atômico vigente e que explicava parte da
constituição da matéria considerava que o átomo era
composto de um núcleo com carga positiva. Ao redor deste,
haviam partículas negativas uniformemente distribuídas. A
experiência investigativa que levou à proposição desse
modelo foi aquela na qual
a) realizou-se uma série de descargas elétricas em tubos de
gases rarefeitos.
b) determinou-se as leis ponderais das combinações
químicas.
c) analisou-se espectros atômicos com emissão de luz com
cores características para cada elemento.
d) caracterizou-se estudos sobre radioatividade e dispersão
e reflexão de partículas alfa.
e) providenciou-se a resolução de uma equação para
determinação dos níveis de energia da camada
eletrônica.
17. (G1 - cftmg 2013) As investigações realizadas pelos
cientistas ao longo da história introduziram a concepção do
átomo como uma estrutura divisível, levando à proposição
de diferentes modelos que descrevem a estrutura atômica.
O modelo que abordou essa ideia pela primeira vez foi o de
a) Bohr.
b) Dalton.
c) Thomson.
d) Rutherford.
18. (Mackenzie 2013)
6x +8
3x +3 A
Sabendo-se que dois elementos
3x + 20
2x + 8 B
químicos
e
são isóbaros, é correto afirmar
que o número de nêutrons de A e o número atômico de B
são, respectivamente,
a) 15 e 32.
b) 32 e 16.
c) 15 e 17.
d) 20 e 18.
e) 17 e 16.
19. (Espcex (Aman) 2013)
Urânio-238
(
238
92 U
Um isótopo radioativo de
) , de número atômico 92 e número de
massa 238, emite uma partícula alfa, transformando-se
num átomo X, o qual emite uma partícula beta, produzindo
um átomo Z, que por sua vez emite uma partícula beta,
transformando-se num átomo M. Um estudante analisando
essas situações faz as seguintes observações:
I. Os átomos X e Z são isóbaros;
(
)
II. O átomo M é isótopo do Urânio-238 238
92 U ;
III. O átomo Z possui 143 nêutrons;
IV. O átomo X possui 90 prótons.
www.soexatas.com
Página 3
Das observações feitas, utilizando os dados acima, estão
corretas:
a) apenas I e II.
b) apenas I e IV.
c) apenas III e IV.
d) apenas I, II e IV.
e) todas.
20. (Ime 2013) Os trabalhos de Joseph John Thomson e
Ernest
Rutherford
resultaram
em
importantes
contribuições na história da evolução dos modelos
atômicos e no estudo de fenômenos relacionados à
matéria. Das alternativas abaixo, aquela que apresenta
corretamente o autor e uma de suas contribuições é:
a) Thomson – Concluiu que o átomo e suas partículas
formam um modelo semelhante ao sistema solar.
b) Thomson – Constatou a indivisibilidade do átomo.
c) Rutherford – Pela primeira vez, constatou a natureza
elétrica da matéria.
d) Thomson – A partir de experimentos com raios
catódicos, comprovou a existência de partículas
subatômicas.
e) Rutherford – Reconheceu a existência das partículas
nucleares sem carga elétrica, denominadas nêutrons.
21. (Ita 2013) Um átomo A com n elétrons, após ( n − 1)
sucessivas ionizações, foi novamente ionizado de acordo
(
)
com a equação A n−1 + → A n+ + 1 e− . Sabendo o valor
experimental da energia de ionização deste processo, podese conhecer o átomo A utilizando o modelo proposto por
a) E. Rutherford.
b) J. Dalton.
c) J. Thomson.
d) N. Bohr.
e) R. Mulliken.
22. (Udesc 2013) Assinale a alternativa correta sobre o
modelo atômico atual.
a) O número de prótons é sempre igual ao número de
nêutrons, em todos os átomos.
b) Os elétrons se comportam como partículas carregadas,
girando ao redor do núcleo em órbitas definidas.
c) A descrição probabilística de um elétron em um orbital p
gera uma forma esférica em torno do núcleo.
d) Orbital é a região mais provável de se encontrar o
elétron a uma certa distância do núcleo.
e) Os átomos são formados pelas partículas elétrons,
prótons e nêutrons, cujas massas são semelhantes.
23. (Espcex (Aman) 2013)
afirmativas:
Pauling – igual a 1s2 2s2 2p6 3s2 3p6 ;
III. A afinidade eletrônica (eletroafinidade) aumenta
conforme o raio atômico diminui. Dessa forma, devido
ao seu menor raio atômico, o oxigênio (Z=8) possui
maior afinidade eletrônica do que o enxofre (Z=16),
ambos pertencentes à mesma família da Tabela
Periódica;
IV. O raio de um íon negativo (ânion) é sempre menor que
o raio do átomo que lhe deu origem.
Das afirmações feitas, utilizando os dados acima, estão
corretas apenas:
a) I e II.
b) I e III.
c) II e III.
d) I e IV.
e) II e IV.
Parte II: como cai na UFJF
1. (Ufjf 2011) O Brasil é o campeão mundial da reciclagem
de alumínio, colaborando com a preservação do meio
ambiente. Por outro lado, a obtenção industrial do alumínio
sempre foi um processo caro, consumindo grande
quantidade de energia. No passado, a obtenção industrial
do alumínio já foi tão cara que, apenas em ocasiões
especiais, Napoleão III usava talheres de alumínio. Com
relação ao alumínio, pede-se:
a) Qual a configuração eletrônica do cátion do alumínio
isoeletrônico ao gás nobre neônio?
3+
+
2+.
b) Compare o íon Aℓ com os íons Na e Mg Ordene as 3
(três) espécies em ordem crescente de raio iônico.
c) Sabendo-se que o óxido de alumínio é Aℓ2O3, represente
a fórmula eletrônica (ou de Lewis) para esse composto.
d) Escreva a reação química balanceada que ocorre entre o
alumínio metálico e o ácido clorídrico. Identifique o tipo
de ligação existente no sal formado.
2. (Ufjf 2007) Na tabela a seguir, qual é a alternativa que
melhor preenche as lacunas nas colunas de I a IV,
RESPECTIVAMENTE?
São dadas as seguintes
I. Joseph J. Thomson, em seu modelo atômico, descrevia o
átomo como uma estrutura na qual a carga positiva
permanecia no centro, constituindo o núcleo, enquanto
as cargas negativas giravam em torno desse núcleo;
II. Um átomo, no estado fundamental, que possui 20
elétrons na sua eletrosfera, ao perder dois elétrons,
www.soexatas.com
gerará um cátion bivalente correspondente, com
configuração eletrônica – segundo o diagrama de Linus
a) 20, I, S, 17.
b) 18, I, S, 18.
2c) 20, I , O , 17.
Página 4
d) 22, I, O, 18.
- 2e) 18, I , S , 18.
3. (Ufjf 2002) O chumbo é venenoso e se acumula
lentamente no organismo, podendo afetar as pessoas
expostas, mesmo que em pequenas doses e por um longo
período de tempo. Sua forma catiônica é tóxica, afetando
principalmente a síntese da hemoglobina.
Assinale a alternativa que apresenta a afirmativa ERRADA:
a) Sabendo-se que a configuração eletrônica do chumbo é
14
10 2
2
[Xe] 4f 5d 6s 6p , podemos prever que a forma
3+
catiônica mais estável do chumbo deve ser Pb .
b) O raio atômico do chumbo deve ser maior do que o do
arsênio.
206
207
c) 82Pb e 82Pb são isótopos.
d) Sabendo-se que o óxido de chumbo (PbO2) é anfótero,
deduzimos que ele deve reagir tanto com ácido quanto
com base.
e) O chumbo tem tendência a formar compostos iônicos.
www.soexatas.com
Página 5











