Atividade prática - Estudando a água – Parte 9
9º ano do Ensino Fundamental e 1º ano do Ensino Médio
Objetivo
Diversos experimentos, usando principalmente água e materiais de fácil obtenção, são possíveis e
importantes para vivenciar as principais propriedades físicas e químicas da água, bem como de
sua interação com outras substâncias.
É desnecessário falar da importância de se conhecer as propriedades da água, principalmente em
tempos que anunciam a escassez desse recurso. Além disso, o estudo da água também permite
introduzir a compreensão das propriedades de outras substâncias, ampliando os horizontes do
entendimento científico de diversos fenômenos do cotidiano; que, por sua vez, são inerentes às
questões ambientais, industriais, culinárias, medicinais e muitas outras.
Introdução
Como foi visto na parte 8, a tensão superficial é uma das mais importantes propriedades da água.
Mas, ao contrário do que se costuma pensar, essa não é uma propriedade exclusiva da água:
outras substâncias também apresentam tensão superficial, em maior ou menor intensidade.
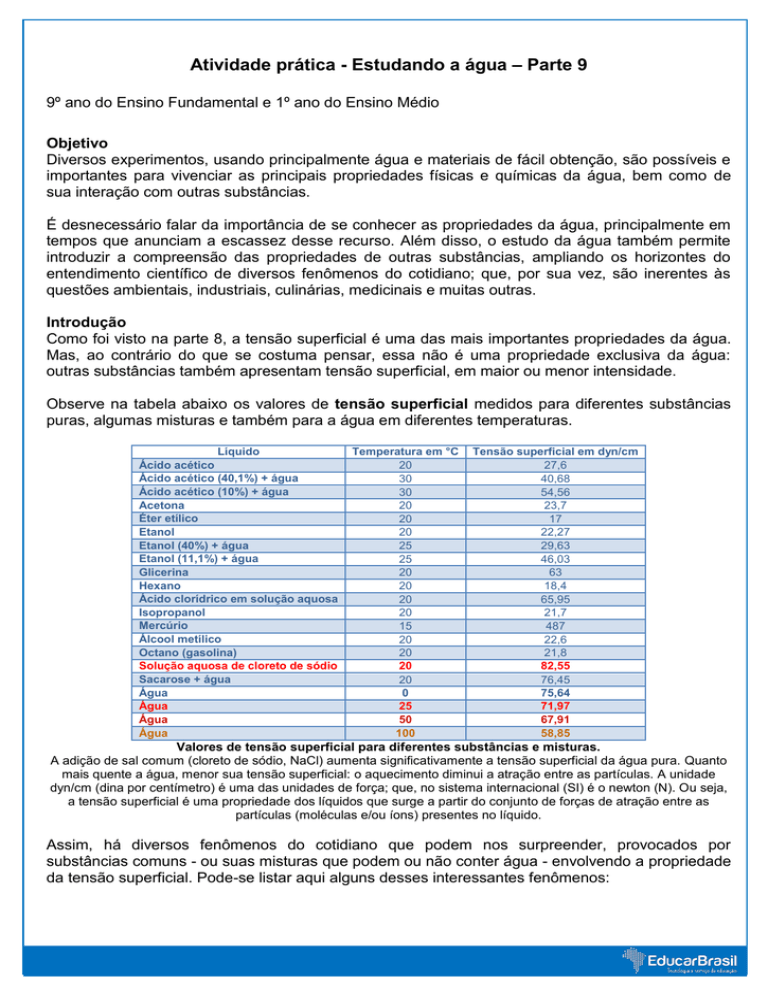
Observe na tabela abaixo os valores de tensão superficial medidos para diferentes substâncias
puras, algumas misturas e também para a água em diferentes temperaturas.
Líquido
Ácido acético
Ácido acético (40,1%) + água
Ácido acético (10%) + água
Acetona
Éter etílico
Etanol
Etanol (40%) + água
Etanol (11,1%) + água
Glicerina
Hexano
Ácido clorídrico em solução aquosa
Isopropanol
Mercúrio
Álcool metílico
Octano (gasolina)
Solução aquosa de cloreto de sódio
Sacarose + água
Água
Água
Água
Água
Temperatura em °C
20
30
30
20
20
20
25
25
20
20
20
20
15
20
20
20
20
0
25
50
100
Tensão superficial em dyn/cm
27,6
40,68
54,56
23,7
17
22,27
29,63
46,03
63
18,4
65,95
21,7
487
22,6
21,8
82,55
76,45
75,64
71,97
67,91
58,85
Valores de tensão superficial para diferentes substâncias e misturas.
A adição de sal comum (cloreto de sódio, NaCl) aumenta significativamente a tensão superficial da água pura. Quanto
mais quente a água, menor sua tensão superficial: o aquecimento diminui a atração entre as partículas. A unidade
dyn/cm (dina por centímetro) é uma das unidades de força; que, no sistema internacional (SI) é o newton (N). Ou seja,
a tensão superficial é uma propriedade dos líquidos que surge a partir do conjunto de forças de atração entre as
partículas (moléculas e/ou íons) presentes no líquido.
Assim, há diversos fenômenos do cotidiano que podem nos surpreender, provocados por
substâncias comuns - ou suas misturas que podem ou não conter água - envolvendo a propriedade
da tensão superficial. Pode-se listar aqui alguns desses interessantes fenômenos:
Quando uma torneira aberta é fechada aos poucos, deixando um filete líquido cada vez mais
fino, chega o momento em que o filete se transforma em uma sucessão de gotas. Isso
acontece quando a tensão de superfície rompe o filete e há a formação de gotas esféricas.
As gotas de água de orvalho ou de chuva sobre uma superfície
cerosa, como, por exemplo, uma folha de uma árvore de cerrado, se
apresentam quase esféricas. Isso acontece porque a folha cerosa é
hidrofóbica, e as “forças de adesão” entre a folha e a água são
muito mais fracas que as “forças de coesão” intermoleculares da
água. A forte tensão superficial da água favorece a forma esférica,
porque a esfera é a forma com a menor relação possível de
área/volume, ou seja, que “guarda” mais volume (mais moléculas)
dentro de uma menor superfície (área em torno da gota). Assim, a
forte atração entre as moléculas de água favorece a forma com
menor superfície, desde que a força de atração entre a água e a
superfície onde a gota de água está apoiada seja fraca.
Gotas de água sobre superfícies cerosas tendem a assumir forma esférica.
Disponível (acesso: 20.03.2015):
http://commons.wikimedia.org/wiki/File:Dew_on_a_Equisetum_fluviatile_Luc_Viatour.jpg
Objetos mais densos que a água podem flutuar quando eles têm superfície hidrofóbica
(pouco “molhável”) e se seu peso for menor que as forças resultantes da tensão superficial,
como visto na parte 8, com o caso do clipe, da lâmina de barbear e da moeda. Há muitos
insetos que também podem andar sobre a água, usando a tensão superficial que funciona
como uma película.
O limite entre a superfície de dois líquidos imiscíveis como o óleo e a água é formado pela
tensão superficial dos dois líquidos, chamado de tensão de interface.
As “lágrimas de vinho” acontecem quando bebidas alcoólicas
sobem sobre o vidro, acumulam e descem em forma de gotas.
Esse é o chamado “efeito de Marangoni”, que ocorre porque há
uma graduação na tensão superficial nos cantos do copo. A
bebida alcoólica é uma mistura de água e álcool, cuja tensão
superficial é mais baixa que a da água pura; e, enquanto as
gotas sobem pelo vidro, o álcool vai evaporando e a tensão
superficial tende a aumentar novamente, descendo novamente
as gotas pelo vidro já com menor teor de álcool.
Lágrimas de vinho projetadas na sombra da taça.
Disponível (acesso: 19.04.2015):
http://commons.wikimedia.org/wiki/File:Wine_legs_shadow.jpg
As bolhas de sabão são formadas por uma membrana d'água com ar dentro e fora. Esse
tipo de bolha acontece por ação do sabão, que é “tensoativo” ou “surfactante”, ou seja, que
quebra ou diminui a tensão superficial, deixando a bolha mais estável e com menor
tendência a formar a esfera líquida (gota), sem ar no interior.
Obs.: Sabões, detergentes e outros surfactantes rompem a tensão superficial, por que essas
moléculas possuem um lado com boa afinidade com a água (hidrofílico) e outro lado com
boa afinidade com gorduras (hidrofóbico ou lipofílico).
A “capilaridade” é um fenômeno interessante, que permite que o líquido suba por um tecido,
papel, vidro ou outra superfície mais ou menos porosa. Isso acontece quando a afinidade do
líquido pela superfície de um sólido é grande o suficiente para vencer o seu próprio peso.
Quanto mais poroso é o sólido, maior a superfície de contato do líquido, permitindo uma
maior subida do líquido pelo sólido.
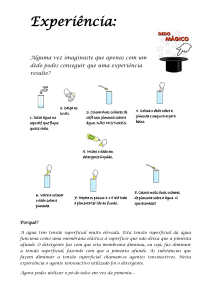
Mais um experimento sobre tensão superficial – Mágica, truque ou Ciência?
Material
A) Frasco de boca larga, do tipo de maionese ou similar.
B) Tela plástica ou metálica, que seja flexível para ser amarrada e fixada na boca do frasco, e que
tenha orifícios bem pequenos.
C) Folha de cartolina ou papel cartão.
D) Água de torneira.
E) Bacia plástica comum.
F) Barbante.
G) Sal de cozinha (se necessário).
Obs.: Deve-se usar uma tela com os orifícios tanto menores quanto possível. Caso o procedimento
2 não dê certo, e não tenha disponível uma tela muito fina, pode-se usar sal de cozinha dissolvido
na água para aumentar a tensão superficial do líquido.
Procedimento – Segurando água com papel
1. Adicione água no frasco vazio e destampado até que a água transborde.
2. Coloque o papel cartão sobre a boca do frasco, de forma a tampar toda a boca, sem deixar
bolhas de ar.
3. Posicione o frasco com as mãos logo acima da bacia para realizar o restante do experimento.
4. Segurando o papel com uma das mãos, fazendo pressão sobre a boca do frasco, vire o conjunto
com a boca para baixo.
5. Retire a mão que segura o papel, de forma a segurar apenas o frasco. O que acontece?
Questões
1) Descreva o que aconteceu no item 5. O experimento apresentou um resultado inesperado para
os componentes do grupo? Comente.
______________________________________________________________________________________
______________________________________________________________________________________
______________________________________________________________________________________
______________________________________________________________________________________
_____________________________________________________________________________________
2) Qual é a influência da pressão atmosférica na primeira parte do experimento? Explique.
______________________________________________________________________________________
______________________________________________________________________________________
______________________________________________________________________________________
______________________________________________________________________________________
_____________________________________________________________________________________
Procedimento – Segurando água com tela
6. Estique a tela sobre a boca do frasco vazio e amarre-a firmemente com o pedaço de barbante,
em torno do gargalo do frasco.
7. Adicione água dentro do frasco através da tela, até que a água transborde.
8. Coloque o papel cartão sobre a boca do frasco, de forma a tampar toda a boca, sem deixar
bolhas de ar.
9. Posicione o frasco com as mãos logo acima da bacia para realizar o restante do experimento.
10. Segurando o papel com uma das mãos, fazendo pressão sobre a boca do frasco, vire o
conjunto com a boca para baixo.
11. Retire a mão que segura o papel, segurando apenas o frasco. O que acontece?
12. Retire o papel. O que acontece?
13. Incline lentamente o frasco, retirando-o da posição vertical. O que acontece?
Questões
3) Como a tela plástica ou metálica consegue segurar a água? Em que a tensão superficial da
água se relaciona com o experimento? E a pressão atmosférica? Explique cuidadosamente as
causas do fenômeno observado.
______________________________________________________________________________________
______________________________________________________________________________________
______________________________________________________________________________________
______________________________________________________________________________________
______________________________________________________________________________________
_____________________________________________________________________________________
4) Quando o frasco foi sendo lentamente inclinado, por que chegou o momento em que a água saiu
do frasco? Explique, usando o conceito de “impenetrabilidade” da matéria, segundo o qual “dois
corpos não ocupam o mesmo lugar no espaço ao mesmo tempo”.
______________________________________________________________________________________
______________________________________________________________________________________
______________________________________________________________________________________
______________________________________________________________________________________
______________________________________________________________________________________
______________________________________________________________________________________
_____________________________________________________________________________________
5) O fenômeno das “lágrimas de vinho” é mais comum nos vinhos de maior graduação alcoólica,
como os licorosos e os fortificados, como é o caso do famoso “vinho do Porto”. Por que esse
fenômeno é mais marcante para esses vinhos? Explique.
______________________________________________________________________________________
______________________________________________________________________________________
______________________________________________________________________________________
______________________________________________________________________________________
_____________________________________________________________________________________
6) Se repetirmos os dois experimentos dessa aula, usando uma mistura de água e álcool, ou
mesmo álcool comercial, haverá mais chances de o experimento dar certo ou de dar errado?
Explique. Se houver dúvidas, realize o experimento nessas condições.
______________________________________________________________________________________
______________________________________________________________________________________
______________________________________________________________________________________
_____________________________________________________________________________________