UNIVERSIDADE FEDERAL DO PARÁ
LICENCIATURA EM FÍSICA
ELIELZER DE SOUZA NUAYED
CARLOS WILSON TEIXEIRA CORREA
TERMODINÂMICA
BELÉM – PA
2013
UNIVERSIDADE FEDERAL DO PARÁ
LICENCIATURA EM FÍSICA
ELIELZER DE SOUZA NUAYED
CARLOS WILSON TEIXEIRA CORREA
TERMODINÂMICA
Trabalho apresentado ao curso Licenciatura
em Física como requisito para a 3° avaliação
da disciplina Física Básica II.
Prof.º Dr. Jaime Urban.
BELÉM - PA
2013
UNIVERSIDADE FEDERAL DO PARÁ
LICENCIATURA EM FÍSICA
ELIELZER DE SOUZA NUAYED
CARLOS WILSON TEIXEIRA CORREA
TERMODINÂMICA
Este Trabalho foi julgado adequado para a disciplina Física Básica II, e aprovado na sua
forma final pela Universidade Federal do Párá.
Data: ____/____/____
Nota: _____________
________________________________________________
Prof. Dr. Jaime Urban
Avaliador UFPA
BELÉM - PA
2013
Autorização para Publicação Eletrônica de Trabalhos Acadêmicos
Na qualidade de titular dos direitos autorais do trabalho citado, em consonância com a
Lei nº 9610/98, autorizo a Universidade Federal do Pará a disponibilizar gratuitamente em sua
Biblioteca Digital, e por meios eletrônicos, em particular pela Internet, extrair cópia sem
ressarcimento dos direitos autorais, o referido documento de minha autoria, para leitura,
impressão e/ou download, conforme permissão concedida.
"[...] só quando a última árvore for derrubada, o
último peixe for morto e o último rio for poluído é
que o homem perceberá que não pode comer
dinheiro".
Provérbio Indígena
RESUMO
Este artigo trata da atividade final da disciplina Física II. Trata-se de um trabalho de pesquisa
sobre o assunto Termodinâmica. O trabalho feito com base nos requisitos estabelecidos, nas
orientações do professor e em pesquisa incessante na literatura indicada levou a grandes
resultados. O trabalho conclui a viabilidade do conhecimento em física. É a persistência no
estudo que levou a identificar cada conceito e definição e trazer novos conhecimentos.
Palavras-chave: Termodinâmica.
ABSTRACT
This article deals with the final activity of the subject Physics II. This is a research paper on
the subject Thermodynamics. The work was done on the basis of incessant research literature
indicated by the teacher. That led to great results. The work concludes the feasibility is
persistence and willpower it took to identify each concept and definition and bring new
knowledge.
Keywords: Thermodynamics.
LISTA DE ABREVIATURAS
Energia (calor) transferida.
É a energia na forma de trabalho realizado por forças que agem através da fronteira
do sistema.
Corresponde à variação na energia interna do sistema que ocorre quando a
energia é transferida como calor ou trabalho.
Estado de equilíbrio inicial.
Estado de equilíbrio final.
Pressão.
Volume.
Temperatura.
Constante molar.
n Número de moles.
Energia cinética
Constate de Boltzmann
Energía interna
SUMÁRIO
1
INTRODUÇÃO .................................................................................................... 11
1.1
2
METODOLOGIA E MÉTODO DA PESQUISA........................................... 11
DESENVOLVIMENTO ...................................................................................... 12
2.1
LEI ZERO DA TERMODINÂMICA ............................................................. 12
2.2
CALOR ........................................................................................................... 13
2.3
CALOR ESPECÍFICO.................................................................................... 13
2.4
CONDUÇÃO TÉRMICA. LEI DE FURIER ................................................. 13
2.5
ENERGIA INTERNA .................................................................................... 15
2.6
PRIMEIRA LEI DA TERMODINÂMICA – ENUNCIADO GERAL .......... 16
2.7
PROCESSO TERMODINÂMICO – TIPOS .................................................. 19
2.8
SEGUNDA LEI DA TERMODINÂMICA .................................................... 20
Enunciado 1 – Enunciado de Kelvin .................................................................... 20
Enunciado 2 – Enunciado de Clausius ................................................................. 20
2.9
CICLO DE CARNOT ..................................................................................... 22
2.9.1 Validade .......................................................................................................... 23
2.9.2 Rendimento térmico ........................................................................................ 24
2.10 ENTROPIA ..................................................................................................... 24
2.11 VISÃO MICROSCÓPICA DA TEMPERATURA ABSOLUTA DE UM
GAS IDEAL 25
3
RESULTADOS ..................................................................................................... 26
4
CONCLUSÃO ...................................................................................................... 27
REFERÊNCIAS.......................................................................................................... 28
APENDICE ................................................................................................................. 29
ÍNDICE DE FIGURAS
Figura 2.1. (a) Os sistemas A e B estão separados por uma parede adiabática. Os
sistemas possuem diferentes níveis de energia térmica
e
. (b) Os sistemas estão
separados diatermicamente. A figura permite representar graficamente a tendência de
equilíbrio térmico. Fonte: adaptado de Halliday quinta edição volume 2 ................................ 12
Figura 2.2 Variação da temperatura ............................................................................. 14
Figura 2.3 A energia de um sistema pode ser alterada através do trabalho realizado
sobre ou pela sua vizinhança, e através do calor transferido para ou da vizinhança. Fonte:
Halliday, vol. 1, quinta edição ano 2002. ................................................................................. 16
Figura 2.4 (a) Representação esquemática de um refrigerador. Trabalho é realizado
sobre o refrigerador. (b) Um refrigerador real. Fonte: adaptado de Tipler, volume 1, sexta
edição. ....................................................................................................................................... 21
Figura 2.5 Esquema de uma máquina térmica segundo Carnot. Fonte: Torres et al,
2001. ......................................................................................................................................... 22
Figura 2.6 Ciclo de Carnot para um gás ideal. Fonte: Tipler. ...................................... 23
1 INTRODUÇÃO
O objetivo deste trabalho é estudar, em equipe, a termodinâmica e apresentar o
resultado do estudo segundo as diretrizes indicadas pelo professor, na forma de trabalho
escrito e atendendo requisitos de avaliação que vai desde a forma de apresentação até o nível
de esforço dedicado, de forma que atendidos todos os requisitos o valor vale dez pontos.
1.1 METODOLOGIA E MÉTODO DA PESQUISA
O estudo foi feito de forma qualitativa através de consulta em autores diversos.
No trabalho foram apresentados os conceitos alguns na forma de citação direta e
outros adequados conforme o nível de entendimento e para atender um estilo literário mais
didático. Procurou-se manter aderência com a descrição matemática dos conceitos até para
que o trabalho possa servir como referência de trabalhos futuros ou quiça melhorado.
Foi utilizada a lista de assuntos definida pelo professor como a técnica de pesquisa a
qual transcrevemos em apêndice.
12
2 DESENVOLVIMENTO
2.1 LEI ZERO DA TERMODINÂMICA
No estudo da termodinâmica o primeiro conceito que se apresenta é a temperatura.
Dentro desse conceito encontram-se também definições de ordem prática como Isolantes
Térmicos
Isolantes térmicos são materiais que se usados como separação entre sistemas físicos
formam paredes ditas adiabáticas, o que quer dizer que variações nas propriedades medidas
de um dos sistemas não influenciam as propriedades do outro sistema.
De outro lado há uma propriedade térmica que representa a situação na qual uma
parede de separação tal como acima, porém que permita o fluxo de energia entre os sistemas
neste caso tal parede é dita diatérmica. Obviamente que haverá ou não a passagem dessa
energia na medida em que houver condição necessária e suficiente para isso.
Figura 2.1. (a) Os sistemas A e B estão separados por uma parede adiabática. Os sistemas possuem
diferentes níveis de energia térmica
e
. (b) Os sistemas estão separados diatermicamente. A figura permite
representar graficamente a tendência de equilíbrio térmico. Fonte: adaptado de Halliday quinta edição volume 2
Conforme a literatura consultada as mudanças nas propriedades, decorrente da
passagem ou não de energia pode ser evidenciado e que conforme o resultado, em não
havendo, o estado dos sistemas é denominado equilíbrio térmico. Então, o equilíbrio térmico
é uma constatação que pode ser observada a partir de um teste onde se utilize, por exemplo,
sistema dois sistema A e B e um e um terceiro C, então é postulado que:
13
SE CADA UM DOS SISTEMAS A E B ESTÁ EM EQUILÍBRIO TÉRMICO COM O
TERCEIRO SISTEMA C, ENTÃO A E B ESTÃO EM EQUILÍBRIO TÉRMICO
ENTRE SI.
Este postulado é conhecido como LEI ZERO DA TERMODINÂMICA. O termo Lei
Zero foi termo originalmente aplicado por Ralph H. Fowler (1889 – 1994), físico e astrônomo
britânico, e apesar de seu enunciado ser mais fundamental que as demais leis, somente este
tornou se uma lei formal da física bem após a publicação das demais leis da termodinâmica. A
lei zero leva ao conceito de temperatura.
Seguindo as indicações do diagrama esquemático da Figura 2.1, se
então
e
,
.
2.2 CALOR
Calor é energia térmica em transito, que vai do corpo de maior temperatura para o de
menor temperatura.
2.3 CALOR ESPECÍFICO
Calor específico é a quantidade de energia necessária para aumentar de 1ºC ou 1K
(neste caso, as duas unidades são válidas porque indicam uma variação de 1 grau na
temperatura, e não a temperatura absoluta, e as duas escalas são em centigrados, isto é,
divididas em 100 partes iguais) a massa de 1g de uma substância.
Para a água, este valor é de 1 cal/g, ou seja, é necessária 1 caloria para aumentar 1ºC
ou 1K a temperatura de 1g de água. Em Joules, este valor equivale a 3,14J/g, para a água.
2.4 CONDUÇÃO TÉRMICA. LEI DE FURIER
Quantifica a habilidade dos materiais de conduzir energia térmica, ou seja, de
propiciar calor. Estruturas feitas com materiais de alta condutividade térmica conduzem
energia térmica de forma mais rápida e eficiente que estruturas análogas feitas, contudo de
materiais com baixa condutividade térmica. Desta maneira, materiais com alta condutividade
térmica são utilizados em dissipadores térmicos e materiais de baixa condutividade térmica
são utilizados na confecção de objetos que visam a prover isolamentos térmicos, a exemplo,
em cobertores.
14
A lei de Fourier permite quantificar a transmissão de calor entre os extremos da barra
em regime permanente (estacionário), em função das dimensões da barra, das características
do material de que ela é feita e ainda das temperaturas nos seus extremos.
A equação que traduz a lei de Fourier é: Q = k x A x (TD-TE)/l, em que Q é o débito
de calor de D para E, A é a área da secção reta, l o comprimento da barra, TD e TE as
temperaturas nos extremos da barra e k é a condutibilidade térmica do material de que é feita
a barra.
A condutibilidade térmica de um material é uma propriedade física desse material e
existem tabelas que indicam os valores de k para os diferentes materiais
A transmissão de calor por condução vê-se que seu processo de transferência de calor
ocorre através de todo o material através da troca de energia entre partículas próximas, ou
seja, entre partículas adjacentes. O mecanismo de condução ocorre quando moléculas ou
átomos que estão a uma temperatura mais elevada transferem parte da energia para as
moléculas ou átomos próximos que estão com baixa energia. Assim, dizemos que a energia se
transfere da região de alta temperatura para a região de baixa temperatura. A condução
térmica visa o equilíbrio térmico do material.
Na figura temos uma barra metálica ligada a dois recipientes, um contendo água em
ebulição e outro contendo uma mistura de água e gelo. Pela figura vemos que a barra está
isolada lateralmente.
Através de experimentos, pode ser observado que a temperatura varia linearmente por
toda a barra, ou seja, de uma extremidade a outra. Sendo assim, o fluxo de calor
através da
barra é proporcional à área de seção A da barra e à diferença de temperatura, ΔT = Tf - Ti,
entre as duas extremidades; e inversamente proporcional ao comprimento, L, da barra. Veja a
figura abaixo:
Figura 2.2 Variação da temperatura
15
Podemos definir que o fluxo de calor nada mais é do que o quociente do calor Q
transmitido de uma face para outra, num intervalo de temperatura. Então, o fluxo de calor é
definido por:
Eq. 2-1
Lei de Fourier, ou lei da condução térmica, pode ser expressa por:
k é uma constante que depende do material e é denominada condutividade térmica do
material. O valor desse coeficiente é elevado para os bons condutores de calor; e baixo para os
maus condutores, conhecidos como isolantes térmicos.
2.5 ENERGIA INTERNA
Energia interna U é a capacidade total de um sistema de realizar um trabalho. Essa
energia está distribuída entre as partículas que formam o sistema e entre as diversas formas
em que cada partícula pode armazená-la
16
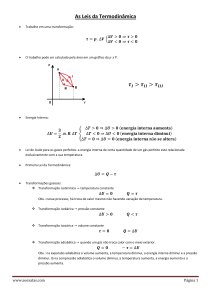
2.6 PRIMEIRA LEI DA TERMODINÂMICA – ENUNCIADO GERAL
A física de modo geral se ocupa com a descrição dos fenômenos responsáveis pela
transferência de energia. Neste sentido a termodinâmica como parte da física se ocupa com a
descrição da transferência de energia calorífica e suas relações entre a energia térmica e
energia mecânica. A primeira lei da termodinâmica geralmente ocupa um capítulo nos livros
de Física, aqui seremos precisos, mas sem a mínima pretensão de esgotar totalmente o
assunto.
Os processos de transferência de calor que foram referidos acima são:
Condução térmica
Convecção
Radiação
De forma consistente, deve-se aplicar na termodinâmica o princípio da conservação da
energia no contexto da energia calorífica.
Figura 2.3 A energia de um sistema pode ser alterada através do trabalho realizado sobre ou pela sua
vizinhança, e através do calor transferido para ou da vizinhança. Fonte: Halliday, vol. 1, quinta edição ano 2002.
Tomando como referência o diagrama da figura 2.2, pode-se escrever que a variação
da energia total, dentre as quais cinética, potencial, interna, e outras têm que ser igual à
integralização do calor recebido mais o trabalho realizado.
Eq. 2-2
É a energia calorífica transferida
17
É a energia na forma de trabalho realizado por forças que agem através da fronteira
do sistema.
A declaração acima se aplica, por exemplo, a sistemas mecânicos como, por exemplo,
um bloco deslizando sobre uma superfície horizontal.
O mais importante, é que, definido o sistema, devem-se levar em consideração todas
as transferências de energia. A regra para isso é desenhar uma fronteira imaginária que separa
o sistema da sua vizinhança, e cuidadosamente, levantar todas as interações entre o sistema e
essa vizinhança.
Em termos de sistema termodinâmico a lei da conservação da energia pode então ser
expressa como:
Eq. 2-3
Onde,
É a energia calorífica transferida
É a energia na forma de trabalho realizado por forças que agem através da fronteira
do sistema.
Corresponde à variação na energia interna do sistema que ocorre quando a
energia é transferida como calor ou trabalho.
A equação Eq. 2-3 acima é a declaração da primeira lei da termodinâmica.
De forma a aplicá-la convenientemente, é necessário o enumerar alguns termos
inerentes à termodinâmica, são eles:
1. Estado inicial de equilíbrio ;
2. Processo termodinâmico – interação com sua vizinhança do sistema durante o
qual trabalho pode ser realizado; energia na forma de calor pode ser trocada;
3. Estado final de equilíbrio ;
4. Função ou Equação de estado – relaciona os potenciais termodinâmicos através
de variáveis de estado. Em sistemas termodinâmicos as equações fundamentais
ou de estado, que são funções que descrevem o sistema são definidas a partir
de variáveis de estado. Nestas equações estão embutidas as variáveis
extensivas (volume, entropia, energia interna e número de moles) e intensivas
(temperatura e pressão). Geralmente é preciso nada menos que três equações
para descrever um sistema, como no caso do gás perfeito temos a entropia, a
energia interna e a equação de estado (
).
Onde : pressão; : volume; : temperatura. : constante molar
18
Assim pode-se enunciar a primeira lei da termodinâmica na sua forma geral, que
conforme Halliday et al. (2002) é descrita como:
“Em qualquer processo termodinâmico entre estados de equilíbrio
e , a grandeza
possui o mesmo valor para qualquer caminho entre i e f. Esta grandeza é igual a variação no valor
da funcão de estado chamada de energia interna
”
19
2.7 PROCESSO TERMODINÂMICO – TIPOS
No processo termodinâmico ocorre uma interação entre o sistema e sua vizinhança
durante o qual trabalho pode ser realizado e energia na forma de calor trocada,
simultaneamente ou não.
Quando alguma das propriedades de um sistema muda, o estado do sistema se
modifica e se diz que experimente um processo de transformação.
Quando um processo termodinâmico é finalizado, o sistema atinge um estado final de
equilíbrio , no qual as suas propriedades, em geral, atingem valores constantes diferentes.
Podemos sintetizar que um processo termodinâmico é a descrição do comportamento
de um sistema quando o mesmo é levado a passar de um estado inicial de suas propriedades
caloríficas, como por exemplo, sua energia interna, para um estado final de equilíbrio.
Se o processo se realiza de tal modo que em cada instante o sistema difere
infinitesimalmente de um estado de equilíbrio, o processo se denomina quase-estático.
Um processo quase-estático se aproxima, por conseguinte, de uma sucessão de estados
de equilíbrio. Se existem diferenças finitas com o equilíbrio o processo é não quase-estático
Muitos processos se caracterizam pelo fato de que alguma propriedade do sistema
permanece constante durante o processo. Quando o volume do sistema permanece constante,
o processo denomina-se isométrico ou isocórico. Se a pressão permanece constante o
processo se denomina isobárico. Um processo a temperatura constante se chama isotérmico.
Um processo que se realiza em um sistema incluído em limites adiabáticos, se chama
adiabático e que pode se descrito com aquele processo em que não há fluxo de calor através
dos limites do sistema.
Um processo é reversível é aquele cujo sentido pode ser invertido por uma mudança
infinitesimal em alguma propriedade do sistema. Um sistema é irreversível se havendo
diferença finita na propriedade do sistema de modo que o fluxo do processo não pode ser
invertido por uma alteração infinitesimal em seu valor.
20
2.8 SEGUNDA LEI DA TERMODINÂMICA
Premissa: A segunda lei da termodinâmica descreve o sentido de realização de um
processo termodinâmico natural. Ela pode ser descrita mediante diversos enunciados
equivalentes. Escreva pelo menos dois deles e explique.
Enunciado 1 – Enunciado de Kelvin
É impossível realizar um processo cujo único efeito seja remover calor de um
reservatório térmico e produzir uma quantidade equivalente de trabalho.
Considere um recipiente de paredes diatérmicas, à temperatura ambiente T, um gás
comprimido a uma pressão inicial
maior que a pressão atmosférica
, e munido de um
pistão. Podemos deixar o gás expandir-se isotermicamente, absorvendo uma quantidade de
calor
da atmosfera (que é um reservatório térmico neste caso). Assim, o gás realizará um
trabalho
dado por
. Pode-se geralmente, com muito boa
aproximação. Tratá-lo como um gás ideal. Como
isotérmico,
e
, ou seja, que seja um processo
, ou seja, a energia interna do gás não muda. O calor
absorvido da atmosfera transforma-se completamente em trabalho. Entretanto, a pressão final
do gás é menor que a inicial já que,
e somente há expansão enquanto
o
processo termina quando a pressão atinge a pressão atmosférica, e só pode este ser executado
uma única vez. Para obter uma máquina térmica, precisa-se de um processo que possa ser
repetido de forma que o estado inicial seja recuperado. Porém, a pressão final
do gás não
permite, tornando assim irreversível. A redução da pressão é um segundo efeito do processo.
Enunciado 2 – Enunciado de Clausius
É impossível realizar um processo cujo único efeito seja transferir calor de um corpo
mais frio para um corpo mais quente.
Clausius afirma que a transferência de calor é um processo irreversível. Se colocarmos
um corpo aquecido em contato com um corpo frio, o calor será transferido do corpo quente
para o corpo frio até que eles atinjam a mesma temperatura, permanece na mesma
temperatura; calor não é transferido de um para o outro deixando um deles mais frio e o outro
mais quente. Este fato experimental nos fornece uma ideia de que para manter o processo
dessa segunda forma haveria a necessidade de fornecer mais trabalho ao sistema, o que
significa outro efeito do processo (ver figura diagrama Figura 2.4)
21
Figura 2.4 (a) Representação esquemática de um refrigerador. Trabalho é realizado sobre o refrigerador.
(b) Um refrigerador real. Fonte: adaptado de Tipler, volume 1, sexta edição.
22
2.9 CICLO DE CARNOT
Sadi Carnot, físico e matemático francês, estabeleceu um modelo teórico para o
funcionamento de toda máquina térmica, que como um princípio percebeu que era
fundamental uma diferença de temperaturas para que uma máquina térmica funcionasse, tanto
quanto uma diferença de altura o é para o funcionamento de uma roda-d’água.
Conforme Carnot, para converter calor em trabalho, a maquina térmica deve funcionar
entre duas fontes térmicas: uma fonte quente a uma temperatura
, da qual retira uma
quantidade de calor
, e uma fonte fria a uma temperatura
quantidade de calor,
(Figura 2.5). A diferença entre essas duas quantidades de calor, que
serão consideradas sempre em módulo, é exatamente o trabalho
, para a qual rejeita uma
obtido da máquina:
Eq. 2-4
Figura 2.5 Esquema de uma máquina térmica segundo Carnot. Fonte: Torres et al, 2001.
Ligado ao conceito de máquina há o termo ciclo termodinâmico, ou seja, toda
máquina térmica possui um tipo de ciclo e nada mais é que um conjunto de processos
termodinâmicos. Há vários ciclos termodinâmicos, o que nos referimos agora se chama ciclo
de Carnot.
Ele pode ser representado por uma sequencia de transformações gasosas onde uma
máquina térmica tem o seu rendimento máximo operando em ciclos, diante de duas fontes
23
térmicas. Carnot mostrou que quanto maior a temperatura da fonte quente, maior seria seu
rendimento para uma substância que se comportasse como um gás ideal.
Assim temos que os subprocessos que formam o ciclo são:
a) Expansão isotérmica 12 onde o gás retira energia térmica da fonte quente;
b) Expansão adiabática 23 onde o gás não troca calor;
c) Compressão isotérmica 34 onde o gás rejeita energia térmica para a fonte fria;
d) Compressão adiabática 41 onde o gás não troca calor.
Figura 2.6 Ciclo de Carnot para um gás ideal. Fonte: Tipler.
2.9.1
Validade
Para falar em validade nos ciclos termodinâmicos já há a necessidade de mencionar o
conceito de eficiência.
Conforme Carnot a máquina mais eficiente é a máquina reversível. Esta proposição é
conhecida como o teorema de Carnot.
Assim uma máquina reversível operando em um ciclo entre dois reservatórios
térmicos é maquina de Carnot, e seu ciclo como mencionado anteriormente é o ciclo de
Carnot.
24
Para que um sistema tenha o maior rendimento possível como a de Carnot deve
atender as considerações de reversibilidade, ou seja:
1. Nenhuma energia mecânica é transformada em energia térmica interna pelo atrito,
por forças viscosas ou por outras forças dissipadoras.
2. Energia é transferida na forma de calor apenas entre corpos com uma diferença
infinitesimal de temperatura.
3. O processo deve ser quase-estático para que o sistema esteja sempre em (ou
infinitesimalmente próximo de) um estado de equilíbrio.
Assim a máquina térmica de Carnot consiste em quatro etapas reversíveis:
1. Uma absorção quase-estática e isotérmica de calor de um reservatório quente
2. Uma expansão quase-estática e adiabática para uma temperatura menor
3. Uma liberação quase-estática e isotérmica de calor para um reservatório frio
4. Uma compressão quase-estática e adiabática de volta ao estado original
2.9.2
Rendimento térmico
Quando se fala em máquina térmica o fator econômico é de interesse fundamental,
então é intuitivo definir-se a eficiência ou rendimento de uma máquina térmica.
Por definição rendimento térmico é expresso por (Figura 2.5):
Eq. 2-5
Onde
é o rendimento.
Ou de outra forma
Eq. 2-6
2.10
ENTROPIA
Originalmente, "entropia" (troca interior) surgiu como uma palavra cunhada do grego
de em (en - em, sobre, perto de...) e sqopg (tropêe - mudança, o voltar-se, alternativa, troca,
25
evolução...). O termo foi primeiramente usado em 1850 pelo físico Rudolf Julius Emmanuel
Clausius (1822-1888).
A entropia é uma propriedade na física relacionada aos processos. A entropia como
uma propriedade da natureza estabelece que os processos naturais ocorram em apenas um
sentido. Esses processos nunca ocorrerão em sentido contrário.
Entropia é diferente de energia, na medida em que não obedece a uma lei de
conservação.
A característica central da entropia é está relacionado com sua definição quantitativa,
:
Se um processo irreversível ocorre em um sistema fechado, o valor
da entropia
deste sistema sempre aumenta; ela nunca decresce.
Em um processo reversível a variação da entropia é dada por:
Eq. 2-7
Já em um processo irreversível é dada por:
Eq. 2-8
2.11
VISÃO MICROSCÓPICA DA TEMPERATURA ABSOLUTA DE UM GAS IDEAL
A visão microscópica da temperatura absoluta está relacionada com a energia cinética
média das partículas do gás, ou seja, com a distribuição das energias moleculares. Essa
formulação foi obtida por primeiramente por Maxwell. Uma dos resultados para essa questão
é conhecida como distribuição de energia de Maxwell-Boltzmann.
Eq. 2-9
26
3 RESULTADOS
O resultado será apresentado na forma deste relatório impresso e encadernado.
O trabalho foi dividido como mencionado na metodologia sendo que o tópico (2.1);
(2.1); (2.8); (2.9); (2.10); (2.11) pesquisado pelo aluno Elielzer e os demais pelo aluno Ivan.
27
4 CONCLUSÃO
Conclui-se que este trabalho, bastante abrangente, foi essencial para completar o
conhecimento de uma parte da física que será muito útil para que no futuro possa haver mais
uma opção de temas para trabalhos tanto de graduação quanto em nível de pós-graduação. Foi
uma oportunidade para relembrar muitos conceitos bem como agregar novos, como o
conceito de entropia.
28
REFERÊNCIAS
NATIONAL CHUNG HSING UNIVERSITY. Department of Mechanical
Engineering.
Disponível
em:
http://wwwme.nchu.edu.tw/~ICE/Courses/thermodynamics/chap%202%20Thermodynamic%
20Laws.pdf. Acesso em 15/08/2013.
Oliveira, M. J. Termodinâmica. Livraria da Física. 2005. Disponível em:
http://books.google.com.br/books?id=sneRJDSuC-QC. Acesso em 15/08/2013.
PROJETO CIENCIANDO. Potenciais termodinâmicos: uma descrição alternativa.
Disponível em: http://projetocienciando.blogspot.com.br/2012/06/potenciais-termodinamicosuma-descricao.html. Acesso em 14/08/2013.
Falleiro, Neusa A. PMT2305 - Físico-química para Engenharia Metalúrgica e de
Materiais
I.
2006.
Disponível
em
http://www.pmt.usp.br/lpe/FisQ1/0_APOSTILA_1a_%20parte.pdf. Acesso em 15/08/2013.
Sears, Francis W. e Salinger, Gerhard L. Termodinámica teoría cinética y
termodinámica estadística. Editorial Reverté. Barcelona. 1978. Varias paginas.
SALAS
DE
FÍSICA.
Biografias.
Disponível
em.
http://www.geocities.ws/saladefisica9/biografias/carnot.html.Página Nicolas Léonard Sadi
Carnot. Acessado em 16/08/2013.
COLÉGIO ESPIRITO SANTO. Ciclos termodinâmicos. Disponível em:
http://www.if.ufrgs.br/~dschulz/web/ciclos_termodinamicos.htm. Acessado em 16/08/2013.
Nussenzveig, Herch M., Física básica 2. 4ª edição, vol. 2 , Edgard Blucher, S. Paulo,
Tipler, Paul A., Física para cientistas e engenheiros, Rio de Janeiro, LTC, 2012, vol.
1, 499f.
Resnick, R., Halliday, D., Krane, Kenneth S., Física 2, Rio de Janeiro: LTC, 2003,
quinta edição,
29
APENDICE