Morfologia Humana
A célula é formada por diversas estruturas, cada uma com suas funções, mas que juntas são responsáveis
pelo funcionamento de toda célula.
A célula é revestida por uma camada fluida, formada por uma dupla camada de fosfolipídios (os
fosfolipídios são sintetizados no REL- retículo endoplasmático liso), proteínas, colesterol e glicoproteínas;
essa camada é chamada de MEMBRANA PLASMÁTICA. Sua estrutura molecular é chamada de
MOSAICO FLUIDO devido ao fato de suas proteínas integrais flutuarem entre os lipídios, estando em
constante movimento.
A camada lipídica da membrana é formada pelas moléculas de fosfolipídios, que possuem uma parte
hidrofóbica que é a camada interna (apolar) e uma parte hidrofílica (polar) que possui afinidade com a água,
ficando nas extremidades da membrana.
A membrana plasmática tem como uma de suas funções a regulação da entrada e saída de substancias na
célula, através da permeabilidade seletiva. Esse processo tem como critérios o tamanho da substancia (só
permite a entrada de substancias menores que os seus poros ou permite a entrada de algumas substancias
maiores, porém por englobamento, chamado de endocitose), a carga elétrica desta (os canais positivos
permitem a entrada de substancias de cargas negativas, e vice-versa), e o formato (através de seus receptores
específicos). Permite a passagem de moléculas necessárias para a sobrevivencia da célula, e principalmente
permite o equilíbrio do meio interno da célula, independente de como esteja o meio extracelular. Tem como
outras funções a de manter ligações entre as células na constituição dos tecidos; reconhecimento celular
através de seus receptores específicos, manter a integridade da estrutura celular, entre outros.
O transporte de substancias para dentro e fora da célula pode ser por:
-Transporte ativo: Na qual as substancias são transportadas com gasto de energia, esta energia vem da
hidrolise do ATP. As moléculas a serem transportadas ligam-se às proteínas da membrana, que gira e libera
a molécula para o outro lado da membrana. Exemplo: bomba de sódio e potássio.
- Transporte passivo: * Difusão simples, *osmose, *difusão facilitada.
*Difusão simples: As pequenas moléculas atravessam a membrana por um processe passivo, dependendo do
tamanho da molécula e do grau de solubilidade em lipídios.
*Osmose: Há a presença de uma membrana semipermeável separando as duas soluções que possuem
concentrações diferentes. A membrana é permeável ao solvente (água) e impermeável ao soluto, ocorrendo a
passagem de solvente do meio hipertônico para o meio hipotônico, com a intencionalidade de equilibrar os
dois meios.
*Difusão facilitada: Processo no qual ocorre à passagem de moléculas para o interior da célula, com uma
proteína ligada à membrana (permease) que se liga à molécula transferindo- a para o interior da célula sem
gasto de energia.
A membrana também pode se comunicar através das captações de sinais, estabelecendo junções
comunicantes para possibilitar a troca de íons e de pequenas moléculas, na qual através das junções passam
diretamente de uma célula para outra sem atravessar o meio extracelular.
As moléculas sinalizadoras participam de três tipos de sinalização:
-Sinalização endócrina: Os hormônios chegam à célula alvos transportados pelo sangue.
-Sinalização parácrina: As moléculas agem no local e nas células próximas, sendo rapidamente inativadas.
Quando esta molécula atua sobre o mesmo tipo celular que a sintetizou ela recebe o nome de sinalização
autócrina.
-Sinalização sináptica: exclusiva do tecido nervoso, na qual os neurotransmissores agem nas sinapses.
Outra estrutura da célula é o retículo endoplasmático, que se apresenta por uma rede intercomunicante de
vesículas achatadas, vesículas redondas e túbulos, formada por uma membrana contínua e que delimita a
cisterna do RE. Existem dois tipos de RE, o retículo endoplasmático rugoso e o retículo endoplasmático liso.
O RER consiste em cisternas saculares ou achatadas, limitadas por uma membrana contínua e uma
membrana externa do envelope nuclear. Apresentam polirribossomos na superfície externa da membrana,
que confere basofilia (afinidade com básicos) ao RER quando estudados ao microscópio óptico.
Participa da síntese de proteínas, que serão enviadas para o exterior das células ou para uso intracelular. Esse
tipo de retículo é muito desenvolvido em células com função secretora ( por exemplo das células do
pâncreas, que secretam enzimas digestivas). Participa da glicosilação(união) inicial das glicoproteinas, da
síntese de fosfolipidios, da síntese das proteinas integrantes da membrana plasmatica e da montagem de
proteinas com multiplas cadeias polipeptidicas.
A sintese de proteinas, acontece com polirribossomos livres no citosol (líquido que preenche o citoplasma,
que compreende microfilamentos de actina, microtubulos, subunidades proteicas do citoesqueleto,
miosina,enzimas,e outras moleculas como a glicose,vitaminas e aminoácidos). O RNA mensageiro das
proteínas contem uma sequencia adicional de bases que codifica uma sequencia de 20-25 aminoácidos,
chamada de sequencia sinal. Essa sequencia interage com um complexo de seis polipeptídeos não-identicos
mais uma molécula de RNA 7S, que formam a particula reconhecedora do sinal ,a SRP. Essa partícula inibe
a continuação da produção da proteina, até que o complexo SRP polirribossomico se ligue a um receptor da
membrana do RER. Na cisterna do RER a sequencia sinal é removida pela enzima Peptidase do sinal; a
ligação do SRP ao RER possibilita a continuação da sintese protéica.
Nas cisternas do RER ocorrem modificações pós-translacionais (modificações químicas em cadeias
proteicas após a tradução), como hidroxilações, glicosilações, sulfatações e fosforilações. As proteínas ali
sintetizadas têm vários destinos como, por exemplo, armazenamento intracelular como nos lisossomos e nos
grânulos dos leucócitos, armazenamento intracelular provisório para exportação, como no pâncreas e em
algumas glândulas endócrinas.
Transcrição celular
É o processo de formação do RNAm mensageiro a partir da cadeia-molde de DNA. Este tem como função
"informar" ao RNAt (RNA transportador) a ordem correta dos aminoácidos a serem sintetizados mais tarde em
proteínas, através da tradução desse RNA. O processo é catalisado pela enzima RNA-polimerase. Os fatores de
transcrição (auxiliares da RNA-polimerase) são responsáveis por romper as ligações de hidrogênio entre as bases
nitrogenadas dos dois filamentos de DNA, como um zíper. A enzima destaca o filamento de RNA formado a partir do
DNA e volta a unir as duas cadeias de DNA.
O retículo endoplasmático liso não apresenta ribossomos em sua membrana, que é contínua com a do RER.
O REL participa de diversos processos funcionais, por exemplo, nas células que produzem esteroides, como
a glândula adrenal, ele ocupa grande parte do citoplasma celular, contendo algumas enzimas necessárias
para as sínteses destes hormônios. O REL também é abundante nas células do fígado, onde é responsável
pelos processos de conjugação e metilação, dos quais as células lançam mão para inativar certos hormônios
e neutralizar substancias nociva e toxicas. Outra função importante do REL é a síntese de fosfolipídios para
todas as membranas celulares. Apresenta a enzima glicose-6-fosfatase em sua membrana o que permite sua
participação da hidrolise do glicogênio, produzindo glicose para o metabolismo energético. Nas células
musculares estriadas, o REL chama-se retículo sarcoplasmático, e tem papel no processo de contração
muscular e liberar íons cálcio, regulando a contração dos músculos.
O complexo de Golgi ou complexo golgiense é uma organela formada por um conjunto de vesículas
(dictiossomo) achatadas e ligeiramente curvas, dispostas umas ao lado das outras com as porções laterais
dilatadas. Essas vesículas são feitas de membrana dupla lipoproteica (lipídios e proteínas) e dispostas de
forma regular, ao contrario do reticulo endoplasmático que é disposto de forma irregular. Possui uma fase
cis (convexa,voltada para o núcleo) e uma face trans (côncava,voltava para a membrana plasmática) e uma
vesícula mediana. Encontramos o complexo de Golgi entre o RE e a membrana plasmática; geralmente
encontramos o complexo de Golgi em uma determinada região do citoplasma, mas podem ser encontrados
dispersos no citoplasma como, por exemplo, nas células nervosas. A sua função é de elaborar e armazenar
proteínas vindas do RE, podendo também eliminar substancias (ex: enzimas) que irão atuar no meio
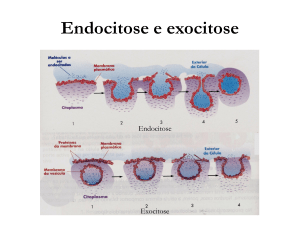
extracelular (exocitose: processo no qual as substancias atuam fora da célula). Ele completa as modificações
pós-tradução, marcando as moléculas sintetizadas e encaminhando- as principalmente para vesículas de
secreção (lisossomos ou membrana celular). As proteínas chegam ao complexo de Golgi por vesículas
transportadoras do RER, entrando na face CIS, e ai migram para as vesículas medianas e finalmente saem
pela face TRANS que origina vesículas secretoras de onde o material deixa o Golgi e depois enviados a
membrana plasmática e aos lisossomos. Tem como função também a produção de enzimas digestivas, nas
células do pâncreas e estomago, secreção de muco nas células caliciformes do intestino, formação do
acrossomo dos espermatozoides e produção de lisossomos.
Os lisossomos são vesículas delimitadas por membrana que impede que as enzimas ataquem o citoplasma,
contem mais de quarenta enzimas hidrolíticas com a função de digestão intracitoplasmática. Estão presentes
em todas as células, porém mais abundantes nas fagocitárias. As enzimas dos lisossomos tem atividade
máxima em pH 5 e variam de célula para célula, sendo as mais frequentes: fosfatases ácida,lipases e betaglicuronidase. As enzimas dos lisossomos são segregadas no RER e transportadas ao complexo de
Golgi,onde existe proteínas, como a mamose fosforilada,possibilitando que as enzimas destinadas ao
lisossomos sejam separadas das outras proteínas. No complexo de Golgi as enzimas serão modificadas e
empacotadas em vesículas que constituem os lisossomos primários.
Os lisossomos primários são lisossomos que ainda não estão participando de processo digestivo. Os
lisossomos secundários são formados a partir da fundição do lisossomo primário com o fagossomo,
misturando assim as enzimas dos lisossomos com o material a ser digerido. Os catabólitos originados da
digestão intralisossomal atravessa a membrana e entram no citosol, onde serão utilizados no metabolismo
celular. Em alguns casos restos de material não digerido podem permanecer no lisossomo, formando corpos
residuais, que podem ser eliminados do citoplasma; quando ocorre o acumulo destes corpos residuais nas
células nervosas e musculares, formam os glanulos de lipofuscina.
Quando os lisossomos secundários recebem o nome de autofagossomo é porque participaram da renovação
de organelas, digerindo organelas da própria célula, que estavam velhas. Estão mais presentes nas células
glandulares, que acumulam excesso de glanulos de secreção, nas células em atrofia, etc.
Em alguns casos os lisossomos são eliminados da célula para que suas enzimas ajam sobre o meio
extracelular.
Já os proteassomos, organelas recentemente descobertas, também ajudam na função de limpeza celular,
porém este complexo de proteases digerem proteínas que estão marcadas pela ubiquitina. Essa degradação
se torna necessária para remover o excesso de enzimas e proteínas, quando estas se tornam inúteis á célula
ou quando estão codificadas por vírus, o que daria origem a milhares de outros vírus. Apresentam a forma de
um barril sobreposto por quatro anéis, e uma partícula reguladora que funciona como uma tampa. Essa
partícula reguladora possui a ATPase, que desenrola a molécula proteica,quando esta é reconhecida devido à
presença de ubiquitina que se liga a um resíduo de lisina na proteína a ser degradada. As ubiquitinas depois
de utilizadas voltam para o citosol para serem usadas novamente.
Os peroxissomos são organelas esféricas, limitadas por membrana, utilizam grande quantidade de oxigênio,
porem não produzem ATP. Oxidam substratos orgânicos específicos, retirando átomos de hidrogênio e
combinando-os com O2; essa reação produz peróxido de hidrogênio, mais conhecido como água oxigenada.
Esta substancia é toxica para célula por isso logo que formadas são degradadas pela enzima catalase,
também presente nos peroxissomos. Os peroxissomos apresenta uma abundancia de enzimas, as mais
abundantes nos humanos são: urato oxidase, D- aminoácido oxidase e catalase.
O ciclo da β- oxidação ocorre nos peroxissomos e nas mitocôndrias, neste ciclo fragmentos com dois átomos
de carbono são removidos sequencialmente dos ácidos graxos de cadeia longa, para a formação de acetilcoenzima A que é exportado para o citosol. O acetil-coenzima A é utilizado em varias reações de síntese
(síntese de ácidos biliares e de colesterol, por exemplo) e pode ser usado nas mitocôndrias para fornecer
energia. As enzimas dos peroxissomos são sintetizadas por polirribossomos livres no citosol, são marcadas
por uma sequencia de aminoácidos localizados próximos à extremidade carboxílica da enzima, funcionando
como um sinal;os peroxissomos reconhecem esse sinal e englobam as enzimas destinadas a ele. Os
peroxissomos se dividem por fissão.
As mitocôndrias são organelas esféricas ou alongadas, que possuem a função de transformar energia
química contida nos metabólicos citoplasmáticos em energia utilizável pela célula. Essa transformação
consiste em 50% para armazenar ligações de fosfato de ATP e os outros 50 % para a manutenção da
temperatura corporal.
Dentro das mitocôndrias encontramos as cristas mitocondriais, a matriz mitocondrial e o citosol, onde são
degradadas inicialmente moléculas como proteínas, lipídios e etc. É também na mitocôndria que acontece o
ciclo de Krebs, que produz inicialmente o ácido cítrico. Nesse ciclo acontece varias reações de
descarboxilação, que produzem CO2 e quatro pares de H+ que são removidos por reações específicas
catalisadas por desidrogenase. Os íons H+ reagem com o oxigênio, gerando H2O. O sistema transportador
de elétrons libera a energia que é capturada para a formação de ATP.
Nas cristas mitocondriais encontramos o DNA, o RNA, proteínas e uma matriz amorfa onde estes
componentes se localizam. Essa matriz é importante no processo de β- oxidação dos ácidos graxos e na
regulação de enzimas.
O DNA desta organela apresenta filamentos duplos e circulares, já o RNA se apresenta de três formas, sendo
elas: RNA ribossomal (RNAr), RNA mensageiro (RNAm), RNA transportador (RNAt).
A reprodução da mitocôndria acontece por mitose, onde cada célula mãe origina duas células- filhas.
Os ribossomos são organelas celulares presentes em todo o citoplasma de células eucarióticas e
procarióticos e também aderidos ao RER. Participam da síntese celular, essas estruturas permanecem
agrupadas ao filamento do RNAm formando os polissomos. São formados a partir de duas subunidades de
tamanhos diferentes: uma maior e outra menor, visíveis ao microscópio eletrônico. São originados da
combinação de ácido nucleico ribossomal (RNAr) a uma enorme quantidade de proteínas, cerca de 50 tipos
diferentes. O ribossomo só funciona quando suas subunidades de juntam. Na subunidade maior temos dois
sítios: um A (aminoacil) e outro P (peptidil) receptivos ao RNAt (substancia carregadora dos aminoácidos).
O núcleo é o ultimo centro de controle da célula, incluindo a tradução. Na cromatina a informação
necessária para a síntese de proteínas é codificada no DNA, cada segmento do DNA é chamado de GENE.
Esta informação contida no gene é copiada para uma molécula de RNAm, que é depois transportada para o
citoplasma. No citoplasma as moléculas de RNAm é usada pelos ribossomos como moldes para a síntese
proteica. O DNA total contem todos os códigos necessários para a formação de milhares de proteínas
diferentes.
No citoplasma um ribossomo move-se ao longo do RNAm lendo o códon para realizar a montagem da
proteína,enquanto ele se move vai reunindo os aminoácidos em uma cadeia polipeptídica que se alonga
gradualmente.No códon final da sequencia a tradução para e as subunidades do ribossomo se separam e a
proteína completa é liberada. O RNAt funciona como um ‘’ dicionário’’ no processo de tradução, ele
reconhece cada um dos 20 aminoácidos que são usados na síntese proteica,ligando cada trinca de bases
(códon) ao RNAm.
As enzimas são produzidas nos ribossomos do RER e de lá vão para o complexo de Golgi onde serão
agrupadas e finalmente expelidas da célula.
Os ribossomos não apresentam membrana e podem ser encontrados em fila com a ajuda de uma fita de RN
A, formando o polirribossomo, ou podem estar espalhados no citoplasma ou no RER, quando um conjunto
de ribossomos atuam no RNAm chamamos de polirribossomos.
O processo de tradução realizado pelo ribossomo se divide em três estágios: o inicial (codificado pelo códon
AUG), o estagio de alongamento (acréscimo de aminoácidos por ligações peptídicas) e o estágio terminal
(codificado por um códon de parada).
O Citoesqueleto é formado por vários tipos de fibras de proteínas que cruzam a célula em diversas direções,
dando-lhe consistência e firmeza. Esta estrutura é importante se lembrarmos de que a célula animal é
desprovida de uma membrana rígida. Os microfilamentos de actina, os microtubulos e os filamentos
intermediários formam estas fibras proteicas que formam o citoesqueleto. O citoesqueleto tem a função de
sustentar, manter a forma e a movimentação de organelas. Os microtubulos são dímeros (dois anéis) de
tubulina cada um com treze protofilamentos, responsáveis pela divisão celular e pela formação de cílios,
flagelos e centríolos. Os microfilamentos são formados por actina, possuem a função de movimentação que
é devido à associação contrátil com a miosina.
Os movimentos celulares podem ocorrer por ação do citoesqueleto, diferenças de viscosidade no
citoplasma ou por sistemas contrateis intracelulares. Estão relacionados com os cílios, flagelos,
pseudopodes, ciclose, sarcomeros. Os cílios e os flagelos tem função de defesa, nutrição e movimentação,
surgem a partir da diferenciação de centríolos que migram ate a membrana plasmática, são formados por
nove pares periféricos de microtubulos e uma central. A base de fixação dos cílios e dos flagelos na
membrana é as proteínas que funcionam como motores. Já o flagelo bacteriano é formado por proteína
flagelina, não tendo nenhuma relação com os centríolos. Os movimentos ameboides ocorrem nas amebas e
leucócitos, ocorrem por diferença de viscosidade ou movimentos contrátil dos microfilamentos.
A contração celular dos sarcomeros promovem os movimentos peristálticos, os batimentos cardíacos, etc.
Ciclose é uma corrente orientada de circulação de matéria gerada no citoplasma por ação de
microfilamentos.
Usualmente o citoplasma contem depósitos transitórios, constituído de reserva de nutrientes ou outras
substancias. Gotícula de lipídios, principais reserva energéticas são frequentes e abundantes nas células do
tecido adiposo, nas da camada cortical da glândula adrenal e nas células do fígado. Depósitos de hidratos de
carbono sob a forma de grânulos de glicogênio (reserva energética) também são frequentes na maioria das
células. Depósitos de pigmentos também são encontrados como a melanina, o caroteno (abundante na
epiderme e na camada pigmentar da retina sob a forma de grânulos envolvidos por membrana). Lipofuscina
é um pigmento pardo que aumenta nas células com a idade, os grânulos de lipofuscina são constituídos por
substancias que não foram digeridas pelos lisossomos. Estão presentes principalmente nas células que não se
renovam como os neurônios e o músculo cardíaco. Todos estes tipos de depósitos são chamados de
depósitos citoplasmáticos.
O citosol ou citomatriz é formado por microfilamentos de actina, microtubulos, subunidades proteicas
desses componentes do citoesqueleto, miosina, enzimas e outras moléculas, como glicose, vitaminas e
aminoácidos, alem de água e íons. Um componente importante do citosol são as proteínas motoras que
participam do transporte intracelular de organelas e vesículas. O citosol fornece substrato para a organização
de moléculas enzimáticas que funcionam melhor quando ordenadas do que dispostas ao acaso (quando
dependeriam de colisões esporádicas com os substratos). No citosol se localizam milhares de enzimas que
produzem muitos tipos de moléculas, bem comoa ruptura de moléculas energéticas para gerar ATP pela via
glicolítica (anaeróbica). Alem disso, toda maquinaria para a síntese proteica, como o RNAr, RNAm, RNAt,
enzimas e outros fatores estão contidos no citosol.
Via endocítica
A via endocítica é também chamada de endocitose, que vem do latim ENDO "dentro" e CITO de "célula" e
SE de "síntese, digestão’’, portanto é a digestão celular, podendo ocorrer de três formas:
* Fagocitose, que consiste na ingestão de partículas grandes ou células através de expansões citoplasmáticas
chamadas pseudópodos;
* Pinocitose, que é o processo contínuo de ingestão de fluídos e moléculas por meio de pequenas
vesículas;apresentando a ultima fase da via endocítica nos lisossomos.
* Endocitose mediada por um receptor , que consiste na ligação duma molécula extracelular a um receptor
na membrana celular. Estes receptores, igualmente constituintes da membrana, estão muitas vezes
associados à proteína do citoplasma denominada clatrina que forma uma depressão na membrana; quando
um receptor se liga a uma molécula, a depressão aumenta até se transformar num vacúolo rodeado de
clatrina, que entra na célula.
O brotamento de membranas mediado por clatrina é usado para transporte de lipídeos e proteínas da
membrana plasmática e da rede trans-Golgi. Nos terminais nervosos, este processo faz parte da reciclagem
de vesículas sinápticas após liberação do neurotransmissor.
A endocitose mediada por clatrina depende de dois grupos de proteínas: as que compreendem a depressão
formando o revestimento da vesícula e um outro grupo que é um arranjo de outras proteínas frequentemente
referidas como proteínas acessórias. Muitas destas proteínas têm sido agora caracterizadas em sua estrutura
cristalizada e suas interações com outras proteínas e fosfolipídios de membrana. O bloco de construção
básico da depressão revestida é a clatrina. Ela consiste de uma estrutura de 3 eixos (tríqueto), sendo que cada
eixo ou perna contém uma cadeia leve e uma cadeia pesada de clatrina. Os tríquetos se reúnem para formar
uma gaiola de hexágonos e pentágonos que se anexa à membrana plasmática via uma proteína adaptadora
tetramérica (complexo AP2) (figura 1). A depressão também contém uma forma específica de neurônio de
uma proteína adaptadora monomérica, AP180, que pode estimular a montagem da clatrina e que parece ser
crítica para a geração de vesículas sinápticas com um tamanho homogêneo.
A formação de uma depressão revestida endocítica parece começar com a ligação da AP2 à membrana. Um
receptor de membrana candidato para AP2 é a proteína de vesícula sináptica sinaptotagmina que se liga a
AP2 via um de seus domínios citoplasmáticos C2. Via um distinto sítio de ligação, AP2 também se liga a
motivos baseados em tirosina que são conhecidos como sinais de direcionamento no contexto da endocitose
mediada por receptor e que ocorre em proteínas de vesículas sinápticas. A formação da depressão revestida
também envolve interações entre proteínas de revestimento e fosfolípides de membrana. Fosfoinositídeos
parecem ter particular importância.
Por exemplo, a membrana plasmática alvo da AP2 depende de seu sítio de ligação a fosfoinositídeos e a
estimulação da síntese de fosfoinositídeos pode acentuar a formação da depressão revestida enquanto
o encobrimento dos fosfoinositídeos pela superexpressão de proteínas ligadoras de fosfoinositídeos tem um
efeito inibidor. A formação da depressão revestida por clatrina pode também ser acentuada pela Dfosfolipase que pode estar parcialmente envolvida na estimulação da síntese de fosfoinositídeos. A DFosfolipase foi encontrada adicionalmente acentuando a estimulação da ligação sinaptotagmina-AP2 pelos
motivos baseados em tirosina, sugerindo uma possível cooperatividade entre a sinalização lipídica e as
interações proteína-proteína.
Entre as proteínas acessórias a dinamina tem sido até aqui a mais estudada. Ela foi originalmente ligada à
endocitose através de uma Drosophila mutante sensível à temperatura (shibire) em que a endocitose é
bloqueada numa temperatura restritiva. A dinamina é uma proteína multi domínio com um domínio GTPase,
um domínio homólogo à pleckstrina ligadora de fosfolípides (PH) e um, então conhecido, domínio efetor
GTPase (GED). O C-terminal consiste de um domínio rico em prolina (PRD) que interage com domínios
homólogos à src (SH3) de outras proteínas acessórias incluindo anfifisina, endofilina, dap 160/intersectina e
sindapina/pacsina. A dinamina tem uma tendência a se reunir em tetrâmeros que podem se polimerizar em
estruturas tipo anel. A estrutura dos polímeros da dinamina é alterada por hidrólise de GTP que pode até
causar vesiculação de túbulos lipídicos. Duas das proteínas acessórias, sinaptojanina e endofilina têm sido
encontradas atuando como enzimas metabolizadoras de lipídeos.
Sinaptojanina é uma polifosfoinositídeo fosfatase que desfosforila fosfoinositídeos nas posições 3, 4 e 5 do
anel inositol e ela pode então regular interações de proteínas endocíticas com a membrana plasmática.
Endofilina atua como uma ácido lisofosfatídico acil transferase (LPAAT) pela conversão de ácido
lisofosfatídico em ácido fosfatídico, a endofilina pode alterar as propriedades biofísicas da bicamada
lipídica. Algumas proteínas acessórias têm sido mostradas por interagirem com proteínas reguladoras de
actina. Por exemplo, dinamina se liga a profilina e sindapina/pacsina se liga a N-WASP.
Figura 1: Diagrama de proteínas implicadas na endocitose de vesículas sinápticas mediado por clatrina. A
clatrina ocorre como um tríqueto consistindo de três cadeias pesadas e leves da clatrina. Os tríquetos se
reúnem em uma gaiola de pentágonos e hexágonos que são conectados à membrana plasmática via um
complexo adaptador AP2. O domínio aminoterminal da cadeia pesada da clatrina (N) se liga ao domínio
dobradiça (hinge) nas subunidades a 2 e b 2 da AP2. O domínio orelha (ou apêndice) da AP2 interage com
um número de proteínas incluindo AP180, Eps 15, anfifisina e auxilina. AP2 interage com sinaptotagmina,
com motivos baseados em tirosina via a subunidade m 2 e com fosfoinositídeos via a subunidade a 2. AP180
é uma proteína tipo adaptadora monomérica que interage com AP2 e estimula a montagem da rede de
clatrina. AP180 também interage com fosfoinositídeos. As proteínas remanescentes (acessórias) não são
usualmente detectáveis em preparações de vesículas revestidas por clatrina; Isto sugere que elas interagem
transientemente com a rede de clatrina. Apenas uma forma está representada, embora existam múltiplas
isoformas.
Cada proteína está representada pelas caixas indicando o tamanho aproximado dos diferentes domínios. Os
domínios com atividade enzimática incluem o domínio GTPase na dinamina e os domínios homólogos a 5fosfatase e Sac1 da sinaptojanina. A atividade LPAAT da endofilina é provável residir na região
aminoterminal conservada da proteína. Domínios moduladores mediando às interações proteín-proteína
incluem os domínios SH3 que interagem com sítios de ligação distintos dentro de domínios ricos em prolina
(PRD) e domínios EH que interagem com motivos NPF (Asn-Pro-Phe). Múltiplas repetições NPF ocorrem
no C-terminal da epsina. As repetições NPF estão também presentes na sindapina e dentro de uma isoforma
da sinaptojanina. ENTH indica um novo domínio denominado domínio homólogo à epsina n-terminal. CC
indica domínios coiled-coil que podem estar envolvidos em heteromerização. Sítios de ligação distintos para
AP2 e clatrina estão presentes na anfifilina e Eps 15
LOCALIZAÇÃO DA ENDOCITOSE MEDIADA POR CLATRINA NAS SINAPSES
As proteínas mencionadas acima são altamente concentradas nos terminais nervosos. Estudos de terminais
em Drosophila e lampréia indicam que, dentro de um terminal, diferentes proteínas endocíticas estão
enriquecidas na região da membrana plasmática, rodeando a zona ativa. Esta região parece definir uma
“zona endocítica" que tipicamente se estende cerca de um mícron da extremidade da zona ativa. A
polimerização da actina pode ser induzida nesta região pela ativação da GTPase com GTPg S. A proteína
ativadora de GTPase tipo rho tem sido localizada nesta zona.
A depressão revestida por clatrina aparece na zona endocítica logo após a exocitose, sugerindo que a
membrana da vesícula sináptica e seus componentes proteicos rapidamente se movem para esta região. O
alvo da formação da depressão revestida por clatrina para a zona endocítica não é, entretanto, absoluto,
como as depressões revestidas podem ocasionalmente ocorrer dentro da zona ativa. Seu número pode
aumentar após manipulações que causam deleção maciça das vesículas sinápticas, sugerindo que a vesículas
sinápticas ancoradas podem limitar a formação de depressões revestidas na zona ativa. A extensão da zona
endocítica na membrana plasmática não parece ser fixa. Após certas manipulações que inibem a endocitose,
as vesículas revestidas podem ocorrer em uma área que se estende diversos mícrons da zona ativa.
Depressões revestidas por clatrina podem também aparecer em invaginações da membrana plasmática que
ocorrem após inibição da endocitose. Neste caso, suas características podem diferir daquelas formadas em
uma zona endocítica intacta, consistente com uma especialização funcional da zona endocítica intacta. A
zona endocítica sináptica pode corresponder a hot spots identificados na membrana plasmática de células
não neuronais.
INÍCIO DA ENDOCITOSE
A endocitose de vesículas sinápticas mediada por clatrina é normalmente acoplada a exocitose, mas os dois
processos podem ser separados experimentalmente. O início da formação da depressão revestida requer
cálcio (baixas concentrações micromolares são suficientes), mas o influxo evocado não é necessário. Este
processo parece também depender de ATP, a queda dos níveis de ATP causa deleção de vesículas e o
aparecimento de invaginações na membrana plasmática. Em contraste, a formação da depressão revestida in
vitro não é dependente de ATP. Após a adição de cálcio, estágios sequenciais da formação da depressão
podem ser identificados pela sua relativa abundância em diferentes pontos no tempo (figura 2). O primeiro
estágio consiste de uma porção da membrana revestida com uma leve curvatura. O segundo estágio é uma
vesícula revestida invaginada com uma ampla base. O terceiro estágio é uma vesícula revestida invaginada
com um estreito pescoço. Uma estrutura tipo anel é ocasionalmente vista em volta do pescoço estreito que
define um quarto estágio embora sua baixa abundância torne a localização na sequencia um tanto incerta. O
próximo estágio é provável ser representado por uma vesícula revestida livre, mas, este estágio parece ser
muito transiente.
INTERMEDIÁRIOS NA FORMAÇÃO DA DEPRESSÃO REVESTIDA: INVAGINAÇÃO DA
MEMBRANA REVESTIDA
Estudos de microinjeções em sinapse gigante de lampréia sugerem que as proteínas da depressão revestida
não podem sozinhas gerar uma depressão revestida invaginada, mas fatores acessórios, incluindo endofilina,
parecem ser requeridos. Após microinjeção pré-sináptica de anticorpos anti-endofilina, a estimulação causa
deleção das vesículas sinápticas juntamente com uma maciça acumulação de vesículas
revestidas superficiais (shallow) na zona endocítica . In vitro, a formação de depressões revestidas a partir
do citosol do cérebro não é afetada pela imunodeleção de endofilina, indicando que ela atua na membrana,
mais propriamente na montagem da depressão. Uma possibilidade é que a conversão de ácido lisofasfatídico
a ácido fosfatídico pela endofilina promove a geração de uma curvatura de membrana negativa nas
extremidades da depressão revestida. Schmidt et al apontam que a atividade LPAAT pode também induzir
outros efeitos tal com um metabolismo de fosfoinositídeos alterado. A importância geral da composição da
membrana plasmática para invaginação da depressão revestida tem sido apoiada pelos achados que a deleção
de colesterol inibe este processo. A tensão de superfície da membrana plasmática é outro fator
potencialmente importante que pode ser indiretamente influenciado pela endofilina, talvez via o
citoesqueleto. Ademais, parceiros de ligação do domínio SH3 da endofilina, incluindo dinamina e
sinaptojanina poderiam estar envolvidos.
ESTREITANDO A REGIÃO DO PESCOÇO
O processo subsequente à invaginação - estreitamento do pescoço da depressão revestida invaginada, parece
também depender de mecanismos extrínsecos para o revestimento de clatrina. A microinjeção de toxinas
para actina pode aumentar a quantidade de depressões revestidas com um grande pescoço em sinapses
estimuladas. A ruptura da actina tem sido proposta por afetar a formação de depressões revestidas de clatrina
na membrana plasmática de outros tipos de células, mas os efeitos são variáveis e o exato papel da actina na
formação de depressões revestidas permanece obscuro. Um envolvimento geral da actina na endocitose tem,
entretanto, sido suportada por estudos de imagem da actina acoplada a GFP (Green fluorescent protein) em
células tronco , que indicam que a polimerização da actina ocorre nas invaginações da membrana endocítica
emergentes. A polimeração da actina na zona endocítica das sinapses parece estar acoplada com a atividade
sináptica, possivelmente através da sinalização via GTPases e fosfoinositideos. Ambos os tipos de sinal
podem regular a polimerização da actina mediada por N-WASP/asp 2,3.
FISSÃO
A fissão do pescoço da depressão revestida é sensível a uma variedade de perturbações. Em terminais
nervosos do mutante shibire, depressões endocíticas invaginadas com um pescoço estreito rodeado por um
anel eletron-denso se acumulam em uma temperatura restritiva. A localização da mutação de shibire para o
domínio GTPase da dinamina junto com as observações que a hidrólise de GTP pode alterar a estrutura do
polímero de dinamina, sugerindo que hidrólise de GTP pela dinamina pode conduzir à fissão. Entretanto,
recentes estudos da dinamina discutem contra este modelo. O GED da dinamina parece mediar o aumento da
atividade GTPase que ocorre durante a oligomerização.
Quando a estimulação da atividade GTPase é perturbada por mutações em GED, a endocitose mediada por
receptor encontra-se acentuada ao invés de inibida. Enquanto esta descoberta não explica o papel da
atividade GTPase da dinamina, ela mostra que a atividade GTPase não é razão limitante para a endocitose. É
possível que a dinamina, como as GTPases convencionais, atue como um regulador que interage com
efetores downstream no seu estado ligado a GTP.
Um outro intermediário relatado à dinamina – uma depressão revestida de clatrina com um pescoço
alongado rodeado por múltiplos anéis eletron-densos, pode estar aprisionado com GTPg s, o análogo de
GTP lentamente hidrolisável. Este intermediário foi primeiro observado in vitro, mas ele também ocorre em
sinapses estimuladas depois da microinjeção de GTPg s. Embora os mecanismos subjacentes à indução deste
intermediário sejam incertos (outras GTPases que a dinamina podem estar envolvidos), têm-se fornecido
insight sobre a composição da maquinária de fissão. Estudos imunocitoquímicos sugerem que os anéis
dependentes de GTPg s contêm ambos dinamina, amfifisina e endofilina. A interação entre dinamina e
amfifisina parece ser essencial para a fissão, como a microinjeção de proteínas ou peptídeos que inibem esta
interação causa deleção de vesícula sináptica juntamente com uma acumulação maciça de depressões
revestidas invaginadas com pescoços estreitos. Anéis eletron-densos não são vistos após esta perturbação,
indicando que interações do domínio SH3 contribuem para a formação do anel.
Um aprisionamento depressões revestidas invaginada, intensamente similares, pode ocorrer também após
perturbação da endofilina. Em estudos de injeção de anticorpos discutido acima, invaginações da membrana
plasmática algumas vezes são estendidas para fora da zona endocítica. A localização destas invaginações
mostram que elas algumas vezes contêm depressões revestidas invaginadas com pescoço estreitos diferindo
das depressões revestidas superficiais (shallow) na zona endocítica. Estas observações parecem convergir
com os estudos de formação de vesícula tipo sináptica em células permeabilizadas PC12. Neste ensaio,
ambas endofilina e dinamina são requeridas para a formação da vesícula. Endofilina é somente ativa quando
seu domínio SH3 está intacto, consistente com o papel das interações dinamina-endofilina na fissão. Esta
possibilidade, entretanto, permanece a ser testada experimentalmente. A formação de vesícula in vitro foi
também observada por ser sensível a tratamentos interferindo com o metabolismo de lipídeos catalisado pela
atividade LPAAT. A proteína de tráfego no Golgi CtBP/BARS (carboxy-terminal-binding protein/brefeldin
A-ADP-ribosylated substrate) tem também sido mostra possuir atividade LPAAT. Túbulos de Golgi
incubados com concentrações crescentes de CtBP/BARS exibem um aumento da ocorrência de invaginações
que parecem proceder à vesiculação.
Assim, estudos recentes indicam que a fissão de depressões revestidas de clatrina depende de uma ação
coordenada de um conjunto de proteínas que inclui dinamina, anfifisina, endofilina e talvez outras. A
sequencia exata de eventos durante a fissão permanece por ser elucidada.
PERDA DO REVESTIMENTO
Ainda não tem sido possível traçar a via exata da vesícula endocítica depois que foi deixada na membrana
plasmática na zona endocítica. Mais provavelmente, uma rápida perda do revestimento ocorre, já que
vesículas revestidas livres são raramente vistas em sinapses estimuladas. A reação de perda de revestimento
envolve dissociação do revestimento de clatrina pela proteína ATPase e auxilina. Sinaptojanina 1 tem
também sido proposta como uma proteína que contribui para a perda do revestimento.
TRANSPORTE DE VESÍCULAS RECÉM-RECUPERADAS
A recente vesícula endocíticas sem revestimento pode retornar diretamente para o sítio de liberação como
vesículas sinápticas totalmente funcional, ou pode passar através de um passo de fusão e brotamento
secundário. Enquanto evidência para a formação de vesícula sináptica de ambos compartimentos
endossomal e de membrana plasmática têm sido obtidos, o passo de brotamento tem recentemente sido
favorecido com principal rota fisiológica. O transporte baseado em actina tem sido implicado no transporte
de vesículas endocíticas em outros tipos celulares e isto pode desempenhar um papel similar no transporte de
vesículas sinápticas entre a zona endocítica e o cluster de vesículas sinápticas.