FESURV – UNIVERSIDADE DE RIO VERDE
FACULDADE DE MEDICINA VETERINÁRIA
AGENTES CAUSADORES DE INFECÇÕES URINÁRIAS EM CÃES EM RIO
VERDE–GO: OCORRÊNCIA E DETERMINAÇÃO DA SENSIBILIDADE A
ANTIMICROBIANOS
LARESSA RODRIGUES FREITAS
Orientadora: Profª. Esp. ANDRÉA CRUVINEL ROCHA SILVA
Trabalho de Conclusão de Curso apresentado
à Faculdade de Medicina Veterinária da
Fesurv – Universidade de Rio Verde,
resultante de Projeto de Pesquisa como parte
das exigências para obtenção do título de
Médico Veterinário
RIO VERDE - GOIÁS
2011
LARESSA RODRIGUES FREITAS
AGENTES CAUSADORES DE INFECÇÕES URINÁRIAS EM CÃES EM RIO
VERDE–GO: OCORRÊNCIA E DETERMINAÇÃO DA SENSIBILIDADE A
ANTIMICROBIANOS
Trabalho de Conclusão de Curso apresentado à
Faculdade de Medicina Veterinária da Fesurv –
Universidade de Rio Verde, resultante de Estágio
Curricular Supervisionado como parte das
exigências para obtenção do título de Médico
Veterinário.
Aprovada em 07/06/11
PROFª. Ms. LUCILIA APARECIDA DA SILVA
PROFª. MED. VET. REJANE GUERRA RIBEIRO
PROFª. Esp. ANDRÉA CRUVINEL ROCHA SILVA
(Orientadora)
RIO VERDE - GOIÁS
2011
DEDICATÓRIA
Este trabalho é dedicado aos meus pais, que sempre me apoiaram e estavam juntos
comigo, em todos os momentos de alegria, tristeza, dificuldade e superação, me fortalecendo
com suas palavras e atitudes e sempre acreditando, que eu estava fazendo o meu melhor.
AGRADECIMENTOS
Senhor, obrigado por me proporcionar mais esta alegria, por ter me dado sabedoria,
força, quando preciso e nunca ter me abandonado.
Aos meus pais Jurandira Pires Rodrigues de Freitas e Soneir Antônio de Freitas, que
sempre estão do meu lado, sendo o meu porto seguro diante das dificuldades e que são para
mim o que há de mais valioso que tenho “amo muito vocês dois”. Mãe, muito obrigada por
acreditar sempre em mim, no meu potencial! Pai, muito obrigada pela força, por me proteger
sempre!
A minha maninha Andressa Paula Rodrigues de Freitas que me aturou nestes anos de
faculdade, que sempre acreditou, que eu seria a melhor e que sempre me motivava, quando
estava triste.
As minhas amigas Fernanda Vieira, Eliane Rodrigues e ao meu primo Diego
Rodrigues, que me ajudaram a tornar este sonho possível.
Aos meus colegas de faculdade, obrigada todos vocês pelas risadas, os momentos
bons, a ajuda quando precisava e que contribuíram muito em meu aprendizado,
proporcionando momentos inesquecíveis, que deixarão saudades. Desejo a vocês todo o
sucesso do mundo!
A minha orientadora Andréa Cruvinel, por ter aceitado me orientar, por ter acreditado
em meu potencial, me ajudado inúmeras, vezes quando solicitei. Tenho-lhe muita admiração,
me orgulho de ser sua orientanda!
Aos meus professores que propuseram seus conhecimentos sempre a disposição
quando solicitados, nunca me negando ajuda, em especial aos professores Rejane Guerra,
Murici Segato, Andrea Cruvinel Rocha Silva, Lucília Silva, Ednea Freitas Portilho e Ariel
Stela.
Aos supervisores, professores, residentes, estagiários e funcionários do Hospital
Veterinário da Universidade Federal de Uberlândia, em especial aos residentes Luiz e Flávia,
que acompanhei na clinica médica de pequenos animais que estavam sempre disponíveis para
tirar qualquer tipo de dúvida e se mostraram com grande humildade, durante o Estágio
Supervisionado. Tenham certeza que todos contribuíram muito para meu aprendizado.
RESUMO
FREITAS, Laressa Rodrigues. Agentes causadores de infecções urinárias em cães em Rio
Verde-GO: ocorrência e determinação da sensibilidade a antimicrobianos. 2011. 44f.
Monografia (Graduação em Medicina Veterinária) – Fesurv – Universidade de Rio Verde, Rio
Verde, 2011.1*
As infecções do trato urinário (ITU) usualmente ocorrem quando há uma falha temporária ou
permanente, nos mecanismos de defesa do hospedeiro e suficiente número, principalmente de
bactérias, que se multiplicam e persistem em numa porção do trato urinário. Foram coletadas
26 amostras de urina obtidas, por cistocentese em cães com sinais clínicos de ITU, no ano de
2010, no Centro de Controle de Zoonoses (CCZ), situados no município de Rio Verde-GO,
com objetivo de estabelecer o índice de ITU, os agentes etiológicos e o antibiograma. As
amostras foram submetidas à urinálise e também à urocultura. Dentre as amostras, 16
(dezesseis) apresentaram bacteriúria, destas somente quatro amostras tiveram cultura positiva.
Na identificação das bactérias utilizaram-se os métodos bioquímicos tradicionais e o
antibiograma. Foram isoladas cinco tipos de bactérias, sendo três bactérias gram-positivas do
tipo Staphylococcus (aureus, epidermides e saprophyticus) e duas gram-negativas Citrobacter
sp e Klebsiella sp. Dentre os antibióticos mais eficazes estão o norfloxacino e a cefalotina,
que apresentaram eficácia contra os cinco tipos encontrados, porém ainda se mostraram
eficientes os fármacos nitrofurantoina, tetraciclina, clorafenicol, norfloxacino, eritromicina e
enrofloxacino. Apesar do número reduzido de amostras, os resultados reforçam a necessidade
do conhecimento do perfil de suscetibilidade antimicrobiana das bactérias causadoras de ITU,
para evitar o uso incorreto de antibióticos.
PALAVRAS-CHAVE:
Urina. Cultura. Antibiograma. Bactérias. Caninos.
1
Banca Examinadora: Profª. Esp. Andréa Cruvinel Rocha Silva (Orientadora); Profª. Rejane Guerra Ribeiro e
Profª. Ms.Lucília Aparecida da Silva. - Fesurv
ABSTRACT
FREITAS, Laressa Rodrigues. Causative agents of urinary infections in dogs in Rio
Verde-GO: occurrence and determination of antimicrobial sensitivity. 2011. 44f.
Monograph (Graduation in Veterinary Medicine) - Fesurv - University of Rio Verde, Rio
Verde, 2011.18
The urinary tract infections (UTI) usually occur when there is a temporary or permanent
failure in the mechanisms of host defense and especially sufficient number of bacteria that
multiply and persist in a portion of the urinary tract. We collected 26 urine samples obtained
by, cystocentesis in dogs with clinical signs of UTI in the year 2010, the Center for Zoonosis
Control (CCZ), located in Rio Verde-GO, aiming to establish the rate of UTI, etiologic agents
and antibiotic susceptibility. The samples were subjected to urinalysis and urine culture to
also. Among the samples, 16 (sixteen) had bacteriuria, only four of these samples were culture
positive. In identifying the bacteria used the traditional biochemical methods and
susceptibility. Were isolated from five types of bacteria, three Gram-positive bacteria like
Staphylococcus (aureus, epidermidis and saprophyticus) and two gram-negative Citrobacter
sp and Klebsiella sp. Among the antibiotics are more effective than norfloxacin and
cephalothin, showed efficacy against five types found, but still were effective drugs
nitrofurantoin, tetracycline, chloramphenicol, norfloxacin, erythromycin and enrofloxacin.
Despite the reduced number of samples, the results reinforce the need for knowledge of
antimicrobial susceptibility of bacteria causing UTI, to prevent the misuse of antibiotics.
KEY WORDS:
Urine. Culture. Sensitivity. Bacteria. Canines.
1
Board of examiners: Profª. Esp. Andréa Cruvinel Rocha Silva (Advisor) – Fesurv; Profª. Rejane Guerra Ribeiro
e Profª. Ms.Lucília Aparecida da Silva. Fesurv
LISTA DE FIGURAS
FIGURA 1
Sistema urinário canino.……………………………………...................
12
FIGURA 2
Rins..........................................................................................................
13
FIGURA 3
Técnica de cistocentese.………………...................................................
20
FIGURA 4
Cultura das amostras.…………………...................................................
29
FIGURA 5
Teste de manitol.……………..……........................................................
30
FIGURA 6
Teste de sensibilidade a novobiocina – amostra 3.…………..................
31
FIGURA 7
Teste de sensibilidade a novobiocina – amostra 10.................................
31
FIGURA 8
Provas bioquímicas.………………….....................................................
32
FIGURA 9
Antibiograma – amostra 3..............………………..................................
34
FIGURA 10
Antibiograma – amostra 6.............…………….......................................
34
FIGURA 11
Antibiograma – amostra 8...........…………….........................................
34
LISTA DE TABELAS
TABELA 1 Provas bioquímicas e identificação de bactérias gram-positivas............
29
TABELA 2 Identificação das espécies de staphylococcus de maior importância
clínica …..................................................................................................
30
TABELA 3 Provas bioquímicas e identificação de bactérias gram-negativas............
32
TABELA 4 Limites para interpretação do antibiograma com 24 antibacterianos de
uso corrente na terapêutica clínica.........………......................................
33
LISTA DE ABREVIATURAS
CCZ – Centro de Controle de Zoonoses
EAS – Uranálise
FESURV – Universidade de Rio Verde
ITU – Infecções do Trato Urinário
NCCL - National Committee for Clinical Laboratory Standards.
VM – Vermelho Metila
VP – Voges-Proskauer
SUMÁRIO
1 INTRODUÇÃO...........................................................................................................
11
2 REVISÃO DA LITERATURA…...............................................................................
12
2.1 Sistema urinário canino……………….…...............................................................
12
2.1.2 Principais doenças do trato urinário………………………………...............…...
13
2.1.3 Infecção do trato urinário......................….............................................................
15
2.1.3.1 Conceito…………………….…….....................................................................
15
2.1.3.2 Sinais clínicos......................…….......................................................................
16
2.1.3.3 Epidemiologia……………………………………………….............................
17
2.1.3.4 Diagnóstico…………………………………….................................................
18
2.1.3.5 Tratamento…………………………………......................................................
23
3 MATERIAL E MÉTODOS……………………………………….............................
27
4 RESULTADOS E DISCUSSÃO …………………..……….....................................
28
5 CONCLUSÃO…….....................................................................................................
36
REFERÊNCIAS.............................................................................................................
38
1 INTRODUÇÃO
O Brasil possui a segunda maior população de cães do Mundo, com cerca de 30
milhões de animais. Os cães são em sua maioria animais dóceis e de fácil trato, porém
algumas doenças podem acometer os caninos durante sua vida.
A infecção urinária é cada vez mais frequente na clínica de cães. A infecção pode
predominar em um ou mais locais do aparelho urinário, como no rim (pielonefrite), ureter
(uretrite), bexiga (cistite), ou pode ainda restringir-se à urina (bacteriúria). O ponto chave é
saber que todo o aparelho urinário está em risco de invasão, tão logo qualquer área esteja
infectada. As infecções do trato urinário (ITU) ocorrem quando a bactéria entra no organismo
dos animais através da uretra e se desenvolve na bexiga, assim uma vez que ITU do cão tornase uma infecção da bexiga, pode ser difícil de tratar.
Esse tipo de infecção usualmente ocorre quando há uma falha temporária ou
permanente, nos mecanismos de defesa do hospedeiro e suficiente número de bactérias, que se
multiplicam e persistem em uma porção do trato urinário. A ITU atinge 14% da população
mundial de cães. Localiza-se nos rins, bexiga urinária, próstata ou mais de um órgão ao
mesmo tempo (BARSANTI; JOHNSON, 1990), sendo que as fêmeas e os animais idosos
estão mais predispostos à infecção (ETÜN et al., 2003).
Não existe levantamento brasileiro sobre a prevalência dos agentes envolvidos, nem da
sensibilidade destes, aos antimicrobianos utilizados rotineiramente, na clínica de pequenos
animais. Estudos, como este, visam aperfeiçoar o tratamento em casos de ITU inferior em
cães e também a orientação dos Médicos Veterinários, sobre o uso racional de
antimicrobianos, para evitar o surgimento de bactérias super-resistentes.
O objetivo deste trabalho é determinar os agentes causadores de ITU inferior de cães e
também estabelecer a sensibilidade dos agentes frente a antimicrobianos usualmente
utilizados, na rotina de uma clínica veterinária.
2 REVISAO DA LITERATURA
2.1 Sistema urinário canino
O sistema urinário dos cães (Figura 1), é composto pelos rins, os ureteres, a bexiga e a
uretra (NETTER, 2000).
Fonte: Swenson; Reece (1996).
FIGURA 1 – Sistema urinário canino.
Esse sistema realiza funções metabólicas, humorais e excretoras, sendo que a maioria
das anormalidades, que o acometem pode ser diagnosticada pelo exame físico, urinálise e pela
interpretação da bioquímica sérica (FRASER et al., 1997).
Os rins (Figura 2), são órgãos pares, em forma de grão de feijão, localizados logo
acima da cintura, entre o peritônio e a parede posterior do abdome. Sua coloração é vermelhoparda. Sua principal função é a regulação do fluido extracelular, que indiretamente contribui
para a composição do liquido intracelular. Estas funções são alcanças, por mecanismos de
filtração, reabsorção, secreção e produção hormonal inerentes aos rins, e fundamentais para a
manutenção da homeostase (NETTER, 2000).
13
Fonte: Veterinary Focus (2007).
FIGURA 2 – Rins.
Segundo descreve Netter (2000), os ureteres têm a função de conduzir a urina dos rins
para a bexiga, onde é temporariamente armazenada. Normalmente se encontram em número
de um por rim, ligando-se a este através da pelve renal, onde todos os ductos papilares se
abrem. Cada ureter se apresenta com uma forma tubular que durante todo o seu trajeto
apresenta um diâmetro bem uniforme, se inserindo obliquamente na parede vesical,
garantindo certo comprimento de trajeto intramural que protege os ureteres contra o refluxo
de urina, quando a pressão se encontra aumentada dentro da bexiga.
Na Figura 1 percebe-se a bexiga, que é um órgão de armazenamento bastante elástico
e, portanto, raramente apresenta tamanho, posição e relação constante com outras estruturas.
Quando contraída, a bexiga se encontra situada sobe os ossos púbicos, estando confinada à
cavidade pélvica ou prolongando-se pelo abdome quando mais distendida (FOGLE, 20110).
A uretra (Figura 1), é o canal que se estende do pescoço da bexiga até o meato uretral,
na extremidade distal do pênis no macho e no vestíbulo vaginal na fêmea, carreando a urina
armazenada na bexiga para o meio exterior. O pescoço da bexiga é bastante curto nos cães
continuando-se quase que diretamente com a próstata, sendo a uretra dividida nas porções
prostática, membranosa e cavernosa ou peniana (NETTER, 2000).
2.1.2 Principais doenças do trato urinário
As doenças do trato urinário são frequentemente diagnosticadas, na rotina de
atendimento clínico a cães e gatos, correspondendo a uma importante parcela das queixas
14
clínicas dos proprietários. Anatomicamente as doenças do trato urinário podem ser classificadas
de acordo com a localização. De acordo com Fraser et al. (1997), as doenças que afetam os rins
e/ou ureteres são classificadas como doença do trato urinário superior, enquanto que aquelas cuja
localização anatômica do órgão afetado está distal ao ureter, como bexiga e uretra, são
denominadas de doenças do trato urinário inferior.
Habitualmente, as cistites são infecções não complicadas, enquanto as pielonefrites, ao
contrário, são mais frequentemente complicadas, pois em geral resultam da ascensão de
microrganismos do trato urinário inferior e estão frequentemente associadas com a presença de
cálculos renais. O diagnóstico das infecções do trato urinário é sempre feito em bases clínicas e
laboratoriais. Estima-se que 14% dos cães irão desenvolver ITU, em alguma fase da vida e, cinco
a 10% dos cães hospitalizados apresentam esta afecção, a despeito da razão para a sua admissão
(LING, 1984; BARSANTI, 1998; BARTGES, 2004).
De acordo com Ricetto (2011), a cistite consiste em processo inflamatório ou infeccioso
vesical. Podem ser não-bacterianas e bacterianas. As não bacterianas são aquelas que são causadas
por vírus, fungos, protozoários, ou ainda relacionadas, às doenças não infecciosas. Já as
bacterianas, é a resposta inflamatória da penetração da bactéria na mucosa vesical. Ocorre, com
grande frequência, em cães, independente da raça, sexo ou idade. Manifesta-se com um quadro
miccional irritativo, caracterizado por disúria, polaciúria, urgência miccional ou mesmo
incontinência de urgência.
Outra doença que afeta o sistema urinário, é a incontinência urinária, que é caracterizada
pela micção involuntária, podendo ter várias causas. Conforme descreve Silva et al. (2011), essa
doença resulta-se de lesões do sistema nervoso, de mal formações congênitas, de lesões adquiridas
na bexiga e nos esfíncteres ou de desequilíbrios hormonais. Não existe, por isso, um tratamento
único para a incontinência urinária, mas tratamentos específicos de acordo com cada causa. A
incontinência associa-se à inflamação prostática, hiperplasia, metaplasia e neoplasias da próstata,
pela compressão de estruturas nervosas ou anatômicas envolvidas na micção. As prostatites
relacionam-se a diferentes causas de alterações da micção, incluindo cistite e uretrite,
incompetência de esfíncter uretral, instabilidade do músculo detrusor da bexiga e espasmo uretra.
A incontinência também pode surgir como sequela de certas intervenções cirúrgicas, causadas por
fístulas ou por aderências (ETTINGER; FELDMAN, 2004).
A insuficiência renal aguda pode ser definida como um declínio abrupto e sustentado na
filtração túbulo-glomerular (GRAUER; LANE, 1997). Neste tipo de doença, o quadro do cão é
mais grave, com vômitos e diarréias, por vezes hemorrágicas. Nesta forma de insuficiência renal,
podem estar fatores isquêmicos (caso do rim que tenha sofrido alterações decorrentes de
15
mudanças de circulação sangüínea), infecciosos (sobretudo leptospirose) e tóxicos (PIRANI,
2008). Essa doença possui três fases distintas: início (momento que vai desde a ocorrência do
insulto renal, até o desenvolvimento de diminuição da capacidade de concentração da urina e da
ocorrência de azotemia), a fase de manutenção (quando já estão estabelecidas as lesões tubulares
renais) e a fase de recuperação (onde as lesões renais são reparadas e a função renal melhora)
(GRAUER; LANE, 1997; NELSON; COUTO, 2001; FORRESTER, 2003).
Os cálculos urinários ou urólitos ocorrem com frequência nos cães e se alojam na bexiga e
uretra. Os cálculos localizados dentro dos rins são bem mais raros. A formação do cálculo se dá a
partir do aparecimento de cristais na urina. Esses cristais podem ter diversas composições (uratos,
oxalato de cálcio, fosfato triplo, sílica e cistina). Por fatores ainda não totalmente conhecidos, os
cristais começam a se agrupar formando o cálculo (OLIVEIRA, 2010). De acordo com Forrester
(2003), encontram-se nos cães quatro tipos de urólitos (cálculos): os de fosfato, geralmente
associados a uma infecção do trato urinário; os de urato; os de oxalato decorrentes de alterações
metabólicas; e os de cistina, cuja ocorrência depende de predisposição hereditária. O diagnóstico
dos cálculos urinários pode ser feito pela simples palpação da bexiga (diagnóstico de cálculos
grandes) e histórico do animal, mas é interessante proceder a exames complementares como
ultrassonografia, raio X e exame de urina (PARISI, 2011). A presença destes cálculos no trato
urinário pode levar ao aparecimento de hematúria (sangue na urina), cistites, incontinência,
retenção urinária, complicações infecciosas e renais. Por vezes um cálculo introduz-se na uretra e
não consegue passar por certas zonas particularmente estreitas. Daí resulta uma obstrução uretral,
que só poderá ser resolvida, muitas vezes, recorrendo-se à cirurgia.
A infecção do trato urinário (ITU) é a presença de microorganismos nos tecidos do
sistema urinário, incluindo rins, sistema coletor, bexiga e próstata. As bactérias são os
microorganismos mais frequentemente envolvidos, mas fungos e vírus também podem ser
agentes etiogênicos das infecções do trato urinário.
2.1.3 Infecção do trato urinário
2.1.3.1 Conceito
As ITUs estão entre as doenças infecciosas mais comuns na prática clínica, sendo
apenas menos frequente que as do trato respiratório (FERREIRA; ÁVILA, 2001). Pode se
conceituar infecção urinária como a presença de microorganismos em alguma parte do trato
urinário. Quando surge no rim, chama-se pielonefrite; na bexiga, cistite; na próstata, prostatite
16
e na uretra, uretrite. A grande maioria das infecções urinárias é causada por bactérias, mas
também podem ser causadas por vírus, fungos e outros microorganismos. A maioria ocorre pela
invasão de alguma bactéria da flora intestinal no trato urinário. A bactéria Escherichia coli,
representa de 80 a 95% dos invasores infectantes do trato urinário (ABC DA SAÚDE, 2011).
A infecção urinária em cães é causada pela proliferação das bactérias na bexiga ou uretra,
ocorrendo principalmente em fêmeas e animais idosos, por terem maior propensão a afecções,
também é comum em animais com a uretra curta, pois esse órgão é considerado uma barreira
contra a ascensão de bactérias até a bexiga (SIVIEIRO, 2011).
O trato urinário dos animais é frequentemente desafiado por microrganismos tanto da
microbiota normal quanto da patogênica e dependendo das condições sanitárias do animal e do
ambiente pode ocorrer desde uma infecção inaparente até lesões graves do aparelho urinário
(GALHARDO et al., 2002). Os cães apresentam diversos mecanismos de defesa contra ITUs,
dentre eles a microflora natural da porção distal da uretra, frequência de micção, anatomia,
mucosa vesical, propriedades antimicrobianas da urina e imunidade local e sistêmica
(OSBORNE; LEES, 1995).
Quando há falhas em alguns destes mecanismos, aumentam-se as chances de uma
infecção. Doenças sistêmicas, como hiperadrenocorticismo e diabetes mellitus, são
predisponentes (MCGUIRE et al., 2002), assim como o uso crônico de glicocorticóides (IHRKE
et al., 1985) e o cateterismo vesical, principalmente em fêmeas (LIPPERT; FULTON; PARR,
1988).
Segundo Duarte (2009), embora não haja uma causa única para as doenças do trato
urinário, os veterinários admitem que alguns componentes podem contribuir com a prevalência do
problema. Entre os componentes destacados pela autora estão: cães entre dois e dez anos de idade
e gatos com mais de um ano de vida são os mais susceptíveis; tanto machos, quanto fêmeas,
adoecem com a mesma frequência, embora os machos apresentem um risco maior de obstrução
uretral por cristais ou urólitos, o que pode, por sua vez, ameaçar a vida; cães de pequeno porte são
mais predispostos que os de raças grandes; entre outros fatores predisponentes. Além desses,
pode-se citar: falta de atividade física, incapacidade de urinar com a regularidade necessária
(animais confinados), baixa ingestão de água.
2.1.3.2 Sinais clínicos
Há um número de lugares em que as bactérias podem igualmente acumular nos cães.
Para fêmeas, está em sua área vaginal, enquanto que a área da próstata é a mais propicia para
17
o macho. Quando as bactérias atingem a uretra e chegam ao aparelho urinário, acabam por
infectá-lo. O acesso dos microorganismos ao trato urinário se dá por via ascendente, ou seja,
pela uretra, podendo se instalar na própria uretra e próstata, avançando para a bexiga e, com
mais dificuldade, para o rim (ABC DA SAÚDE, 2011).
As ITUs classifica-se como complicadas ou não. No segundo caso, enquadram-se as
inferiores bacterianas, nas quais não há falhas nos mecanismos de defesa e respondem bem à
antibioticoterapia. Nas complicadas, as falhas são evidentes e, geralmente, urolitíases,
neoplasias vesicais, divertículos ou retenção urinária são identificados. Estas falhas devem ser
corrigidas para o tratamento ser efetivo (SHAW, 1990).
Os sinais da ocorrência desse fator nos animais se dão pelo aumento do número de
vezes em que ele urina, porém com volume menor, a dificuldade em urinar em virtude da dor,
a perca da capacidade de segurar a urina durante grandes períodos em que fica isolado,
começando assim a urinar em lugares não usuais e ainda sua urina pode conter sangue e ter
cheiro desagradável (SIVIEIRO, 2011).
2.1.3.3 Epidemiologia
A principal via de aquisição da ITU é a via ascendente, por patógenos que colonizam a
região periuretral. A aquisição por via hematogênica ocorre predominantemente no período
neonatal.
Os agentes etiológicos das ITUs em geral são microrganismos de crescimento rápido.
Mais de 95% das ITUs são causadas por enterobactérias, a Escherichia coli, Enterococcus
spp., Klebsiella-Enterobacter spp., Proteus spp. e Pseudomonas spp. representam a maioria
dos isolamentos. Sendo a E.coli o principal agente com aproximadamente 90% dos casos
(MURRAY, 2004).
Essa bactéria é a principal causadora das infecções urinárias, sendo um dos
microrganismos tido como habitante natural da flora microbiana do trato intestinal de
humanos e da maioria dos animais de sangue quente, sendo, portanto, normalmente
encontrado nas fezes destes animais. Muitas cepas de Escherichia coli não são patogênicas
(DOYLE; CLIVER, 1990).
É o microrganismo mais frequente nas infecções não-
complicadas do trato urinário, nos animais jovens o segundo microrganismo mais comum é o
Staphylococcus saprophyticus. Nas infecções complicadas, os mais isolados são as
enterobactérias. Tais como o Acinetobacier spp. e a Candida spp., elas também são
encontradas em pacientes submetidos à instrumentação (FRANCO, 2011).
18
Além da E. coli, a Klebsiella também é uma bactérias que pode causar infecções
hospitalares (principalmente do aparelho urinário e feridas). É uma importante causa de
infecção do trato urinário, seguida por bacteremia secundária (KANEKO, 2009). A bactéria
Proteus é um componente da flora intestinal, mais presente em machos, porém, está associada
à presença de fimose e contaminação pelo esmegma. Pode ser causa de calculose, pois
sintetiza uréase, que metaboliza uréia em CO2 e amônia, alcalinizando a urina e formando
cálculos, embora a presença de cálculo coraliforme é mais frequente em fêmeas (MENDES,
2011).
Essas bactérias são microorganismos gram-positivos frequentemente encontrados em
encontrados em animais com lesões obstrutivas, doenças paralíticas, afetando a função renal,
ou naqueles que foram manipulados no trato urinário (CAMARGO et al., 2001). A flora
intestinal anaeróbia raramente é causa de ITU, apesar de ser 100 a 1000 vezes mais frequente
que a E.coli na flora fecal (GRISI; ESCOBAR, 2000).
O trato urinário comunica-se constantemente com o meio externo repleto de bactérias,
sendo o trato genital comumente colonizado por algumas colônias bacterianas (microflora). A
microflora genitourinária inferior possui uma função protetora, inibindo a aderência de
micróbios patogênicos à mucosa (JOSÉ, 2011).
2.1.3.4 Diagnóstico
ITU inferior (cistite), quando sintomática, exterioriza-se clinicamente pela presença
habitual de disúria, urgência miccional, polaciúria, nictúria e dor suprapúbica. Febre, neste
caso, não é comum. Na anamnese, a ocorrência prévia de quadros semelhantes,
diagnosticados como cistite, deve ser valorizada (HOOTON; STAMM, 1997).
A ITU superior (pielonefrite), que se inicia como um quadro de cistite é habitualmente
acompanhada de febre, geralmente superior a 38º, de calafrios e de dor lombar, uni ou
bilateral (HOOTON; STAMM, 1997).
O diagnóstico clínico pode ser feito observando-se os sintomas dos animais. O
primeiro sinal para se procurar um médico veterinário é a mudança nos hábitos de urinar ou
micção frequente dos animais, a interrupção no ato de urinar em vários locais, dor ou lamento
dos cães, sangue, pus ou cristais na urina e gritos, lambidas na genitária e febre são alguns dos
sintomas que podem ser considerados como de infecção urinária (PETER, 2010).
A suspeita clínica baseia–se na presença de sintomatologia própria do trato urinário
(disúria, polaciúria, tenesmo urinário, urgência miccional, retenção urinária, incontinência,
19
enurese etc) associada a sintomas de acometimento sistêmico, tais como: anorexia, prostração,
febre, vômitos, dor abdominal, toxemia, entre outros (GRISI; ESCOBAR, 2000).
Segundo José (2011), os animais acometidos por ITU podem apresentar ou não
sintomas. Os sinais clínicos observados são variáveis, sendo dependentes de diversos fatores.
Destacam-se alterações na micção e na coloração da urina. O diagnóstico é confirmado a
partir de ultrassonografia abdominal, exame de urina, urocultura.
O diagnóstico laboratorial é feito através da urinálise (EAS). Esse método é um exame
simples e não oneroso que analisa a urina avaliando a saúde do animal, e oferece informações
valiosas sobre condições sistêmicas (MAIA, 2006). No EAS deve-se realizar tanto a análise
físico-química, quanto a sedimentoscopia (BASTOS; BICALHO, 2003), pois as fitas
reagentes empregadas podem apresentar resultados falsos. Pode haver piúria, hematúria e
proteinúria (LEES, 1984; OSBORNE; LEES, 1995). A detecção de bacteriúria pela fita, como
nitrito presente, não é confiável em cães, resultando em muitos resultados falso-negativos,
pois a excreção de ácido ascórbico na urina inibe a reação química, necessitando da análise do
sedimento (VAIL; ALLEN; WEISER, 1986).
Para a realização deste procedimento é necessário que se faça a coleta da urina. A
coleta pode ser feita pelo método de cistocentese (Figura 3), que é a técnica mais adequada
para animais de pequeno porte, sendo a amostra obtida ideal para cultura e antibiograma
(MAIA, 2006). Essa técnica se caracteriza, por colocar uma agulha diretamente na vesícula
urinária, através da parede abdominal, utilizada frequentemente como forma de obtenção de
amostragem de urina principalmente por se tratar de uma urina estéril, pois não há
contaminação bacteriana e a contaminação iatrogênica com hemácias é mínima, sendo essa
amostra ideal para urocultura com resultado final mais fidedigno (RIBEIRO; SOARES,
1998).
20
Fonte: Pet Imagem (2011).
FIGURA 3 – Técnica de cistocentese.
Porém bactérias podem não ser visualizadas na sedimentoscopia, não indicando
ausência de infecção, sendo necessário urocultura para confirmar (OSBORNE; LEES, 1995).
Além disso, casos de ITU oculta (ausência de bactérias e leucócitos no sedimento urinário)
podem acontecer em algumas doenças endócrinas (MCGUIRE et al., 2002).
A urocultura é o procedimento mais confiável para o diagnóstico de ITU. Uma cultura
bacteriana positiva em amostra de urina coletada por cistocentese antepúbica é confirmatória
(COMER; LING, 1981; ALLEN; JONES; PURVANCE, 1987). Esse exame identifica a
bactéria causadora da infecção urinária. De modo mais simples, podemos dizer que o EAS
nos mostra as consequências de uma possível infecção urinária, enquanto que apenas a
urocultura é capaz de identificar o germe que está causando a infecção (PINHEIRO, 2010).
São utilizadas alças bacteriológicas calibradas ou pipetas mecânicas na faixa dos
microlitros, para semear exatamente 0,01 ou 0,001mL de urina em meios próprios para
crescimento bacteriano (LULICH et al., 1997). Contagem de organismos inferior a 10.000
bactérias/mL sugere contaminação e um número superior a 100.000 indica infecção. Valores
entre 10.000 e 100.000 organismos/mL são considerados suspeitos e exige uma nova
avaliação (COMER; LING, 1981; ALLEN; JONES; PURVANCE, 1987).
Este exame deve ser repetido após três ou cinco dias para avaliar a eficácia do
tratamento, se houver crescimento da mesma espécie de bactéria, a escolha do antibiótico
deve ser reavaliada, porém se crescer outra espécie, está ocorrendo uma reinfecção (POLZIN,
1997). Nos casos complicados, as falhas dos mecanismos de defesa devem ser reconhecidas e
21
tratadas da forma adequada. O tratamento de ITUs complicadas só tem êxito quando as causas
primárias são corrigidas (LING, 1984; SHAW, 1990; POLZIN, 1997).
Com a urocultura detecta-se a presença de bactérias na urina, porém, é necessário que
estas bactérias sejam identificadas para que seja feito o tratamento correto. Neste sentido, é
que é feita a coloração de Gram que consiste no método de identificação das bactérias em
positivas ou negativas. A coloração de Gram recebeu este nome em homenagem a seu
descobridor, o médico dinamarquês Hans Cristian Joaquim Gram. Em 1884, Gram observou
que as bactérias adquiriram cores diferentes, quando tratadas com diferentes corantes. Isso
permitiu classificá-las em dois grupos distintos: as que ficavam roxas, que foram chamadas de
Gram-positivas, e as que ficavam vermelhas, chamadas de Gram-negativas (CAMARGO et
al., 2001).
Neste procedimento, as bactérias são submetidas primeiro à ação de um corante
violeta, seguido de fixação com iodo e depois um agente de descoloração, como o metanol.
Seguidamente, são novamente coradas com safranina. As bactérias Gram-positivas fixam o
primeiro corante, devido à maior espessura da parede celular, e ficam coradas de azul ou
violeta, enquanto que as bactérias Gram-negativas, após a descoloração pelo metanol, são
coradas pela safranina e ficam vermelhas. As bactérias que retêm a coloração violeta são
designadas por Gram-positivas. As bactérias que perdem a coloração violeta depois de
descoloradas, mas que adquirem um corante de contraste (ficando com um tom cor-de-rosa) é
Gram-negativa. Esta distinção de manchas é um reflexo das suas diferenças no que diz
respeito à composição básica das suas paredes celulares (MARTINS et al., 1997).
Como exemplo de bactérias gram-negativas tem-se o vibrão colérico, o colibacilo e as
salmonelas. As Streptococcus, Staphylococcus e as Enterococcus, são exemplos de bactérias
gram-positivas. Entre as bactérias gram-positivas, o Staphylococcus aureus tende a ser mais
invasivo e pode ser secundário à bacteriemia, produzindo abscessos renais (FRANCO, 2011).
A S. epidermidis é segunda espécie mais importante do gênero Staphylococcus e faz parte da
flora normal da pele e da mucosa de seres humanos e animais superiores, é a causa mais
frequente de infecção associada ao uso do cateter (MAMIZUKA; PIGNATARI, 2011).
Para se analisar o tipo de bactéria, após saber se ela é gram-positiva ou gram-negativa
é necessário, que se faça as provas bioquímicas. Dentre os testes das bactérias gram-positivas
estão, a catalase, o manitol e a prova da sensibilidade a novobiocina. A prova da catalase
caracteriza-se por colocar em uma lâmina uma amostra da bactéria que se deseja identificar
em contato com uma gota de peróxido de hidrogênio (H2O2), para diferenciar Staphylococcus
spp de Streptococcus spp e Enterococcus spp. Esse teste é utilizado para detectar a presença
22
da enzima catalase que é produzida por Staphylococcus pela decomposição de peróxido de
hidrogênio em oxigênio e água, que ocorre na maioria das bactérias aeróbias e anaeróbias
facultativas que contêm citocromo P450. Catalase positiva há formação de bolha em cima da
lamina, caso contrario é catalase negativa.
O teste do manitol é um meio salino (7,5% de Cloreto de Sódio) com indicador de pH
que provoca mudança da sua cor, quando o manitol é fermentado e produzindo ácido, a única
espécie capaz de realizar esta transformação da coloração do meio é Staphylococcus aureus
(VITAL, 2006). Como já foi citado, é o mais virulento da espécie, é considerado uma super
bactérias gram positivas de forma esférica e cor amarelada que se desenvolve em locais
salinos. Essa bactéria pode provocar impetigo, foliculite, pneumonia, endocardite,
osteomielite, furúnculo, meningite, infecções urinárias, intoxicação alimentar, septicemia e
síndrome do choque tóxico (doença feminina causada pela permanência de tampões durante a
menstruação por longos períodos) matando cerca de 5% dos pacientes que adquirem a doença
(CABRAL, 2011).
No processo de identificação de estafilococos, a prova de resistência a novobiocina
permite distinguir cepas de S.saprophyticus de outros estafilococos não produtores de
coagulase (RIBEIRO; SOARES, 1998). Essa espécie de Staphylococcus tem coagulase
negativa além da resistência a novobiocina, sendo frequentemente isolada no trato urinário de
fêmeas jovens e sexualmente ativas (MILAGRES; MELLES, 1992). É uma bactéria que está
presente na microbiota normal da pele, região periuretral e mucosas do trato urinário. A
patogenecidade está relacionada com a sua capacidade de poder aderir às células do aparelho
urinário devido à presença de proteína com propriedade de adesina/hemaglutinina, é tido
como agente patogênico oportunista (KANEKO, 2009).
As bactérias gram-negativas seguem outro tipo de provas bioquímicas, para a
identificação de bactérias. As provas de Indol, Vermelho Metila (VM), Voges-Proskauer
(VP), Citrato e Urease permite diferenciar os principais grupos de Enterobacteriaceae, que
são: Grupo I: Escherichia, Edwardsiella, Citrobacter, Salmonella, Shigella. Grupo II:
Klebsiella, Enterobacter, Hafnia, Serratia. Grupo III: Proteus e Grupo IV: Yersinia. A
Citrobacter é a principal responsável por infecções urinárias e diarréias, sendo encontrada na
natureza ou na microbiota normal do homem e animais. São bacilos gram-negativos e podem
ser móveis ou imóveis (FRANCO, 2011).
Com a análise dos tipos de bactérias, passa-se ao antibiograma que visa identificar o
antibiótico específico para combater o agente causador da doença (OLIVEIRA, 2010). A
realização de antibiograma, ou teste de sensibilidade a antimicrobianos, é de extrema
23
importância, devendo ser realizado na sequência da urocultura. Pois, ele é indicado para
qualquer microorganismo relacionado ao processo infeccioso, mas principalmente àqueles
cuja sensibilidade a drogas normalmente empregadas na terapia não seja previsível como, por
exemplo: S. aureus, bacilos gram-negativos não fermentadores (Pseudomonas), bacilos gramnegativos fermentadores (enterobactérias), etc. (RIBEIRO; SOARES, 1998).
Este exame atua complementando a cultura de urina, porém, na rotina das cistites não
complicadas, sua utilidade é pequena, haja vista a predominância maciça e resolutiva da
terapia empírica. No entanto, naqueles casos em que ocorre falha desse tipo de terapia, nas
pielonefrites e nas infecções urinárias hospitalares, a presença do antibiograma é de grande
utilidade. Igualmente sua importância cresce nas cistites complicadas, quando o risco de
insucesso da terapia empírica aumenta. O antibiograma fornecerá os antimicrobianos
potencialmente úteis a serem prescritos (WARREN et. al. 1999; HOOTON; STAMM, 1997).
A técnica mais empregada é o Kyrbi-Bauer, porém este método tende a subestimar o
sucesso do tratamento. Os discos são impregnados com antibióticos, em quantidades similares
aos níveis plasmáticos alcançados pela droga, mas a concentração urinária de muitas destes é
muito superior a esta. Desta forma, algumas bactérias aparentemente resistentes in vitro
podem não ser in vivo, devido à maior concentração da medicação na urina (SHAW, 1990).
Assim, o que se percebe é que são necessários diversos exames para a obtenção de um
diagnóstico eficaz nos casos de ITUs. Segundo Costa e Príncipe (2005) o diagnóstico de ITU
deve assentar na realização de urocultura com o respectivo antibiograma, o que garante a
escolha do antibiótico mais adequado, limitando os custos e efeitos adversos destes fármacos
e prolongando a sua eficácia impedindo a seleção de estirpes resistentes.
Na maior parte dos casos, a ITU canina é consequência de infecções em órgãos
vizinhos, como na próstata, útero, vagina ou, mais raramente, sistêmicas. Por conseguinte, não
basta tratar os seus sintomas, tem é que tratar a sua causa. Para tanto, deve-se procurá-la
mediante um exame clínico aprofundado com radiografias e exames complementares,
conforme descrito.
2.1.3.5 Tratamento
O tratamento tem por objetivo curar a infecção bacteriana, aliviar os sintomas agudos
e evitar o aparecimento de lesões renais, investigando alterações anatômicas e/ou funcionais
que acarretem recidivas infecciosas e/ou acometimento do parênquima renal. O tratamento
das ITUs varia conforme sua classificação. Nos casos não complicados, a antibioticoterapia
24
resolve o quadro. A escolha do antibiótico deve ser realizada conforme o resultado do teste de
sensibilidade do agente (LING, 1984; POLZIN, 1997).
Conforme citado na literatura, o Staphylococus aureus invade o organismo através da
ingestão de alimentos contaminados, atacando diretamente o corpo, produzindo uma série de
toxinas, que quando ingeridas provocam uma intensa infecção intestinal com vômitos e
diarréia. Pode ainda, invadir o sangue causando infecções graves, sepse e choque séptico.
Causa problemas no coração, e ainda a pneumonia. Assim, como enfatiza Pinheiro (2010),
que reforça que essas bactérias são classicamente tratadas, com derivados da penicilina, como
a Oxacilina, Cefazolina e Cefalotina. Infecções restritas a pele podem ser tratadas com
antibióticos por via oral. Infecções mais graves devem ser tratadas com internação hospitalar
e antibióticos venosos (PINHEIRO, 2010).
O tratamento no caso de ITU, onde existam fortes indícios clínicos, pode ser iniciado
logo após a coleta da urina para cultura (RICETTO, 2011). Porém, em casos de bacteriúria
assintomática, o tratamento é contra-indicado devido a sua possibilidade de ocasionar a
substituição da bactéria contaminante por uma cepa de maior virulência, uma vez que o cão
tende a recolonizar o trato urinário pouco após, a suspensão do antimicrobiano, portanto,
nestes casos faz-se necessário o antibiograma para a correta identificação do antibiótico, para
que não haja tratamento incorreto (OLIVEIRA, 2010).
A escolha do antibiótico nos casos de ITUs complicadas seguem os mesmos critérios
das ITUs simples, porém nestes casos crônicos a terapia é mais prolongada. Nos casos de
ITUs crônicas em machos, deve-se avaliar a próstata, pois talvez o antibiótico possa ser
mudado, para um com boa penetração nesta glândula, em casos de
prostatite. Novas
abordagens para tratamento de ITUs crônicas estão sendo pesquisadas, entre elas podemos
citar drogas estimulantes de produção de glicosaminoglicanos e bloqueadores da aderência
bacteriana, imunização contra os patógenos e colonização da porção externa do trato urinário
com bactérias não patogênicas (SHAW, 1990).
A recorrência dos sinais clínicos e/ ou laboratoriais da infecção do trato urinário, em
seguida à interrupção do tratamento, é bastante comum, sendo importante diferenciar entre
recidivas, reinfecção ou hiperinfecção (JOSÉ, 2011).
O tratamento da ITU é feito com antibióticos, escolhidos de preferência após os
resultados da cultura de urina. Entretanto, isso não é necessário na maioria das vezes.
Excetuando-se os casos de infecção dos rins, quando os antibióticos são dados por via venosa,
os outros casos podem ser tratados com medicamentos por via oral (OLIVEIRA, 2010). Na
concepção da autora, a duração do tratamento depende do tipo de infecção urinária e do
25
antibiótico escolhido, podendo durar 3, 7 10 ou 14 dias. É importante que se faça o tratamento
durante todo o período prescrito pelo médico, para evitar a recorrência do quadro.
Vários são os grupos de antimicrobianos empregados no tratamento das ITUs como, βlactâmicos, cefalosporinas, fluorquinolonas,aminoglicosídeos, tetraciclinas, cloranfenicol,
sulfonamidas e nitrofuranos (BARSANTI, 1998; BLANCO; BARTGES, 2001).
Nesse sentido, Heilberg e Schor (2003), enfatizam que as cefalosporinas de terceira
geração são altamente eficazes contra enterobactérias em geral, mas não contra Pseudomonas.
Alguns germes gram-positivos como Enterococcus e Staphylococcus também são pouco
sensíveis. Quando possível, a realização do teste de gram pode auxiliar bastante na
identificação da presença de enterococcus. Se os gram-positivos estão presentes ou se esta
informação não está disponível, deve-se associar Ampicilina endovenosa ou Vancomicina aos
aminoglicosídeos (HEILBERG; SCHOR, 2003).
Quando somente gram-negativos estão
presentes, torna-se preferencial o uso por via parenteral, desde a associação SMZ-TMP, até
fluorquinolonas, aminoglicosídeos ou cefalosporinas de amplo espectro como a Ceftriaxona
(HEILBERG; SCHOR, 2003).
Os aminoglicosídeos como Amicacina ou Gentamicina são bastante eficazes, para
germes gram-negativos, mas deve-se ter em mente o especial efeito nefrotóxico destes
agentes. Porém, as drogas aminoglicosídicas não devem ser usadas como primeira escolha
para tratamento de ITU, uma vez que estas são potencialmente nefrotóxicas (LING; RUBY,
1979a; LESS; ROGERS, 1986). Dentre estas, a gentamicina é considerada a mais efetiva
contra microrganismos aeróbios Gram-negativos (GREENE; WATSON, 1998).
Contra o Staphylococcus spp., Streptococcus spp., Escherichia coli, Klebsiella spp. e
Proteus mirabilis, pode se utilizar a cefalexina, cefalosporina de primeira geração, que
demonstra um resultado eficiente, porém não se deve utilizar para Pseudomonas spp. e
algumas cepas de Proteus e Enterococcu (PRESCOTT; BAGGOT, 1993; GREENE;
WATSON, 1998). A nitrofurantoína é um derivado nitrofurânico utilizado especificamente
para tratamento das infecções urinárias, principalmente em cães. As bactérias usualmente
sensíveis a este antimicrobiano são a Escherichia coli, Staphylococcus spp., Streptococcus
spp. e Enterobacter spp. Porém, bactérias como Pseudomonas spp., Streptococcus faecalis e
Proteus spp. podem apresentar resistência (GÓRNIAK, 1996).
Embora haja indicação para o emprego das drogas acima citadas nas situações
indicadas, é importante ressaltar, que os testes de sensibilidade às drogas são fundamentais
para o mapeamento de aparecimento de cepas resistentes, bem como para o sucesso do
tratamento das ITUs (COOKE et al., 2002; NICKEL, 2005). Uma bactéria é considerada
26
sensível a um antimicrobiano, quando o seu crescimento é inibido, in vitro, por uma
concentração três, ou mais vezes, inferior àquela, que o antimicrobiano atinge no sangue, caso
contrário ela é considerada resistente (RIBEIRO; SOARES, 1998). Para tanto, o teste de
sensibilidade mais comumente utilizada na rotina clínica é a técnica de difusão em placa de
Kirby-Bauer que, segundo Bartges (2004), é adequado para avaliar a sensibilidade bacteriana
nos casos de ITU. Já o meio termo (bactérias moderadamente resistentes) é dado por aquelas
cujo crescimento é inibido por concentrações intermediárias (RIBEIRO; SOARES, 1998).
3 MATERIAL E MÉTODOS
O estudo foi desenvolvido na cidade de Rio Verde-GO, fazendo-se busca ativa de
dados no Laboratório de Microbiologia da FESURV e no Centro de Controle de Zoonoses
(CCZ) de Rio Verde, de onde foram selecionados animais utilizados neste estudo. Para tanto,
foram colhidas 26 (vinte seis) amostras de urina, sendo 17 machos e 9 fêmeas, pela técnica de
cistocentese. As amostras selecionadas foram de cães com sinais clínicos de ITU, e foram
colhidas, no decorrer do ano de 2010. O estudo objetivou analisar quais os agentes causadores
de infecções urinárias em cães em Rio Verde-GO, verificando a ocorrência e determinação da
sensibilidade a antimicrobianos.
Para a confecção e análise dos resultados primeiramente foi feita a urinálise das
amostras. As amostras foram divididas em dois frascos esterilizados, sendo semeadas com
Agar Nutriente e incubadas a 37ºC por 24 horas. Neste exame foram utilizadas 26 (vinte e
seis) amostras. Para se fazer a cultura para identificação das bactérias, através da urocultura.
Foi utilizadas alças bacteriológicas calibradas ou pipetas mecânicas na faixa dos microlitros,
para semear exatamente 0,01 ou 0,001mL de urina em meios próprios para crescimento
bacteriano. A técnica de coloração de gram, para identificar as bactérias em gram-positivas e
gram-negativas foi feita nos padrões utilizados pela Microbiologia.
Com a identificação das amostras em positivas ou negativas, utilizaram-se as provas
bioquímicas tradicionais para determinação das espécies de bactéria. Indol, Vermelho de
Metila (VM), Voges-Proskauer (VP) e citrato conforme preconizado por Koneman (2001)
para os gram-negativos. E Catalase, Manitol e Sensibilidade ao Disco de Novobiocina, para
os cocos gram-positivos (OPLUSTIL et. al., 2004). Os testes de suscetibilidade aos
antimicrobianos foram realizados pelo método descrito pelo NCCLS - National Committee
For Clinical Laboratory Standards (2003).
Na realização do antibiograma utilizaram-se os principais antibióticos disponíveis,
empregados, no tratamento de cães com ITU. Sendo a amoxicilina, cefalexina, cefotaxima,
ceftiofur,
ciprofloxacina,
gentamicina,
cloranfenicol,
nitrofurantoína,
(clotrimazol), norfloxacina.
penicilina
doxiciclina,
G,
enrofloxacina,
tetraciclina,
estreptomicina,
trimetoprim,
sulfadiazina
4 RESULTADOS E DISCUSSÃO
A ITU é uma das infecções bacterianas mais comuns na clínica médica sendo que seu
tratamento, na maioria das vezes, é empírico, contribuindo para o aparecimento de resistência.
Para se analisar os dados primeiramente fizeram-se a coleta de 26 amostras de animais sem
raça definida, sendo dezessete machos e nove fêmeas do Centro de Zoonose (CCZ) de Rio
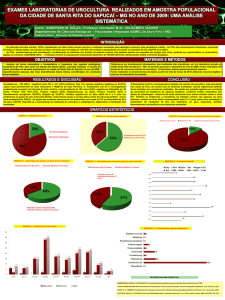
Verde (Gráfico 1).
Fonte: Dados da autora
GRÁFICO 1 – Sexo dos animais.
O resultado da urinálise das amostras pesquisadas demonstrou que 16 (dezesseis), ou
seja, 61,53 % das amostras apresentaram bacteriúria. Destas, 25% (quatro) apresentaram
crescimento bacteriano na urocultura (Figura 4). Rocha, Carvalhal e Monti (2003),
enfatizaram que a presença de bactérias na análise do sedimento urinário (bacteriúria)
apresenta algumas limitações de sensibilidade e especificidade para o diagnóstico de
infecções do trato urinário, também descrito no trabalho de Vail et. al. (1986), que relataram
sobre os resultados falso-positivos.
29
Fonte: Arquivo pessoal
FIGURA 4 – Cultura das amostras.
As amostras três, seis e oito são de fêmeas, isso demonstra, que a ITU é mais
frequente em fêmeas devido à menor extensão da uretra (SILVEIRA et. al, 2010), no entanto,
também pode se identificar essa bactéria em macho, como é o caso da amostra dez (Figura 4).
Nas amostras número três, oito e dez identificou-se a bactéria do tipo Staphylococcus. Na
amostra nº oito detectou-se dois tipos de bactérias, que foram isoladas para que fossem
identificadas.
Nas amostras isoladas foram identificados, quatro isolados Gram-Positivos e dois
isolados Gram-Negativos. Para identificar as bactérias Gram-positivas, fez-se as provas
bioquímicas, utilizando-se como base a Tabela 1.
TABELA 1 – Provas bioquímicas e identificação de bactérias Gram-positivas
Provas bioquímicas
S. aureus
S. epidermidis
S. saprophyticus
Catalase
+
+
+
Fermentação do manitol
+
-
-
Sensibilidade a
novobiocina
R
S
R
Fonte: Koneman et al. (2001).
No primeiro teste, o da catalase, constatou-se que todas as amostras foram positivas. O
teste do manitol e o teste da novobiocina são fundamentais, para a determinação da espécie de
Staphylococcus. Para se determinar a espécie da bactéria utilizou-se como base a Tabela 2.
30
TABELA 2 – Identificação das espécies de Staphylococcus de maior importância clínica
Espécie
DNAse
PYR
Novobiocina
Uréia
Polimixina
Outras
S. aureus
+
+
Sensível
Variável
Resistente
Pig. amarelo
S. epidermidis
-
-
Sensível
+
Resistente
S. lugdunensis
-
+
Sensível
Variável
Variável
Omitina +
S. haemolyticus
-
+
Sensível
-
Sensível
Omitina -
S. saprophyticus
-
-
Resistente
+
Sensível
Isolado urina
S. schleiferi
-
+
Sensível
-
Sensível
Sacarose -
S. intermedius
+
+
Sensível
+
Sensível
S. hyicus
+
-
Sensível
Variável
Resistente
Fonte: ANVISA (2010).
No teste do manitol identificaram-se as bactérias gram positivas (Figura 5). Segundo
Barsanti e Johnson (1990), há somente colonização bacteriana na porção distal da uretra e
genitália externa, constituindo-se basicamente de bactérias Gram-positivas.
Fonte: Arquivo pessoal
FIGURA 5 – Teste do manitol.
Neste estudo, a amostra oito apresentou a bactéria Staphylococcus aureus. Isso porque
essa bactéria tem forma esférica (cocos), cerca de um micrometros de diâmetro, e formam
grupos com aspecto de cachos de uvas com cor amarelada, devido à produção de
carotenóides, sendo daí o nome de "estafilococo dourado". A amostra três apresentou
mudança de coloração, isso sugere a presença da bactéria Staphylococcus, porém, não foi
possível determinar a espécie da mesma. Assim, como na amostra dez que não apresentou
coloração no manitol, o que representa ser um tipo de Staphylococcus, porém necessita de
outros testes, para que se detecte com exatidão sua espécie.
Para tanto, foi feito o teste de sensibilidade a novobiocina nas amostras três e dez. Na
amostra três detectou-se a presença da bactéria S.epidermidi (Figura 6). Essa confirmação foi
31
possível, devido à sensibilidade apresentada pela amostra, conforme descrito na Tabela 2.
Fonte: Arquivo Pessoal
FIGURA 6 – Teste de sensibilidade a novobiocina – amostra 3.
Na amostra dez há a presença da bactéria, S.saprophyticus (Figura 7), confirmada pela
resistência à novobiocina.
Fonte: Arquivo Pessoal
FIGURA 7 – Teste de sensibilidade a novobiocina – amostra 10.
O teste do manitol e da novabiocina confirmou a presença de três tipos de
Staphylococcus, nas amostras três, oito e dez.
Para se identificar as bactérias gram-negativas, fez-se as provas bioquímicas, com base
na Tabela 3.
32
TABELA 3 – Provas bioquímicas e identificação de bactérias gram-negativas
B
C
D
e
F
g
h
Indol
+/-
-
+/-
+/-
+
+/-
-
24 h
VM
+
+
+
+
+
-
-
48 h
VP
-
-
-
+/-
-
+
+
96 h
Citrato
-
+
+
+/-
-
+
+
96 h
Uréase
-
-
+/-
+++
-
+
+/-
48 h
Fonte: Koneman et al. (2001).
Neste estudo, através das provas bioquímicas constatou-se que na amostra seis há a
presença da bactéria Citrobacter sp. Na amostra nº oito encontrou-se a bactéria Klebsiella sp
(Figura 8) que é um tipo de bactéria que causa infecções do trato urinário.
Fonte: Arquivo Pessoal
FIGURA 8 – Provas bioquímicas.
Nas amostras submetidas ao estudo, foram isolados cinco tipos de bactérias. A
Staphylococcus aureus e a Klebsiella na amostra oito, a Staphylococcus epidermidi na
amostra três, a Staphylococcus saprophyticus, na amostra dez e a bactéria Citrobacter sp na
amostra seis. Para se identificar o antibiótico mais eficaz no combate a cada uma delas,
utilizou-se o antibiograma com base na Tabela 4.
33
TABELA 4 – Limites para interpretação do antibiograma com 24 antibacterianos de uso
corrente na terapêutica clínica
DIÁMETRO DO HALO DE INIBIÇÃO
Antimicrobiano
Símbolo
CONC. DISCO
Amicacina
Ampicilina ao testar microorganismos
gram-positivos e enterococos
BB
RESISTENTE
INTERMEDIÁRIO
SENSÍVEL
30 mcg
≤ 14
15 - 18
≥ 17
AP
10 mcg
≤ 11
12 - 13
≥ 14
AP
10 mcg
≤ 20
21 - 28
≥ 29
AP
10 mcg
≤ 19
-
≥ 20
Ac. Nalidíxico
AN
30 mcg
≤ 13
14 - 18
≥ 19
Bacitracina
Carbenicilina ao testar Proteus sp.
e E. Coli
Carbenicilina ao testar Pseudomonas
aeruginosa
Cefalotina ao relatar sensibilidade
a todas as cefalosporinas
BC
10 um
≤8
9 - 12
≥ 13
CR
100 mcg
≤ 17
18 - 22
≥ 23
CR
100 mcg
≤ 13
14 - 16
≥ 17
CF
30 mcg
≤ 14
15 - 17
≥ 18
Cefoxitina
Clidamicina ao relatar sensibilidade a
clindamicina e a lindomicina
CT
-
≤ 14
15 - 17
≥ 18
CI
2 mcg
≤ 14
15 - 16
≥ 17
Cloranfenicol
CO
30 mcg
≤ 12
13 - 17
≥ 18
Colistina
CL
10 mcg
≤8
9 - 10
≥ 11
Eritromicina
EL
15 mcg
≤ 13
14 - 17
≥ 18
Estreptomicina
ET
10 mcg
≤ 11
12 - 14
≥ 15
Gentamicina
GN
10 mcg
≤ 12
13 - 14
≥ 15
Konanilcina
KN
30 mcg
≤ 13
14 - 17
≥ 18
Nalidíxico Ácido
NA
30 mcg
≤ 13
14 - 18
≥ 19
Neomicina
NO
30 mcg
≤ 12
13 - 16
≥ 17
Nitrofurantoína
NT
300 mcg
≤ 14
15 - 16
≥ 17
Novoblocina
NV
30 mcg
≤ 17
18 - 21
≥ 22
Oxocilina
Penicilina G. ao testar
Estafilococos
Penicilina G. ao testar outros
microorganismos
OX
6 mcg
≤9
10 - 13
≥ 14
PN
10 um
≤ 20
21 - 28
≥ 29
PN
10 um
≤ 11
12 - 21
≥ 22
Penicilina G.
PL
500 um
≤8
0 - 11
≥ 12
-
-
≤8
9 - 11
≥ 12
STX
30 mcg
≤ 10
11 - 15
≥ 16
SFT
25 mcg
≤ 10
11 - 15
≥ 16
Sulfonamidas
SFT
300 mcg
≤ 12
13 - 16
≥ 17
Tetraciclina
TT
30 mcg
≤ 14
15 - 18
≥ 19
Tobramicina
TB
10 mcg
≤ 12
13 - 14
≥ 15
Vancomicina
Fonte: Cerqueira (2011).
VC
30 mcg
≤9
10 - 11
≥ 12
Ampicilina ao testar estafilococos
e microorganismos sensíveis à
Penicilina G.
Ampicilina ao testar Haemophilus
sp.
Polimixina
Sulfa-Trimetropim
Sulfazotrim
(Sulfametoxazol
Trimetropim)
+
34
Para se analisar o resultado do antibiograma é importante observar a formação de um
halo transparente sobre a superfície do meio, ao redor de um disco de antibiótico, indica uma
região com ausência de crescimento bacteriano, revelando a ação inibitória do agente
antimicrobiano sobre a bactéria ensaiada (Figuras 9, 10 e 11).
Arquivo Pessoal
FIGURA 9 – Antibiograma – amostra 3.
Fonte: Arquivo Pessoal
FIGURA 10 – Antibiograma – amostra 6.
Fonte: Arquivo Pessoal
FIGURA 11 – Antibiograma – amostra 8.
Das quatro amostras analisadas percebeu-se a maior incidência de Staphylococcus,
diferente do descrito na literatura. A ocorrência de infecção mista ocorreu em uma das
amostras, contudo, a sensibilidade antibiótica pode diferir, demonstrando assim, a importância
do diagnóstico preciso destas infecções, com a realização do antibiograma, permitindo a
35
utilização de um fármaco ou associação de fármacos efetivos no tratamento.
Neste estudo, percebeu-se que foram eficazes os fármacos nitrofurantoína, tetraciclina
e cefalotina, norfloxacino, eritromicina e ainda dosagens altas do clorafenciol (por apresentar
sensibilidade intermediária) no caso da bactéria S. epidermidis. Para a bactéria Citrobacter sp,
foi eficaz o norfloxacino, utilizado em dosagens altas, devido essa bactéria apresentar
sensibilidade intermediária ao antibiótico. Para a bactéria S. saprohyticus identificada pela
amostra dez, pode-se utilizar o fármaco enrofloxacino e o norfloxacino também em dosagem
alta. Na amostra oito foi identificada uma infecção mista das bactérias S. aureus e da
Klebsiella sp, a cefalotina, usada em dosagens altas foi a única associação de fármaco eficaz.
É importante ressaltar que o número de cães desta amostra é limitado. Contudo, os
resultados observados apontam importantes tendências, que devem ser investigados, por
estudos mais amplos, com um número maior de cães.
5 CONCLUSÃO
Na avaliação dos 26 cães com ITU, percebe-se que a bactéria Staphylococcus, foi a
que teve maior prevalência, diferente do resultado em outros estudos. Os sinais clínicos se
mostraram inespecíficos, enquanto que a presença de bacteriúria foi observada em 61,53%
dos animais pesquisados. Apesar da grande prevalência de bacteriúria nas amostras, o
crescimento bacteriano foi encontrado em 25% das amostras. Dentre as bactérias encontradas,
estão a Staphylococcus aureus, a Staphylococcus epidermidi, Staphylococcus saprophyticus, a
Klebsiella sp e a Citrobacter sp.
A ITU de cães pode ocorrer como evento primário, o qual geralmente responde
prontamente ao tratamento com o antibiótico adequado. Para analisar a resistência das
bactérias a vários antibióticos nos pacientes com ITU é de extrema importância a utilização
dos antibiogramas para se obter o conhecimento do perfil de suscetibilidade antimicrobiana
das bactérias causadoras de ITU, para o correto tratamento da infecção.
O uso incorreto de antibióticos no tratamento das ITU, principalmente de origem
hospitalar, pode levar a uma piora da infecção e favorecer o aparecimento de cepas
bacterianas resistentes. É necessário desestimular o uso indiscriminado e por automedicação
de antibióticos nas ITU, procurando orientar aos veterinários e também os proprietários de
animais para os riscos deste ato.
Neste estudo, percebe-se que ao se isolar as bactérias analisaram-se os tipos de
antibióticos mais sensíveis a cada espécie, proporcionando assim um tratamento mais eficaz.
A cefalotina e o norfloxacino foram os medicamentos que mais se destacaram, pois foram
eficazes para tratar as cinco espécies de bactérias encontradas neste estudo, porém, há ainda
outros que também se apresentaram eficazes.
Outro dado importante, demonstrado neste estudo, foi à necessidade de não se ater
somente nos exames de EAS, para a obtenção do resultado de ITU. Pois há sempre a
necessidade de exames complementares para se descobrir o tipo e a espécie de bactéria que o
cão apresenta. Isso proporciona uma eficácia maior no tratamento e ainda evita que os animais
criem resistência aos medicamentos.
37
Conclui-se, portanto, que conhecer os agentes causadores de ITU inferior de cães e
também estabelecer a sensibilidade dos agentes frente a antimicrobianos é de suma
importância, para auxiliar os profissionais a tratar com maior eficácia esse tipo de infecção,
porém ressalta-se que mais estudos são necessários, para uma melhor avaliação dos
resultados.
REFERÊNCIAS
ABC DA SAÚDE. Infecção Urinária. Disponível em:
<http://www.abcdasaude.com.br/artigo.php?258>. Acesso em: 10/03/2011.
ALLEN, T.A.; JONES, R.L.; PURVANCE J. Microbiologic evaluation of canine urine:
Direct microscopic examination and preservation of specimen quality of urine for culture,
Journal of the American Veterinary Medical Association, v.190, n.10, p.1289-1291, 1987.
ANVISA, Agencia Nacional de Vigilancia Sanitária. Principais Síndromes Infecciosas.
Disponível em: <http://www.anvisa.gov.br/servicosaude/microbiologia/mod_1_2004.pdf>.
Acesso em: 12/04/2011.
BARSANTI, J. A. Genitourinary infections. In: GREENE, C. E. Infections diseases of the
dog and cat. 2ⁿ ed. Philadelfia: WB Saunders; 1998. p. 626-646.
BARSANTI, J.A.; JOHNSON, C.A. Genitourinary Infections. In: GREENE, C. E. Infectious
Diseases of the Dog and Cat. W.B. Saunders, Philadelphia, EUA, 1990. p.157-183.
BARTGES, J.W. Diagnosis of urinary tract infections. Veterinary Clinical Small Animal,
2004. p. 923–933
BASTOS, C.V.; BICALHO A.P. Sedimentoscopia em urinas caninas com características
físico-químicas normais: qual seu valor? Revista Clínica Veterinária. Editora Guará, n.45,
2003.
BLANCO, L. J.; BARTGES, J. W. Understanding and erradicating bacterial urinary tract
infections. Veterinary Medicine, v. 96, n. 6, p. 777-789, 2001.
CABRAL, G.. Staphylococcus aureus. Disponível em:
<http://www.brasilescola.com/biologia/staphylococcus-aureus.htm>. Acesso em: 13/05/2011.
39
CAMARGO, I.B.C.; MASCHIETO, A.; SALVINO, C.; DARINI, A.L.C. Diagnóstico
bacteriológico das infecções do trato urinário - Uma revisão técnica. Medicina, Ribeirão
Preto, 34: 70-78, jan./mar. 2001. Disponível em:
<http://www.fmrp.usp.br/revista/2001/vol34n1/diagnostico_bacteriologico.pdf>. Acesso em:
13/05/2011.
CERQUEIRA, A. Apostila de Aulas Práticas: Bacteriologia. Disponível em:
<http://www.uff.br/labac/Apostila_Pratica_Vet.pdf>. Acesso em: 07/05/2011.
COMER, K.M.; LING, G.V. Results of urinalusis and bacterial culture of canine urine
obtained by antepubic cystocentesis, catheterization and midstream voided methods. Journal
of the American Veterinary Medical Association, p.179-891.1981.
COOKE, C. L.; RANDALL S.S.; SPENCER, S. J.; DWIGHT, C.H. Enrofloxacin resistance
in Escherichia coli isolated from dogs with urinary tract infections. Journal of American
Veterinary Medicine Association, v. 220. n. 2. p. 190-192, 2002.
COSTA, L; PRINCIPE, P. Infecção do Trato Urinário. Rev Port Clin Geral. v. 21. p. 219225. 2005.
DOENÇAS DO TRATO URINÁRIO INFERIOR. Veterinary Focus, v. 17, n.1, 2007.
DOYLE, P. M.; CLIVER, D. O. Escherichia coli. In: CLIVER, D. O (Ed.). Foodborne
Diseases .London: Academy Press, 1990. p. 209-215.
DUARTE, N. Doenças do trato urinário em cães. 13/04/2009. Disponível em:
<http://www.estilors.com.br/pet/detail.php?pet=335&cat=10>. Acesso em: 10/03/2011.
ETTINGER, S.J.; FELDMAN, E.C. Tratado de Medicina Interna Veterinária. 5 ed. Rio
de Janeiro: Guanabara Koogan, 2004. p. 894-1102.
ETÜN, C.; SENTÜRK, S.; KOCABIYIK, A. L.; TEMÜZEL, M.; OZEL, E.; Bacteriological
Examination of Urine Samples from Dogs with Symptoms of Urinary Tract Infection. Turkey
Journal Veterinary Animal Science, v.27, p.1225-1229, 2003.
FERREIRA, W.; ÁVILA, S.L.M. Diagnóstico laboratorial das principais doenças
infecciosas e auto-imunes. 2. ed. São Paulo: Guanabara-Koogan, 2001. p. 289-295.
40
FOGLE, B. Sistema Urinário e Genital. Disponível em:
<http://caotinhodolabrador.com/m_sistema.php>. Acesso: 02/05/2011.
FORRESTER, S.D. Nefropatias e Ureteropatias. In BIRCHARD, S.J.; SHERDING, R.G.
Manual Saunder Clínica de Pequenos Animais. São Paulo: Roca, 2003.
FRANCO, S. Infecções do Trato Urinário. Disponível em:
<http://www.sergiofranco.com.br/bioinforme/index.asp?cs=Microbiologia&ps=infeccoesTrat
oUrinario>. Acesso em: 13/05/2011.
FRASER, C.M. KAHN, C.M.; SCOTT, L. Manual Merck de Veterinária. 7. ed. São Paulo:
Roca, 1997.
GALHARDO, J. A.; HASHIMOTO, ANZAI, E.K; SALVADOR, R.; GIRODANO, L.G.P;
FREITAS, J. C.; MÜELLER, E.E. Agentes Bacterianos Isolados de Cães com Infecção
Urinária na Região de Londrina – PR. Maringá: UEM, 2002. Disponível em:
<http://www.ppg.uem.br/Docs/pes/eaic/XI_EAIC/trabalhos/arquivos/11-0310-0.pdf>.
Acesso em: 14/03/2011.
GÓRNIAK, S. L. Quimioterápicos. In: SPINOSA, H. S.; GÓRNIAK, S. L.; BERNARDI, M.
M. Farmacologia aplicada à Medicina Veterinária. Rio de Janeiro: Guanabara Koogan,
1996, p. 347-356.
GRAUER, G.F; LANE, I.F. Insuficiência Renal Aguda. In: ETTINGER, S.J.; FELDMAN,
E.C. Tratado de Medicina Interna Veterinária. 4 ed. São Paulo: Manole, v. 2. 1997. p.
2374-2393.
GREENE; C. E.; WATSON, J. Genitourinary infections. In: GREENE, C. E. Infections
diseases of the dog and cat. 2ⁿ ed. Philadelphia: WB Saunders; 1998. p. 798-915.
GRISI, S.; ESCOBAR, A. M. Prática pediátrica. São Paulo: Atheneu, 2000. p. 329-422.
HEILBERG, I. P.; SCHOR, N. Abordagem diagnóstica e terapêutica na infecção do trato
urinário: ITU. Revista da Associação Médica Brasileira. 2003, vol.49, n.1, pp. 109-116.
Disponível em: <http://www.scielo.br/scielo.php?pid=S010442302003000100043&script=sci_arttext>. Acesso em: 13/05/2011.
HOOTON, T. M.; STAMM, W. E. Diagnosis and treatment of uncomplicated urinary tract
infection. Infect Dis Clin North Am, vol.11. p. 551. 1997.
41
IHRKE, P.J.; NORTON, A.L.; LING, G.V.; STANNARD, A.A. Urinary tract infection
associated with long-term corticosteroid administration in dog with chronic skin disease.
Journal of the American Veterinary Medical Association, v.186, n.1, p.43-46, 1985.
JOSÉ, M. Infecção Urinária em Cães e Gatos. Disponível em:
<http://magnoveterinario.blogspot.com/2011/01/infeccao-urinaria-em-caes-e-gatos.html>.
Acesso em: 16/03/2011.
KANEKO, J.N. Infecções Urinárias. Londrina: Instituto Filadélfia. 2009. 07 p.
KONEMAN, E.W. WINN, W.; ALLEN, S.; JANDA, W.; PROCOP, G.;
SCHRECKENBERGER, P.; WOODS, G. Diagnóstico Microbiológico. 5 ed. Rio de Janeiro:
Medsi, 2001. p.177-261.
LEES, G.E. Epidemiology of Naturally Occurring Feline Bacterial Urinary Tract Infections.
Veterinary Clinics of North America, v.14, nº 3, 1984. p. 471-479.
LESS, G. E.; ROGERS, K. S. Treatment of urinary tract infections in dogs and cats. Journal
of American Veterinary Medicine Association, v. 189, n. 6, 1986. p. 648-652.
LING, G.V. Therapeutic strategies involving antimicrobial treatment of canine urinary.
Journal of the American Veterinary Medical Association, v.185, n.10, p.1162-1164, 1984.
LING, G. V.; RUBY, A. L. Gentamicin for treatment of resistant urinary tract infections in
dogs. Journal of American Veterinary Medicine Association, v. 175, n. 5, 1979. p. 480481.
LIPPERT, A.C.; FULTON, R.B.; PARR, A.M. Nosocomial Infection Surveillance in a
Small Animal Intensive Care Unit. Journal of the American Animal Hospital Association,
v.24, p.627-636, 1988.
LULICH, J.P.; OSBORNE, C.A.; BARTGES, J.W; LEES, G. E. Afecções do trato urinário
inferior dos caninos. In: ETTINGER S. J.; FELDMAN, E.C. Tratado de Medicina
Veterinária - Moléstias do cão e do gato. 4º Ed. São Paulo: Roca, v.2, 1997. p.2496-2533.
MAIA, L. Urinálise. Laboratório Veterinário Genesi - Informe Científico, agosto/2006.
Disponível em:
<http://www.laboratoriogenesi.com.br/artigos/5_Informe%20cient%EDfico%20%20Urin%E1lise%20parte%20I%20.pdf>. Acesso em: 13/05/2011.
42
MAMIZUKA, E. M. PIGNATARI, A. C. Staphylococcus. Disponível em:
<www.anvisa.gov.br/.../staphylococcus_antonio_carlos_pignatari.ppt>. Acesso em:
20/03/2011.
MARTINS, C. R. F; FERREIRA, J. A. P. S; SIQUEIRA, L.F.G.; FERREIRA, L. A. P.;
BAZZAO, M. L.; FRANCHINI, M.; BERRO, O. J.; VALLE, S. Técnica de Coloração de
Gram. Brasília: Ministério da Saúde, Programa Nacional de Doenças Sexualmente
Transmissíveis e AIDS, 1997.
MCGUIRE, N.C.; SCHULMAN, R.; RIDGWAY, M.D; BOLLERO, G. Detection of Occult
Urinary Tract Infections in Dogs with Diabetes Mellitus. Journal of the American Animal
Hospital Association, v.38, p.541-544. 2002.
MENDES, M. S. Infecção Urinária. Disponível em:
<http://www.publisaude.com.br/portal/artigos/para-o-leigo/infeccao-urinaria.html>. Acesso
em: 13/05/2011.
MILAGRES, L.G.; MELLES, C. E.A. Diferenças nas propriedades adesivas
de Staphylococcus saprophyticus a células HEp-2 e eritrócitos. Revista do Instituto de
Medicina Tropical de São Paulo., vol.34, n.4, p. 315-321. 1992. Disponível em:
<http://www.scielo.br/scielo.php?pid=S003646651992000400008&script=sci_abstract&tlng=pt>. Acesso em: 20/03/2011.
MURRAY, P. R. Microbiologia Médica. 4. ed. São Paulo: Elsevier, 2004.
NATIONAL COMMITTEE FOR CLINICAL LABORATORY STANDARDS - NCCLS.
Performance standards for antimicrobial disk susceptibility tests. Approved standards..
Wayne: NCCLS, 2003. 58p. (NCCLS, Document M2-A8)
NELSON, R.W.;COUTO, C.G. Insuficiência Renal. Medicina Interna de Pequenos
Animais. 2. ed. Rio de Janeiro: Guanabara Koogan, 2001. p. 487-493.
NETTER, F. H.. Atlas de Anatomia Humana. 2. ed. Porto Alegre: Artmed, 2000.
NICKEL, J. C. Management of urinary tract infections: historical perspective and current
strategies: part 2- modern management. Journal of Urology, v. 173, n.1, p. 27-32, 2005
OLIVEIRA, A. C. S. Urolitiase Canina. Brasília: UCB, 2010. p. 17.
43
OPLUSTIL, C.P.; ZOCCOLI C. M.; TOBOUTI, N.R. SARVIER, B. T. Microbiologia
Clínica. 2. ed. São Paulo: Sarvier, 2004. p. 412.
OSBORNE, C.A.; LEES, G.E. Bacterial Infections of the Canine and Feline Urinary Tract.
In: FINCO, D. R. Canine and Feline Nephrology and Urology. Williams & Wilkins,
Baltimore, 1995. p.759-797.
PARISI. S. Cálculo urinário: seu cãozinho tem?. Disponível em:
<http://www.pequenoscaes.com.br/calculo-urinario.php> Acesso em: 29/04/2011.
PET IMAGEM. Disponível em: < http://www.petimagem.com/Diagnostico-imagem.aspx>.
Acesso em 16/04/2011.
PETER, J. 7 sinais de infecção urinária, 2/03/2010. Disponível em:
<http://peturineodorremover.com/pt/pets-animals/7-signs-of-dog-urinary-tract-infection/>.
Acesso em: 29/04/2011.
PINHEIRO, P. Staphylococcus aureus: quais os riscos desta bactéria? Blog MD.Saúde,
30/05/2010. Disponível em: <http://www.mdsaude.com/2009/02/estafilococos-aureusmrsa.html#ixzz1LFMIoaW2>. Acesso em: 22/04/2011.
______. Urocultura: indicações e como colher. Blog MD. Saúde, 15/09/2010. Disponível
em: <http://www.mdsaude.com/2010/09/exame-urocultura.html#ixzz1MHX2jZaD>. Acesso
em: 13/05/2011.
PIRANI, T. B. Insuficiência Renal Aguda em Cães. Trabalho apresentado para conclusão
do curso de Clínica Médica de Pequenos Animais – UCB, Ribeirão Preto, 2008. Disponível
em: <http://www.qualittas.com.br/documentos/Insuficiencia%20Renal%20Aguda%20%20Tatiane%20Bortolato%20Pirani.PDF>. Acesso em 8 maio de 2011.
POLZIN, D.J. Tratamiento de lãs infecciones bacterianas difíciles dei tracto urinário.
Waltham Focus, v.7, n.1, p.13-19, 1997.
PRESCOTT, J. F; BAGGOT, J. D. Antimicrobial therapy in veterinary medicine, 2ⁿ ed,
Iowa: Iowa State University Press, 1993. 612 p.
RIBEIRO, M. C.; SOARES, M. M. S. R. Microbiologia Prática Roteiro e Manual:
Bactérias e Fungos. São Paulo: Atheneu, 1998.
44
RICETTO, C. L. Z.. Infecção do Trato Urinário. Disponível em:
<http://www.trabalhosfeitos.com/ensaios/Infec%C3%A7%C3%B5es-Do-TratoUrin%C3%A1rio/7897.html>. Acesso em: 10/04/2011.
ROCHA, L. C. A.; CARVALHAL, G. F.; MONTI, P. P. - Exames complementares na
infecção do trato urinário. Int. Braz. J. Urol., 29(3): 15-20, 2003.
SHAW, D.H. A systemic approach to managing lower urinary tract infections. Journal of
the American Veterinary Medical Association, v.85, n.4, p.379-386, 1990.
SILVA, G.O.; CASTRO, M.C.N.; BERNARDES, J.P.; DIECKMANN, A.M.; VIEIRA, A.B.
Doenças do trato urinário: perfil nosológico dos atendimentos a cães e gatos em um
hospital universitário. Disponível em:
<http://www.sovergs.com.br/conbravet2008/anais/cd/resumos/R0093-2.pdf>. Acesso em:
04/05/2011.
SILVEIRA, S. A. ARAÚJO, M.C.; FONSECA, F. M.; OKURA, M. H.; OLIVEIRA, A.C.S.
Prevalência e Suscetibilidade Bacteriana em Infecções do Trato Urinário de Pacientes
Atendidos no Hospital Universitário de Uberada. RBAC, vol. 42, p. 157-160. 2010.
SIVIEIRO, A. Infecção Urinária. Blog o Nosso Latido, 05/04/2011. Disponível em:
<http://www.caoemquadrinhos.com.br/site/blog/?p=2291>. Acesso em: 19/04/2011.
SWENSON, M. J.; REECE, W.O. Dukes Fisiologia dos Animais Domésticos. 11º ed. Rio
de Janeiro: Guanabara Koogan, 1996. p. 623-625.
VAIL, D.M.; ALLEN, T.A.; WEISER, G. Applicability of leukocyte esterase test strip in
detection of canine pyuria. Journal of the American Veterinary Medical Association,
v.189, nº 11, p.1451-1453. 1986.
VITAL, M.J.S. Entrevista sobre microorganismos. Blog Microbiologia na UFRR,
10/04/2006. Disponível em: < http://biologiaufrr.blogspot.com/>. Acesso em: 19/04/2011.
WARREN, J. W.;ABRUTYN, E. HEBEL, J. R.; JOHNSON, J. R.; SCHAEFFER, A. J.;
STAMM, W. E. Guidelines for antimicrobial treatment of uncomplicated acute bacterial
cystitis and acute pyelonephritis in women. Infectious Diseases Society of America (IDSA).
Clin Infect Dis, nº 29, 1999. p. 745-758.