Reação de ciclocondensação de Biginelli-Like: síntese de 5-não substituído- 3, 4Dihidropirimidin- 2 (1H) -ona sob condições livre de solventes
Felipe Bruno Lourenço
1
Mestrando em Ciências Moleculares, bolsa FAPEG, Universidade Estadual de Goiás UnUCET
Anápolis (GO),[email protected]
1
Lalessa Lustosa da Costa
Graduanda em Química Industrial, Universidade Estadual de Goiás CCET Anápolis
(GO), [email protected]
Luciana Machado Ramos
Docente, Universidade Estadual de Goiás UnUCET Anápolis (GO), [email protected]
INTRODUÇÃO
A busca por metodologias químicas ambientalmente corretas tornam-se necessário a
investigação de rotas sintética menos poluentes, visando a utilização de catalisadores, solventes e
reagentes não tóxicos (KHOSROPOUR et al., 2006).
As Reações Multicomponentes (RMC) se enquadram nos padrões da química verde, sendo
uma excelente estratégia para a combinação de reagentes, obtendo excelentes rendimentos,
promovendo economia atômica, além da sua sustentabilidade (ALVIM et al., 2014).
As RMC é uma poderosa ferramenta na área síntese orgânica, química combinatória e
química medicinal. Essas reações ocorrem em “in situ” em métodos “one pot” o que proporciona
uma redução no número de passos reacionais, consequentemente uma menor quantidade de resíduos
gerados no processo, principalmente quando comparados às demais reações lineares (PHUKAN et
al., 2010; MISTRY e MAHERIA, 2012).
Dentre as reações multicomponentes destacam-se as reações de Biginelli, que atualmente
tem atraído atenção devido aos seus produtos apresentarem potenciais farmacológicos: antitumoral,
anti-inflamatórias, antiviral e analgésica (HERAVI et al., 2008; MISTRY e MAHERIA, 2012;
Pirenópolis – Goiás – Brasil
20 a 22 de outubro de 2015
PHUKAN et al.,2010; HERAVI et al., 2010, RAMOS et al., 2013).
As reações de Biginelli é uma metodologia bastante utilizada na síntese de heterocíclicos,
conhecidos como Dihidropirimidinonas (DHPMs). Por apresentar grande potencial biológicos há
um grande interesse em métodos mais viáveis, menos nocivos e mais eficientes para a síntese desses
compostos. Todavia, a busca por novos catalisadores e novas moléculas com propriedades
farmacológicas são constantemente exploradas (HERAVI et al., 2008; MISTRY e MAHERIA,
2012; PHUKAN et al.,2010; HERAVI et al., 2010).
Neste contexto, as reações de Biginelli-like vêm aumentando o interesse em estratégias
sintéticas com abordagens variadas para sua síntese aumentou ao longo dos últimos anos ampliando
tanto o interesse químico quanto biológico, o que tem proporcionado grande exploração na
literatura de DHPMs.
OBJETIVO(S)
Analisar as melhores condições reacionais para síntese de Dihidropirimidinonas via reação de
Biginelli-Like.
METODOLOGIA
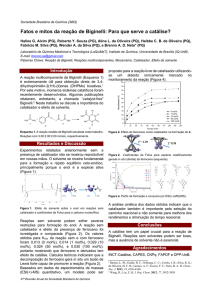
Foram realizados vários experimentos via reações de Biginelli-Like (Esquema 1) para
monitorar e determinar as melhores condições de reação: catalisadores, temperatura e solventes. Em
balão de fundo redondo (25mL) , foram adicionados Acetofenona (1,00 mmol), Benzaldeído (1,00
mmol), Uréia (1,00 mmol) na presença de catalisador em sistema de refluxo.
Esquema 1. Esquema representativo da reação de Biginelli-likes
O
O
H
+
O
+
H2N
NH2
N
N
H
H
O
Nestes experimentos empregou-se 50 mg de catalisadores distintos: Imidazol, MAI.Cl-,
FeCl3, CuCl2, TEBAC, DABCO, SnCl2.2H2O, CoCl2.6H2O, Ce(NO3)3.6H2O, ZnCl2, Diácido
Imidazol e um Líquidos iônico específico. Todos os experimentos foram mantidos sob temperatura
de 60°C e agitação por 2 horas.
Na quarta etapa da cinética determinou-se o tipo de solvente ideal para a reação de Biginellilikes, foram testados solventes polares e apolares (próticos e apróticos). A reação também foi
realizada na ausência de solvente.
RESULTADOS E DISCUSSÃO
Vários catalisadores podem ser utilizados em reações do tipo Biginelli-Likes, ácidos de
Lewis, Bronsted Lory, Líquidos iônicos entre outros. Dos catalisadores testados neste trabalho o que
apresentou mais eficácia foi um Liquido Iônico (LI) (Tabela 1).
Tabela 1. Resultados das reações com variados tipos de catalisadores.
Entrada
Catalisador
Rendimento (%)
1
Sem catalisador
28
2
Imidazol
33
3
MAI.Cl-
14
4
5
FeCl3
CuCl2
2
8
6
LI
88
7
DABCO
4
8
SnCl2.2H2O
14
9
CoCl2. 6H2O
-
10
Diácido imidazol
22
11
Ce(No3)3.6 H2O
-
12
ZnCl2
7
*1mmol de Benzaldeido,1mmol Acetofenona , 1mmol ureia, 50mg catalisador, 60°C, 2h
Pirenópolis – Goiás – Brasil
20 a 22 de outubro de 2015
Os testes com variados solventes também apresentaram rendimentos significativos porem
abaixo do rendimento da reação na ausência de solvente, o que torna a reação mais viável sem
solvente e consequentemente a geração de menos resíduos ao final do processo.
Tabela 2. Resultado da variação do solvente para Biginelli-Likes.
Entrada
solvente
Rendimento (%)
1
Acetonitrila
39
2
Diclorometano
26
3
Tolueno
13
4
Hexano
18
5
BMI.BF4
6
BMI.BF6
* 1mmol benzaldeido, 1mmol Acetofenona, 1mmol ureia, 50 mg catalisador, 3h (os melhores rendimentos
com solvente foi alcançado com 3 horas de reação), 60°C.
A reação ocorreu na ausência de solventes apresentando rendimentos significativos o que a
torna ainda mais interessante e menos poluente, levando-se em consideração também a parte
financeira que a torna mais viável. Entre os catalisadores analisados o LI foi o que apresentou
melhores rendimentos quando comparado aos demais catalisadores apresentados. O processo
abordado é simples, eficiente e ambientalmente amigável com o uso de pequena quantidade de
catalisador. Podemos afirmar que os rendimentos foram satisfatórios quando comparamos com
demais dados da literatura.
CONSIDERAÇÕES FINAIS
O trabalho em questão evidencia que as condições reacionais para Biginelli-like, se
enquadram nos padrões da química verde.
Em conclusão, um protocolo eficiente e de alto rendimento para a síntese de 5-não
substituído-3,4-di-hidropirimidin- 2(1H)-ona que envolvem condensação tricomponente em meio
“one pot” utilizando um aldeído aromático, acetofenona e ureia catalisada por um Líquido iônico e
em condições livre de solvente foi desenvolvido. O procedimento descrito apresentou rendimentos
tão bons quanto a reação clássica Biginelli. Acredita-se que este método versátil seja aplicável para
a geração rápida de estruturas com potencial biológico.
Contudo, tem-se como perspectivas futuras a variação de substratos para a geração de diferentes
produtos, espera-se também que com a aplicação de outros reagentes de partida com grupos
ativantes e desativantes possam proporcionar melhores rendimentos reacionais.
AGRADECIMENTOS
FAPEG e PBI-UEG pelas bolsas concedidas.
REFERÊNCIAS
ALVIM, H. G. O.; JUNIOR, E. N. S.; NETO, B. A. D. What do we know about multicomponent
reactions? Mechanisms and trends for the Biginelli, Hantzsch, Mannich, Passerini and Ugi MCRs.
Royal society of chemistry, v. 20, p. 1-18, 2014.
HERAVI M. M.; DERIKVAND F.; RANJBAR L.; BAMOHARRAM F. F. H6P2W18O62.18H2O, a
green and reusable catalyst for the three-component, one-pot synthesis of 4,6-diarylpyrimidin2(1h)-ones under solvent-free conditions. Synthetic Communication. v. 40, p. 1256-1263, 2010.
HERAVI M. M.; RANJBAR L.; DERIKVAND F.; ALIMADADI B. Three-component one-pot
synthesis of 4,6-diarylpyrimidin- 2(1H)-ones under solvent-free conditions in the presence of
sulfamic acid as a green and reusable catalyst. Springer Science. v. 12, p. 191-196, 2008.
KHOSROPOUR A. R.; MOHAMMADPOOR-BALTORK I.; GHORBANKHANI H. Bi(TFA)3
immobilized in [nbpy]FeCl4 : An efficient catalyst system for the one-pot synthesis of 4,6diarylpyrimidin-2(1H)-ones. Catalysis Communications, v. 7, p. 713-716, 2006.
MISTRY S.R. e MAHERIA K. C. Synthesis of dyarylpyrimidinones (DHPMs) using large pore
zeolites. Journal of Molecular Catalysis A: Chemical. v. 355, p. 210-215, 2012.
PHUKAN M.; KALITA M. K.; BORAH R. A new protocol for Biginelli (or like) reaction under
solvent-free grinding method using Fe (NO3)3.9H2O as catalyst. Green Chemistry Letters and
Reviews, v. 3, n. 4, p. 329-334, 2010.
RAMOS, L. M.; GUIDO, B. C.; NOBREGA, C. C.; CORRÊA, J. R.; SILVA, R. G.; OLIVEIRA, H.
C. B.; GOMES, A. F.; GOZZO, F. C.; NETO, B. A. D. The Biginelli Reaction with an
Imidazolium–Tagged Recyclable Iron Catalyst: Kinetics, Mechanism, and Antitumoral Activity.
Chemistry a European Journal, v.19, p. 4156–4168, 2013.
Pirenópolis – Goiás – Brasil
20 a 22 de outubro de 2015