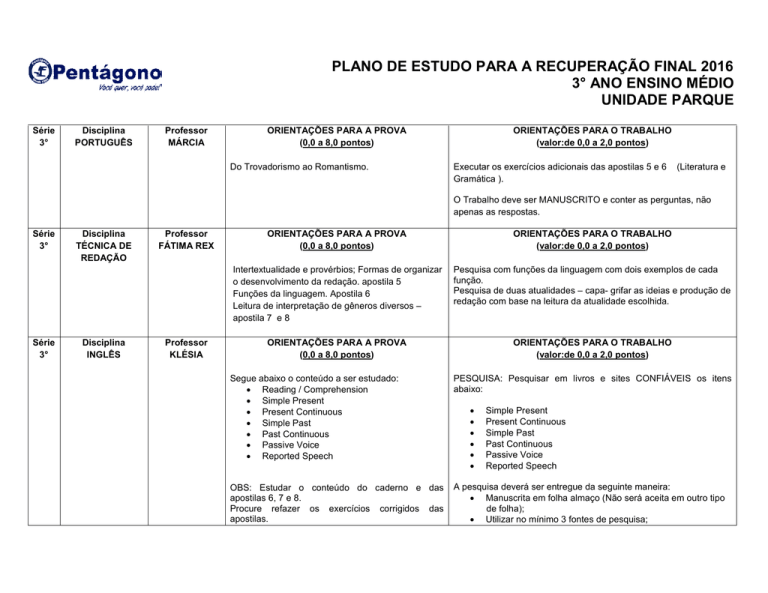
PLANO DE ESTUDO PARA A RECUPERAÇÃO FINAL 2016
3° ANO ENSINO MÉDIO
UNIDADE PARQUE
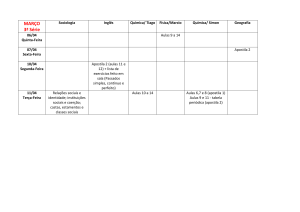
Série
3°
Disciplina
PORTUGUÊS
Professor
MÁRCIA
ORIENTAÇÕES PARA A PROVA
(0,0 a 8,0 pontos)
Do Trovadorismo ao Romantismo.
ORIENTAÇÕES PARA O TRABALHO
(valor:de 0,0 a 2,0 pontos)
Executar os exercícios adicionais das apostilas 5 e 6
Gramática ).
(Literatura e
O Trabalho deve ser MANUSCRITO e conter as perguntas, não
apenas as respostas.
Série
3°
Série
3°
Disciplina
TÉCNICA DE
REDAÇÃO
Disciplina
INGLÊS
Professor
FÁTIMA REX
Professor
KLÉSIA
ORIENTAÇÕES PARA A PROVA
(0,0 a 8,0 pontos)
ORIENTAÇÕES PARA O TRABALHO
(valor:de 0,0 a 2,0 pontos)
Intertextualidade e provérbios; Formas de organizar
o desenvolvimento da redação. apostila 5
Funções da linguagem. Apostila 6
Leitura de interpretação de gêneros diversos –
apostila 7 e 8
Pesquisa com funções da linguagem com dois exemplos de cada
função.
Pesquisa de duas atualidades – capa- grifar as ideias e produção de
redação com base na leitura da atualidade escolhida.
ORIENTAÇÕES PARA A PROVA
(0,0 a 8,0 pontos)
ORIENTAÇÕES PARA O TRABALHO
(valor:de 0,0 a 2,0 pontos)
Segue abaixo o conteúdo a ser estudado:
Reading / Comprehension
Simple Present
Present Continuous
Simple Past
Past Continuous
Passive Voice
Reported Speech
PESQUISA: Pesquisar em livros e sites CONFIÁVEIS os itens
abaixo:
OBS: Estudar o conteúdo do caderno e das
apostilas 6, 7 e 8.
Procure refazer os exercícios corrigidos das
apostilas.
A pesquisa deverá ser entregue da seguinte maneira:
Manuscrita em folha almaço (Não será aceita em outro tipo
de folha);
Utilizar no mínimo 3 fontes de pesquisa;
Simple Present
Present Continuous
Simple Past
Past Continuous
Passive Voice
Reported Speech
Série
3°
Disciplina
EDUCAÇÃO
FÍSICA
Professor
JORGE
NÃO HÁ PROVA:
SEGUIR AS ORIENTAÇÕES PARA O TRABALHO.
Dar a definição, estrutura e quatro exemplos de cada item;
Capa conforme norma ABNT;
Fazer com Introdução, Desenvolvimento, Conclusão e
Bibliografia;
Letra legível, cuidado com erros ortográficos e falta de
acentuação, pois será descontado 0,2 para cada erro.
ORIENTAÇÕES PARA O TRABALHO
(valor: de 0,0 a 10,0 pontos)
A SER ENTREGUE E APRESENTADO CONFORME
CALENDÁRIO DE PROVAS DE RECUPERAÇÃO (SEGUIR DIA E
HORÁRIO).
Pesquisar os seguintes temas:
1)Benefícios e importância da atividade física para prevenção de
doenças.
2)Explique a atividade física para cada faixa etária.
3)Doping no Esporte
PARTE 1: seminário (apresentação).
PARTE 2: toda parte escrita fica com o professor para acompanhar
a apresentação.
Os trabalhos podem ser digitados ou manuscritos.
O trabalho que não tiver uma fonte de pesquisa confiável (exemplo
WIKIPÉDIA) ou trabalhos iguais serão desconsiderados.
O TRABALHO DEVE CONTER: CAPA, INTRODUÇÃO, ÍNDICE,
BIBLIOGRAFIA, CONCLUSÃO.
Série
3°
Disciplina
MATEMÁTICA
Professor
MÁRCIO
ORIENTAÇÕES PARA A PROVA
(0,0 a 8,0 pontos)
Juros simples.(Apostila 3, aula 53);
Juros compostos. (Apostila 3, aula 53);
ORIENTAÇÕES PARA O TRABALHO
(valor:de 0,0 a 2,0 pontos)
Este trabalho deverá ser entregue em folha de almaço ou
sulfite, manuscrito, com enunciados copiados e resoluções
completas.
Progressão Aritmética I. (Apostila 3, aula 55).
Progressão Aritmética II. (Apostila 3, aula 56).
Reta, distâncias (Apostila 4, Aula 85)
Equação da circunferência. (Apostila 4, Aula 86)
1.Quanto renderá um capital de R$500,00, aplicado à taxa de 20%
ao ano, durante 3 anos em regime de juros simples?. (0,25 pontos).
2. Quanto renderá um capital de R$500,00, aplicado à taxa de 20%
a.a, durante 3 anos em regime de juros compostos?. (0,25 pontos).
3.Determine o 100º termo da PA: (2,5,8,11,15...). (0,25 pontos).
4.Determine a soma dos 1000 primeiros termos da PA: (1,3,5,7,...).
(0,25 pontos).
5. Verifique se os pontos A (2 ; 5) ,
colineares. (0,25 pontos).
B ( 3 ; 7 ) e C ( 5 ; 11 ) são
6. Determine a área do triangulo cujos vértices são os pontos A (2 ;
1) , B (3 ; 2 ) e C (1 ; 2 ). (0,25 pontos)
7. Por meio do determinante, determine a equação da reta que
passa pelos pontos A (1 ; 2) e B (4 ; 3). (0,25 pontos)
8. Determine a equação reduzida e a equação normal da
circunferência de centro C (4 ; 6) e raio 3. (0,25 pontos)
Série
3°
Disciplina
FÍSICA
Professor
FERNANDA
ORIENTAÇÕES PARA A PROVA
(0,0 a 8,0 pontos)
ORIENTAÇÕES PARA O TRABALHO
(valor:de 0,0 a 2,0 pontos)
Força elétrica, campo elétrico, termometria,
dilatometria, diferença de potencial, resistência
elétrica, Leis geral dos gases, equação de estado
dos gases, quantidade de movimento, impulso,
teorema do impulso, associação de resistores,
medidores elétricos, potência elétrica e noções de
magnetismo, produção de campo magnético e força
magnética sobre carga.
Fazer resumo e resolver exercícios indicados para cada um dos
temas. Os exercícios que necessitem de cálculos para a resolução,
devem apresentar todas as contas.
Apostila 4: resumir aulas 57 a 60, 65 e 66
Exercícios 3 e 4 da página 68
Exercícios 1, 2 e 4 da página 72
Exercício 5 da página 73
Exercícios 2 e 3 da página 89
Exercícios 1 a 5 das páginas 92 e 93
Apostila 5: resumir aulas 73 a 75 e 78 a 82
Exercícios 1 a 4 das páginas 74 e 75
Exercícios 1 a 4 das páginas 77 e 78
Exercícios 1 e 2 das páginas 80 e 81
Exercícios 3 e 4 da página 91
Exercícios 1 a 6 das páginas 94 e 95
Exercícios 1 a 4 da página 99
Exercícios 1 a 3 das páginas 101 e 102
Apostila 6: resumir aulas 89 a 92 e 95 a 97
Exercícios 1 e 2 da página 49
Exercícios 1 e 2 da página 56
Exercícios 1 a 4 da página 68
Exercícios 1 a 3 das páginas 70 e 71
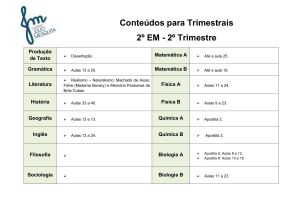
Série
3°
Disciplina
QUÍMICA
Professor
WANDERLEI
ORIENTAÇÕES PARA A PROVA
(0,0 a 8,0 pontos)
ORIENTAÇÕES PARA O TRABALHO
(valor:de 0,0 a 2,0 pontos)
Ácidos e Bases segundo Arrhenius Ionização e
dissociação iônica. Ácidos e bases conjugadas de
Brönsted-Lowry. (apostila: 3 – Parte - B - páginas:
233 até 245).
Resolver a lista de exercícios (QUE ESTÁ DISPONÍVEL AO FINAL
DESTE PLANO) de forma organizada, sem rasuras, respostas
dissertativas com clareza e objetividade; para os exercícios que
exijam raciocínio lógico matemático, deve ser registrado o
desenvolvimento dos cálculos para sua resolução.
Química nuclear, 1ª e 2ª Leisda radioatividade e
Período de meia vida ou semidesintegração.
Reações Orgânicas: Substituição em alcanos e
aromáticos; Adição em alcenos e alcinos;Reações
de Desidratação, esterificação e hidrólise. (apostila:
4 – Parte - A - páginas: 205 até 241).
Termoquímica: Entalpia de formação; de combustão;
de reação; Lei de Hess e Entalpia de ligação.
Cinética Química; velocidade das reações; lei das
velocidades; Ordem de reações elementares e não
elementares; Fatores que alteram a velocidade da
reação; (apostila: 4 – Parte - B - páginas: 242 até
276).
Reações Orgânicas de oxidação e redução; Ácidos
e bases orgânicas.(apostila: 5 – Parte - A páginas: 199 até 257).
Para rever o conteúdo teórico para resolução dos exercícios, utilizar
as apostilas do Etapa como apoio, utilizando os capítulos citados
nas orientações para a prova para realização do trabalho e da
prova.
A Prova será baseada em exercícios abordados no conteúdo do
trabalho o que torna sua resolução fundamental para o
desenvolvimento do conteúdo do semestre letivo que será cobrado
na atividade e na prova de recuperação semestral.
Série
3°
Disciplina
BIOLOGIA
Professor
NATHÁLIA
ORIENTAÇÕES PARA A PROVA
(0,0 a 8,0 pontos)
Genética (Leis de Mendel, Sistema ABO/Rh e
Herança do sexo);
Biologia celular (mitose e meiose, metabolismo
energético);
Fotossíntese;
Vertebrados (evolução, principais características de
cada Classe);
Sistemas digestório, nervoso e circulatório;
Parasitoses (protozoários, platelmintos e
nematelmintos – só doenças – ciclo de vida dos
parasitas).
ORIENTAÇÕES PARA O TRABALHO
(valor:de 0,0 a 2,0 pontos)
- Pesquisar e explicar resumidamente3 endemias tropicais, à
escolha do aluno. O trabalho deve conter introdução explicando o
que são endemias, o desenvolvimento explicando as características
da doença (agente, transmissores, sintomas, tratamento e profilaxia)
e uma conclusão pessoal do aluno sobre porque estas doenças são
problemáticas e qual a maneira de lidar com elas - manuscrito,
individual. Trabalhos iguais e/copiados da internet serão ZERADOS!
- Esquematizar com desenhos os ciclos de vida das Divisões do
Reino Plantae (Briófitas, Pteridófitas, Gimnospermas e
Angiospermas), indicando o nome das principais estruturas, sua
ploidia (n, 2n ou 3n) e em que fase dos ciclos ocorre a meiose.
Manuscrito, em folha de sulfite.
As duas partes do trabalho serão avaliadas nos quesitos gerais:
- Conteúdo (se está correto e completo);
- Organização das ideias (texto deve ser coeso e coerente);
Série
3°
Disciplina
HISTÓRIA
Professor
NÍLSON
ORIENTAÇÕES PARA A PROVA
(0,0 a 8,0 pontos)
Ap.5 – Regime Militar; Segunda Guerra Mundial;
Guerra Fria; Descolonização e Neocolonialismo
Ap.6 – Brasil: 1985 até hoje; África; Conflitos no
Oriente
Médio
e
Tendência
do
Mundo
contemporâneo
Série
3°
Disciplina
GEOGRAFIA
Professor
DANILO
ORIENTAÇÕES PARA A PROVA
(0,0 a 8,0 pontos)
Geomorfologia - conceitos
- Estética (especialmente dos desenhos, letra legível, rasuras).
ORIENTAÇÕES PARA O TRABALHO
(valor:de 0,0 a 2,0 pontos)
PESQUISA:
Manuscrito ou digitado; entregar “em papel” e não via e-mail, como
foi ao longo do ano letivo.
Temas:
• Segunda Guerra e Descolonização da África e Ásia e
• Características políticas e econômicas do Brasil de 1985 a 2011.
ORIENTAÇÕES PARA O TRABALHO
(valor:de 0,0 a 2,0 pontos)
Trabalho; nas normas da ABNT sobre;
- demografia – conceitos e definição.
TRABALHO DE RECUPERAÇÃO FINAL DE QUÍMICA
TURMA: 1A3AP
PROFESSOR: WANDERLEI A. PIROLLO
NOME: ______________________________________________________________________________________
NOTA: _________
N°: _______
LEIA ATENTAMENTE AS INSTRUÇÕES:
1. Preencha corretamente o cabeçalho com caneta. Na falta do mesmo a prova será cancelada.
2. Este trabalho tem o valor de zero até dois pontos.
3. A resposta final deverá ser à tinta esferográfica azul ou preta.
4. Resolução obrigatória das questões dissertativas.
5. Registro obrigatório do raciocínio lógico matemático nos testes que apresentam cálculos para chegar à alternativa correta.
6. Esta lista de exercícios traz a base para elaboração da prova de recuperação final.
Ácidos e bases de Arrhenius e Bronsted- Lowry:
1. Na reação segundo a equação:
___________________________________________________________________
_________________________________________________________________
d) Qual a base de Bronsted-Lowry na reação direta (1)?
___________________________________________________________________
___________________________________________________________________
a) Qual o doador de próton na reação direta (1)?
___________________________________________________________________
___________________________________________________________________
e) Qual o doador de próton na reação inversa (2)?
___________________________________________________________________
___________________________________________________________________
b) Qual o receptor de próton na reação direta (1)?
___________________________________________________________________
___________________________________________________________________
c) Qual o ácido de Bronsted-Lowry na reação direta (1)?
f) Qual o receptor de próton na reação inversa (2)?
___________________________________________________________________
___________________________________________________________________
g) Qual o ácido de Bronsted-Lowry na reação inversa (2)?
___________________________________________________________________
___________________________________________________________________
3. Escrever a equação de ionização (total) dos “ácidos” abaixo em solução
aquosa, nomeando seu respectivo ânion.
a) HBr
h) Qual a base de Bronsted-Lowry na reação inversa (2)?
___________________________________________________________________
___________________________________________________________________
b) HIO4
i) Qual os pares conjugados?
___________________________________________________________________
___________________________________________________________________
d) H3PO4
c) H2SO4
e) HNO2
f) H4SeO7
2. Indique os ácidos e bases pela teoria de Bronsted-Lowry, e os respectivos pares
conjugados nas reações abaixo equacionadas:
1ª e 2ª Leis da Radioatividade
4. A partir da aplicação das 1ª e 2ª Leis da Radioatividade aplique esses conceitos
e registre seus cálculos para calcular os valores das incógnitas em cada uma das
reações abaixo:
b) Sabendo que um determinado isótopo do 106Sg perde 50% de sua massa inicial
em 10 segundos, calcule a massa final de uma amostra de 800 gramas deste
isótopo após 30 segundos.
6. O acidente do reator nuclear de Chernobyl, em 1986, lançou para a atmosfera
grande quantidade de 38Sr90 radioativo, cuja meia-vida é de 28 anos. Supondo ser
este isótopo a única contaminação radioativa e sabendo que o local poderá ser
considerado seguro quando a quantidade de 38Sr90 se reduzir, por desintegração,
a 1/16 da quantidade inicialmente presente. Calcule quantos anos serão
necessários para o local poder ser habitado novamente? Registre seus cálculos.
5. Glenn T. Seaborg é um renomado cientista que foi agraciado com o Prêmio
Nobel de Química em 1951, por seus trabalhos em radioquímica. Em 1974 foi
sintetizado, nos Estados Unidos, o elemento de número atômico 106 que, em sua
homenagem, teve como nome proposto Seaborgium (106Sg).
a) O bombardeio do 98Cf249 por um elemento X produz o 106Sg263 e 4 nêutrons.
Determine o número atômico e o número de massa do elemento X.
7. Quando se fala em isótopos radioativos, geralmente a opinião pública os
associa a elementos perigosos, liberados por reatores nucleares. No entanto,
existem isótopos de elementos naturais que estão presentes no nosso dia-a-dia.
O gráfico mostra a cinética de desintegração do rádio-226, que pode estar
presente em materiais de construção, em geral em concentrações muito baixas
para que se possa comprovar qualquer relação com danos à saúde. As
coordenadas de um ponto do gráfico são indicadas na figura.
Reações Orgânicas de: Substituição, Adição, Desidratação, Esterificação e Hidrólise:
8. Complete os mecanismos de reações abaixo devidamente balanceadas e
escreva a fórmulas dos reagentes e dos produtos formados assim como o nome
dos mesmos.
9. Complete os mecanismos de reações de adição abaixo devidamente
balanceadas e escreva a fórmulas dos reagentes e dos produtos formados assim
como o nome dos mesmos.
9. Na reação de substituição do cloro gasoso com 2,2-dimetilbutano, em
presença de luz,indique quantos compostos monoclorados diferentes que podem
ser formados escreva siuas fórmulas e nomes:
Álcoois podem ser obtidos pela hidratação de alcenos, catalisada por ácido
sulfúrico. A reação de adição segue a regra de Markownikoff, que prevê a adição
do átomo de hidrogênio da água ao átomo de carbono mais hidrogenado do
alceno. Escreva a equação química balanceada de hidratação catalisada do but-1eno.
Faça a reação do principal produto obtido pela adição de 1 mol de HBr ao
eritreno (1,3-butadieno).
Qual o principal composto formado na reação entre 1 mol de butano e 1 mol de
bromo? Explique por quê.
Faça a reação do principal produto obtido pela adição de 1 mol de HClao metil-2but-2-eno.
Numa reação de 2-metilbutano com Cℓ2, ocorreu a substituição de hidrogênio.
Faça a reação do composto clorado obtido em maior quantidade.
10. Complete as seguintes reações de desidratação dos álcoois:
A reação que resulta na formação do éster metanoato de isopropila:
A reação que resulta na formação do éster 2-metil butanoato de etila:
A reação de hidrólise ácida do éster etanoato de terc-butila.
11. Complete as reações de esterificação abaixo e indique o nome dos
componentes envolvidos na reação:
Entalpia de formação, de combustão, Lei de Hess e Entalpia de Ligação.
12. São dadas as equações termoquímicas a 25 °C e 1 atm:
2 C2H2(g) + 5 O2(g) 4 CO2(g) + 2 H2O(ℓ) H1 = – 2602 kJ (combustão do
acetileno)
2 C2H6(g) + 7 O2(g) 4 CO2(g) + 6 H2O(ℓ) H2 = – 3123 kJ (combustão do etano)
H2(g) + ½ O2(g) H2O(ℓ) H3 = – 286 kJ (formação de água) a)
Aplique a lei de Hess para a determinação do H da reação de hidrogenação do
acetileno, de acordo com a equação IV. Registre todas as alterações para o
cálculo.
_____________________________________________________________
_____________________________________________________________
_____________________________________________________________
_____________________________________________________________
_____________________________________________________________
_____________________________________________________________
_____________________________________________________________
C2H2(g) +2 H2 C2H6(g)
H4= ___________
13. O metanol, um combustível líquido, tem sido utilizado como substituto da
gasolina, e pode ser produzido a partir do metano, conforme a reação
representada a seguir:
14. Calcular a variação de entalpia na reação: 2 HBr(g) + Cℓ2(g) 2 HCℓ(g) +
Br2(g), conhecendo-se as seguintes energias de ligação todas nas mesmas
condições de pressão e temperatura, calcule e registre o H da reação.
a) Calcule a variação de entalpia (H°) da reação I, a partir dos dados fornecidos
aplicando a Lei de Hess. Registre todas as alterações necessárias.
b) Determine o calor liberado na reação III, quando 280 gramas de monóxido de
carbono são consumidos.
15. Calcule a energia envolvida na reação: 2 HI(g) + Cℓ2(g) I2(g) + 2 HCℓ(g).
Expresse o resultado em kcal/mol de HI(g). Indique se a reação é exotérmica ou
endotérmica. Dados:
Cinética Química e Fatores que alteram a velocidade de uma reação.
16. Considere o gráfico abaixo, referente ao diagrama energético da reação: N2(g) + 3 H2(g) → 2 NH3(g), sob a ação de um catalisador:
c)
Calcule o valor energia de ativação da reação com catalisador.
d)
Nas condições-padrão, calcule a entalpia de formação do gás amoníaco
(NH3).
e)
Qual o efeito do catalisador na reação? Explique.
17. No diagrama abaixo estão representados os caminhos de uma reação na
presença e na ausência de um catalisador. Com base neste diagrama, é correto
afirmar que:
19. O esquema mostra observações feitas por um aluno, quando uma chapa de
alumínio foi colocada em um tubo de ensaio, contendo solução aquosa de HCℓ.
Nessa experiência, ocorre o desprendimento de um gás e a formação de
um sal. A respeito dela é correto afirmar que:
a) a frio, a reação é forte e processa-se instantaneamente.
b) o sal formado é insolúvel.
c) o gás formado é o oxigênio.
d) a reação é acelerada quando o sistema é aquecido.
e) a velocidade da reação não se altera com o aumento de temperatura.
20. Num laboratório foram efetuadas diversas experiências para a reação: 2 H2(g)
+ 2 NO(g) → N2(g) + 2 H2O(g). Com os resultados das velocidades iniciais obtidos,
montou-se a tabela abaixo. Pede-se a partir da tabela:
(01) A curva II refere-se à relação catalisada e a curva I refere-se à reação não
catalisada.
(02) Se a reação se processar pelo caminho II, ela será mais rápida.
(04) A adição de um catalisador à reação diminui seu valor de ∆H.
(08) O complexo ativado da curva I apresenta a mesma energia do complexo
ativado da curva II.
(16) A adição do catalisador transforma a reação endotérmica em exotérmica.
Somatória das alternativas corretas: Total = ( ___________________ )
b) Escreva a equação da velocidade.
c) Calcule o valor da constante da velocidade (K).
21. Dados experimentais sobre a reação do brometo de t-butila com hidroxila, a
55 °C:
Reações Orgânicas de Oxidação e Redução
22. Dadas as reações abaixo calcule o numero de oxidação (NOX) de cada
elemento e indique os participantes que sofreram oxidação e redução.
23. A prática secular que recomenda o armazenamento "deitado" de garrafas de
vinho, para umedecimento da rolha, assegura maior durabilidade do produto ao
evitar a degradação do etanol, conforme a sequência de reações:
As etapas I e II indicadas na sequência de reações são, respectivamente:
a) desidratação e oxidação.
b) eliminação e adição.
c) oxidação e hidratação.
d) oxidação e oxidação.
e) desidratação e hidratação.
Ácidos e Bases Orgânicos
24. Os analgésicos acetaminofen e aspirina têm as fórmulas estruturais As
afirmações seguintes referem-se a estes dois analgésicos:
I) Ambos possuem anel aromático.
II) O acetaminofen possui as funções álcool e amida.
III) A aspirina possui a função ácido carboxílico.
IV) Tanto a aspirina como o acetaminofen têm comportamento ácido em solução
aquosa.
São verdadeiras as afirmações:
a) I e II, apenas.
b) I e III, apenas.
c) II, III e IV, apenas.
d) I, III e IV, apenas.
e) I, II, III e IV
Bom Trabalho!
Prof.: Wanderlei A. Pirolo