QUÍMICA 3
Resoluções das atividades
Aula 11
Ligação coordenada e representações de
fórmulas
Par de elétrons livres
Atividades para sala
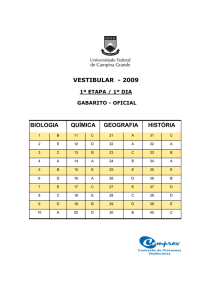
01 D
A molécula de CO2 é obtida a partir da combustão
­completa dos hidrocarbonetos, e a molécula do CO, da
combustão incompleta. As fórmulas estruturais de ambas
as moléculas são, respectivamente:
FM = C12H4O2Cl4 → fm = C6H2OCl2
Ao analisar a fórmula estrutural plana, conclui-se que sua
fórmula molecular é C12H4O2Cl4, a sua fórmula mínima é
C6H2OCl2 e o número de pares de elétrons livres é 16.
Atividades propostas
A molécula do CO2 é formada por quatro ligações covalentes, e a do CO, por duas ligações covalentes simples e
uma coordenada (dativa).
02 D
a) (F) As moléculas de NO são covalentes, pois nitrogênio e oxigênio compartilham elétrons.
b) (F) As ligações presentes no NO são covalentes polares, e a molécula de NO é polar.
c) (F) O nitrogênio não apresenta octeto completo nesse
composto.
d) (V) O nitrogênio no composto NO apresenta 7 elétrons.
e) (F) A molécula de NO apresenta forte caráter covalente.
01 A
03 D
a) (F)Os átomos presentes no açúcar do refrigerante
estão unidos por ligações covalentes, pois compartilham elétrons.
b)(F)O solvente utilizado nos refrigerantes é a água,
cujas moléculas são polares.
c) (F) As moléculas do gás do refrigerante apresentam
duas ligações duplas.
d)(V)
e) (F) O ácido fosfórico é molecular.
As fórmulas estruturais dos ácidos são:
HPO3
02 D
A representação estrutural mostrada na figura é o NH+4 ,
cuja fórmula estrutural é:
⇒
03 A
Tem-se a seguinte estrutura:
H3PO4
H4P2O7
04 A
O composto é o dióxido de enxofre, e a geometria de sua
molécula é angular.
O ácido metafosfórico (HPO3) apresenta cinco ligações
covalentes, sendo uma coordenada (dativa).
04 C
05 C
a) (F) O número de oxidação do fósforo é +5.
+3 +5 –8
A fórmula estrutural plana da dioxina é dada a seguir.
H3PO4
+1
Pré-Universitário – Livro 3
–2
1
QUÍMICA 3
b) (F) As ligações que ocorrem entre os átomos são covalentes polares, pois são formadas por elementos
com diferentes eletronegatividades.
c) (V) Alguns elementos, tais como o fósforo, o enxofre e
o cloro, podem aumentar a sua camada de valência
quando ligados a elementos muito eletronegativos como o flúor, o cloro e o oxigênio. Neste caso,
ocorre a hibridização do fósforo em sp3d, havendo,
dessa forma, a possibilidade de acomodar dez elétrons na camada de valência, sendo cinco próprios
do fósforo e cinco do oxigênio.
d) (F) A geometria ao redor do fósforo é tetraédrica.
e) (F) Além do tipo dipolo permanente, o ácido fosfórico
também apresenta ligações de hidrogênio em sua
estrutura.
10 B
OH
O P
Ocorre que o átomo de oxigênio à esquerda da estrutura
não está estável, já que apresenta apenas seis elétrons. O
átomo de fósforo, por ainda possuir um par de elétrons
disponível, forma uma ligação covalente dativa ou coordenada com esse átomo de oxigênio. Dessa maneira, o
composto assume a seguinte forma:
As estruturas corretas das alternativas falsas são:
H2O
HCHO
OH
CO2
NH3
O P
H
H
H
H
07 C
a) (F) O cloreto de amônio (NH4C) e o sulfato de magnésio
(MgSO4) também apresentam ligações iônicas.
b) (F) O brometo de sódio (NaBr) é um composto iônico,
pois é formado por metal + ametal.
c) (V) Na molécula sulfato de bário (BaSO4), existem quatro
ligações covalentes entre oxigênio (O) e enxofre (S)
e uma ligação iônica entre o cátion bário (Ba2+) e o
ânion (SO2–
).
4
d) (F) No nitrato de prata (AgNO3), existem ligações iônicas e covalentes entre o oxigênio e o nitrogênio.
e) (F) A fórmula do cloreto de amônio é NH4C.
Agora que todos os átomos se estabilizaram, verifica-se, por
fim, uma ligação iônica (entre O– e Na), cinco ligações covalentes normais (entre P e O e entre O e H) e uma ligação
dativa ou coordenada (entre P e O que estava mais afastado).
08 E
O átomo que possui essa distribuição eletrônica é o
bromo. Em ligações com outros não metais, ele é capaz
de realizar, no máximo, uma ligação covalente normal e
três ligações covalentes coordenadas. É importante ressaltar que a sua configuração eletrônica está representada
seguindo a ordem geométrica dos subníveis.
09 B
A substância X apresenta características específicas dos
compostos iônicos, tais como não conduzirem corrente
elétrica no estado sólido, serem bons condutores em meio
aquoso e possuírem alto ponto de fusão. A substância Y,
por outro lado, apresenta características específicas dos
compostos moleculares, tais como serem insolúveis em
solvente polar (água), serem solúveis em solvente apolar
(CC4), possuírem baixo ponto de fusão e serem maus condutores de corrente elétrica
2
O– Na+
OH
O
H
O– Na+
OH
06 E
Ao se fazer a distribuição eletrônica do Na, do H, do O e
do P, encontra-se respectivamente, na última camada de
valência, 1, 1, 6 e 5 elétrons. Dessa forma, a estrutura de
Lewis para esse composto pode ser a seguinte:
Pré-Universitário – Livro 3