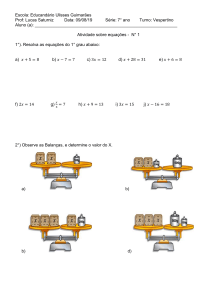
Gabarito P2
TT011 - Termodinâmica - Engenharia Ambiental - UFPR
Data: 26/04/2016
Professor: Emílio G. F. Mercuri
Antes de iniciar a resolução leia atentamente a prova e verifique se a mesma está completa.
A avaliação é individual e sem consultas. Marque a resposta final a caneta. Boa sorte!
(1) (25.0 pontos) Gás hélio se expande do estado inicial dado por 125 kPa, 350 K e 0,25 m3 para 100 kPa em um
processo politrópico com n = 1,667. Qual é o calor transmitido no processo?
Solução da Questão 1
Considerando o sistema termodinâmico definido pelo gás hélio, por exemplo, um cilindro pistão contendo o gás (sistema).
Como não há fluxo de massa no sistema, m = constante.
A equação da energia (1a lei da termodinâmica) para sistemas é:
∆E = 1 Q2 − 1 W2
v2
v22
+ gZ2 ) − m(u1 + 1 + gZ1 ) = 1 Q2 − 1 W2
2
2
Consideraremos que durante o processo de expansão as variações de energia potencial (1) e cinética (2) são desprezíveis.
Essa suposição se baseia nos fatos: 1. a alteração da altura do centro de massa é relativamente pequena (desprezível) e
2. o sistema encontra-se em repouso. A equação da energia pode ser reescrita como:
∆E = E2 − E1 = m(u2 +
m(u2 − u1 ) = 1 Q2 − 1 W2
(1)
Como temos um processo politrópico, P V
n
= constante. Nesse caso o expoente politrópico é n = 1,667.
P1 V11,667 = P2 V21,667 = C
(2)
(constante)
Do enunciado sabemos que T1 = 350 K, P1 = 125 kPa, v1 = 0,25 m3 e P2 = 100 kPa,
O gás hélio é um gás nobre, da Tabela A.2: Tc = 145,19 K e Pc = 227 kPa
Como T1 > 2Tc e P1 , P2 < Pc → o gás nobre pode ser tratado como um gás ideal, portanto podemos utilizar a relação:
P V = mRT
Do estado 1 e da Tabela A.2 temos:
m=
125(0,25)
P1 V1
=
= 0,043 kg
R T1
2.0771(350)
Isolando V2 da Equação 2, obtemos:
P1 1/1,667
125
= 0,25 ×
P2
100
Se dividirmos a Equação P1 V1 = mRT1 por P2 V2 = mRT2 obtemos:
P1 V 1
mRT1
T1
=
=
P2 V 2
mRT2
T2
0,6
V2 = V1
= 0,2852 m3
P2 V 2
100 × 0,2852
= 350
= 319,4 K
P1 V 1
125 × 0,25
O trabalho pode ser calculado para um processo politrópico com n 6= 1:
T2 = T1
Z
W =
Z
P dV =
C
dV = C
Vn
Z2
V −n dV =
P2 V 2 − P1 V 1
= 4,09 kJ
1−n
1
Da tabela A.5, encontra-se Cv , e utilizando a aproximação u2 − u1 ≈ Cv (T2 − T1 ), podemos reescrever a Equação 1:
mCv (T2 − T1 ) = 1 Q2 − 1 W2
1 Q2
= mCv (T2 − T1 ) + 1 W2 = 0,043 × 3,116 × (319,4 − 350) + 4,09 = −0,0100328 kJ = −10,0328 J
(2) (25.0 pontos) Uma usina de energia elétrica a carvão produz 1.000 MW de eletricidade queimando combustível com
um conteúdo de energia de 2.800 MW. Desse total, 340 MW são perdidos como calor na chaminé, deixando 2.460 MW
para turbinas de energia que movem um gerador para produzir eletricidade. Entretanto, a eficiência térmica das turbinas
é de somente 42%. Isso significa que 42% dessa energia é utilizada para mover o gerador, mas o resto (58% de 2.460 =
1.430 MW) é calor excedente que deve ser removido por água de resfriamento. Suponha que a água de resfriamento de
um rio adjacente, captada a uma vazão V̇ = 100 m3 /s, seja usada para remover o calor excedente. Em quanto aumentará
a temperatura do rio como resultado da adição desse calor?
Q̇
V̇ , Ta
V̇ , Te
Considere que o sistema de resfriamento opera em regime permanente e que os fluxos de calor afluente e efluente são,
respectivamente: qacalor = ṁ c Ta e qecalor = ṁ c Te . Dados: massa específica da água ρH2 O = 1.000 kg/m3 , capacidade
calorífica da água cH2 O = 4.184 J/(kg◦ C)
Solução da Questão 2:
Uma quantidade de calor é adicionada a um escoamento de água, a temperatura resultante deve ser determinada. Um
balanço de energia pode ser ser escrito para a confluência do sistema de resfriamento.
dE
= Ėa − Ėe
dt
Sendo que:
dE
=0
dt
(regime permanente)
Ėa = (Taxa de calor da usina elétrica) + (Taxa de calor do escoamento afluente)
Ėe = (Taxa de calor do escoamento efluente)
Portanto, tem-se:
0 = 1.430 × 106 + ṁ c Ta − ṁ c Te
ṁ c (Te − Ta ) = 1.430 × 106
Mas ṁ = V̇ ρ = 100(1000) = 105 kg/s
ṁ c ∆T = 1.430
∆T =
1.430 × 106
1.430 × 106
= 5
= 3,42◦ C ṁ c
10 × 4.184
(3) (25.0 pontos) Ar é admitido em um compressor que opera em regime permanente com uma pressão de 1 bar,
temperatura igual a 290 K e a uma velocidade de 6 m/s por uma entrada cuja área é de 0,1 m2 . Na saída a pressão é
de 7 bar, a temperatura é 450 K e a velocidade é 2 m/s. A transferência de calor do compressor para a sua vizinhança
ocorre a uma taxa de 180 kJ/min. Empregando o modelo de gás ideal, calcule a potência de entrada do compressor em
kW. (1 bar = 105 Pa)
Ẇvc = ?
p1 = 1 bar
T1 = 290 K 1
v1 = 6 m/s
A1 = 0,1 m2
Compressor
de ar
2
p2 = 7 bar
T2 = 450 K
v2 = 2 m/s
Q̇vc = −180 kJ/min
Solução da Questão 3
Para calcular a potência de entrada do compressor, considere a 1a lei da termodinâmica para um volume de controle:
X
X
dEvc
1
1
= Q̇vc − Ẇvc +
ṁe (he + ve2 + gZe ) −
ṁs (hs + vs2 + gZs )
dt
2
2
Considerando regime permanente com uma entrada e uma saída:
1
1
0 = Q̇vc − Ẇvc + ṁ(he + ve2 + gZe ) − ṁ(hs + vs2 + gZs )
2
2
Desprezando as variações de energia potencial e considerando a entrada (e = 1) e saída (s = 2):
1 2
Ẇvc = Q̇vc + ṁ (h1 − h2 ) +
v1 − v22
2
O fluxo de massa ṁ pode ser avaliado pelos dados fornecidos na entrada, considerando a definição de volume específico,
V
, temos que: m = Vν e ṁ = V̇ν = vA
ν=m
ν
v 1 A1
ν1
Da equação de gás ideal P1 ν1 = R T1 e a constante dos gases para o Ar é (Tabela A.5) RAr = 287 J/kg K, portanto:
ṁ =
v1 A1 P1
6(0,1)105
=
= 0,72 kg/s
R T1
287(290)
As entalpias específicas podem ser encontradas na Tabela A.7.
Para T1 = 290K → h1 = 290,43 kJ/kg.
Para T2 = 450K → h2 = 452,135 kJ/kg.
Portanto:
ṁ =
1
1 2
180
+ 0,72 (290,43 − 452,135) +
6 − 22
60
2
1000
Ẇvc = −
Ẇvc = −
180
+ 0,72 (−161,705 + 0,016) = −3 − 116,416 = −119,4 kW 60
(4) (25.0 pontos) Um tanque de 2 m3 contém amônia saturada a 40◦ C. Inicialmente, o tanque contém 50% do volume
na fase líquida e 50% na fase vapor. Vapor é retirado pelo topo do tanque até que a temperatura atinja 10◦ C. Admitindo
que somente vapor (ou seja, nenhum líquido) saia e que o processo seja adiabático, calcule a massa de amônia retirada de
tanque.
ṁ
× válvula
(saída de vapor saturado)
vapor
líquido
Solução da Questão 4
Seja o volume de controle definido pela região interna do tanque, nota-se que temos um problema com massa variável
e que a hipótese de regime permanente não é válida. Portanto, nesse caso podemos escrever a 1a lei da termodinâmica
como:
X
X
1
1
E2 − E1 = Qvc − Wvc +
me (he + ve2 + gZe ) −
ms (hs + vs2 + gZs )
2
2
Considerando a 1a lei da termodinâmica observamos que Qvc = Wvc = 0, me = 0, e que há apenas um fluxo de massa
de saída:
1
E2 − E1 = Qvc − Wvc − ms (hs + vs2 + gZs )
2
1 2
E = m(u + v + gZ)
2
Como o processo é adiabático Qvc = 0, além disso não há trabalho de fronteira Wvc = 0. Considerando que a variação
de energia potencial (altura do centro de massa) é desprezível e considerando que a velocidade do escoamento de saída é
muito baixa (desprezível), tem-se que:
m2 u2 − m1 u1 = −ms hs
A equação da continuidade é:
(m2 − m1 )vc = −ms
Combinando as duas equações acima, obtém-se:
(3)
m2 (hs − u2 ) = m1 hs − m1 u1
A entalpia de vapor saturado do fluxo de saída, hs , varia com a temperatura. Das tabelas: a 40◦ C, hv = 1470,2 kJ/kg
e a 10◦ C, hv = 1452,0 kJ/kg. Como a variação de hv nesse processo é pequena, podemos admitir que hs seja a média
desses valores, portanto: (hs )médio = 1461,1 kJ/kg.
Das tabelas da amônia:
νl1 = 0,001725 m3 /kg
νl2 = 0,00160 m3 /kg
ul1 = 368,7 kJ/kg
ul2 = 226,0 kJ/kg
νv1 = 0,08313 m3 /kg
νlv2 = 0,20381 m3 /kg
uv1 = 1341,0 kJ/kg
ulv2 = 1099,7 kJ/kg
Calculando primeiro a massa inicial no tanque, m1 , encontramos que a massa inicial de líquido presente, ml1 :
1,0
Vl
=
= 579,7 kg
ml1 =
νl1
0,001725
Analogamente, a massa inicial de vapor, mv1 , é:
mv1 =
Vv
1,0
=
= 12,0 kg
νv1
0,08313
m1 = mv1 + ml1 = 12,0 + 579,7 = 591,7 kg
m1 hs = 591,7(1461,1) = 864.532,87 kJ
m1 u1 = (mu)l1 + (mu)v1 = 579,7(368,7) + 12,0(1341,0) = 229.827,39 kJ
Substituindo esses valores na equação 3:
m2 (hs − u2 ) = m1 hs − m1 u1 = 864.532,87 − 229.827,39 = 634.705,48 kJ
m2 (1461,1 − u2 ) = 634.705,48 kJ
(4)
Existem duas incógnitas nessa equação: m2 e u2 . Ambas variáveis são funções do título final x2 :
m2 =
2,0
V
=
ν2
0,00160 + x2 (0,20381)
u2 = 226,0 + x2 (1099,7)
Substituindo na Equação 4:
2,0
[1461,1 − (226,0 + x2 1099,7)] = 634.705,48
0,00160 + x2 (0,20381)
Isolando x2 , obtemos:
x2 = 0,011057
Consequentemente:
ν2 = 0,00160 + 0,011057(0,20381) = 0,0038535 m3 /kg
m2 =
V
2,0
=
= 519 kg
ν2
0,0038535
e a massa de amônia retirada, ms , é
ms = m1 − m2 = 591,7 − 519 = 72,69 kg Relações Matemáticas
X
dmvc X
=
ṁe −
ṁs
dt
(m2 − m1 )vc =
X
me −
X
ms
X
X
dEvc
1
1
= Q̇vc − Ẇvc +
ṁe (he + ve2 + gZe ) −
ṁs (hs + vs2 + gZs )
dt
2
2
E2 − E1 = Qvc − Wvc +
P V = mRT = nR̄T
X
n=
X
1
1
ms (hs + vs2 + gZs )
me (he + ve2 + gZe ) −
2
2
m
M
u2 − u1 ≈ Cv (T2 − T1 )
PV n = C