Calendário da Criança até 6 anos de idade 2011
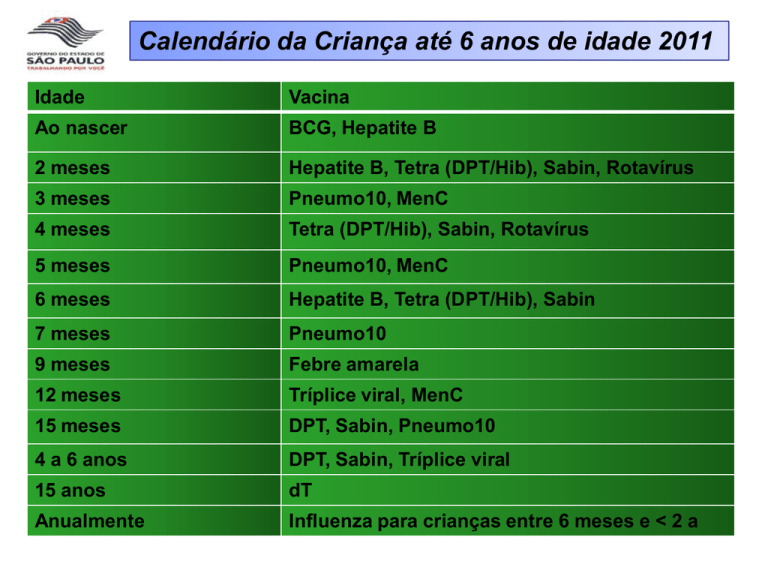
Idade
Vacina
Ao nascer
BCG, Hepatite B
2 meses
Hepatite B, Tetra (DPT/Hib), Sabin, Rotavírus
3 meses
Pneumo10, MenC
4 meses
Tetra (DPT/Hib), Sabin, Rotavírus
5 meses
Pneumo10, MenC
6 meses
Hepatite B, Tetra (DPT/Hib), Sabin
7 meses
Pneumo10
9 meses
Febre amarela
12 meses
Tríplice viral, MenC
15 meses
DPT, Sabin, Pneumo10
4 a 6 anos
DPT, Sabin, Tríplice viral
15 anos
dT
Anualmente
Influenza para crianças entre 6 meses e < 2 a
Eventos Adversos
Helena Keico Sato
Diretora Técnica
Divisão de Imunização
CVE/CCD/SES-SP
Manifestações que contra-indicam o
prosseguimento do esquema vacinal com a DPT
•Convulsões até 72 horas após a aplicação da vacina.
•Síndrome hipotônico-hiporresponsivo (SHH), até 48
horas após a aplicação da vacina.
•Encefalopatia nos primeiros 7 dias após a aplicação
da vacina.
•Reação anafilática.
Manifestações que contra-indicam o
prosseguimento do esquema vacinal com a DPT
• convulsão e SHH oferecer DTPa
• encefalopatia oferecer DT
• reação anafilática: não aplicar nenhuma vacina
associada ao evento
Quadro comparativo das incidências dos eventos
adversos pós-vacina DPT
Cody et al
1981
Martins
e cols
2007
São Paulo *
DPT
Swiss
Serum
Convulsão
1/1.750
1/5.231
1/62.000
1/5.078
SHH
1/1.750
1/1.495
1/9.471
1/2.539
* em 2008
Fonte: SVE/CVE - Divisão de Imunização, SI-EAPV / MS
Eventos Adversos associado a
vacina poliomielite
Doença
• Poliomielite é uma doença viral aguda;
• RNA vírus, gênero Enterovírus, família
picornaviridae;
• Três tipos: 1, 2,e 3.
Figura: Polioeradication
Considerações sobre a polio
Quadros Clínicos da Poliomielite
0
Assintomáticas
Doenças que não-SNC
Meningite asséptica
Paralisia flácida aguda
20
Slide:Toscano, Cristiana
40
%
60
80
100
OPS
Definição de caso
• Associado a vacina: paralisia flácida e aguda com
início entre 4 e 40 dias após a vacinação e com
sequela compatível com poliomielite até 60 dias após.
Definição de caso em comunicante
• paralisia flácida e aguda que surge após contato com
a criança vacinada com Sabin até 40 dias, com início
entre 4 e 85 dias após a vacinação e com sequela
compatível com poliomielite até 60 dias após.
Incidências no Brasil
• na primeira dose: 1/1,2 a 2,4 milhões de doses aplicadas
• demais doses: 1/3,6 a 1/13 milhões de doses aplicadas
5. POLIOVÍRUS DERIVADO VACINAL
Poliovírus Derivado do Vírus Vacinal
Vírus que sofreram mutação genética
Reversão da neurovirulência e transmissibilidade,
Divergência entre 1-15% em VP1 em com a cepa Sabin.
VPg
PROTEÍNAS DO CAPSÍDEO
VPO
VP3
VP1
PROTEÍNAS NÃO ESTRUTURAIS
2A 2B
2C
3A 3B 3C
A (n)
3D
3’
5’
VP4
VP2
743 949 1765
VP3
2479
VP1
2A
3385
CDC.MMWR. 2002; 51(17):369-371.
2B
2C
3A
5110
3C
3D
A (n)
7369
7441
Figura: Silva, Edson Elias – FIOCRUZ.
6.SITUAÇÃO E RISCOS BRASIL
2004 - 140.000
PASSAGEIROS vieram
diretamente da ÁFRICA e
ÁSIA.
Brasil- Não realiza
nenhuma ação de
controle e imunização
nos aeroportos.
Fonte: Ministério da Defesa/ Infraero. Anuário 2004.Acessado em 08 de agosto de 2006.
• “ A maioria das pessoas não se lembra ou
nem teve contato com o sofrimento e a
devastação causada pela poliomielite, a
não ser por velhas fotografias em preto e
branco de crianças com aparelhos
ortopédicos para as pernas ou pessoas
dentro de pulmão de aço”
O Vírus
Capsídeo Médio
(VP6, Subgrupo)
Capsídeo Interno (VP2)
Genoma segmentado fdRNA
VP7 (Sorotipo G)
VP4 (Sorotipo P)
}
VP1/VP3b
Representação esquemática do Rotavírus
Figura adaptada de Cunliffe et al, Lancet 2002, 359 640–642
Capsídeo
Externo
ESQUEMA DE ADMINISTRAÇÃO
• Aos 2 e 4 meses de idade
– No calendário juntamente com Tetravalente e OPV
• PRIMEIRA DOSE
– Idade mínima – 1m e 15d (6 semanas)
– Idade máxima – 3m e 7d (14 semanas)
• SEGUNDA DOSE
– Idade mínima – 3m e 7d (14 semanas)
– Idade máxima – 5m e 15d (24 semanas)
• INTERVALO MÍNIMO ENTRE AS DOSES
– 4 SEMANAS
Invaginação intestinal
IS events after Rotarix vs Placebo*
Outcome
<31 days dose 1
Vaccine
N=31,673
1
Placebo
N=31,552
2
0.50 (0.07-3.80)
<31 days dose 2
5
5
0.99 (0.31-3.21)
<31 days any dose
6
7
0.85 (0.30-2.42)
0-14 days dose 1
0
0
--
17
*Ruiz-Palacios et al. NEJM 2006;354(1)
Relative Risk
(95% CI)
Brazil: Dose 1 Analysis*
Risk
window
Cases
N=330
1-7
8-14
15-21
4 (1.2%)
6 (1.9%)
3 (0.9%)
Incidence ratio
Odds ratio
(95% confidence (95% confidence
interval)
interval)
1.1 (0.3 to 3.3)
1.3 (0.5 to 3.4)
0.2 (0.0 to 1.4)
1.4 (0.4 to 4.8)
1.6 (0.5 to 4.7)
0.6 (0.1 to 2.2)
*Case-series adjusted for age in 14 day interval; denominators used for risk-window percents include unvaccinated and
cases >21 days;
Case-series model only includes post-exposure intussusception events; total child-months of follow-up = 62.5 within 1-7
days and 2004 child-months for the cases outside the 1-21 day risk window
18
Brazil: Dose 2 Analysis
Risk
window
Cases
N=330
Incidence ratio
(95% confidence
interval)
1-7
8-14
15-21
21 (7%)
15 (5%)
15 (5%)
2.6 (1.3 to 5.2)
1.4 (0.7 to 3.0)
0.9 (0.4 to 2.0)
Odds ratio
(95% confidence
interval)
1.8 (1.0 to 3.3)
0.9 (0.5 to 1.8)
0.8 (0.4 to 1.6)
*Case-series adjusted for age in 14 day interval; denominators used for risk-window percents include unvaccinated and
cases >21 days;
Case-series Model only includes post-exposure intussusception events
19 19
Mexico: Dose 1 Analysis*
Risk
window
Cases
N=286
Incidence ratio
(95% confidence
interval)
1-7
8-14
15-21
24 (9%)
6 (2%)
5 (2%)
5.3 (3.0 to 9.3)
1.1 (0.5 to 2.9)
0.9 (0.4 to 2.3)
Odds ratio
(95% confidence
interval)
5.8 (2.6 to 13.0)
1.0 (0.4 to 2.9)
0.6 (0.3 to 2.1)
*Control enrollment incomplete; case-series adjusted for age in 14 day interval; denominators used for risk-window
percents include unvaccinated and cases >21 days;
Case-series model only includes post-exposure intussusception events; total child-months of follow-up = 62.5 within 1-7
days and 1728 child-months for the cases outside the 1-21 day risk window
20
Mexico: Dose 2 Analysis*
Risk
window
Cases
N=281
Incidence ratio
(95% confidence
interval)
1-7
8-14
15-21
12 (5%)
19 (8%)
16 (7%)
1.8 (0.9 to 3.8)
2.2 (1.1 to 4.2)
2.2 (1.2 to 4.0)
Odds ratio
(95% confidence
interval)
1.1 (0.6 to 2.2)
2.3 (1.2 to 4.4)
2.0 (1.0 to 3.8)
*Adjusted for age in 14 day interval; denominators used for risk-window percents include unvaccinated and cases >21 days;
Model only includes post-exposure intussusception events
21 21
Distribuição dos casos notificados de invaginação intestinal segundo
idade (meses) e período de análise (285 casos). Estado de São Paulo
(hospitais selecionados), 2001 a 2008.
60
55
50
45
40
35
30
25
20
15
10
5
0
0
1
2
3
4
5
6
7
8
9
Idade (meses)
PROSPECTIVO
RETROSPECTIVO
TOTAL
10
11
12
After Rotavirus vaccine introduction,
Brazil had 1500 fewer under 5
diarrhea deaths during 2007-2009
Without vaccine
With vaccine
2007
2008
2009
After Rotavirus vaccine introduction,
Brazil had 130,000 fewer under 5
diarrhea admissions during 2007-2009
Without vaccine
2007
2008
With vaccine
2009
Considerações finais
• É uma vacina com elevada eficácia
• Os estudos realizados não demonstraram
risco
aumentado
de
invaginação,
comparado-se grupo vacinado e placebo
• É necessário respeitar as idades mínimas
e máximas de aplicação de cada dose
Vacina contra febre amarela
§ Doença Viscerotrópica Aguda
§ Semelhante a febre amarela
§ Início dos sintomas até 10 dias após a vacinação
§ Febre, mialgia, náuseas e vômitos, astenia, icterícia,
rabdomiólise, hemorragia, comprometimento hepático,
renal, respiratório, cardíaco
§ 46 casos descritos no mundo, e 27 óbitos (letalidade de
58,7%).
§ No Brasil 21 casos e 19 óbitos (letalidade de 90,5%)
Vacina contra febre amarela
• Doença Neurotrópica Aguda
• Início dos sintomas entre 1 a 30 dias após a
vacinação
• Febre, cefaléia, disfunção neurológica focal
(ataxia, afasia e paresia), alteração do estado
mental, convulsão
• Envolvimento do sistema nervoso central ou
periférico
MacMahon AW et al. Vaccine 2007;25:1727-34
Eventos adversos graves
Estado de São Paulo, 2000-2010
• 2000: 1 caso de DVA
• 2008: 3 casos (1 provável) de DVA e 1 caso de DNA
• 2009:
– 5 casos ( 2 prováveis e 3 confirmados) de DVA
– 2 casos de DNA
– 1 reação de hipersensibilidade imediata
Doença Viscerotrópica Aguda
• Risco
– Cenário 1: Doses aplicadas entre 1991 e 2001
• 93.567.028 doses aplicadas
– Cenário 2: Doses aplicadas entre 1998 e 1001
• 70% do total aplicado no cenário 1 (cerca de 65
milhões)
– Risco: 0,043 (IC 95%:0,012-0,109) a 2,13 (IC 95%: 0,37612,071) por 1.000.000 de doses aplicadas
Struchiner CJS et al. Epidemiol Infect 2004: 1-8
Vacina contra febre amarela: precauções
• mães amamentando lactentes até 6 meses de vida, como
precaução, nesse momento não serão vacinadas
- RNs filhos de mães vacinadas após o nascimento dos seus
filhos, apresentaram encefalite
- início dos sintomas (convulsão): 8 e 25 dias após a vacinação
materna
- evoluiram para cura sem sequelas
Vacina contra febre amarela: precauções
•
Pessoas com lúpus eritematoso
• Pessoas com Doença de Addison
• Pessoas que tiveram timoma
Indicações da vacina contra febre amarela
• A vacina contra febre amarela está indicada apenas para
quem precisa ser vacinada, ou seja, para as pessoas que
moram ou viajam para as áreas de risco












