![Formaç o do acetil-CoA e Ciclo de Krebs/relatorio_2[2].](//s1.studylibpt.com/store/data/000359751_1-d8b668589c3f8259477a871b2c64ee50-768x994.png)
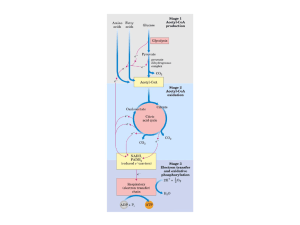
Origens e síntese do Acetil-CoA
O
Acetil-CoA,
componente
fundamental e transversal no metabolismo dos seres
vivos, forma-se a partir do catabolismo das três
biomoléculas principais a nível energético.
A partir dos açúcares (graças ao
intermediário
piruvato),
por
descarboxilação
oxidativa; a partir dos lípidos que se decompõem em
ácidos gordos livres, por Beta-oxidação (não será
aprofundado este mecanismo visto ter sido abordado
anteriormente); a partir das proteínas, por
desaminação oxidativa dos aminoácidos cetogénicos
(entre outros).
Figura 1: Origens e síntese do Acetil-CoA
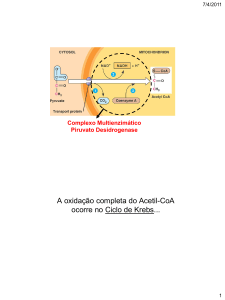
O mecanismo da descarboxilação oxidativa é
realizado sequencialmente, na matriz mitocondrial, por
acção
do
complexo
multienzimático
Piruvato
Desidrogenáse (PDH). Este é composto: pelas enzimas
Figura 2: Formação de Acetil-CoA através do
E1 –Desidrogenase Pirúvica (grupo prostético TPP), E2 –
piruvato
Dihidrolipolitranscetilase
(g.p.
Lipoamida)
e
E3Dihidropolidesidrogenase (g.p. FAD); e pelas coenzimas Tiamina pirofosfato (TPP), Lipoamida, CoA, FAD, NAD+.
Como se pode constatar pelo valor da energia livre de Gibbs, esta reacção é fortemente exergónica,
levando a que não seja reversível.
Catabolismo dos aminoácidos
cetogénicos
Os aminoácidos cetogénicos, por
desaminação oxidativa, podem originar Acetil-CoA e
Acetoacetil-CoA (origina Acetil-CoA por cisão tiolítica como
se constata na Fig.3). Observamos na Fig.4 os aminoácidos
que geram Acetil-CoA e Acetoacetil-CoA.
Figura 3: Conversão Acetoacetil-CoAAcetil-CoA
Aminoácidos que formam só Acetoacetil-CoA
A partir da Tirosina, por transaminação, obtém-se para-hidroxifenilpiruvato que é
degradado em Fumaril-acetoacetato, que de seguida é hidrolisado em Acetoacetato que se degrada em
Acetoacetil-CoA.
Através da Fenilalanina, é possível obter Tirosina, que se degrada em AcetoacetilCoA.
Aminoácidos que formam Acetoacetil-CoA e Acetil-CoA
A partir da Leucina, por perda dos grupos α-amina em reacções de
transaminação, formam-se α-cetoácidos ramificados que, por cisão tiolítica, formam
Acil-CoA. Este dá origem a Acetil-CoA e Acetoacetato que se decompõe em
Acetoacetil-CoA.
O Triptofano, gera 3-hidroxiantranilato que se degrada em Acetil-CoA.
Por outro lado, o Triptofano degrada-se em Glutanil-CoA que se degrada em
Acetoacetil-CoA.
Figura 4:
Aminoácidos
cetogénicos
Aminoácidos que formam só Acetil-CoA
A partir da Isoleucina, por perda dos grupos α-amina em reacções de
transaminação, formam-se α-cetoácidos ramificados que, por cisão tiolítica, formam
acetil-CoA.
A partir da Treonina, por acção da treonina desidrogenase, forma-se o 2-amino-3-cetobutirato, que por
acção de uma ligase gera Acetil-CoA
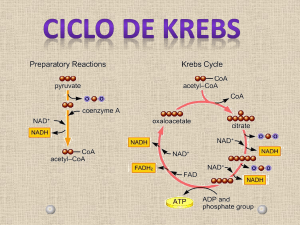
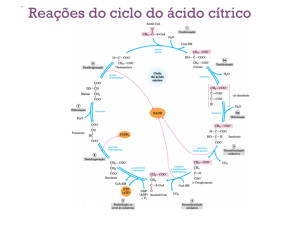
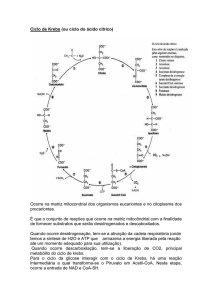
Ciclo de Krebs – Etapas e intervenientes
O ciclo de Krebs vai aproveitar o catabolismo das principais biomoléculas para a obtenção de energia. É
um ciclo anfibólico que se realiza na matriz mitocondrial pois é ai que se encontram as principais fontes do seu
substrato – Acetil-CoA. O seu objectivo primário é a oxidação completa de Acetil-CoA em CO2 resultando na
formação de equivalentes redutores através de 8 reacções sequenciais.
Análise sequencial do ciclo de Krebs:
1ª reacção: o Acetil-CoA entra no ciclo e
reage com oxaloacetato através dos carbono
metilo e do grupo carbonilo respectivamente,
por acção da citrato sintase. Esta enzima é
constituída por 2 domínios diferentes, sendo
um grande e rígido e o outro mais pequeno e
flexível. O oxaloacetato, induz uma alteração
na conformação da parte mais pequena
permitindo ligar a Acetil.CoA, formando-se um
composto intermédio bastante energético
(citroil-CoA) que rapidamente se transforma
em citrato pela libertação da coenzimaA,
devido a uma nova alteração conformacional
da enzima.
2ª reacção: o citrato, por acção da enzima
aconitase transforma-se em isocitrato. A
reacção envolve a formação de um
intermediário, o cis-aconitato, que se obtém
por desidratação do citrato. Posteriormente,
forma-se isocitrato, por hidratação do cisaconitato através da reacção com a mesma
aconitase. Assim o citrato e o isocitrato são
isómeros de posição. A reacção de formação
do cis-aconitato é endergónica, logo a
formação de citrato por este, é exergónica
(tem tendência para se dar). No entanto, o
Figura 5: Ciclo de Krebs- etapas e intervenientes
isocitrato está em baixa concentração na
célula pois é consumido rapidamente no próximo passo do ciclo. A aconitase consegue assim captar H20, sendo
no entanto necessário a presença Fe2+ ( co-factor).
3ª reacção: a formação de α-cetoglutarato por descarboxilação oxidativa, implica um conjunto de 3 reacções que
se iniciam por desidrogenação do isocitrato por acção da isocitrato desidrogenase na presença de NAD+ (que se
reduz a NADH), formando assim oxalosuccinato. Depois o Mn2+ liga-se ao grupo carbonilo deste composto,
estabilizando o enol e provocando a libertação de CO2. Na última reacção, dá-se uma hidrogenação, com
rearranjo do híbrido de ressonância.
4ª reacção: na formação de succinill-CoA por descarboxilação oxidativa do α-cetoglutarato liberta-se novamente
NADH. Esta reacção é catalizada pelo complexo multienzimático α-cetoglutarato desidrogenase (α-cetoglutarato,
dihidrolipoil transsuccinilase e dihidrolipoil desidrogenase), na presença de coenzimas e grupos proestéticos
(tiamina pirofosfato, ácido lipóico, CoA, FAD e NAD+), activada pelo Ca2+. Esta reacção é altamente exergónica
devido à energia armazenada na ligação S-CoA. A α-cetoglutarato desidrogenase é idêntica em estrutura e
função ao PDH.
5ª reacção: A succinil-CoA sintetase (constituída por 2 subunidades: alfa e beta) converte o succinil-CoA em
succinato, quebrando a ligação tiol-éster (S-CoA). A parte alfa liga-se ao CoA e a parte beta tem especificidade
para se ligar ao GDP (ADP). Da quebra da ligação tiol-éster resulta uma grande libertação de energia que é
utilizada para converter GDP em GTP (na presença do nucleósido difosfato cinase).
6ª reacção: o succinato é oxidado a fumarato pela acção da succinato desidrogenase. Esta enzima faz parte do
complexo II da cadeia respiratória, estando intimamente ligada à membrana mitocondrial interna (esta é a única
enzima do ciclo que não se localiza na matriz mitocondrial). O FAD liga-se covalentemente a esta enzima
reduzindo-se nesta reacção a FADH2 pois capta os electrões libertados pelo succinato. Após esta reacção de
redução, os electrões são encaminhados para a quinona sendo utilizados para a formação de ATP através de
fosforilação oxidativa.
7ª reacção: o fumarato é hidratado a malato (mais concretamente L-malato) pela enzima fumarase. È uma
reacção reversível em condições fisiológicas.
8ª reacção: a formação de oxaloacetato é catalizada pela enzima malato desidrogenase na presença de NAD+,
dando-se a formação de NADH. Esta reacção é endergónica no sentido directo, no entanto a baixa concentração
de oxaloacetato na célula- devido à entrada num novo ciclo; e a oxidação de NADH a NAD+ pela respiração
mitocondrial obrigam a reacção a progredir no sentido da formação de oxaloacetato.
Características energéticas do ciclo de Krebs
No fim de um ciclo de Krebs completo, que se dá segundo a seguinte equação química:
é possível obter o seguinte rendimento energético: 3 moléculas de NADH, uma molécula de FADH 2 e uma
molécula de GTP/ATP.
Em termos energéticos as moléculas de ATP e de GTP são semelhantes e, como tal, a única razão para
a produção de uma ou de outra no ciclo de Krebs relaciona-se apenas com o tecido onde o ciclo se dá, ou seja,
com a afinidade de cada tecido para cada uma das moléculas.
Embora em cada ciclo apenas seja produzida uma molécula de GTP/ATP, o rendimento global vai ser
muito superior, pois as 4 moléculas reduzidas nas diferentes etapas oxidativas do ciclo de Krebs (NADH e
FADH2) são depois transportadas para a
cadeia
respiratória
onde
através
de
fosforilação oxidativa irão gerar mais ATP.
Características anfibólicas do ciclo
de Krebs
Uma das características do
ciclo de Krebs está relacionada com o facto
de este ser um ciclo anfibólico, ou seja, tem a
capacidade de participar em reacções de
catabolismo e de anabolismo. Por um lado
participa, tal como foi visto anteriormente, no
catabolismo de aminoácidos, ácidos gordos e
oses, que servem como percursores de vários
intermediários do ciclo.
Figura 6: Características anfibólicas do ciclo de Krebs
Por outro lado, em caso de necessidade, alguns intermediários do ciclo também podem servir como
percursores na biossíntese de determinados compostos, como se pode observar na imagem 6. Alguns exemplos
importantes são os casos do oxaloacetato e do alpha-cetoglutarato que por transaminação dão origem
respectivamente ao aspartato e ao glutamato, que por sua vez são percursores de outros aminoácidos e de
bases azotadas. O succinil-CoA também tem um papel muito importante, ao ser um percursor das porfirinas,
constituintes do grupo heme.
Todavia, para que um ciclo decorra normalmente é necessário que as concentrações dos vários
intermediários se mantenham mais ou menos constantes, e como tal torna-se necessário repor um dos
intermediários de cada vez que este sai do ciclo para originar outro composto. Para que isso seja possível
ocorrem as chamadas reacções anapleróticas, que permitem uma renovação eficiente dos intermediários em
caso de necessidade. Estas reacções permitem regenerar as concentrações de malato e oxaloacetato a partir do
piruvato e do fosfoenolpiruvato.
Formas de regulação do ciclo de Krebs
A regulação do ciclo de Krebs é feita em todas as etapas devido à concentração dos substratos e dos
produtos. Contudo, é importante referir o papel que têm as etapas
mais exergónicas (síntese do citrato, descarboxilação do isocitrato e
descarboxilação do alpha-cetoglutarato) nessa mesma regulação,
visto serem consideradas as etapas limitantes do ciclo. Torna-se
necessário existir um controlo mais eficaz destas etapas, pois
devido às suas características exergónicas são as que têm mais
tendência para se dar.
As enzimas participantes nestas 3 etapas são reguladas de
forma alostérica por acção de vários compostos.
Também se deve referir o papel da regulação da conversão
do piruvato em Acetil-CoA que, embora não faça parte do ciclo,
influencia o funcionamento deste através do controlo da quantidade
de Acetil-CoA que reage com o oxaloacetato. A regulação desta
conversão é feita de forma alostérica e covalente.
É importante referir a regulação covalente do complexo
PDH visto esta ser semelhante à do complexo alpha-cetoglutarato
desidrogenase (os dois são estruturalmente semelhantes). Na
Figura 7: Formas
presença de uma grande concentração de ATP, a enzima E1 do
de regulação do
complexo sofre uma fosforilação num resíduo específico de
ciclo
serotonina, fazendo com que a proteína altere a sua conformação e
consequentemente a sua função.
Bibliografia:
- Principles of Biochemistry (3ª Ed) , H. R. Horton, L. A. Moran, R. S. Ochs, J. D. Rawn, K. G. Scrimgeour ,
2002, Prentice Hall, Upper Saddle River, NJ 07458;
- Portal de ensino - e-escola/Biologia , Universidade Técnica de Lisboa, http://www.eescola.
pt/site/index.asp;
- Entender a Bioquímica (4ª Edição) , L. Campos. 2005, Escolar Editora, ISBN: 9789725921838;
- http://www.wiley.com/legacy/college/boyer/0470003790/animations/tca/tca.htm;
-http://www.science.smith.edu/departments/Biology/Bio231/krebs.html.
![Formaç o do acetil-CoA e Ciclo de Krebs/relatorio_2[2].](http://s1.studylibpt.com/store/data/000359751_1-d8b668589c3f8259477a871b2c64ee50-768x994.png)