Centro Federal de Educação Tecnológica de Minas Gerais
Prefeitura Municipal de Vespasiano
CT Vespasiano/ unidade conveniada CEFET-MG
Rua: Maria Saliba Nassif Nº. 80 Caieiras - Vespasiano MG.
Telefone: 3621.4680 - [email protected]
Cursos de Mecatrônica – Eletrotécnica
DISCIPLINA: FÍSICA
Cursos: Mecatrônica e Eletrotécnica
POFESSOR: MENDELSON DE OLIVEIRA AARÃO
Turma: 2º ANO
O CALOR COMO ENERGIA
A TEORIA DO CALÓRICO
Até o início do século passado, os cientistas explicavam este fato, que todos os corpos continham, em seu interior,
uma substância fluida, invisível, de peso desprezível, que era denominada calórico.
Quanto maior fosse a temperatura de um corpo, maior seria a quantidade de calórico em seu interior. Conforme este
modelo, quando dois corpos, a temperatura diferentes, eram colocados em contato, haveria a passagem de calórico do corpo
mais quente para o mais frio, acarretando uma diminuição na temperatura do primeiro e um aumento do segundo corpo.
Quando os corpos atingiam a mesma temperatura, o fluxo de calórico era interrompido e eles permaneciam, a partir
daquele instante, em equilíbrio térmico.
CALOR É ENERGIA
A idéia de que o calor é energia foi introduzido por Rumford, um engenheiro militar que, em 1798, trabalhava na
perfuração de canos de canhão. Observando o aquecimento das peças ao serem perfuradas, Rumford teve a idéia de atribuir
este aquecimento ao trabalho que era realizado contra o atrito, na perfuração. Em outras palavras, a energia empregada na
realização daquele trabalho era transferida para as peças, provocando uma elevação em suas temperaturas.
Portanto, a idéia de que um corpo mais aquecido possui maior quantidade de calórico começava a ser substituída pela
idéia de que este corpo possui, realmente, maior quantidade de energia em seu interior.
Modernamente, considera-se que, quando a temperatura de um corpo é aumentada, a energia que ele possui em seu
interior, denominada energia interna, também aumenta
CALOR é a energia transferida de um corpo para o outro em virtude, unicamente, de uma diferença de temperatura
entre eles.
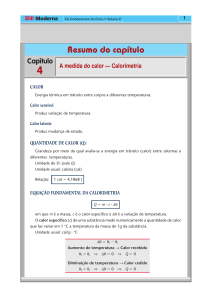
UNIDADES DE CALOR
Calor é uma forma de energia, no S.I., mediremos o calor em joules (J). Até hoje é usada uma outra unidade muito antiga,
denominada 1 caloria = 1 cal. Poe definição, 1 cal é a quantidade de calor que deve ser transferida a 1 g de água para que sua
temperatura se eleve de 1°C.
Em suas experiências já mencionadas, Joule estabeleceu a relação entre estas duas unidades, encontrando.
1 cal = 4,18 J ------- 1kcal = 103 cal
TRANSFERÊNCIA DE CALOR. (Transmissão de calor)
A transmissão de calor entre dois pontos pode ocorrer por três processos diferentes: a condução, a convecção e a
irradiação.
CONDUÇAO TÉRMICA: Consiste numa transferência de energia de vibração entre as moléculas que constituem o sistema.
As substâncias em que o processo de condução é rápido, como os metais, são denominados bons condutores. Os materiais
em que o processo de condução é muito lento são denominados maus condutores, ou isolantes.
CONVECÇÃO TÉRMICA: é a propagação que ocorre nos fluidos (líquidos, gases e vapores) em virtude de uma diferença de
densidade entre partes do sistema. Um líquido sendo aquecido por uma chama. A parte inferior, ao ser aquecido, tem sua
densidade diminuída e, então, sobe na massa líquida. O líquido da parte superior, sendo relativamente denso, desce. Essas
correntes líquidas são denominadas correntes de convecção.
IRRADIAÇÃO TÉRMICA: é a transmissão de energia entre dois sistemas, sem que haja contato físico entre eles. Essa
transmissão ocorre por meio dos denominados raios infravermelhos, que são ondas eletromagnéticas. A energia que
recebemos do Sol chega até nós por irradiação. Realmente, a inexistência de meio material contínuo entre eles os astros
(vácuo) impede a ocorrência tanto de condução com de convecção.
CAPACIDADE TÉRMICA
Se um corpo recebe uma quantidade de calor ∆Q e sua temperatura varia de ∆t, a capacidade térmica deste corpo é
dada por: C =∆Q /∆t. A unidade usual da capacidade térmica é caloria por graus Celsius (cal/°C). Por exemplo, se um corpo
recebe 20 calorias e sua temperatura varia 5°C, sua capacidade térmica vale: C = 4 cal/°C ( o corpo deve receber 4 calorias
para que sua temperatura aumente 1°C.
CALOR ESPECÍFICO
Se um corpo de massa m tem capacidade térmica C, o calor específico, c, do material que constitui o corpo é dado
por:
c = C/m. A unidade usual de calor específico é a caloria por grama e por grau Celsius (cal/g.°C). Vamos considerar que, no
exemplo anterior, de capacidade térmica 4 cal/°C, tenha massa igual a 10 gramas. O calor específico da substância que o
constitui vale: c = C/m = 4/10 = 0,4 cal/g.°C.
O calor específico pode ser entendido como sendo a medida numérica da quantidade de calor que acarreta uma
variação unitária de temperatura de temperatura na unidade de massa da substância. No exemplo, a massa de 1 grama da
substância deve receber 0,4 caloria para que sua temperatura aumente 1°C. O calor específico é uma grandeza característica do
material que constitui o corpo.
FÓRMULA GERAL DA CALORIMETRIA (cálculo do calor absorvido por um corpo)
A quantidade de calor, ∆Q, absorvida ou liberada por um corpo de massa m e calor específico c, quando sua
temperatura varia de ∆t, pode ser calculada pela relação: ∆Q = mc∆t.
Ex°: Um bloco de alumínio, cuja massa é m = 200 g, absorve calor e sua temperatura se eleva de 20°C para 140°C.
Qual a quantidade de calor absorvida pelo bloco?
TRABALHO EM UMA VARIAÇÃO DE VOLUME
O QUE É UM SISTEMA
A palavra sistema é usada, na Física, para designar um corpo (ou um conjunto de corpos) sobre o qual fixamos nossa
atenção a fim de estudá-lo. Tudo aquilo que não pertencer ao sistema, isto é, o resto do universo, denomina-se vizinhança do
sistema.
Um sistema pode trocar energia com sua vizinhança sob forma de calor ou pela realização de trabalho (diferença de
temperatura entre o sistema e a vizinhança) uma certa quantidade, Q, de calor poderá ser transferida de um para o outro. O
sistema pode se expandir, vencendo uma pressão externa e, portanto, realizando trabalho sobre a vizinhança ou, ainda, o
sistema poderá ter seu volume reduzido, com a realização do trabalho da vizinhança sobre ele.
TRABALHO REALIZADO EM UMA EXPANSÃO
Consideremos como sistema um gás ideal, encerrado em um cilindro de um êmbolo (pistom) que pode se deslocar
livremente. Suponha que o gás se encontre em um estado inicial i, ocupando um volume Vi. Em virtude da pressão do gás, ele
exerce uma força F o pistom que, estando livre, desloca-se uma distância d. Assim ,o gás se expandiu até o estado final f onde
o seu volume é Vf, e realizou trabalho T.
Se a pressão p, do gás permanecer constante ( transformação isobárica), o valor de F também será constante durante a
expansão e o trabalho, T, realizado pelo gás pode ser facilmente calculado. De fato, para este caso ( força constante e no
mesmo sentido do deslocamento), temos: T = p( Vf – Vi ). Esta expressão nos permite calcular o trabalho que um gás realiza,
ao sofrer uma variação de volume, sob pressão constante.
Ex°: Um gás se expandiu, exercendo uma pressão constante p = 2,0 atm, desde o volume Vi = 200 cm3 até o volume
Vf = 500 cm3. Qual o trabalho realizado pelo gás nesta expansão?
TRABALHO POSITIVO E TRABALHO NEGATIVO
A expressão T = p(V2 – V1) pode ser usada também, para se calcular o trabalho realizado quando o gás é
comprimido isobaricamente. Na expansão como V2 > V1, a diferença V2 – V1 é positiva e o trabalho realizado é positivo.
Neste caso dizemos que o trabalho foi realizado pelo sistema.
Quando ocorre uma compressão do gás, V2 < V1, a diferença V2 – V1 será negativo e o trabalho realizado é
negativo. Nestas condições, dizemos que o trabalho foi realizado sobre o sistema.
De modo geral: (aumenta o volume – trabalho positivo – sistema realiza trabalho), (diminui o volume – trabalho
negativo – trabalho realizado sobre o sistema) e ( volume constante – sistema não realiza trabalho e nem trabalho é realizado
sobre ele).
A PRIMEIRA LEI DA TERMODINÂMICA
ENERGIA INTERNA
Quando um sistema vai do estado inicial 1 a outro estado final 2, ele geralmente troca energia com a sua vizinhança,
como vimos(absorve e libera calor e realiza ou recebe trabalho). Conseqüentemente, sua energia interna U sofre variações,
passando de um valor inicial U1 para um valor final U2, ou seja, a energia interna varia de ∆U = U2 – U1.
1ª LEI DA TERMODINÂMICA (Conservação de energia)
Quando uma quantidade de calor Q é absorvida (Q positivo) ou cedida (Q negativo) por um sistema e um trabalho T
é realizado por este sistema (T positivo) ou sobre ele (T negativo), a variação da energia interna, ∆U, do sistema é dada por
∆U = Q - T.
Ex°: Suponha que um sistema passe de um estado a outro, trocando energia com a sua vizinhança. Calcule a variação
de energia interna do sistema nos seguintes casos:
a) O sistema absorve 100 cal de calor e realiza um trabalho de 200J.
b) O sistema absorve 100 cal de calor e um trabalho de 20 J é realizado sobre ele.
c) O sistema libera 100 cal de calor para a vizinhança e um trabalho de 200 J é realizado sobre ele.
APLICAÇÕES DA PRIMEIRA LEI DA TERMODINÂMICA
TRANSFORMAÇÃO ADIABÁTICA
Considere um gás encerrado em um cilindro, cujas paredes são feitas de um material isolante térmico. Em virtude
disso, se este se expandir (ou for comprimido), ele não poderá ceder nem receber calor da vizinhança. Uma transformação
como esta, em que o sistema não troca calor com a vizinhança, isto é, na qual Q = 0 é denominada transformação adiabática.
Aplicando a 1ª lei da Termodinâmica, ∆U = Q – T, a uma transformação adiabática, como temos Q = 0, vem ∆U = -T.
Expansão de um gás, o trabalho T que ele realizou é positivo, ∆U será negativo, a energia interna do sistema, diminui.
Compressão de um gás, o trabalho T é negativo, ∆U será positivo, a energia interna do gás aumenta, havendo um aumento na
sua temperatura.
TRANSFORMAÇÃO ISOTÉRMICA
Um gás absorvendo uma quantidade de calor Q e se expandindo, realizando um trabalho T. Se o trabalho que o gás
realiza for igual ao calor que ele absorve, Istoé, se Q = T, teremos, pela 1ª lei de Termodinâmica ∆U = Q – T, donde, ∆U = 0,
ou seja, U = constante.
O fato de a energia interna permanecer constante indica que a temperatura também não sofreu alteração e, portanto,
o gás se expandiu isotermicamente. A expansão isotérmica de um gás acontece quando ele recebe uma quantidade de calor
igual ao trabalho que realiza na expansão. Do mesmo modo, par que um gás seja comprimido sem que a sua temperatura se
eleve, ele deve liberar uma quantidade de calor igual ao trabalho realizado sobre ele.
Massas iguais de um mesmo gás sejam aquecidas, uma delas a volume constante e a outra a pressão constante. Ambas
sofreram a mesma elevação de temperatura, a quantidade de calor que devemos fornecer a pressão constante é maior do que
aquela que devemos fornecer a volume constante (Qp > Qv). A 1ª lei da termodinâmica nos permite entender este resultado.
O aumento da energia interna foi o mesmo para as duas massas, o gás não realizou trabalho (V = constante), então, se T = 0,
∆ U = Qv, isto é, todo o calor absorvido foi usado para provocar o aumento da energia interna.