SIMULAÇÃO DO SISTEMA CARDIOVASCULAR E
CONTROLE DA FREQUÊNCIA CARDÍACA POR UM
CIRCUITO ELÉTRICO EQUIVALENTE
Simão Coutinho de Albuquerque Neto
Projeto de Graduação apresentado ao Curso de
Engenharia Eletrônica e de Computação da Escola
Politécnica, Universidade Federal do Rio de
Janeiro, como parte dos requisitos necessários à
obtenção do título de Engenheiro.
Orientador: Heraldo Luis Silveira de Almeida
Co-orientador: Marco Antonio von Krüger
Rio de Janeiro
Agosto de 2014
SIMULAÇÃO DO SISTEMA CARDIOVASCULAR E
CONTROLE DA FREQUÊNCIA CARDÍACA POR UM
CIRCUITO ELÉTRICO EQUIVALENTE
Simão Coutinho de Albuquerque Neto
PROJETO DE GRADUAÇÃO SUBMETIDO AO CORPO DOCENTE DO CURSO
DE ENGENHARIA ELETRÔNICA E DE COMPUTAÇÃO DA ESCOLA
POLITÉCNICA DA UNIVERSIDADE FEDERAL DO RIO DE JANEIRO COMO
PARTE DOS REQUISITOS NECESSÁRIOS PARA A OBTENÇÃO DO GRAU DE
ENGENHEIRO ELETRÔNICO E DE COMPUTAÇÃO
Autor:
_________________________________________________
Simão Coutinho de Albuquerque Neto
Orientador:
_________________________________________________
Prof. Heraldo Luis Silveira de Almeida, D. Sc.
Orientador:
_________________________________________________
Prof. Marco Antonio von Krüger, Ph. D.
Examinador:
_________________________________________________
Prof. Rubem Pinto Mondaini, D. Sc.
Examinador:
_________________________________________________
Prof. Joarez Bastos Monteiro, D. Sc.
Rio de Janeiro – RJ, Brasil
Agosto de 2014
ii
UNIVERSIDADE FEDERAL DO RIO DE JANEIRO
Escola Politécnica – Departamento de Eletrônica e de Computação
Centro de Tecnologia, bloco H, sala H-217, Cidade Universitária
Rio de Janeiro – RJ
CEP 21949-900
Este exemplar é de propriedade da Universidade Federal do Rio de Janeiro, que
poderá incluí-lo em base de dados, armazenar em computador, microfilmar ou adotar
qualquer forma de arquivamento.
É permitida a menção, reprodução parcial ou integral e a transmissão entre
bibliotecas deste trabalho, sem modificação de seu texto, em qualquer meio que esteja
ou venha a ser fixado, para pesquisa acadêmica, comentários e citações, desde que sem
finalidade comercial e que seja feita a referência bibliográfica completa.
Os conceitos expressos neste trabalho são de responsabilidade do(s) autor(es).
iii
AGRADECIMENTO
Aos meus pais por todo suporte, incentivo e amor dados em todos os momentos
de minha vida. Sem vocês nunca teria chegado até aqui.
À minha irmã pelos conselhos, amizade e companheirismo.
A todos os professores que tive pelos ensinamentos e exemplos que auxiliaram
em minha formação, não apenas profissional como também pessoal.
Ao meu orientador Marco Antonio von Krüger e aos colegas Cátia Carvalho e
Vinícius Martins por sempre me receberem muito bem no Laboratório de Ultrassom e
por estarem sempre dispostos a me tirar as dúvidas sobre os assuntos que não dominava.
Ao meu orientador Heraldo Luis Silveira de Almeida por aceitar fazer parte deste
projeto.
Aos orientadores de estágios, alunos e funcionários de laboratórios com quem
tive o prazer de trabalhar: Roldão, Otávio, Patricia, Guilherme, Rafael Tavares, Amauri,
Renato, Henrique, Neide, Felipe, Jacqueline, Eliane, Fernanda, Gabriela, Hugo, Jordana,
Tiago, Samantha, Rafael Assumpção, Douglas, João Pedro, André e Aline.
Aos que conviveram comigo durante o curso na faculdade, em especial:
Madureira, Daniel, Rodrigo, Leandro, Renato, Clark, João Paulo, Virgínia, Renan,
Denis, Gabriel, Zheng, Jaqueline, Felipe Ribeiro, Danilo, Claudio, Govinda, Felipe
Mota, Gustavo, Thiago, Zanon, Victor, José Felipe, Oliver, Vitor, Paulo Victor, Noel,
Rafael, Kauli e Marcelo. Agradeço pelos momentos de estudo, trabalhos, almoços,
caronas, passeios, jogos e conversas sobre os mais diversos assuntos. Vocês foram de
fundamental importância pra mim nestes anos.
Aos meus grandes amigos, Luís, Maia, Ferreira, Thiago, Rômulo, Marcos, Diego
Cortinhas, Vittorio, Yuri, Diego Borges e Kate, por serem minha segunda família.
iv
RESUMO
As cirurgias de bypass coronariano vêm sendo aperfeiçoadas desde a sua
primeira realização, no início da década de 1960. Muito se deve à utilização de
dispositivos eletrônicos desenvolvidos para auxiliar nos procedimentos cirúrgicos.
O fluxômetro por tempo de trânsito (transit time flowmeter – TTFM) é um
equipamento ultrassônico minimamente invasivo usado para a medição da vazão
sanguínea em artérias coronarianas e vasos periféricos durante as cirurgias. Como todo
mecanismo eletrônico, é necessária a realização de calibrações periódicas de forma a
garantir medições confiáveis. Para este fim, o Laboratório de Ultrassom (LUS) do
Programa de Engenharia Biomédica (PEB) da COPPE/UFRJ desenvolveu um phantom
de fluxo que produz perfis de pressão semelhantes aos medidos em aortas. Uma bomba
de pistão e um circuito hidráulico simulam o padrão de ejeção do ventrículo esquerdo e
as características viscoelásticas, resistivas e capacitivas da rede vascular humana,
respectivamente.
O presente trabalho tem como objetivo simular variações na resistência
periférica e a resposta do coração para manter a pressão no interior da aorta a mais
inalterada possível. Para isto, foi elaborado um algoritmo em MATLAB para emular o
circuito elétrico equivalente ao hidráulico. A pressão na aorta é representada como a
tensão de saída do circuito, o fluxo sanguíneo como a corrente de entrada e as
resistências encontradas ao longo da rede vascular humana como um resistor.
Simulações foram realizadas com o software OrCAD para auxiliar na proposta
do controle da tensão de saída.
Palavras-Chave: simulação, controle, phantom de fluxo, TTFM.
v
ABSTRACT
Coronary arterial bypass surgery have been improved since its first realization in
the early 1960s Much is due to the use of electronic devices developed to aid in surgical
procedures.
The transit time flowmeter (TTFM) is a minimally invasive ultrasonic
equipment used for the measurement of blood flow in coronary arteries and peripheral
vessels during surgeries. Like any electronic device, is necessary to perform periodic
calibrations to ensure reliable measurements. For this purpose, a flow phantom that
produces similar pressure profiles to the measured in aortas was developed in the
Ultrasound Laboratory (LUS) of COPPE/UFRJ Biomedical Engineering Program
(PEB). A piston pump and a hydraulic circuit simulate the pattern of left ventricular
ejection and viscoelastic, resistive and capacitive characteristics of the human vascular
network, respectively.
The present work aims to simulate variations in peripheral resistance and the
response of the heart to maintain the pressure within the aorta more unchanged as
possible. For this, an algorithm was developed in MATLAB to emulate the electric
circuit equivalent to the hydraulic. Aortic pressure is represented as the output voltage
of the circuit, blood flow as the input current and the resistance found throughout the
human vascular network as a resistor.
Simulations were performed with the OrCAD software to assist in the proposed
control of the output voltage.
Key-words: simulation, control, flow phantom, TTFM.
vi
SIGLAS
UFRJ – Universidade Federal do Rio de Janeiro
COPPE – Instituto Alberto Luiz Coimbra de Pós-Graduação e Pesquisa de Engenharia
PEB – Programa de Engenharia Biomédica
LUS – Laboratório de Ultrassom
TTFM – Fluxômetro por Tempo de Trânsito
MATLAB – Matrix Laboratory
OrCAD – Oregon + CAD (Computer-aided Design)
LabVIEW – Laboratory Virtual Instrument Engineering Workbench
vii
Sumário
1
Introdução
1.1 - Tema
1
............................................
1.2 - Delimitação
.......................................
1
1.3 - Justificativa
.......................................
1
.........................................
2
.......................................
2
.........................................
3
1.4 - Objetivos
1.5 - Metodologia
1.6 - Descrição
2
Fisiologia do Sistema Cardiovascular
2.1 - Circulação sanguínea
2.2 - O coração
4
..............................
4
.......................................
6
2.3 - O ciclo cardíaco
..................................
2.4 - Curva de pressão aórtica
2.5 - Débito cardíaco
10
..................................
11
.......................
Dispositivos
3.2 - Phantoms de fluxo
12
16
3.1 - Fluxômetros ultrassônicos
4
7
...........................
2.6 - Regulação da função cardíaca
3
1
..........................
16
................................
17
Modelo Elétrico Equivalente
20
4.1 - Características do circuito
viii
..........................
20
4.2 - Simulação do circuito
5
.............................
Resultados
26
5.1 - Formas de onda obtidas com o algoritmo
5.2 - Variação de R4
..............
26
..................................
28
5.3 - Introdução do controle
6
22
............................
Conclusão
30
35
Bibliografia
36
Anexo 1
37
Anexo 2
41
Anexo 3
45
Anexo 4
50
ix
Lista de Figuras
2.1 – Representação do sistema circulatório. . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
5
2.2 – Interrelação entre pressão, resistência e fluxo sanguíneo. . . . . . . . . . . . . . . .
5
2.3 – Resistências vasculares: A em série e B em paralelo. . . . . . . . . . . . . . . . . . .
6
2.4 – Estrutura do coração. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
7
2.5 – Eventos do ciclo cardíaco. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
10
2.6 – Curva de pressão aórtica. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
11
2.7 – O sistema barorreceptor para o controle da pressão arterial. . . . . . . . . . . . . .
13
2.8 – Controle realimentado da pressão arterial (PA) pelo sistema nervoso
autônomo (SNA) e rins. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
15
3.1 – Transdutores para vasos de pequeno (A) e grande calibre (B). Medição do
fluxo sanguíneo em um bypass coronariano com veia safena (C). . . . . . . . . . . . .
16
3.2 – Funcionamento de um TTFM. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
17
3.3 – Representação do circuito hidráulico desenvolvido no LUS. . . . . . . . . . . . .
18
3.4 – Posicionamento dos registros R1, R2 e R3. . . . . . . . . . . . . . . . . . . . . . . . . .
19
3.5 – Circuito hidráulico incluindo o sensor de pressão para a aquisição do sinal.
19
4.1 – Circuito elétrico com os elementos representativos do circuito hidráulico. .
20
4.2 – Forma de onda gerada pela fonte da Figura 4.3. . . . . . . . . . . . . . . . . . . . . . .
21
4.3 – Exemplo de fonte de corrente de pulso. . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
21
4.4 – Circuito elétrico com o acréscimo do capacitor C4 de 1µF. . . . . . . . . . . . . .
22
4.5 – Forma de onda da fonte de corrente. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
22
4.6 – Tensão em R1 sem C4. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
23
4.7 – Tensão em R1 com C4. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
23
4.8 – Tensão no ramo contendo C1 e R2 sem C4. . . . . . . . . . . . . . . . . . . . . . . . . .
23
4.9 – Tensão no ramo contendo C1 e R2 com C4. . . . . . . . . . . . . . . . . . . . . . . . . .
24
4.10 – Tensão em R4 sem C4. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
24
4.11 – Tensão em R4 com C4. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
24
x
5.1 – Forma de onda da fonte de corrente. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
26
5.2 – Tensão em R1. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
26
5.3 – Tensão no ramo contendo C1 e R2. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
27
5.4 – Tensão em R4. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
27
5.5 – Tensão em R4 com resistência variando de 1590Ω a 1690Ω. . . . . . . . . . . . .
28
5.6 – Tensão em R4 com resistência variando de 1590Ω a 2090Ω. . . . . . . . . . . . .
28
5.7 – Tensão em R4 com resistência variando de 1590Ω a 1490Ω. . . . . . . . . . . . .
29
5.8 – Tensão em R4 com resistência variando de 1590Ω a 1090Ω. . . . . . . . . . . . .
29
5.9 – Tensão em R4 com resistência variando de 1590Ω a 1690Ω e com controle
(visão completa do ciclo). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
32
5.10 – Tensão em R4 com resistência variando de 1590Ω a 1690Ω e com
controle. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
32
5.11 – Tensão em R4 com resistência variando de 1590Ω a 2090Ω e com
controle. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
32
5.12 – Tensão em R4 com resistência variando de 1590Ω a 1490Ω e com
controle. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
33
5.13 – Tensão em R4 com resistência variando de 1590Ω a 1090Ω e com
controle. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
33
5.14 – Tensão em R4 com resistência variando de 1590Ω a 2090Ω e com novo
controle. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
34
5.26 – Tensão em R4 com resistência variando de 1590Ω a 1090Ω e com novo
controle. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
34
xi
Lista de Tabelas
4.1 – Equivalência entre os componentes elétricos e hidráulicos. . . . . . . . . . . . . .
20
4.2 – Valores dos componentes. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
21
5.1 – Tabela com os valores utilizados para a criação da lei de controle. . . . . . . .
31
xii
Capítulo 1
Introdução
1.1 – Tema
As cirurgias de bypass coronariano vêm se aperfeiçoando desde que se deu o
primeiro caso na década de 1960. Para uma melhor qualidade dos enxertos, os métodos
de avaliações devem ser os mais confiáveis possíveis. A utilização de fluxômetros por
tempo de trânsito (transit time flowmeters – TTFM) vem se mostrando promissora nos
procedimentos cirúrgicos. Este trabalho tem como objetivo agregar valor ao phantom de
fluxo desenvolvido no LUS para a calibração de um TTFM.
O tema do trabalho é a reprodução do funcionamento do sistema cardiovascular
mediante uma variação de pressão. É dado enfoque ao caso em que o controle é
exercido por uma variação na frequência cardíaca. Com o auxílio de um modelo elétrico
equivalente, variações em componentes podem ser simuladas, viabilizando um estudo e
uma proposta de mecanismo de regulação que se assemelhe ao orgânico.
1.2 – Delimitação
O objeto de estudo é um circuito elétrico equivalente a um circuito hidráulico
desenvolvido para a calibração de TTFMs [1]. O circuito hidráulico em conjunto com
uma bomba por pistão, ambos projetados no Laboratório de Ultrassom (LUS) do
Programa de Engenharia Biomédica (PEB) da COPPE/UFRJ, reproduzem perfis de
pressão semelhantes aos observados no interior da aorta de pessoas saudáveis.
1.3 – Justificativa
Nesta última década, deu-se início à utilização de TTFMs em cirurgias
vasculares com o intuito de tornar mais simples e menos invasiva a medição de vasão
1
sanguínea e auxiliar no traçar de estratégias a serem tomadas durante o procedimento
cirúrgico ou no período pós-operatório. Devido a isto, o sucesso em operações deste
tipo tem grandes chances de ser aumentado, resultando em menor mortalidade.
Como todo instrumento de medição, o TTFM deve ser devidamente calibrado
para que opere corretamente, fornecendo informações da forma mais precisa possível. O
presente projeto se encaixa neste contexto: auxiliar na calibração do fluxômetro.
Os trabalhos feitos até o momento [1, 2] apresentam diferentes níveis de pressão
ao se variar algum dos componentes. As variações são feitas antes dos testes e mantêmse fixas durante todo o processo. Neste projeto, variar-se-á uma resistência específica,
que representa o somatório das resistências encontradas principalmente nas arteríolas e
esfíncteres pré-capilares [1]. A simulação se dará em “tempo real”, onde serão
observadas as consequências da variação e será proposta uma solução que se aproxime
do caso real.
1.4 – Objetivos
Os objetivos são, então, desenvolver um algoritmo para a simulação do circuito
elétrico equivalente, capaz de reproduzir as formas de onda obtidas em softwares
simuladores de circuito, porém com a vantagem de observar mudanças ocorridas devido
a variações de componentes em “tempo real” e propor uma forma de controle da tensão
de saída, através de uma variação da frequência da fonte de corrente, que se assemelhe
ao comportamento observado do coração para o controle da pressão na aorta.
1.5 – Metodologia
Neste projeto utilizar-se-á um circuito elétrico equivalente a um hidráulico cujos
perfis de pressão observados são semelhantes aos do interior da aorta de uma pessoa
saudável. Serão feitas simulações com o auxílio de softwares simuladores de circuitos
para a obtenção de valores que auxiliem a validar o algoritmo a ser desenvolvido. O
algoritmo será construído com o auxílio de métodos numéricos de aproximação.
2
1.6 – Descrição
No capítulo 2 será feita uma pequena revisão sobre o sistema cardiovascular,
dando enfoque na circulação sistêmica, no coração e nas diversas formas de controle da
pressão arterial.
O capítulo 3 apresenta os dispositivos abordados no trabalho.
As características e simulações do circuito elétrico equivalente são apresentadas
no capítulo 4.
No capítulo 5 são mostrados os resultados da simulação feita a partir do
algoritmo, demonstrando os efeitos da variação da resistência e, posteriormente, da
inclusão de um controle.
O capítulo 6 apresenta a conclusão deste projeto.
3
Capítulo 2
Fisiologia do Sistema Cardiovascular
2.1 – Circulação sanguínea
A circulação sanguínea exerce um papel essencial para a manutenção da vida,
pois é através dela que os substratos metabólicos (nutrientes e oxigênio) são levados até
as células e os dejetos provenientes de seus metabolismos são removidos. Além disso,
tem outras funções como, por exemplo, transportar hormônios de uma parte do corpo
para outra, fazer trocas de calor para equalizar a temperatura corporal e distribuir
anticorpos para combater infecções. Para que isto tudo possa ocorrer, o sistema
cardiovascular (coração, artérias e veias) garante a entrega adequada do fluxo sanguíneo
aos órgãos.
O coração é um órgão muscular especializado que pode ser visto funcionalmente
como duas bombas separadas: a do lado direito responsável pela circulação pulmonar e
a do esquerdo pela circulação sistêmica (também chamada de grande circulação ou
circulação periférica). A circulação pulmonar consiste no sangue pobre em oxigênio
fluindo para os pulmões, através do tronco pulmonar, para a troca de gases (oxigênio e
dióxido de carbono) entre o sangue nos capilares pulmonares e o alvéolo pulmonar. O
sangue enriquecido é então transportado pelas veias pulmonares para o lado esquerdo
do coração que o bombeia através da aorta para dentro das artérias que, por sua vez, se
ramificam em arteríolas e depois em capilares onde o oxigênio se difunde do sangue nas
células ao redor, vascularizando os órgãos. O conjunto formado por todos os vasos
sanguíneos dentro e fora dos órgãos, com exceção do pulmão, compõe a circulação
sistêmica.
O fluxo sanguíneo através de um vaso sanguíneo é definido pela razão entre a
diferença de pressão de dois pontos do vaso e a resistência vascular, e é expresso pela
lei de Ohm:
(2.1)
4
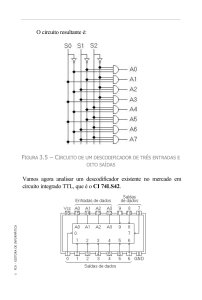
Figura 2.1 – Representação do sistema circulatório.
Fonte: Adaptado de [3].
Figura 2.2 – Interrelação entre pressão, resistência e fluxo sanguíneo.
Fonte: Adaptado de [3].
5
Figura 2.3 – Resistências vasculares: A em série e B em paralelo.
Fonte: [3].
2.2 – O coração
Ambos os lados do coração são formados por duas câmaras: um átrio na parte
superior e um ventrículo na inferior. O átrio direito recebe o sangue venoso da
circulação sistêmica pelas veias cavas superior e inferior. Em seguida, flui para o
ventrículo direito, através da válvula tricúspide, de onde é bombeado para os pulmões,
passando pela válvula pulmonar semilunar e pela artéria pulmonar. O sangue saído dos
pulmões retorna ao coração através de quatro veias pulmonares que entram no átrio
esquerdo. Do átrio, flui para o ventrículo esquerdo, passando pela válvula mitral. O
ventrículo esquerdo ejeta o sangue através da válvula aórtica para a aorta, que então
distribui o sangue para o resto do corpo.
Os bombeamentos nos ventrículos ocorrem ao mesmo tempo e sua eficiência se
deve à sequência ordenada de contração e à presença das válvulas que garantem que o
sangue flua na direção correta sem refluxo. O ventrículo esquerdo é uma bomba de alta
pressão, podendo exceder 120 mm Hg de pico, enquanto o direito é de baixa pressão
(em torno de 25 mm Hg) [4].
6
Figura 2.4 – Estrutura do coração.
Fonte: Adaptado de [3].
2.3 – O ciclo cardíaco
À sequência de eventos entre o início de um batimento do coração e outro, é
dado o nome de ciclo cardíaco. De uma forma mais geral, este pode ser divido em duas
categorias: diástole (período de relaxamento, durante o qual ocorre o enchimento
ventricular) e sístole (período de contração e ejeção ventricular). Alguns autores
dividem o ciclo cardíaco em sete fases: contração atrial, contração isovolumétrica,
ejeção rápida, ejeção reduzida, relaxamento isovolumétrico, enchimento rápido e
enchimento reduzido.
7
Fase 1: Contração Atrial.
Nesta fase, as válvulas atrioventriculares se encontram abertas, permitindo que a
grande parte do sangue que flui continuamente das grandes veias para os átrios passe
diretamente para os ventrículos antes mesmo da contração atrial. A contração é,
normalmente, responsável por apenas 10 [5] a 20% [3] do enchimento dos ventrículos.
Entretanto, durante exercícios (ou situações que elevem as frequências cardíacas), o
tempo de diástole é encurtado consideravelmente, aumentando a contribuição da
contração atrial para até 40% e, consequentemente, diminuindo a quantidade de sangue
que entra de forma passiva nos ventrículos. O refluxo nas veias cavas e pulmonares é
impedido pela inércia do retorno venoso e pela onda de contração ao longo dos átrios.
Ao final desta fase, o ventrículo esquerdo apresenta um volume de sangue em torno de
120 ml e pressão de 8 a 12 mm Hg (no direito, em torno de 3 a 6 mm Hg). Na
Figura 2.3, o aumento de pressão atrial é representado como a onda “a”.
Fase 2: Contração Isovolumétrica.
Assim que a contração isovolumétrica começa, juntamente com o fechamento
das válvulas atrioventriculares, a pressão ventricular sobe abruptamente sem mudança
no volume ventricular, excedendo a pressão atrial. A onda “c” na Figura 2.3 representa
o aumento de pressão atrial devido ao súbito aumento da pressão ventricular, que causa
um abaulamento das válvulas atrioventriculares em direção ao átrio.
Fase 3: Ejeção Rápida.
Quando a pressão no ventrículo torna-se maior que a da artéria (no lado
esquerdo, 80 mm Hg da aorta, e no direito, 8 mm Hg da artéria pulmonar), as válvulas
semilunares (aórtica e pulmonar) não resistem mais e se abrem. Imediatamente, o
sangue começa a deixar os ventrículos, chegando a 70% do volume total somente nesta
fase, que corresponde ao primeiro terço da ejeção. Enquanto isso, sangue começa a
retornar aos átrios. Porém, apesar do aumento no volume atrial, as pressões nos átrios
inicialmente decrescem, pois as câmaras estão se expandindo devido à contração
ventricular que puxa a base atrial para baixo.
Fase 4: Ejeção Lenta.
Representa os dois terços restantes da ejeção quando ocorre a saída dos últimos
30% do sangue nos ventrículos. A atividade ventricular diminui e a pressão cai para
8
valores ligeiramente menores que das artérias, porém a inércia mantém o fluxo de
sangue para fora. As válvulas atrioventriculares permanecem fechadas e a pressão atrial
cresce gradualmente devido ao retorno venoso contínuo.
Fase 5: Relaxamento Isovolumétrico.
Ao fim da sístole, o progressivo relaxamento da musculatura ventricular faz
com que as pressões intraventriculares caiam rapidamente, tornando-se menores que as
atriais. Isto causa o fechamento abrupto das válvulas semilunares (a aórtica antes da
pulmonar). As pressões intraventriculares caem rapidamente aos seus baixos níveis
diastólicos, enquanto que nas artérias aórtica e pulmonares o declínio é muito menor. O
volume ventricular não se modifica durante o relaxamento, mas as pressões e volumes
atriais continuam a aumentar devido ao sangue que continua voltando.
Fase 6: Enchimento Rápido.
No momento em que a pressão ventricular se torna menor que a atrial, ocorre a
abertura das válvulas atrioventriculares que dá inicio ao preenchimento dos ventrículos.
O relaxamento do ventrículo gera uma queda de pressão mais rápida no seu interior do
que a atrial, causando uma sucção que auxilia no enchimento inicial, que é bastante
rápido.
Fase 7: Enchimento Lento.
Não existe uma demarcação clara entre as fases de enchimento ventricular
rápido e lento, sendo esta última definida como o período durante a diástole em que o
enchimento ventricular está quase completo. Há uma queda nas pressões arteriais
aórtica e pulmonar conforme o sangue flui para as circulações sistêmica e pulmonar.
9
Figura 2.5 – Eventos do ciclo cardíaco.
Fonte: Adaptado de [3].
2.4 – Curva de pressão aórtica
A curva de pressão aórtica é o objeto de estudo do presente trabalho e foi
reproduzida por um circuito hidráulico no LUS [1]. Os principais fatores que
determinam sua forma são o débito sistólico e a complacência da parede aórtica. A
complacência é definida como a razão entre a variação de volume (ΔV) e a variação de
pressão (ΔP).
(2.2)
Como dito anteriormente (fase 3 do ciclo cardíaco), com a pressão ventricular
maior que a da aorta devido à contração, a válvula aórtica se abre, permitindo o fluxo de
sangue para a circulação sistêmica. Com a abertura, a aorta se expande e sua pressão
chega a cerca de 120 mm Hg (pressão sistólica). Durante a diástole, a aorta volta
lentamente à forma relaxada (devido à sua alta complacência), mantendo assim um
nível de pressão alto.
10
Figura 2.6 – Curva de pressão aórtica.
Fonte: [1].
2.5 – Débito cardíaco
A quantidade de sangue bombeada por minuto pelo coração para a aorta é
chamada de débito cardíaco. Diversos fatores como idade, tamanho e nível de atividade,
o afetam diretamente. Sob a maioria das condições normais, o valor do débito cardíaco
a longo prazo varia de forma inversamente proporcional à resistência periférica total, ou
seja, um acréscimo no valor da resistência gera uma diminuição do débito cardíaco e
vice-versa. A lei de Ohm, expressa em (2.1), pode ser reescrita como:
(2.3)
Onde:
DC = Débito cardíaco
PA = Pressão arterial
RP = Resistência periférica total
11
Outra forma de expressar o débito cardíaco é em função do volume sistólico
(VS) e da frequência cardíaca (FC):
(2.4)
2.6 – Regulação da função cardíaca
O sistema cardiovascular é bastante robusto, sendo capaz de se adaptar a
mudanças de condições e demandas do corpo. A função cardíaca, a resistência vascular
sistêmica e o volume de sangue são ajustados de forma a manter a pressão arterial
dentro de limites bem restritos, uma vez que ela é responsável por fornecer a força
motriz necessária para a perfusão dos órgãos. O controle é realizado tanto nas atividades
dos nervos autonômicos conectados ao coração e à vasculatura quanto por alterações
hormonais na circulação.
As mudanças no volume de sangue fluindo ao coração são reguladas
intrinsecamente, gerando uma alteração no bombeamento cardíaco. O volume extra de
sangue preenchendo os ventrículos faz com que o músculo cardíaco seja esticado para
um comprimento maior, aumentando a força de contração e, assim, conseguindo
bombear o sangue com volume extra para as artérias. Esta capacidade de adaptação é
chamada de mecanismo Frank-Starling do coração.
O sistema nervoso autônomo apresenta diversos mecanismos especiais de
controle (em grande parte, negativamente realimentados) que operam continuamente
para manter a pressão arterial o mais próximo do normal. Uma característica
especialmente importante é a sua rapidez de resposta a variações. O aumento da
atividade do coração se dá por estimulação simpática, que age elevando a frequência
cardíaca e/ou a força e o volume de bombeamento. A estimulação parassimpática, por
sua vez, causa um acentuado decréscimo na frequência cardíaca e uma leve diminuição
na contractilidade do músculo cardíaco. A estimulação simpática pode aumentar o
débito cardíaco em duas ou três vezes em adição ao aumento causado pelo mecanismo
de Frank-Starling (muito se deve ao aumento da frequência cardíaca que pode chegar a
até três vezes o valor normal). Assim, para um aumento de pressão, as funções
vasoconstrictoras e cardioaceleradoras do sistema nervoso simpático são estimuladas,
enquanto os sinais vagais parassimpáticos são inibidos.
12
Os impulsos simpáticos transmitidos pelo centro vasomotor para as pequenas
artérias e arteríolas aumentam a resistência ao fluxo sanguíneo, decrescendo, assim, a
taxa de fluxo através dos tecidos. Já os transmitidos para os grandes vasos,
particularmente as veias, diminuem o seu volume, transferindo o sangue de um
segmento para outro. Desta forma, um grande volume pode ser direcionado ao coração,
resultando num aumento do bombeamento.
Um dos principais mecanismos de controle da pressão arterial é o reflexo
barorreceptor, que responde extremamente rápido a variações, mas é mais efetivo na
faixa de pressão de 60 a 180 mm Hg. Os barorreceptores monitoram continuamente a
pressão arterial e fornecem informações para o sistema nervoso central através de suas
conexões neurais aferentes para o cérebro. Um aumento na pressão arterial estica os
barorreceptores, fazendo-os transmitir sinais ao sistema nervoso central que, como
reflexo, causa tanto uma diminuição da resistência periférica quanto do débito cardíaco,
trazendo a pressão de volta a um nível normal. Reciprocamente, uma diminuição na
pressão tem o efeito oposto.
Figura 2.7 – O sistema barorreceptor para o controle da pressão arterial.
Fonte: Adaptado de [3].
13
Quando a pressão arterial cai abaixo de 80 mm Hg, em direção a um nível
crítico, entra em ação o reflexo quimiorreceptor. Com a diminuição do fluxo sanguíneo,
ocorre um decréscimo de oxigênio e o acúmulo em excesso de dióxido de carbono e
íons de hidrogênio que estimulam os quimiorreceptores. Estes, por sua vez, transmitem
sinais ao centro vasomotor que eleva a pressão de volta ao normal.
Nos átrios e artérias pulmonares existem receptores de baixa pressão similares
aos barorreceptores. Eles detectam aumentos nas áreas de baixa pressão da circulação
causados por aumentos do volume, provocando reflexos paralelos aos dos
barorreceptores e, assim, tornando o sistema de reflexo total mais potente para o
controle da pressão arterial. Ainda, o aumento da pressão atrial ativa o reflexo nervoso
chamado reflexo de Bainbridge que causa uma elevação na frequência cardíaca entre 40
e 60 por cento, de forma a prevenir o represamento de sangue em veias, átrios e
circulação pulmonar.
Há ainda mecanismos de regulação da pressão arterial a longo prazo que se dão,
basicamente, pelo balanceamento entre a entrada e saída de fluidos. O excesso de fluido
extracelular faz com que o volume de sangue aumente e, consequentemente, também a
pressão arterial. Os rins, então, aumentam a filtração no interior de seus túbulos e
diminuem a reabsorção de fluidos, resultando na excreção do excesso de sais e água e,
assim, retornando a pressão de volta ao normal.
Durante a prática de exercícios físicos, o sistema circulatório enfrenta condições
muito estressantes, uma vez que a contração dos músculos esqueléticos requer um
aumento da atividade metabólica, ou seja, o aumento do fornecimento de nutrientes e a
remoção dos subprodutos provenientes do metabolismo. Para atender a esta demanda,
os vasos sanguíneos nos músculos em exercício se dilatam, aumentando suas áreas e,
assim, permitindo um aumento no fluxo sanguíneo. Porém, esse aumento de fluxo só
pode ocorrer se a pressão arterial for mantida, o que ocorre através da constrição de
vasos sanguíneos espalhados pelo corpo que, por sua vez, resulta no translocamento de
sangue para o coração e pulmões, aumentando o débito cardíaco. Sem alterações, a
pressão arterial cairia vertiginosamente durante o exercício, limitando a perfusão de
sangue nos órgãos e a capacidade de exercício [5].
14
Figura 2.8 – Controle realimentado da pressão arterial (PA) pelo sistema nervoso
autônomo (SNA) e rins. Uma súbita queda na PA provoca um rápido reflexo
barorreceptor que aciona o SNA para estimular o coração (aumentando o débito
cardíaco) e comprime os vasos sanguíneos para restaurar a PA. Os rins respondem à PA
reduzida retendo Na+ e água para aumentar o volume de sangue, o que ajuda a restaurar
a PA. O (+) indica a restauração da pressão arterial seguinte a queda inicial na pressão
(ou seja, uma resposta negativamente realimentada).
Fonte: Adaptado de [5].
15
Capítulo 3
Dispositivos
3.1 – Fluxômetros ultrassônicos
Diversos métodos já foram e são utilizados para a realização da fluxometria
sanguínea tanto durante quanto no final do procedimento cirúrgico. Dentre os
instrumentos ultrassônicos para este fim, encontram-se o Doppler e o fluxômetro por
tempo de trânsito (TTFM). Sua utilização crescente se deve ao fato de ser um método
diagnóstico não invasivo, ser bastante sensível, ter transdutores de tamanho reduzido e,
em sua maioria, serem portáteis.
Figura 3.1 – Transdutores para vasos de pequeno (A) e grande calibre (B). Medição do
fluxo sanguíneo em um bypass coronariano com veia safena (C).
Fonte: [1].
O funcionamento do TTFM se dá da seguinte maneira: um feixe de ultrassom é
transmitido de forma a atravessar todo o vaso sanguíneo, quando então é refletido na
superfície metálica no lado oposto e, em seguida, chegando a um elemento
piezoelétrico. Um segundo pulso é então transmitido, fazendo o caminho oposto. O
pulso cuja componente horizontal se deu no mesmo sentido que o fluxo sanguíneo
chegará em um tempo menor do que o que foi transmitido no sentido oposto. A partir da
diferença entre os tempos de trânsito, pode ser obtida a velocidade média do fluxo.
16
O TTFM, quando devidamente calibrado, é bastante confiável e preciso, e seu
uso auxilia no sucesso das cirurgias de revascularização. A avaliação dos fluxos nos
enxertos possibilita um maior controle de qualidade dos procedimentos.
Figura 3.2 – Funcionamento de um TTFM.
Fonte: Adaptado de [6].
3.2 – Phantoms de fluxo
Para garantir o funcionamento adequado dos instrumentos ultrassônicos
utilizados em procedimentos médicos, tanto em diagnósticos quanto em terapias, é
necessária sua calibração periódica com o auxílio de sistemas denominados phantoms:
corpos de prova que mimetizam propriedades e geometrias de materiais biológicos.
Phantoms de fluxo têm como finalidade a reprodução de padrões de fluxo
conhecidos de tecidos biológicos, podendo ser contínuos ou pulsáteis, e simulam
situações fisiológicas normais e patológicas do sistema cardiovascular. São utilizados
tanto para avaliação de técnicas de imagens quanto para estudos e calibração de
equipamentos ultrassônicos de medição de fluxo, como o Doppler e o TTFM [7]. O
fluido utilizado nestes phantoms pode ser água [1] ou soluções elaboradas que
mimetizam as propriedades reológicas e acústicas do sangue.
O circuito hidráulico desenvolvido por França [1] reproduz as características
viscoelásticas, resistivas e capacitivas da rede vascular humana. Uma bomba por pistão
(acionada por um motor de passo que, por sua vez, é controlado por um programa
implementado em LabVIEW) reproduz o padrão de ejeção do ventrículo esquerdo.
Monitorado por um sensor de pressão, o circuito apresenta perfis de pressão
semelhantes aos encontrados no interior da aorta.
Na Figura 3.3, Figura 3.4 e Figura 3.5 são mostrados componentes do circuito
hidráulico. A válvula de admissão representa a válvula mitral, enquanto a de ejeção
17
reproduz o funcionamento da válvula aórtica. Ambas são unidirecionais e funcionam de
forma passiva e alternadamente, uma vez que são abertas de acordo com o gradiente de
pressão. A unidade viscoelástica confere as características de elasticidade e viscosidade
das paredes arteriais ao circuito hidráulico de paredes rígidas. É formada por duas
provetas que amortecem a pressão durante a sístole e mantêm o bombeamento durante a
diástole através da queda lenta de pressão. O registro R2 controla a vazão entre as
provetas, enquanto R1 regula a taxa de amortecimento que é fornecida ao circuito
(Figura 3.4). O registro R3 funciona como o somatório das resistências exercidas pelas
arteríolas e esfíncteres pré-capilares do sistema vascular. O comportamento capacitivo
da rede venosa é reproduzido pelo recipiente despressurizado, que acomoda grande
parte do volume de líquido do circuito.
Figura 3.3 – Representação do circuito hidráulico desenvolvido no LUS.
Fonte: [1].
18
Figura 3.4 – Posicionamento dos registros R1, R2 e R3.
Fonte: [1].
Figura 3.5 – Circuito hidráulico incluindo o sensor de pressão para aquisição do sinal.
Fonte: [8].
19
Capítulo 4
Modelo elétrico equivalente
4.1 – Características do circuito
O circuito elétrico equivalente ao hidráulico sistêmico elaborado por França [1]
foi simulado no OrCAD Capture CIS utilizando os valores de Carvalho [2] para o
modelo cardiovascular (Figura 4.1). A tensão em cima do resistor R4 equivale à curva
de pressão aórtica (Figura 2.6).
Figura 4.1 – Circuito elétrico com os elementos representativos do circuito hidráulico.
Os componentes do circuito hidráulico são representados pelos elementos
elétricos conforme a Tabela 4.1.
Tabela 4.1 – Equivalência entre os componentes hidráulicos e elétricos.
Circuito hidráulico
Circuito elétrico
Bomba de pistão
Fonte de corrente (I1)
Válvula aórtica
Diodo (D1)
Características do líquido utilizado
Indutor (L1) e resistor (R1)
Características das tubulações
Capacitor (C1) e resistor (R2)
Unidade viscoelástica
Capacitores (C2 e C3) e resistor (R3)
Resistência periférica
Resistor (R4)
20
Os elementos passivos do circuito têm seus valores conforme a Tabela 4.2.
Tabela 4.2 – Valores dos componentes.
Componentes
Valores
R1
0,1 MΩ
R2
34 Ω
R3
160 kΩ
R4
1590 Ω
C1
300 µF
C2
1100 µF
C3
1000 µF
L1
3H
A fonte de corrente utilizada (IPULSE) tem seu formato descrito a partir da
configuração de sete parâmetros. Os valores de correntes (I1 e I2) são os níveis mínimo
e máximo da variação na fonte (I2 pode tanto ser maior quanto menor que I1), o tempo
de atraso (TD) indica o momento em que se dará início à variação, os tempos de subida
e descida (TR e TF, respectivamente) definem a duração do estágio de mudança entre os
dois níveis de corrente, o comprimento de pulso (PW) é a duração de tempo que a fonte
permanece no valor de I2 e o período (PER) indica a duração total da onda (incluso os
valores indicados em TR, TF e PW). A Figura 4.2 apresenta um exemplo da forma de
onda gerada pela fonte.
Figura 4.2 – Forma de onda gerada pela fonte de corrente da Figura 4.3.
Figura 4.3 – Exemplo de fonte de corrente de pulso.
21
Simulações com o acréscimo de um capacitor C4 em paralelo com o resistor R1
também foram realizadas (Figura 4.4). Na seção a seguir, as formas de onda obtidas de
ambos os circuitos (com e sem o capacitor C4) são apresentadas.
Figura 4.4 – Circuito elétrico com o acréscimo do capacitor C4 de 1µF.
4.2 – Simulação do circuito
A fonte de corrente de entrada do circuito tem os valores de I1 e I2 como 0 e
100 mA, respectivamente. Não foi utilizado atraso (TD = 0), os tempos de subida e
descida são de 10 µs, o comprimento de pulso é de 0,33 s (tempo aproximado de
duração da sístole) e o período tem duração de 1 s (tempo aproximado do ciclo cardíaco
completo). Sua forma de onda pode ser observada na Figura 4.4.
Figura 4.5 – Forma de onda da fonte de corrente.
As formas de onda das tensões em cima de R1, do ramo contendo C1 e R2 e de
R4 para ambos os circuitos (sem e com o capacitor C4) são apresentadas nas figuras a
seguir.
22
Figura 4.6 – Tensão em R1 sem C4.
Figura 4.7 – Tensão em R1 com C4.
Figura 4.8 – Tensão no ramo contendo C1 e R2 sem C4.
23
Figura 4.9 – Tensão no ramo contendo C1 e R2 com C4.
Figura 4.10 – Tensão em R4 sem C4.
Figura 4.11 – Tensão em R4 com C4.
24
Vários valores de C4 foram simulados com o intuito de aumentar o ponto de
inflexão da pressão aórtica (“ombro” esquerdo na Figura 4.11), de forma a ficar similar
à pressão real (Figura 2.6). Porém, os valores de tensão máxima e mínima (equivalentes
às pressões sistólica e diastólica, respectivamente) tornaram-se mais próximas, o que é
indesejado. Então, optou-se por manter o capacitor C4 com valor de 1µF, onde a queda
de tensão em R1 não é tão abrupta e a diferença entre as tensões em R4 mantém-se
praticamente inalterada.
Para a simulação da variação da resistência periférica foi implementado um
algoritmo em MATLAB. Através do método dos trapézios de integração numérica são
feitas aproximações dos elementos dinâmicos de forma que o circuito resultante seja
aproximado como resistivo e seja facilmente resolvido. O método dos trapézios é muito
mais preciso que os de Euler (Backward e Forward), apesar de apresentar um pequeno
erro na frequência, e, aproximadamente, não modifica as perdas no circuito, porém gera
memória falsa de corrente nos capacitores e de tensão nos indutores.
Para o diodo foi adotado um modelo de um resistor em paralelo com uma fonte
de corrente, cujo valor depende da diferença de tensão do instante anterior entre os nós
a que está conectada. Esta aproximação permitiu simulações muito mais rápidas do que
as que necessitam de diversas iterações para alcançar a convergência da linearização do
circuito (por exemplo, o método de Newton-Raphson).
25
Capítulo 5
Resultados
Nesta seção são apresentados os resultados obtidos através da simulação do
circuito realizada pelos códigos escritos no MATLAB anexados no final deste trabalho.
5.1 – Formas de onda obtidas com o algoritmo
Adotando os mesmos valores de componentes utilizados na simulação feita no
OrCAD, incluindo C4, foram obtidas as seguintes formas de onda:
Figura 5.1 – Forma de onda da fonte de corrente.
Figura 5.2 – Tensão em R1.
26
A forma de onda da tensão sobre o resistor R1 (Figura 5.2) apresentou algumas
diferenças em relação à obtida pela simulação no OrCAD (Figura 4.7). O novo sinal
contém um nível DC somado ao caráter transitório da onda, com uma diferença entre o
máximo e o mínimo menor em comparação com a outra, apesar de apresentar um valor
máximo maior, e a descarga apresenta uma oscilação não observada no outro caso. O
motivo destas diferenças está no modelo adotado para o diodo. Sem a presença do
“isolamento” que ocorre no caso real, onde R1 e C4 são “separados” do resto do
circuito no instante em que a fonte de corrente é desligada e toda tensão armazenada no
capacitor C4 é descarregada no resistor R1, a presença dos outros elementos resulta
nestas características observadas.
Figura 5.3 – Tensão no ramo contendo C1 e R2.
Figura 5.4 – Tensão em R4.
27
As formas de onda das tensões do ramo contendo C1 e R2 e do contendo R4,
obtidas na simulação do código construído no MATLAB, se assemelham as do OrCAD,
apresentando uma pequena diferença no valor da tensão.
5.2 – Variação de R4
Após a reprodução dos resultados encontrados através do software de simulação
de circuitos, introduziu-se a variação do resistor R4, representando a variação na
resistência periférica. Neste momento, ainda não há a presença do controle da tensão de
saída. Exemplos de variações da forma de onda podem ser observados a seguir.
Figura 5.5 – Tensão em R4 com resistência variando de 1590Ω a 1690Ω.
Figura 5.6 – Tensão em R4 com resistência variando de 1590Ω a 2090Ω.
28
Figura 5.7 – Tensão em R4 com resistência variando de 1590Ω a 1490Ω.
Figura 5.8 – Tensão em R4 com resistência variando de 1590Ω a 1090Ω.
Os resultados das variações condizem com o esperado, como é demonstrado pela
associação das equações (2.3) e (2.4):
(5.1)
Como a frequência cardíaca e o volume sistólico não se alteraram (a forma de
onda da fonte de corrente manteve-se a mesma), o débito cardíaco (equivalente da
corrente) permaneceu constante. Uma variação da resistência periférica (cujo
equivalente é o resistor R4), portanto, resulta na variação da pressão arterial
(equivalente da tensão) de forma a manter o débito cardíaco constante. A introdução do
29
controle tem, então, a finalidade de tornar o sistema hidráulico mais próximo do
circulatório real que evita a variação de pressão.
5.3 – Introdução do controle
Antes da elaboração de uma lei de controle, algumas considerações foram feitas.
Como a bomba por pistão é composta por materiais rígidos, ela não se estica para
comportar um aumento de volume como ocorre no coração, desta forma, optou-se por
realizar apenas alterações no período de relaxamento do bombeamento (período
diastólico). Um limite de 0,66 s foi adotado como período mínimo do ciclo cardíaco,
sendo uma metade correspondente à sístole (que permanece inalterada) e a outra à
diástole.
Com o auxílio do OrCAD, foram feitas as medidas de tensão para diversos
valores do resistor R4 e, posteriormente, foram feitos ajustes no período da fonte de
corrente de forma a obter uma tensão aproximadamente igual em todos os casos (a
medida foi realizada nos máximos locais mais próximos possíveis, com variação entre
58,907 s e 59,773 s, e a tensão obtida foi entre 60,420V e 60,423V). Com estes valores
em mãos (apresentados na Tabela 5.1), realizou-se uma regressão linear com o auxílio
do software Excel.
Após a regressão linear foi proposta a seguinte lei de controle:
(5.2)
Onde:
T = período da fonte de corrente
CL = coeficiente linear
CA = coeficiente angular
VR4 = tensão no resistor R4
Os coeficientes linear e angular, obtidos pela regressão, foram, respectivamente,
-0,297243246 e 0,021477327.
Os resultados obtidos com este controle são mostrados nas figuras a seguir. Em
azul estão as formas de onda sem a introdução do controle e em vermelho as formas de
onda com o controle.
30
5.1 – Tabela com valores utilizados para a criação da lei de controle
Vmax (V) para T =
T (s) para Vmax ≈ T (s) após regressão
R4 (Ω)
1s
60,421 V
linear
990
41,006
0,586200000
0,583456022
1090
44,245
0,654469500
0,653021084
1190
47,47
0,723200000
0,722285463
1290
50,692
0,791350000
0,791485411
1390
53,911
0,860575200
0,860620926
1490
57,213
0,930800000
0,931539059
1500
57,527
0,937683200
0,938282940
1510
57,856
0,944585823
0,945348981
1520
58,162
0,951470000
0,951921043
1530
58,489
0,958437000
0,958944129
1540
58,82
0,965246500
0,966053124
1550
59,129
0,972200000
0,972689618
1560
59,457
0,979126050
0,979734181
1570
59,782
0,986185000
0,986714312
1580
60,101
0,993050000
0,993565580
1590
60,421
1,000000000
1,000438324
1600
60,736
1,006923206
1,007203682
1610
61,065
1,013817848
1,014269723
1620
61,384
1,020800000
1,021120990
1630
61,702
1,027600000
1,027950780
1640
62,03
1,034550000
1,034995343
1650
62,341
1,041500000
1,041674792
1660
62,672
1,048332542
1,048783787
1670
62,996
1,055300000
1,055742441
1680
63,307
1,062214300
1,062421890
1690
63,633
1,069100550
1,069423498
1790
66,721
1,135600000
1,135745484
1890
69,909
1,204650000
1,204215202
1990
73,093
1,273500000
1,272599011
2090
76,274
1,342400000
1,340918388
2190
79,444
1,411300000
1,409001514
31
Figura 5.9 – Tensão em R4 com resistência variando de 1590Ω a 1690Ω e com controle
(visão completa do ciclo).
Figura 5.10 – Tensão em R4 com resistência variando de 1590Ω a 1690Ω e com
controle.
Figura 5.11 – Tensão em R4 com resistência variando de 1590Ω a 2090Ω e com
controle.
32
Figura 5.12 – Tensão em R4 com resistência variando de 1590Ω a 1490Ω e com
controle.
Figura 5.13 – Tensão em R4 com resistência variando de 1590Ω a 1090Ω e com
controle.
O controle não se mostrou muito eficaz para grandes variações, mesmo estas
sendo previstas de não ocorrerem nos testes. Mas, para estes casos, foi proposta a
inclusão de mais duas retas de mesmo coeficiente linear, porém com diferentes
coeficientes angulares, obtidas de forma empírica. O resultado pode ser conferido nas
figuras a seguir.
33
Figura 5.14 – Tensão em R4 com resistência variando de 1590Ω a 2090Ω e com novo
controle.
Figura 5.15 – Tensão em R4 com resistência variando de 1590Ω a 1090Ω e com novo
controle.
As formas de onda obtidas com o controle apresentaram diferenças entre os
valores máximos e mínimos conforme o esperado, uma vez que a alteração no período
de diástole altera a descarga da energia armazenada.
34
Capítulo 6
Conclusão
Neste trabalho foi realizada uma simulação de um circuito, com resultados
similares aos obtidos com softwares específicos, porém com a vantagem de realizar a
variação de valores de componentes e observar as suas consequências conforme elas
ocorreram.
O sistema cardiovascular apresenta diversos mecanismos complexos que se
combinam de forma a regular a função cardíaca para diversas situações e manter a
pressão arterial a mais adequada possível para atender a demanda dos órgãos. O
presente trabalho limitou-se a apenas uma forma de controle devido às restrições do que
pode ser implementado em curto prazo no circuito hidráulico existente.
O controle adotado se restringiu à variação do período de diástole, uma vez que
a bomba utilizada no circuito hidráulico é rígida e, portanto, não permite uma variação
de volume como ocorre no caso real, devendo, então, uma alteração no tempo de sístole
da simulação ser acompanhada de uma alteração na intensidade de bombeamento para
manter o volume constante.
Os resultados obtidos foram satisfatórios para as limitações existentes. Havendo
a necessidade de simular casos reais extremos, com grandes variações de pressão,
algumas alterações no circuito hidráulico seriam necessárias como a capacidade de
expansão do volume da câmara da bomba e o controle do dimensionamento dos
volumes na unidade viscoelástica.
Para trabalhos futuros ficam a integração do controle ao sistema hidráulico,
podendo ser feitas possíveis melhorias em relação ao proposto neste trabalho, e a
implementação das alterações sugeridas.
35
Bibliografia
[1] FRANÇA, B. R., Circuito Hidráulico Mimetizador de Ejeção do Ventrículo
Esquerdo e da Pressão no Interior da Aorta. Dissertação de M.Sc., COPPE/UFRJ,
Rio de Janeiro, RJ, Brasil, Junho 2011.
[2] CARVALHO, C. P., Modelagem Elétrica e Mecânica do Fluxo da Artéria
Coronária Esquerda. Dissertação de M.Sc., COPPE/UFRJ, Rio de Janeiro, RJ,
Brasil, Novembro 2012.
[3] GUYTON, A. C., HALL, J. E., Textbook of Medical Physiology. 11ed. Philadelphia,
Pennsylvania, Elsevier Saunders, 2006.
[4] TUSZYNSKI, J. A., KURZYNSKI, M., Introduction to Molecular Biophysics,
chapter Tissue and Organ Biophysics. Boca Raton, Florida, CRC Press LLC, pp.
341-393, 2003.
[5] KLABUNDE, R. E., Cardiovascular Physiology Concepts. Philadelphia,
Pennsylvania, Lippincott Williams & Wilkins, 2005.
[6] BERGSON, H., “Measuring Pipe Flow Rate with an Ultrasonic Flow Meter”,
http://www.brighthubengineering.com/manufacturing-technology/66827measuring-pipe-flow-rate-with-an-ultrasonic-flow-meter/, 2010, (Acesso em 27 de
Junho de 2014).
[7] SILVA, F. A. M., Phantom de Fluxo Para Calibração de Fluxômetro Ultrassônico
Por Tempo de Trânsito. Dissertação de M.Sc., COPPE/UFRJ, Rio de Janeiro, RJ,
Brasil, Agosto de 2009.
[8] FRANÇA, B. R., MARTINS, V. C., CATUNDA, J. M. Y., PEREIRA, W.C.A., von
KRÜGER, M. A., “Circuito Hidráulico Mimetizador de Ejeção do Ventrículo
Esquerdo e de Pressão no Interior da Aorta”, Anais do XXII Congresso Brasileiro
de Engenharia Biomédica, v.1, pp. 375-378, Tiradentes, MG, Brasil, Novembro.
36
Anexo 1
Código feito em MATLAB com os resultados similares aos obtidos no OrCAD,
sem variação do resistor e sem a implementação de controle.
function [tempo, v1, v2, v3, I] = circuito1
%Funcao que simula o circuito eletrico equivalente ao sistema hidraulico
%Valores dos componentes
R1 = 0.1e6;
R2 = 34;
R3 = 0.16e6;
R4 = 1590;
C1 = 0.3e-3;
C2 = 1.1e-3;
C3 = 1e-3;
C4 = 1e-6;
L1 = 3;
%Condicoes iniciais dos componentes
vC1b = 0;
iC1b = 0;
vC2b = 0;
iC2b = 0;
vL1b = 0;
iL1b = 0;
vC3b = 0;
iC3b = 0;
vC4b = 0;
iC4b = 0;
%Vetor com os valores de corrente de entrada
I = zeros(1,600001);
37
I(1) = 0.1;
%Vetor com os valores das tensoes dos nos
v1 = zeros(1,600001);
v1(1) = vC4b;
v2 = zeros(1,600001);
v2(1) = vC1b;
v3 = zeros(1,600001);
v3(1) = vC2b;
%Incremento de tempo
dt = 1e-4;
%Indice do vetor
iVetor = 1;
%Vetor tempo
tempo = linspace(0,60,600001);
%Nos 1 e 2
v1b = 9.507*10^(-3);
v2b = 194.375*10^(-9);
for t = 0.0001:dt:60
iVetor = iVetor + 1;
auxI = floor(t);
if (t < auxI+0.33001)
I(iVetor) = 0.1;
else
I(iVetor) = 0;
end
%Diodo
vn = v1b - v2b;
38
G = 9.9855e-5/0.5424;
if (vn < 0.5424)
Id = -0.76e-6 - (vn*10^4)*(0.75e-6);
else
Id = 1.15e-6 + (vn*10^4)*(0.39e-6);
end
a11 = G + 1/R1 + 2*C4/dt;
a12 = -G;
a13 = 0;
a21 = -G;
a22 = G + dt/(2*L1) + (2*C1/dt)*(1 + 2*C1*R2/dt)^-1;
a23 = -dt/(2*L1);
a31 = 0;
a32 = -dt/(2*L1);
a33 = dt/(2*L1) + 2*C2/dt + 1/R4 + (2*C3/dt)*(1 + 2*C3*R3/dt)^-1;
b1 = I(iVetor) - Id + (2*C4/dt)*v1b + iC4b;
b2 = Id - iL1b -(dt/(2*L1))*vL1b +((2*C1/dt)*vC1b + iC1b)*(1 + 2*C1*R2/dt)^-1;
b3 = iL1b + iC2b + (dt/(2*L1))*vL1b + (2*C2/dt)*vC2b + ((2*C3/dt)*vC3b +
iC3b)*(1 + 2*C3*R3/dt)^-1;
A = [a11 a12 a13;a21 a22 a23;a31 a32 a33]; %Matriz de Condutancia
B = [b1; b2; b3]; %Vetor de Correntes
N1 = A;
N2 = A;
N3 = A;
for ilinha = 1:3
N1(ilinha, 1) = B(ilinha,1);
N2(ilinha, 2) = B(ilinha,1);
N3(ilinha, 3) = B(ilinha,1);
39
end
v1a = det(N1)/det(A);
v2a = det(N2)/det(A);
v3a = det(N3)/det(A);
iC1a = ((2*C1/dt)*(v2a - vC1b) - iC1b)*(1 + 2*C1*R2/dt)^-1;
iL1a = iL1b + (v2a - v3a + vL1b)*dt/(2*L1);
iC2a = (2*C2/dt)*(v3a - vC2b) - iC2b;
iC3a = ((2*C3/dt)*(v3a - vC3b) - iC3b)*(1 + 2*C3*R3/dt)^-1;
iC4a = (2*C4/dt)*(v1a - vC4b) - iC4b;
vC1b = v2a - R2*iC1a;
iC1b = iC1a;
vL1b = v2a - v3a;
iL1b = iL1a;
vC2b = v3a;
iC2b = iC2a;
vC3b = v3a - R3*iC3a;
iC3b = iC3a;
vC4b = v1a;
iC4b = iC4a;
v1b = v1a;
v2b = v2a;
v1(iVetor) = v1a;
v2(iVetor) = v2a;
v3(iVetor) = v3a;
end
40
Anexo 2
Código feito em MATLAB com os resultados similares aos obtidos no OrCAD,
com variação do resistor e sem a implementação de controle.
function [tempo, v3, I] = circuito2
%Funcao que simula o circuito eletrico equivalente ao sistema hidraulico
%R4 variável
%Valores dos componentes
R1 = 0.1e6;
R2 = 34;
R3 = 0.16e6;
C1 = 0.3e-3;
C2 = 1.1e-3;
C3 = 1e-3;
C4 = 1e-6;
L1 = 3;
%Condicoes iniciais dos componentes
vC1b = 0;
iC1b = 0;
vC2b = 0;
iC2b = 0;
vL1b = 0;
iL1b = 0;
vC3b = 0;
iC3b = 0;
vC4b = 0;
iC4b = 0;
%Vetor com os valores de corrente de entrada
I = zeros(1,600001);
I(1) = 0.1;
41
%Vetor com os valores da tensao de saida (no 3)
v3 = zeros(1,600001);
v3(1) = vC2b;
%Incremento de tempo
dt = 1e-4;
%Indice do vetor
iVetor = 1;
%Vetor tempo
tempo = linspace(0,60,600001);
%Nos 1 e 2
v1b = 9.507*10^(-3);
v2b = 194.375*10^(-9);
for t = 0.0001:dt:60
%R4
if (t < 20.0001)
R4 = 1590;
elseif (t > 20)&&(t < 30.0001)
R4 = 1590 + 10*dt;
else
R4 = 1690;
end
%Fonte de Corrente
iVetor = iVetor + 1;
auxI = floor(t);
if (t < auxI+0.33001)
I(iVetor) = 0.1;
else
42
I(iVetor) = 0;
end
%Diodo
vn = v1b - v2b;
G = 9.9855e-5/0.5424;
if (vn < 0.5424)
Id = -0.76e-6 - (vn*10^4)*(0.75e-6);
else
Id = 1.15e-6 + (vn*10^4)*(0.39e-6);
end
%Matriz de Condutancia
a11 = G + 1/R1 + 2*C4/dt;
a12 = -G;
a13 = 0;
a21 = -G;
a22 = G + dt/(2*L1) + (2*C1/dt)*(1 + 2*C1*R2/dt)^-1;
a23 = -dt/(2*L1);
a31 = 0;
a32 = -dt/(2*L1);
a33 = dt/(2*L1) + 2*C2/dt + 1/R4 + (2*C3/dt)*(1 + 2*C3*R3/dt)^-1;
A = [a11 a12 a13;a21 a22 a23;a31 a32 a33];
%Vetor de Correntes
b1 = I(iVetor) - Id + (2*C4/dt)*v1b + iC4b;
b2 = Id - iL1b -(dt/(2*L1))*vL1b +((2*C1/dt)*vC1b + iC1b)*(1 + 2*C1*R2/dt)^-1;
b3 = iL1b + iC2b + (dt/(2*L1))*vL1b + (2*C2/dt)*vC2b + ((2*C3/dt)*vC3b +
iC3b)*(1 + 2*C3*R3/dt)^-1;
B = [b1; b2; b3];
N1 = A;
43
N2 = A;
N3 = A;
for ilinha = 1:3
N1(ilinha, 1) = B(ilinha,1);
N2(ilinha, 2) = B(ilinha,1);
N3(ilinha, 3) = B(ilinha,1);
end
v1a = det(N1)/det(A);
v2a = det(N2)/det(A);
v3a = det(N3)/det(A);
iC1a = ((2*C1/dt)*(v2a - vC1b) - iC1b)*(1 + 2*C1*R2/dt)^-1;
iL1a = iL1b + (v2a - v3a + vL1b)*dt/(2*L1);
iC2a = (2*C2/dt)*(v3a - vC2b) - iC2b;
iC3a = ((2*C3/dt)*(v3a - vC3b) - iC3b)*(1 + 2*C3*R3/dt)^-1;
iC4a = (2*C4/dt)*(v1a - vC4b) - iC4b;
vC1b = v2a - R2*iC1a;
iC1b = iC1a;
vL1b = v2a - v3a;
iL1b = iL1a;
vC2b = v3a;
iC2b = iC2a;
vC3b = v3a - R3*iC3a;
iC3b = iC3a;
vC4b = v1a;
iC4b = iC4a;
v1b = v1a;
v2b = v2a;
v3(iVetor) = v3a;
end
44
Anexo 3
Código feito em MATLAB com os resultados similares aos obtidos no OrCAD,
com variação do resistor e com a implementação de controle.
function [tempo, v3, I] = circuito3
%Funcao que simula o circuito eletrico equivalente ao sistema hidráulico
%R4 variável
%Fonte de Corrente com controle
%vAux sendo zerado para notar a queda de tensão
%Valores dos componentes
R1 = 0.1e6;
R2 = 34;
R3 = 0.16e6;
C1 = 0.3e-3;
C2 = 1.1e-3;
C3 = 1e-3;
C4 = 1e-6;
L1 = 3;
%Condicoes iniciais dos componentes
vC1b = 0;
iC1b = 0;
vC2b = 0;
iC2b = 0;
vL1b = 0;
iL1b = 0;
vC3b = 0;
iC3b = 0;
vC4b = 0;
iC4b = 0;
%Vetor com os valores de corrente de entrada
45
I = zeros(1,600001);
I(1) = 0.1;
%Vetor com os valores da tensao de saida (no 3)
v3 = zeros(1,600001);
v3(1) = vC2b;
%Incremento de tempo
dt = 1e-4;
%Indice do vetor
iVetor = 1;
%Vetor tempo
tempo = linspace(0,60,600001);
%Nos 1 e 2
v1b = 9.507*10^(-3);
v2b = 194.375*10^(-9);
%Período da Fonte de Corrente
T = 1;
Taux = 0.6699;
%Sensor de Tensão
vAux = 59.27;
%Reta de Controle
a = -0.297243246;
b = 0.021477327;
for t = 1e-4:dt:60
%R4
46
if (t < 30.0001)
R4 = 1590;
elseif (t > 30)&&(t < 40.0001)
R4 = 1590 + 10*dt;
else
R4 = 1690;
end
%Fonte de Corrente
iVetor = iVetor + 1;
if (t < 20.0001)
auxI = floor(t);
if (t < auxI+0.3301)
I(iVetor) = 0.1;
else
I(iVetor) = 0;
end
elseif (T < dt)
y = (a + b*vAux)*1e4;
T = (1e-4)*floor(y);
if (T < 0.6601)
T = 0.66;
end
Taux = T - 0.3301;
I(iVetor) = 0.1;
vAux = 0;
else
if (T > Taux)
I(iVetor) = 0.1;
else
I(iVetor) = 0;
end
T = T - dt;
end
47
%Diodo
vn = v1b - v2b;
G = 9.9855e-5/0.5424;
if (vn < 0.5424)
Id = -0.76e-6 - (vn*10^4)*(0.75e-6);
else
Id = 1.15e-6 + (vn*10^4)*(0.39e-6);
end
a11 = G + 1/R1 + 2*C4/dt;
a12 = -G;
a13 = 0;
a21 = -G;
a22 = G + dt/(2*L1) + (2*C1/dt)*(1 + 2*C1*R2/dt)^-1;
a23 = -dt/(2*L1);
a31 = 0;
a32 = -dt/(2*L1);
a33 = dt/(2*L1) + 2*C2/dt + 1/R4 + (2*C3/dt)*(1 + 2*C3*R3/dt)^-1;
A = [a11 a12 a13;a21 a22 a23;a31 a32 a33]; %Matriz de Condutancia
b1 = I(iVetor) - Id + (2*C4/dt)*v1b + iC4b;
b2 = Id - iL1b -(dt/(2*L1))*vL1b +((2*C1/dt)*vC1b + iC1b)*(1 + 2*C1*R2/dt)^-1;
b3 = iL1b + iC2b + (dt/(2*L1))*vL1b + (2*C2/dt)*vC2b + ((2*C3/dt)*vC3b +
iC3b)*(1 + 2*C3*R3/dt)^-1;
B = [b1; b2; b3]; %Vetor de Correntes
N1 = A;
N2 = A;
N3 = A;
for ilinha = 1:3
N1(ilinha, 1) = B(ilinha,1);
N2(ilinha, 2) = B(ilinha,1);
48
N3(ilinha, 3) = B(ilinha,1);
end
v1a = det(N1)/det(A);
v2a = det(N2)/det(A);
v3a = det(N3)/det(A);
iC1a = ((2*C1/dt)*(v2a - vC1b) - iC1b)*(1 + 2*C1*R2/dt)^-1;
iL1a = iL1b + (v2a - v3a + vL1b)*dt/(2*L1);
iC2a = (2*C2/dt)*(v3a - vC2b) - iC2b;
iC3a = ((2*C3/dt)*(v3a - vC3b) - iC3b)*(1 + 2*C3*R3/dt)^-1;
iC4a = (2*C4/dt)*(v1a - vC4b) - iC4b;
vC1b = v2a - R2*iC1a;
iC1b = iC1a;
vL1b = v2a - v3a;
iL1b = iL1a;
vC2b = v3a;
iC2b = iC2a;
vC3b = v3a - R3*iC3a;
iC3b = iC3a;
vC4b = v1a;
iC4b = iC4a;
v1b = v1a;
v2b = v2a;
v3(iVetor) = v3a;
if vAux < v3a
vAux = v3a;
end
end
49
Anexo 4
Código feito em MATLAB com os resultados similares aos obtidos no OrCAD,
com variação do resistor e com a implementação de controle para grandes variações.
function [tempo, v3, I] = circuito4
%Funcao que simula o circuito eletrico equivalente ao sistema hidraulico
%R4 variável
%Fonte de Corrente com controle
%vAux sendo zerado para notar a queda de tensao
%3 retas de controle
%Valores dos componentes
R1 = 0.1e6;
R2 = 34;
R3 = 0.16e6;
C1 = 0.3e-3;
C2 = 1.1e-3;
C3 = 1e-3;
C4 = 1e-6;
L1 = 3;
%Condicoes iniciais dos componentes
vC1b = 0;
iC1b = 0;
vC2b = 0;
iC2b = 0;
vL1b = 0;
iL1b = 0;
vC3b = 0;
iC3b = 0;
vC4b = 0;
iC4b = 0;
50
%Vetor com os valores de corrente de entrada
I = zeros(1,600001);
I(1) = 0.1;
%Vetor com os valores da tensao de saida (no 3)
v3 = zeros(1,600001);
v3(1) = vC2b;
%Incremento de tempo
dt = 1e-4;
%Indice do vetor
iVetor = 1;
%Vetor tempo
tempo = linspace(0,60,600001);
%Nos 1 e 2
v1b = 9.507*10^(-3);
v2b = 194.375*10^(-9);
%Período da Fonte de Corrente
T = 1;
Taux = 0.6699;
%Sensor de Tensão
vAux = 59.27;
ctrl = 0;
%Reta de Controle
a = -0.297243246;
b = 0.021477327;
c = 0.02618;
d = 0.014;
51
for t = 1e-4:dt:60
%R4
if (t < 30.0001)
R4 = 1590;
elseif (t > 30)&&(t < 40.0001)
R4 = 1590 + 50*dt;
else
R4 = 2090;
end
iVetor = iVetor + 1;
if (t < 20.0001)
auxI = floor(t);
if (t < auxI+0.3301)
I(iVetor) = 0.1;
else
I(iVetor) = 0;
end
elseif (T < dt)
if (vAux > 60.2)
y = (a + c*vAux)*1e4;
elseif (vAux < 59.5)&&(ctrl < 1)||(vAux < 59.8)&&(ctrl >0)
y = (a + d*vAux)*1e4;
else
y = (a + b*vAux)*1e4;
end
T = (1e-4)*floor(y);
if (T < 0.6601)
T = 0.66;
ctrl = 1;
52
end
Taux = T - 0.3301;
I(iVetor) = 0.1;
vAux = 0;
else
if (T > Taux)
I(iVetor) = 0.1;
else
I(iVetor) = 0;
end
T = T - dt;
end
%Diodo
vn = v1b - v2b;
G = 9.9855e-5/0.5424;
if (vn < 0.5424)
Id = -0.76e-6 - (vn*10^4)*(0.75e-6);
else
Id = 1.15e-6 + (vn*10^4)*(0.39e-6);
end
a11 = G + 1/R1 + 2*C4/dt;
a12 = -G;
a13 = 0;
a21 = -G;
a22 = G + dt/(2*L1) + (2*C1/dt)*(1 + 2*C1*R2/dt)^-1;
a23 = -dt/(2*L1);
a31 = 0;
a32 = -dt/(2*L1);
a33 = dt/(2*L1) + 2*C2/dt + 1/R4 + (2*C3/dt)*(1 + 2*C3*R3/dt)^-1;
A = [a11 a12 a13;a21 a22 a23;a31 a32 a33]; %Matriz de Condutancia
53
b1 = I(iVetor) - Id + (2*C4/dt)*v1b + iC4b;
b2 = Id - iL1b -(dt/(2*L1))*vL1b +((2*C1/dt)*vC1b + iC1b)*(1 + 2*C1*R2/dt)^-1;
b3 = iL1b + iC2b + (dt/(2*L1))*vL1b + (2*C2/dt)*vC2b + ((2*C3/dt)*vC3b +
iC3b)*(1 + 2*C3*R3/dt)^-1;
B = [b1; b2; b3]; %Vetor de Correntes
N1 = A;
N2 = A;
N3 = A;
for ilinha = 1:3
N1(ilinha, 1) = B(ilinha,1);
N2(ilinha, 2) = B(ilinha,1);
N3(ilinha, 3) = B(ilinha,1);
end
v1a = det(N1)/det(A);
v2a = det(N2)/det(A);
v3a = det(N3)/det(A);
iC1a = ((2*C1/dt)*(v2a - vC1b) - iC1b)*(1 + 2*C1*R2/dt)^-1;
iL1a = iL1b + (v2a - v3a + vL1b)*dt/(2*L1);
iC2a = (2*C2/dt)*(v3a - vC2b) - iC2b;
iC3a = ((2*C3/dt)*(v3a - vC3b) - iC3b)*(1 + 2*C3*R3/dt)^-1;
iC4a = (2*C4/dt)*(v1a - vC4b) - iC4b;
vC1b = v2a - R2*iC1a;
iC1b = iC1a;
vL1b = v2a - v3a;
iL1b = iL1a;
vC2b = v3a;
iC2b = iC2a;
vC3b = v3a - R3*iC3a;
iC3b = iC3a;
54
vC4b = v1a;
iC4b = iC4a;
v1b = v1a;
v2b = v2a;
v3(iVetor) = v3a;
if vAux < v3a
vAux = v3a;
end
end
55