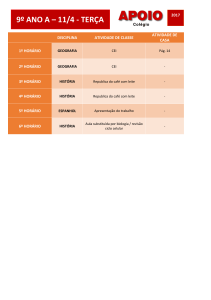
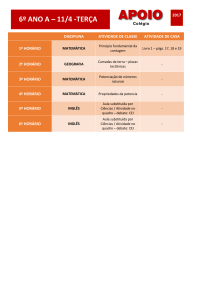
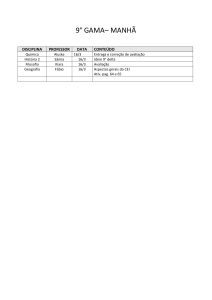
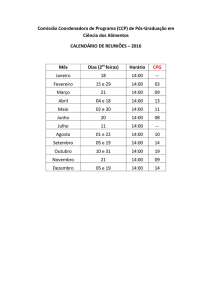
IMPLEMENTANDO
ESTUDOS ADAPTATIVOS
[email protected]
[email protected]
Vida real adaptativa
- Aichner et al (Stroke,1998)
Hypervolemic hemodilution vs placebo in Acute Ischaemic
Stroke (MAHST study)
- Madisch et al (Arzneim.-Forsch, 1999)
Peppermint/Caraway Oil vs Cisapride in Dyspepsia
- Kalb et al (Pharmacopsychiatry, 2001).
St John’s Wort vs Placebo in Depression
- Pffafenrath et al (Cephalgia, 2002).
Tanacetum parthenium in Migraine Prophylaxis
- Matthys et al (Phytomedicine, 2003)
Pelagomium sidoides vs placebo in acute bronchitis
- Idenmann et al (Gastroenterology, 2004)
Ciproxafloxacin/metroidazole vs placebo in prophylactic
necrotizing pancreatitis
Introdução
• Custos dos ensaios clínicos
• Tempo gasto no desenvolvimento do novo
fármaco
Estudos Clínicos
Testes Pré
Clínicos
Anos
Amostras
médias
6,5
F
D
A
Fase I
Fase II
Fase III
1,5
2
3,5
100 a 500
pacientes
1000 a 5000
pacientes
20 a 100
saudáveis
F
D
A
Fase IV
Estudos
adicionais
pós
aprovação
Introdução
• Custos dos ensaios clínicos
• Tempo gasto no desenvolvimento do novo
fármaco
• Valores éticos
• Dificuldades dos ensaios
Racional
O estudo adaptativo deve ter o seu delineamento
definido desde o início, e não ser decorrente de
uma alteração posterior
Racional
O estudo adaptativo deve ter o seu delineamento
definido desde o início, e não ser decorrente de
uma alteração posterior
Adaptativo é uma característica do delineamento
e não uma emenda de um planejamento mal feito
Definição
• Delineamento adaptativo utiliza os dados
acumulados para decidir como modificar
aspectos do estudo mantendo a validade e
integridade do estudo
Princípios
Validade
• Prover correta inferência estatística
• Assegurar consistência entre diferentes
estágios do estudo
• Diminuir viés
operacional
Princípios
Validade
Integridade
• Prover correta inferência estatística
• Prover resultados convincentes
• Assegurar consistência entre diferentes
estágios do estudo
• Planejamento prévio
baseado em adaptações pretendidas
• Diminuir viés
operacional
• Manter confidencialidade dos dados
Requisitos
• Acesso aos dados acumulados
• Ter regras
Alocação
Amostra
Interrupção
Decisão
• Redelineamento nos estágios previamente
definidos
Estrutura do delineamento
Estudo central
análise
Estrutura do delineamento
Estudo central
CIMD
CEI
Comitê científico
de pesquisa
análise
recomendação
decisão
Estudo com uma análise interina
análise
CIMD – Comite Independente de Monitoramento de Dados
CEI – Centro Independente de Estatística
Estrutura do delineamento
Estudo central
CIMD
CEI
análise
recomendação
Comitê científico
de pesquisa
decisão
Estudo com uma análise interina
n análises interinas
CIMD
CEI
CIMD
recomendação
Comitê científico
de pesquisa
decisão
CEI
Comitê científico
de pesquisa
Estudo adaptativo
análise
recomendação
decisão
análise
Quem está habilitado a ver os dados
CEI
Ficha
Clinica
•
•
•
•
•
CIMD ECNP
CCP
TE
s
CEI
– Centro Independente de Estatística
CIMD – Comite Independente de Monitoramento de Dados
ECNP – Estatístico interno não participante do projeto
CCP
– Comite Científico de Pesquisa
TE
– Time de estudo
PESQ/PAC
Quem está habilitado a ver os dados
CEI
Ficha
Clinica
CIMD ECNP
CCP
TE
s
Análise
dos dados
•
•
•
•
•
PESQ/PAC
CEI
– Centro Independente de Estatística
CIMD – Comite Independente de Monitoramento de Dados
ECNP – Estatístico interno não participante do projeto
CCP
– Comite Científico de Pesquisa
TE
– Time de estudo
n
Quem está habilitado a ver os dados
CEI
Ficha
Clinica
CIMD ECNP
CCP
TE
s
Análise
dos dados
Análise dos
Grupos
•
•
•
•
•
PESQ/PAC
CEI
– Centro Independente de Estatística
CIMD – Comite Independente de Monitoramento de Dados
ECNP – Estatístico interno não participante do projeto
CCP
– Comite Científico de Pesquisa
TE
– Time de estudo
n
Quem está habilitado a ver os dados
CEI
Ficha
Clinica
CIMD ECNP
CCP
TE
s
Análise
dos dados
Análise dos
Grupos
Análise interina
Do que está em
Análise
•
•
•
•
•
PESQ/PAC
CEI
– Centro Independente de Estatística
CIMD – Comite Independente de Monitoramento de Dados
ECNP – Estatístico interno não participante do projeto
CCP
– Comite Científico de Pesquisa
TE
– Time de estudo
n
Quem está habilitado a ver os dados
CEI
Ficha
Clinica
CIMD ECNP
CCP
TE
s
Análise
dos dados
Análise dos
Grupos
Análise interina
Do que está em
Análise
Recomendações
CIMD
•
•
•
•
•
PESQ/PAC
CEI
– Centro Independente de Estatística
CIMD – Comite Independente de Monitoramento de Dados
ECNP – Estatístico interno não participante do projeto
CCP
– Comite Científico de Pesquisa
TE
– Time de estudo
n
Características
Alocação - Randomização:
• Blocos (clássica)
Características
Alocação - Randomização:
• Blocos (clássica)
• Adaptação covariada
(ponderada, conhece previamente a covariância)
Características
Alocação - Randomização:
• Blocos (clássica)
• Adaptação covariada
(ponderada, conhece previamente a covariância)
• Adaptação conforme resposta
Características
Alocação - Randomização:
• Blocos (clássica)
• Adaptação covariada
(ponderada, conhece previamente a covariancia)
• Adaptação conforme resposta
• Play the winner
(O próximo paciente terá mais chance de ser alocado no grupo com melhor resposta)
Características
Alocação - Randomização:
• Blocos (clássica)
• Adaptação covariada
(ponderada, conhece previamente a covariancia)
• Adaptação conforme resposta
• Play the winner
(O próximo paciente terá mais chance de ser alocado no grupo com melhor resposta)
• Bandit
(Após um paciente com resposta negativa, o próximo paciente terá mais chance de
ser alocado no outro grupo)
Características
Alocação - Randomização:
• Blocos (clássica)
• Adaptação covariada
(ponderada, conhece previamente a covariancia)
• Adaptação conforme resposta
• Play the winner
(O próximo paciente terá mais chance de ser alocado no grupo com melhor resposta)
• Bandit
(Após um paciente com resposta negativa, o próximo paciente terá mais chance de
ser alocado no outro grupo)
• Up-and-down
(Ajuste a cada paciente. Se a dose utilizada apresentar resposta positiva a dose é
reduzida, se tem, evento adverso, ou super-dosagem a próxima dose será menor e se não
tiver resposta a próxima dose será maior)
Características
Alocação - Randomização:
• Blocos (clássica)
• Adaptação covariada
(ponderada, conhece previamente a covariancia)
• Adaptação conforme resposta
• Play the winner
(O próximo paciente terá mais chance de ser alocado no grupo com melhor resposta)
• Bandit
(Após um paciente com resposta negativa, o próximo paciente terá mais chance de
ser alocado no outro grupo)
• Up-and-down
(Ajuste a cada paciente. Se a dose utilizada apresentar resposta positiva a dose é
reduzida, se tem, evento adverso, ou super-dosagem a próxima dose será menor e se não
tiver resposta a próxima dose será maior)
• Bayesiana
(randomização ponderada – baseado em probabilidade estimada)
Características
Alocação - Randomização:
• Blocos (clássica)
• Adaptação covariada
Cegamento
(ponderada, conhece previamente a covariancia)
• Adaptação conforme resposta
• Play the winner
(O próximo paciente terá mais chance de ser alocado no grupo com melhor resposta)
• Bandit
(Após um paciente com resposta negativa, o próximo paciente terá mais chance de
ser alocado no outro grupo)
• Up-and-down
(Ajuste a cada paciente. Se a dose utilizada apresentar resposta positiva a dose é
reduzida, se tem, evento adverso, ou super-dosagem a próxima dose será menor e se não
tiver resposta a próxima dose será maior)
• Bayesiana
(randomização ponderada – baseado em probabilidade estimada)
Características
Tamanho amostral:
(Pode requerer ajuste de p e precisa assegurar poder)
• Fixo (clássica)
Características
Tamanho amostral:
(Pode requerer ajuste de p e precisa assegurar poder)
• Fixo (clássica)
• Estimada por estágios de tamanhos fixos
X meses
Y pacientes
alocados
X meses
X meses
Y pacientes Y pacientes
alocados
alocados
Tempo
Características
Tamanho amostral:
(Pode requerer ajuste de p e precisa assegurar poder)
• Fixo (clássica)
• Estimada por estágios de tamanhos fixos
• Estimada paciente a paciente
Características
Tamanho amostral:
(Pode requerer ajuste de p e precisa assegurar poder)
•
•
•
•
Fixo (clássica)
Estimada por estágios de tamanhos fixos
Estimada paciente a paciente
Estimada após incrementos de informação fixa
Y resultados Y resultados Y resultados
X meses
Y pacientes
alocados
X meses
X meses
Y pacientes Y pacientes
alocados
alocados
Tempo
Características
Tamanho amostral:
(Pode requerer ajuste de p e precisa assegurar poder)
•
•
•
•
•
Fixo (clássica)
Estimada por estágios de tamanhos fixos
Estimada paciente a paciente
Estimada após incrementos de informação fixa
Estimada por estágios
(o tamanho do próximo estágio é calculado a partir do resultado do estágio
anterior)
Características
Tamanho amostral:
(Pode requerer ajuste de p e precisa assegurar poder)
•
•
•
•
•
Fixo (clássica)
Estimada por estágios de tamanhos fixos
Estimada paciente a paciente
Estimada após incrementos de informação fixa
Estimada por estágios
(o tamanho do próximo estágio é calculado a partir do resultado do estágio
anterior)
• Inclusão de novos grupos com doses maiores, ou
menores se a eficácia e/ou toxicidade permitir
Características
Interrupções precoces:
• Eficácia
• “Futility”
(Aumentar o tamanho amostral não irá acrescentar ao
resultado já obtido)
• Segurança
Características
Delineamento (Objetivos, grupos, exames,
visitas):
• Fixo – os caminhos já são pré-definidos
• Mudar após análise interina
(sugerida pelo comite científico de pesquisa, não envolvida no
gerenciamento do projeto de pesquisa, com base em parâmetros pré
definidos)
• Segurança (Fase II, II/III e IV)
• Variável resposta
• Fase II
• Doenças novas
Aprender, selecionar e confirmar
• O objetivo primário é combinar aprendizado e confirmarção num único
estudo
• Durante o ensaio, selecionar o melhor tratamento baseado na análise interina
• Admissão continua sem interrupção, agora só para o tratamento selecionado
e controles
• A análise final é baseada em dados dos tratamentos selecionados e controle
usando método freqüentista, combinando evidência ao longo dos dois estágios
• O falso positivo é controlado e a integridade do estudo deve ser mantida
Aprender, selecionar e confirmar
• O objetivo primário é combinar aprendizado e confirmarção num único
estudo
• Durante o ensaio, selecionar o melhor tratamento baseado na análise interina
• Admissão continua sem interrupção, agora só para o tratamento selecionado
e controles
• A análise final é baseada em dados dos tratamentos selecionados e controle
usando método freqüentista, combinando evidência ao longo dos dois estágios
• O falso positivo é controlado e a integridade do estudo deve ser mantida
APRENDIZADO
A
B
C
D
CONTROLE
CONFIRMAÇÃO
Planejamento
e delineamento
fase III
Aprender, selecionar e confirmar
• O objetivo primário é combinar aprendizado e confirmarção num único
estudo
• Durante o ensaio, selecionar o melhor tratamento baseado na análise interina
• Admissão continua sem interrupção, agora só para o tratamento selecionado
e controles
• A análise final é baseada em dados dos tratamentos selecionados e controle
usando método freqüentista, combinando evidência ao longo dos dois estágios
• O falso positivo é controlado e a integridade do estudo deve ser mantida
APRENDIZADO
A
B
C
D
CONTROLE
A
B
C
D
CONTROLE
CONFIRMAÇÃO
Planejamento
e delineamento
fase III
Aprendendo, selecionando e confirmando
Características
• Redução no tempo de desenvolvimento do fármaco
• Uso agrupando as fases do desenvolvimento (I/II ou II/III)
Estágio de aprendizado seguido de estágio
confirmatório
Se a probabilidade estimada parece boa expande-se
para a fase seguinte
Características
• Redução no tempo de desenvolvimento do fármaco
• Uso agrupando as fases do desenvolvimento (I/II ou II/III)
Estágio de aprendizado seguido de estágio
confirmatório
Se a probabilidade estimada parece boa expande-se
para a fase seguinte
Resposta
Fase II
6 meses
Características
• Redução no tempo de desenvolvimento do fármaco
• Uso agrupando as fases do desenvolvimento (I/II ou II/III)
Estágio de aprendizado seguido de estágio
confirmatório
Se a probabilidade estimada parece boa expande-se
para a fase seguinte
Vantagem
boa
Resposta
Fase II
6 meses
9 a 12 meses
Características
• Redução no tempo de desenvolvimento do fármaco
• Uso agrupando as fases do desenvolvimento (I/II ou II/III)
Estágio de aprendizado seguido de estágio
confirmatório
Se a probabilidade estimada parece boa expande-se
para a fase seguinte
Vantagem
boa
Resposta
Fase II
6 meses
Fase III
9 a 12 meses
> 2 anos
Características
• Redução no tempo de desenvolvimento do fármaco
• Uso agrupando as fases do desenvolvimento (I/II ou II/III)
Estágio de aprendizado seguido de estágio
confirmatório
Se a probabilidade estimada parece boa expande-se
para a fase seguinte
Vantagem
lançamento
boa
Resposta
Fase II
6 meses
Fase III
9 a 12 meses
> 2 anos
Características
• Redução no tempo de desenvolvimento do fármaco
• Uso agrupando as fases do desenvolvimento (I/II ou II/III)
Estágio de aprendizado seguido de estágio
confirmatório
Se a probabilidade estimada parece boa expande-se
para a fase seguinte
Vantagem
lançamento
boa
Resposta
Fase II
Fase III
6 meses
9 a 12 meses
Agrupamento adaptativo
< 2 anos
> 2 anos
Infra-estrutura necessária
• Acesso on line dos dados
Infra-estrutura necessária
• Acesso on line dos dados
• Dados disponíveis em tempo real
Infra-estrutura necessária
• Acesso on line dos dados
• Dados disponíveis em tempo real
• Capacidade de rever e analisar os dados
freqüentemente
Infra-estrutura necessária
• Acesso on line dos dados
• Dados disponíveis em tempo real
• Capacidade de rever e analisar os dados
freqüentemente
• Capacidade de implementar rapidamente
as mudanças (logística)
Infra-estrutura necessária
• Acesso on line dos dados
• Dados disponíveis em tempo real
• Capacidade de rever e analisar os dados
freqüentemente
• Capacidade de implementar rapidamente
as mudanças (logística)
• Comitê de Monitoramento Independente
de Dados (CMID)
Infra-estrutura necessária
• Acesso on line dos dados
• Dados disponíveis em tempo real
• Capacidade de rever e analisar os dados
freqüentemente
• Capacidade de implementar rapidamente
as mudanças (logística)
• Comitê de Monitoramento Independente
de Dados (CMID)
• Centro Independente de Estatística (CIE)
Infra-estrutura necessária
• Acesso on line dos dados
• Dados disponíveis em tempo real
• Capacidade de rever e analisar os dados
freqüentemente
• Capacidade de implementar rapidamente
as mudanças (logística)
• Comitê de Monitoramento Independente
de Dados (CMID)
• Centro Independente de Estatística (CIE)
• Comitê Científico de Pesquisa (analistas
médicos, estatístico e analista regulatório)
Primeiros passos para
Implementar estudos adaptativos
• Fazer o processo adaptativo como parte
integrante do desenvolvimento dos projetos
de pesquisa
Primeiros passos para
Implementar estudos adaptativos
• Fazer o processo adaptativo como parte
integrante do desenvolvimento dos projetos
de pesquisa
• Ter a infra-estrutura
Primeiros passos para
Implementar estudos adaptativos
• Fazer o processo adaptativo como parte
integrante do desenvolvimento dos projetos
de pesquisa
• Ter a infra-estrutura
• Analisar as adaptações necessárias baseada
em resultados simulados
Primeiros passos para
Implementar estudos adaptativos
• Fazer o processo adaptativo como parte
integrante do desenvolvimento dos projetos
de pesquisa
• Ter a infra-estrutura
• Analisar as adaptações necessárias baseada
em resultados simulados
• Iniciar com ajuste da amostra e retirada de
grupos com doses ineficazes
Primeiros passos para
Implementar estudos adaptativos
• Fazer o processo adaptativo como parte
integrante do desenvolvimento dos projetos
de pesquisa
• Ter a infra-estrutura
• Analisar as adaptações necessárias baseada
em resultados simulados
• Iniciar com ajuste da amostra e retirada de
grupos com doses ineficazes
• Sincronizar todos os elementos envolvidos na
pesquisa (Indústria, CRO, Centro, Órgãos
regulatórios)
Considerações
• Visão regulatória
Interim analyses are usually an ethical mandate:
Sufficient uncertainty about treatment effects will
often remain at the beginning of phase III that it may be
seen as an ethical mandate, to assess whether early or
interim results from such trials of long duration
convincingly establish a treatment effect, raise safety
concerns, or indicate that it is unlikely that the trial will
meet its pre-specified objective.
Dr. Astrid Heinicke and Dr. Armin Koch
Federal Institute for Drugs and Medical Devices Germany
Considerações
Um bom modelamento flexível evita
“oversize” assim como evita “under-power”
expondo o menor número possível de
voluntários a esquemas ineficázes, ou com
maior risco. Propiciando maior rapidez no
acesso de novos medicamentos à população
geral.
Muito Obrigado !
Agora é só aplicar na prática da pesquisa clínica.