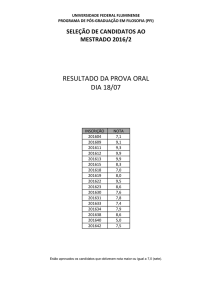
150
QUÍMICA
25) As transformações que ocorrem em um sistema podem ou não ocasionar alteração na constituição da matéria envolvida. De acordo com
o enunciado, está(ão) CORRETA(S) a(s) associação(ões):
01. Digestão de um alimento
02. Água oxigenada luz água + oxigênio gasoso
04. Queima de fogos de artifício
08. Transformação do gelo em água
16. Sublimação do iodo sólido
Fenômeno físico
Reação química
Fenômeno físico
Fenômeno físico
Reação química
Gabarito: 10 (02 + 08)
Número de acertos: 3.578 (41,54%)
Grau de dificuldade previsto: Fácil
Grau de dificuldade obtido: Fácil
ANÁLISE DA QUESTÃO
A questão teve como objetivo principal verificar o grau de
conhecimento e compreensão dos estudantes sobre o assunto
Transformações Químicas e os conceitos de fenômeno físico e fenômeno
químico nele implícitos.
Ao constatar que grande parte dos candidatos (41,54%) respondeu
corretamente a questão e que a freqüência de acertos parciais foi
significativa, a Banca concluiu que o grau de dificuldade, inicialmente
previsto, foi alcançado, o que demonstra que esse conteúdo vem sendo
ensinado de forma adequada no Ensino Médio.
26) Assinale a(s) proposição(ões) CORRETA(S). Os compostos formados a partir dos elementos oxigênio, cloro, sódio e cálcio devem
apresentar fórmulas, ligações químicas predominantes e estados
físicos, em condições ambientes, respectivamente:
01. CaCl2, iônica, sólido.
02. NaCl, iônica, líquido.
04. Cl2, covalente, gás.
08. Na2O, covalente, líquido.
16. O2, iônica, gás.
Gabarito: 05 (01 + 04)
Número de acertos: 1.777 (20,61%)
Grau de dificuldade previsto: Fácil
Grau de dificuldade obtido:
ANÁLISE DA QUESTÃO
Um número expressivo de candidatos (20,61%) associa, de modo
correto, fórmulas químicas com suas ligações químicas e estado físico,
demonstrando conhecimento sobre propriedades das substâncias.
Contudo, aproximadamente 10% dos candidatos assinalaram apenas a
proposição 16, onde a molécula de oxigênio aparece como substância
iônica, e outros, ainda associaram a mesma proposição com a 02 e/ou 08,
onde não identificaram o NaCl e/ou o Na2O como um sólido, estado
físico mais provável de um sal.
151
27) Observe os recipientes A, B e C e seus respectivos conteúdos.
álcool
cubos de gelo
água
NaCl
açúcar
(A)
(B)
(C)
Após mistura e agitação do conteúdo dos três recipientes em um só,
observa-se que apenas parte do açúcar e parte do gelo permanecem
insolúveis. Assinale o número de fases e o número de componentes
do sistema resultante.
01. trifásico
02. 4 componentes
04. bifásico
08. 5 componentes
16. 2 componentes
32. monofásico
64. 3 componentes
Gabarito: 03 (01 + 02)
Número de acertos: 2.859 (33,17%)
Grau de dificuldade previsto: Médio
Grau de dificuldade obtido: Médio
ANÁLISE DA QUESTÃO
A questão versou sobre Misturas e a classificação desses sistemas em
função do número de componentes e de fases.
Os percentuais obtidos, ou seja, 33,17% para a resposta correta e
cerca de 6% para acertos parciais, indicam que boa parcela dos candidatos
apresenta um conhecimento satisfatório sobre o assunto. No entanto, uma
parte dos candidatos indicou a resposta 06, deduzindo corretamente o
número de componentes do sistema, mas considerando erroneamente que
água e gelo formam uma só fase. Da mesma forma, outro percentual
optou pela resposta 09, identificando corretamente o número de fases da
mistura, mas assinalando que a mesma apresenta 5 componentes,
provavelmente por desconhecer o fato de que água e gelo representam a
mesma substância!
De acordo com as observações feitas confirmou-se a previsão de um
grau de dificuldade médio para essa questão.
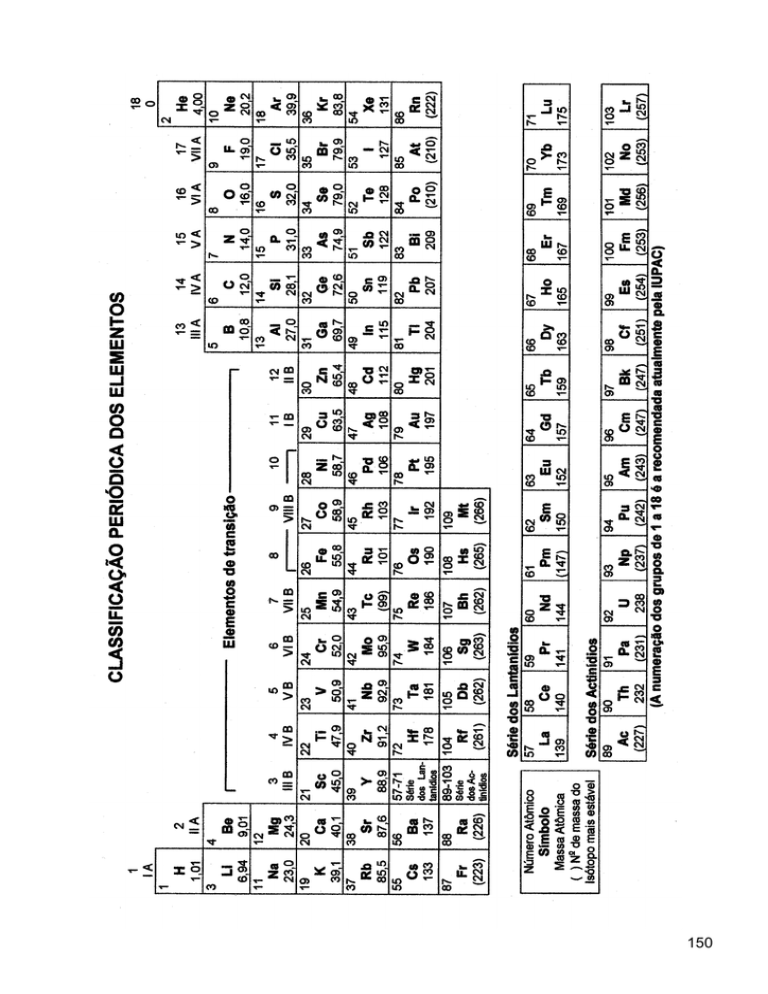
28) Os símbolos X e Y representam elementos químicos quaisquer,
diferenciados por seus números atômicos (Z). Sobre eles, é
CORRETO afirmar que:
01. quando X (Z=19) se combina com Y (Z=17), o composto resultante
tem fórmula molecular XY e a ligação é covalente apolar.
02. se X e Y estão bem afastados na fila de reatividade química, e X e Y
têm 1 e 6 elétrons, respectivamente, na última camada eletrônica, o
composto resultante da combinação entre eles será molecular e com
fórmula XY2.
04. átomos do elemento X (Z=20) e do elemento Y (Z=7) unem-se por
ligações covalentes e o composto tem fórmula molecular X3Y4.
152
08. pela configuração eletrônica da última camada dos elementos X e Y,
X =
1s
Y =
2p
2p
2p
2s
o composto formado entre X e Y tem fórmula X2Y.
16. se X (Z=1) e Y (Z=11, 37 ou 55), os compostos formados serão todos
hidretos metálicos.
Gabarito: 24 (08 + 16)
Número de acertos: 1.527 (17,12%)
Grau de dificuldade previsto: Médio
Grau de dificuldade obtido:
ANÁLISE DA QUESTÃO
Nessa questão, os candidatos deveriam, com auxílio da tabela
periódica, localizar os grupos pertinentes aos elementos químicos
fornecidos e identificar a fórmula molecular resultante da combinação
entre eles . Com exceção das proposições corretas (08 e 16), as demais
continham informações praticamente absurdas do ponto de vista químico,
fórmulas moleculares ou estados físicos incorretos. Por outro lado, muitos
candidatos ou assinalaram apenas a proposição 08, ou apenas a 16,
indicando um conhecimento parcial sobre o assunto envolvido nas
proposições, isto é, ou têm deficiências quanto à distribuição eletrônica ou
não reconhecem os hidretos metálicos.
29) Considere a tabela abaixo e selecione a(s) proposição(ões) que
relaciona(m) CORRETAMENTE a forma geométrica e a polaridade
das substâncias citadas:
FÓRMULA
MOMENTO DIPOLAR RESULTANTE (µR )
CO2
µR =0
H2O
µR 0
NH3
µR 0
CCl4
µR=0
01. H2O: angular e polar.
02. CO2: linear e apolar.
04. CCl4: trigonal e polar.
08. NH3: piramidal e polar.
16. CCl4: tetraédrica e apolar.
Gabarito: 27 (01 + 02 + 08 + 16)
Número de acertos: 1.482 (17,19%)
Grau de dificuldade previsto: Fácil
Grau de dificuldade obtido: Médio
ANÁLISE DA QUESTÃO
A questão envolveu conteúdos de Geometria e Polaridade das
Moléculas, apresentando a fórmula de algumas substâncias de uso
cotidiano e informações sobre o vetor momento dipolar das mesmas. Para
respondê-la corretamente, os candidatos deveriam recorrer a alguns
conhecimentos prévios, tais como distribuição eletrônica, montagem de
fórmulas, teoria da repulsão dos pares eletrônicos e eletronegatividade.
153
Considerando que um total de 17,19% dos candidatos acertaram
totalmente a questão, demonstrando informação e um conhecimento
parcial sobre o assunto, pode-se concluir que o índice de acertos obtido
foi médio. Depreende-se, portanto, que os conteúdos relativos a tópicos
como ligações químicas e polaridade das moléculas devem ser
regularmente exercitados no Ensino Médio.
30) Escolha a(s) proposição(ões) que combina(m) CORRETAMENTE os
valores de pH fornecidos e as características de cada solução
aquosa abaixo:
PROPOSIÇÕES
SOLUÇÃO a 25ºC [H+], mol.L-1 [OH- ], mol.L-1 pH
01.
Suco gástrico
10-2
10-12
2
Básico
02.
Água de chuva
10-6
10-8
6
Ácido
04.
NaOH
10-13
10-1
13
Básico
-3
-11
Caráter
08.
Ácido nítrico
10
10
3
Básico
16.
NH4OH
10-9
10-5
9
Básico
Gabarito: 22 (02 + 04 + 16)
Número de acertos: 3.433 (39,82%)
Grau de dificuldade previsto: Médio
Grau de dificuldade obtido:
ANÁLISE DA QUESTÃO
O tema envolvido na questão é o conhecimento básico da escala
logarítmica de pH. Os candidatos deveriam associar a potência elevando a
base decimal como indicação da concentração dos íons H+ ou OH- e o
respectivo valor do pH, inferindo o caráter ácido ou básico das soluções
apresentadas. Se assim não o fizeram, restava ainda outra análise,
meramente de caráter intuitivo, dada pela descrição das soluções;
exemplo: solução de ácido nítrico, ou solução de suco gástrico, o que para
um observador razoavelmente atento seria uma fiel indicação. Assim,
quase 40% dos candidatos assinalaram corretamente as proposições 02, 04
e 16. Contudo, quase 20% dos candidatos deixaram de assinalar a
proposição 02, a água da chuva como exemplo de solução ácida, assunto
extensamente discutido em todos os níveis. Isso deixa muito a refletir,
pois após tantos anos se falando em poluição ambiental, chuva ácida, etc.,
é intrigante que não lembrem desta informação. Em adição, havia a
indicação da concentração de íon H+, permitindo um calculo rápido do
pH. Então, pode-se concluir que as informações mais representativas para
os candidatos foram as descrições da solução e não os valores numéricos
das concentrações, ou seja, a intuição acima do conhecimento físicoquímico.
154
31) Assinale a(s) proposição(ões) que define(m) CORRETAMENTE a
entalpia-padrão de formação (25ºC, 1 atm) das substâncias indicadas
abaixo:
01. 6 C(grafite) + 3H2(g) C6H6(l)
02. C(diamante) +
O2(g)
CO2(g)
04. S(rômbico) +
O2(g)
SO2(g)
08. CH4(g)
2O2(g)
+
16. ½H2(g) + ½Cl2(g)
HCl(g)
32. 2S(rômbico) + C(grafite)
64. S(monoclínico) + O2(g)
CO2(g) + 2H2O(g)
CS2()
SO2(g)
Gabarito: 53 (01 + 04 + 16 + 32)
Número de acertos: 158 (1,83%)
Grau de dificuldade previsto: Médio
Grau de dificuldade obtido: Difícil
ANÁLISE DA QUESTÃO
A questão foi formulada com o objetivo de avaliar conhecimentos
específicos de Termoquímica, tais como o conceito de entalpia-padrão de
formação (obtenção de uma substância, a partir de substâncias simples
mais estáveis) e os requisitos necessários à definição de estado padrão.
A compreensão e aplicação desse tópico requer dos estudantes
conhecimento e domínio de conceitos que expressam condições de
temperatura e pressão, além dos estados físico e alotrópico das
substâncias representadas nas equações termoquímicas.
De acordo com a freqüência das respostas, deve-se registrar que
houve grande espalhamento, sendo oportuno destacar que: a) o índice de
acertos (1,83%) esteve muito abaixo do esperado; b) os acertos parciais
foram pouco expressivos (cerca de 5,30%); c) uma porcentagem
significativa dos candidatos (8,08%) indicou a proposição 24,
demonstrando domínio sobre as condições de estado físico das
substâncias, mas desconhecendo o fato de que o metano (CH4) é uma
substância composta.
Por todo o exposto, a Banca considerou que o nível da questão foi
mantido como difícil, sendo oportuno recomendar maior ênfase nos
exemplos e exercícios que incluam os tópicos aqui abordados.
32) Na pilha esquematizada a seguir, é fornecido o sentido do fluxo de
elétrons. Dados os valores dos potenciais-padrão de redução (a 25ºC
e 1 atm) do eletrodo de cobre (Ered= 0,34 V) e do eletrodo de prata
(Ered= 0,80 V), indique a(s) proposição(ões) CORRETA(S):
e -
V
Ponte salina
Cu(s)
[Cu2+(aq)] = 1,0 M
Ag(s)
[Ag1+ (aq)] = 1,0 M
155
01. No eletrodo de cobre ocorre a redução.
02. Os elétrons fluem do eletrodo de cobre para o eletrodo de prata.
04. O cobre é o agente redutor.
08. A reação global da pilha é: Cu(s) + 2Ag1+(aq) Cu2+(aq) + 2Ag(s).
16. A diferença de potencial da pilha é 0,46 V, nas condições indicadas.
32. A representação correta da pilha é: Ag1+(aq) | Ag(s) || Cu(s) | Cu2+(aq).
Gabarito: 30 ( 02 + 04 + 08 + 16)
Número de acertos: 630 (2,76%)
Grau de dificuldade previsto: Médio
Grau de dificuldade obtido:
ANÁLISE DA QUESTÃO
O assunto desenvolvido na questão, a Eletroquímica, envolve
diversas convenções, como por exemplo, a notação da pilha, cátodo,
ânodo, agente oxidante e agente redutor, o que pode trazer um certo grau
de dificuldade em virtude da troca que o candidato possa fazer em relação
às mesmas. Isto talvez explique a grande dispersão dos candidatos nas
diferentes proposições apresentadas. Um número razoável deles assinalou
a proposição 32, onde a notação da pilha se encontrava escrita na forma
inversa dos seus eletrodos. São corretas as proposições 02, 04, 08 e 16.
Verifica-se que é grande a incidência de respostas que envolvem essas
proposições ou a cominação de duas delas, por exemplo 02 e 04 ou 02 e
16 e outras, indicando um conhecimento parcial do fenômeno da oxiredução.
33) As velocidades iniciais foram obtidas para a reação elementar
2A + B C + D, conforme representado abaixo:
Experimento
1
2
3
[A] (mol.L-1)
0,1
0,2
0,2
[B] (mol.L-1)
0,2
0,2
0,4
V0 (mol.L-1.s-1)
0,1
0,2
0,8
Com base nos resultados apresentados, é CORRETO afirmar que a
01. lei de velocidade para a reação dada é: V = k [A]2[B].
02. lei de velocidade para a reação dada é: V = k [A] [B]2.
04. constante k de velocidade da reação vale 25 mol-2.L2.s-1.
08. constante k de velocidade da reação vale 50 mol-2.L2.s-1.
16. velocidade de desaparecimento de A é o dobro da velocidade de desaparecimento de B.
32. velocidade de desaparecimento de A, quando [A] = 0,1M e [B] = 0,1M,
é de 0,4 mol.L-1.s-1.
Gabarito: 22 (02 + 04 + 16)
Número de acertos: 238 (2,76%)
Grau de dificuldade previsto: Difícil
Grau de dificuldade obtido: Difícil
156
ANÁLISE DA QUESTÃO
Na reação elementar 2A + B C + D as velocidades iniciais para
três experimentos são indicadas na tabela que acompanha a questão.
A partir de cálculos apropriados, os candidatos deveriam deduzir a lei
de velocidade da reação, tendo em mente que os expoentes dos reagentes
não se relacionam, necessariamente, com os coeficientes da equação
química. Assim, conforme os dados da tabela, a velocidade da reação
dobra do 1o para o 2o experimento, à medida em que também dobra a
concentração de A, sendo que B permanece constante. E, do 2o para o 3o
experimento, a velocidade da reação torna-se quatro vezes maior, quando
a concentração de B dobra e a concentração de A é mantida. Portanto, a
lei de velocidade deve ser escrita como: V= k.[A].[B]2. O valor da
constante k, de velocidade pode ser obtido a partir da tabela e é
igual a 25 mol-2.L2.s-1. Finalmente, a velocidade de desaparecimento de
A é o dobro da velocidade de desaparecimento de B, de acordo com a
proporção estequiométrica da reação.
Os resultados indicaram que apenas 2,76% dos candidatos chegaram
à resposta correta. Os acertos parciais atingiram um percentual de
20,92%, porém muitos candidatos (10,40%) optaram pela resposta 17,
acertando o cálculo da velocidade de desaparecimento de A, baseados na
estequiometria da reação e errando na determinação da lei de velocidade,
por seguirem o mesmo princípio.
De acordo com a análise feita confirma-se a previsão da Banca,
reconhecendo que o conteúdo abordado pela questão continua requerendo
a aplicação de metodologias específicas para enfrentar tais dificuldades.
34) Assinale, abaixo, o(s) reagente(s) estritamente necessário(s) para,
numa seqüência de etapas reacionais, envolvendo hidrogenação e
oxidação, obter-se a cicloexanona.
01.
OH
02. H2, CrO3
04. CH3COOH
08. CH3Br
16. CHBr3
32. CH3CH2-OH
64. NaOH
Gabarito: 03 (01 + 02)
Número de acertos: 321 (3,73%)
Grau de dificuldade previsto: Difícil
Grau de dificuldade obtido:
157
ANÁLISE DA QUESTÃO
Os candidatos mostraram um elevado grau de dificuldade na
resolução desta questão que envolve conhecimentos sobre Reações
Orgânicas, mais precisamente a hidrogenação e a oxidação. Um fator que
possa agregar mais dificuldade seria a identificação dos compostos
envolvidos; a estrutura do fenol e a da ciclohexanona podem não ser
familiar para muitos. Contribuiu, também no mesmo sentido, o óxido de
cromo, agente oxidante, pouco familiar ao estudante. Por último, uma das
etapas reacionais solicitadas era a hidrogenação e havia uma única
proposição contendo hidrogênio, então se o conhecimento sobre o assunto
é limitado, faz falta também um pouco de astúcia aos candidatos.
35) Assinale a(s) proposição(ões) CORRETA(S), a partir da análise da
equação abaixo, que expressa a decomposição do carbonato de
cálcio, em um sistema fechado.
CaCO3(s)
Reação direta
CaO(s) + CO2(g),
H= +177,5 kJ.mol-1
Reação inversa
01. A decomposição do carbonato de cálcio ocorre com liberação de
energia.
02. A produção de 224 L de CO2(g), nas CNTP, requer o consumo de
100 g de CaCO3(s).
04. A constante de equilíbrio, expressa em termos das pressões parciais,
é indicada por k p pco .
2
08. O aumento da temperatura favorecerá a reação direta.
16. O carbonato de cálcio e os seus produtos de decomposição formam
um sistema homogêneo.
32. A decomposição do carbonato de cálcio é favorecida por altas
pressões.
Gabarito: 12 (04 + 08)
Número de acertos: 1.007 (11,69%)
Grau de dificuldade previsto: Difícil
Grau de dificuldade obtido: Difícil
ANÁLISE DA QUESTÃO
A questão envolveu uma situação típica de um equilíbrio químico,
onde ocorre a decomposição do carbonato de cálcio sólido (CaCO3), em
um sistema fechado. A equação indica que a reação ocorre com absorção
de energia e que o composto se decompõe, formando óxido de cálcio
sólido (CaO) e dióxido de carbono gasoso (CO2).
Para a resolução do problema, o estudante deveria: a) concluir, pela
análise do estado físico das substâncias, que se trata de um sistema
heterogêneo; b) omitir as substâncias sólidas no cálculo da constante de
equilíbrio (neste caso, na expressão de kp); c) estar atento aos fatores que
determinam o deslocamento do equilíbrio considerado: se a reação é
endotérmica, um aumento na temperatura favorecerá a reação direta; por
outro lado, um aumento na pressão deslocará o equilíbrio para o lado onde
houver menor volume gasoso, desfavorecendo a decomposição do CaCO3.
158
As freqüências obtidas para as respostas revelaram um certo grau
de dispersão, sendo que 11,69% dos candidatos chegaram à resposta
correta. Quanto aos acertos parciais, obteve-se um índice de 8,35%
para as proposições 04 e 08, 10% para a resposta 09 e cerca de 9,00%
para a resposta 40. Desta análise, depreende-se que há falta de
domínio do conteúdo por grande parte dos candidatos, pois apesar de
revelarem algum tipo de conhecimento, incorrem em contradições
devido a problemas conceituais. O grau de dificuldade previsto deve
ser mantido, salientando-se a necessidade de mais exercícios e
demonstrações práticas sobre este item do programa, notadamente os
conceitos referentes ao Princípio de Le Chatelier.
36) As reações químicas podem levar à formação de produtos de interesse comercial. Assinale a(s) proposição(ões) CORRETA(S).
01. A trimerização completa de 3 mols de acetileno produz 2,5 mols de
benzeno.
02. Ésteres de ácidos carboxílicos são os componentes principais do óleo
de soja.
04. São exemplos de polímeros naturais o PVC, a sacarose e o poliéster.
08. O teflon, quimicamente, é o politetrafluoretileno.
16. A vulcanização da borracha baseia-se na reação do látex natural com
quantidades controladas de ozônio.
32. A baquelite, o mais antigo polímero sintético, é obtida pela condensação do fenol comum com aldeído fórmico.
Gabarito: 42 (02 + 08 + 32)
Número de acertos: 215 (2,49%)
Grau de dificuldade previsto: Médio
Grau de dificuldade obtido:
ANÁLISE DA QUESTÃO
Realmente, se o assunto de Reações Orgânicas não foi a parte forte
dos candidatos nesse Concurso Vestibular, associá-la à sua aplicação
cotidiana não revelou nenhuma sinergia. Surpreende até certo ponto que
alunos preparados para etapas mais avançadas não reconheçam a
baquelite, o mais antigo polímero sintético, grande revolução industrial da
era dos plásticos. Fica claro também, pela análise das respostas, que o
interesse dos alunos pelo conhecimento que possa ir um pouco além da
sala de aula e a curiosidade em conhecer os materiais que os cercam e os
métodos de obtenção estão merecendo um maior incentivo.
159