A Segunda Lei da Termodinâmica Washington Braga
Este documento tem nível de compartilhamento de
acordo com a licença 3.0 do Creative Commons.
http://creativecommons.org.br
http://creativecommons.org/licenses/by-sa/3.0/br/legalcode
Sala de Leitura A Segunda Lei da Termodinâmica 1 Introdução
Após a apresentação feita em capítulo anterior sobre o conceito de energia, das suas diversas
manifestações (tais como a energia cinética, a potencial, a química etc.) e do seu princípio de
conservação (a Primeira Lei da Termodinâmica) aplicada às máquinas e sistemas térmicos, a
continuação natural dos estudos passa para a análise da Segunda Lei.
Este capítulo tem como objetivo a apresentação do porquê (ou talvez, dos porquês) da necessidade e
da existência de outra lei para a Termodinâmica, e das suas consequências. De uma maneira simplista,
pode-se argumentar que cada uma das leis (ou princípios) da Termodinâmica está associada a uma
propriedade: a Lei Zero (aquela que trata do equilíbrio térmico) está associada à temperatura; e a
Primeira Lei, à energia. Assim, seria natural que a Segunda Lei se associasse a outra propriedade e esta,
como é sabido, à entropia.
Com este argumento, o presente capítulo apresenta as características básicas desta nova propriedade
termodinâmica. Mais do que formalizar a sua existência a partir de equacionamentos teóricos
complexos, o foco é uma apresentação informal, histórica, baseada em conceitos já vistos em outros
capítulos e em dados e fatos do dia a dia. Finalmente, uma breve conceituação molecular sobre a
entropia será feita, procurando-se uma explicação mais fundamental capaz de desmistificá-la
definitivamente. Sabe-se hoje que a entropia só pode ser entendida com base na teoria molecular da
matéria, como outras propriedades, tais como: a pressão, a temperatura e a energia. Isso é feito pela
utilização do conceito comum da probabilidade.
2 A Segunda Lei: sua necessidade
No capítulo que tratou da Primeira Lei da Termodinâmica, foi apresentada a máquina de Sadi Carnot,
proposta por ele em 1824, importante marco teórico da Termodinâmica devido ao fato dela ter a
máxima eficiência possível. Em seu modelo, o calor flui de uma fonte quente à temperatura TQ para
uma fonte fria à temperatura TF. A máquina é responsável pela conversão de parte do calor QQ em
trabalho W.
Na máquina a vapor, a água era vaporizada junto à fonte quente e depois era condensada junto à fonte
fria1. O funcionamento da máquina era feito através da transferência de calor da fonte quente para a
fonte fria. Assim, para Carnot, uma máquina térmica - ainda que teórica - deveria ser representada por
algo como:
1
Algo semelhante acontece nos motores a gasolina: a mistura ar + combustível é queimada na explosão, que ocorre
dentro dos cilindros, e os produtos desta combustão são liberados para a fonte fria, que é o ambiente (causando
poluição, deve ser registrado).
. 1 . Sala de Leitura A Segunda Lei da Termodinâmica Ao invés de se preocupar com as máquinas que existiam a sua época, a genialidade de Carnot foi
demonstrada quando ele imaginou uma máquina teórica, livre de toda imperfeição, e que deveria ter,
portanto, a máxima eficiência possível. A máquina em questão é composta por processos sem atrito
(que chamamos hoje de processos reversíveis) e que tem sua eficiência (térmica) indicada por η, apenas
como função das temperaturas absolutas TQ e TF:
η = W/ QQ = 1 – TF / TQ
Observe a independência da natureza da substância de trabalho. Para aumentar a eficiência, basta
aumentar a temperatura TQ ou diminuir TF2. Como a menor temperatura disponível é a do ambiente, a
saída é aumentar o valor da temperatura da fonte.
Se imaginarmos uma máquina desse tipo trabalhando entre duas temperaturas, digamos 1000 K e 300
K, a eficiência desta máquina teórica será de apenas 57%. Este é um ponto no qual muitos estudantes
(ou não) se espantam: como a máquina de maior eficiência possível, que é idealizada sem atrito ou
perdas, tem apenas 57% de rendimento? Por que algo ideal não é capaz de ter uma eficiência de 100%?
O estudante imagina que o problema está apenas associado aos níveis de temperatura (o que é
parcialmente correto), refaz seus cálculos para valores mais elevados para a temperatura da fonte,
digamos 10000 K e 300 K, e descobre que, de fato, conseguiu aumentar a eficiência para 97% (mas
ainda não 100%). O aluno ficará feliz até descobrir que atingir os 10000 K não é tão simples, pois os
materiais encontrados fundem (isto é, derretem) em temperaturas muito inferiores3!!
2
Você já pode concluir que o seu automóvel funciona com uma eficiência maior no inverno se comparada com o verão.
Nada drasticamente diferente, mas certamente maior, de acordo?
3
A situação é ainda mais grave, pois a temperatura aparente da superfície do sol é de “apenas” 6000K. Ou seja, não
temos disponível uma fonte de energia capaz de fornecer aquele nível de temperaturas e nem materiais que possam ser
utilizados para conter esta fonte, se ela fosse encontrada.
. 2 . Sala de Leitura A Segunda Lei da Termodinâmica Para atingirmos 100% de eficiência, o ambiente externo
deverá estar no zero absoluto (0 K) ou a fonte quente deverá
estar infinitamente quente. Claro, nenhuma destas duas
alternativas é possível de ser alcançada na prática.
A dificuldade “prática” de atingirmos 100% de eficiência, mesmo para uma máquina sem atritos,
acarreta uma pergunta imediata: qual será a eficiência de uma máquina real, construída em uma linha
de montagem, realizada por meio de processos reais, com atrito e com perdas de todos os tipos? Será
muito pior?
Por exemplo, as usinas termelétricas modernas trabalham com vapor em temperaturas em torno de 530
°C e com temperaturas de condensação deste mesmo vapor em torno de 100 °C, o que resulta em um
rendimento da ordem de 54%. Nos reatores nucleares, restrições de segurança reduzem a temperatura
da fonte quente para uns 350 °C e eficiência de 40%. As perdas reduzem para 32% este valor. Uma
consulta aos especialistas de motores de combustão interna (dos automóveis) nos traz outra resposta:
as eficiências teóricas giram em torno de 56%, mas os rendimentos obtidos na prática - por questões de
redução de peso, de perdas etc., já estão no patamar de uns 30 a 35%! São, de fato, números muito
baixos.
Observe que uma eficiência de 30% acarreta, em última instância,
que de cada 100 litros de combustível (por exemplo, gasolina), cerca
de 70 litros são jogados no ambiente.
Quem impõe estes limites tão baixos? Certamente não é a Primeira Lei, que só trata do Balanço de
Energia. Por que não é possível melhorar significativamente aquelas eficiências? Essas são duas das
perguntas que a 2ª Lei da Termodinâmica vem responder.
Uma questão subsidiária, mas igualmente importante, diz respeito ao funcionamento das máquinas
refrigeradoras que retiram energia das fontes frias e a transferem para a fonte quente. Como é possível
seu funcionamento? Novamente, é a 2ª. Lei que determina isso, como será visto. Ah, antes de alguém
concluir erroneamente que há duas Segundas Leis - uma para máquinas produtoras de trabalho e outra
para máquinas consumidoras de trabalho, deve ficar o registro: há apenas uma única Segunda Lei. Será
mostrado adiante que a formulação associada à máquina térmica produtora de trabalho (ou
eletricidade) é equivalente à formulação da máquina refrigeradora. São apenas dois aspectos, dois
olhares sobre a mesma Segunda Lei. Porém, por ora, é importante que se conclua a necessidade de uma
segunda lei, em adição à primeira. Ou seja, os fenômenos térmicos que acontecem têm as duas leis
como restrições naturais: não é possível produzir trabalho sem fontes externas (assunto da Primeira Lei)
. 3 . Sala de Leitura A Segunda Lei da Termodinâmica e a qualidade com que este trabalho é produzido (assunto da Segunda Lei) não é algo nem
remotamente maravilhoso4.
Sabemos hoje que o princípio de conservação da energia limita - de certa forma - a
eficiência das máquinas térmicas, pois nenhuma delas é capaz de fornecer trabalho em
maior quantidade do que a capacidade do combustível utilizado. Ou seja, eficiências
maiores do que 100% não são alcançáveis a partir de argumentos baseados na Primeira
Lei. Essa situação, que é trivial hoje, à época de Carnot, não estava ainda estabelecida.
3 Segunda Lei: Perspectiva Histórica
Para que se entenda a relevância de uma contribuição científica como a Segunda Lei da Termodinâmica
(entre outras), é importante que o contexto do conhecimento e dos problemas existentes antes da sua
formulação sejam conhecidos. O que pensava, o que sabia a humanidade à época da formulação da lei.
Se hoje é um assunto óbvio (embora não o seja, de fato), como pensavam as pessoas antes dela?
Feche os olhos e pense, por dois minutos: como seria a sua vida se
não existissem a televisão e o forno de micro-ondas? Ou talvez, a
Internet?
3.1 As contribuições de Sadi Carnot
Sadi Carnot, um engenheiro militar de importante família francesa, considerava que o fantástico
poderio militar inglês naquela época baseava-se em dois fatores: a grande disponibilidade de aço,
necessário para a construção de navios e canhões; e a de carvão, necessário para aquecer os altos fornos
usados para a produção do aço. Como o carvão estava no fundo das minas, conforme visto no capítulo
anterior, era preciso usar máquinas a vapor para a retirada da água que se acumulava pelo seu processo
de extração5. O trabalho teórico desenvolvido por Carnot foi motivado por uma grande dose de
patriotismo e orgulho: as máquinas a vapor de origens francesas eram de qualidade inferior do que as
inglesas. Ele sabia que todo o progresso que ocorrera nos últimos 50 anos no desenvolvimento destas
máquinas era devido aos trabalhos experimentais de ingleses e escoceses (tais como James Watt),
nenhum francês. Carnot desconfiava que a nação que dominasse a fabricação eficiente das máquinas a
vapor, já bastante populares, teria um papel relevante na nova ordem mundial.
4
Parece brincadeira hoje, mas durante muito tempo, os engenheiros, os técnicos e os inventores tentaram construir
máquinas que produziriam trabalho sem gastar energia. A eficiência dessas máquinas seria infinita! Atualmente, esta
busca é inútil (graças as duas Leis da Termodinâmica), mas imagine 100 ou 200 anos atrás!
5
Em seu trabalho “Réflexions sur la Puissance Motrice du Feu – Reflexões sobre a Potência Motriz do Fogo”, Carnot
indicou um aumento de 10 vezes no volume de extração de carvão nas minas inglesas após o emprego sistemático das
máquinas a vapor. Algo semelhante aconteceu com a mineração de cobre, de ferro etc.
. 4 . Sala de Leitura A Segunda Lei da Termodinâmica O objetivo de Carnot era, em suma, contribuir para o poderio econômico e militar do seu país,
melhorando a eficiência da máquina térmica francesa.
Assim, o enfoque fundamental de todo o desenvolvimento teórico, que culminou com o aparecimento
de uma lei da Termodinâmica, foi o aumento na eficiência. Entre outros aspectos, esta lei discutida aqui
é uma lei da eficiência. Carnot sabia, como poucos a sua época, que o desenvolvimento feito por
engenheiros não poderia trazer ganhos significantes, pois eram essencialmente baseados em
experimentações. Não havia um desenvolvimento teórico por trás. A consequência disso foram as
eficiências alcançadas, apenas 6% (seis por cento).
A percepção de Sadi Carnot sobre a natureza do trabalho de um cientista e de
um engenheiro foi notável. O engenheiro, em seu esforço de reduzir o
consumo de combustível, por exemplo, busca a melhoria na qualidade de um
produto minimizando as perdas, eliminando falhas e vibrações, trocando
materiais e operações desnecessárias. Por outro lado, o cientista procura
entender os princípios básicos que existem, mesmo que sejam teóricos, mas
sempre procurando o conhecimento. Para isso, é preciso pensar nos
processos em termos abstratos e eliminar as imperfeições da realidade, como
o atrito.
As contribuições de Carnot foram marcantes para o futuro reconhecimento da Segunda Lei e suas
consequências. Em seus estudos sobre as máquinas térmicas, Carnot entendeu que calor precisava ser
rejeitado para uma fonte fria (não era simplesmente uma questão de um projeto melhor, como
pensavam os engenheiros). Isso era inevitável. Constitui o cerne da Segunda Lei da Termodinâmica!
Como consequência da sua brilhante decisão de ignorar os problemas do dia a
dia, tais como aumento de lucros, produtividade etc. Carnot pôde perceber algo
que ninguém antes dele tinha percebido: qualquer motor térmico, de todos os
projetos possíveis, libera energia ao ambiente. Simplesmente não é possível
manter um equipamento funcionando sem esta eliminação de energia.
Outra contribuição foi dada por ele, quando olhando mais adiante ignorou as dificuldades práticas, e
indagou sobre as possibilidades de fazermos a máquina funcionar ao contrário. Ao invés de produzir
trabalho, a máquina poderia receber trabalho e transportar energia da fonte fria para a fonte quente, ou
seja, teríamos um refrigerador. Se o motor a vapor é análogo a uma turbina movida pela água caindo de
uma altura, o refrigerador funciona como uma bomba, retornando a água de volta ao topo da
montanha.
. 5 . Sala de Leitura A Segunda Lei da Termodinâmica Mas ele fez ainda melhor: abstraindo os problemas práticos intransponíveis, ele entendeu que a sua
máquina teórica poderia ser reversível, funcionando perfeitamente como um motor ou como um
refrigerador. O conceito da reversibilidade tem, como sabemos, um papel central em Termodinâmica e
foi outro resultado da mente deste excepcional cientista.
Porém, segundo alguns autores, a contribuição mais brilhante dele foi o teorema, que hoje leva seu
nome. Esse teorema, conforme foi visto, determina que a eficiência da máquina reversível depende
apenas das temperaturas das duas fontes de energia com que ela interage. Assim que a temperatura da
fonte quente (TQ) e a temperatura da fonte fria (TF) forem especificadas, a eficiência ótima das máquinas
está determinada, sem nenhuma possibilidade de aumento. Uma maneira diferente de enunciar o novo
teorema é dizer que todas as máquinas reversíveis, operando entre as duas temperaturas extremas, têm
a mesma eficiência. Não importa mais o projeto das máquinas, os materiais, a fabricação, o combustível
utilizado6, nada pode afetar a eficiência máxima.
Apesar de toda a relevância dos resultados e conclusões de Carnot, seu trabalho - publicado em 1824 foi solenemente ignorado pela comunidade científica da época. Talvez por conta das suas escolhas. Ele
seguiu duas linhas mestras, cada uma muito brilhante, mas que combinadas se anularam. Em primeiro
lugar, ele escreveu seu texto em linguagem pouco técnica7, mais dirigida ao público do que aos
cientistas e engenheiros8. O segundo problema foi tratar do assunto de uma forma muito generalista:
em vez de expor os problemas de como extrair trabalho do calor, ele escreveu uma teoria geral sobre as
máquinas térmicas, procurando responder a qualquer pergunta sobre o assunto, desde questões de
projeto a questões sobre materiais a serem utilizados etc. Mas o público não conseguiu ler e entender a
proposta e os engenheiros a rejeitaram, pois eles não “poderiam” se interessar sobre problemas de
ciência popular (como talvez classificássemos hoje, erradamente, a sua obra). Só algumas décadas
depois é que sua importância foi reconhecida.
Em suas análises, Carnot usou o ponto de vista comum a sua época, ou seja, que calor era uma
substância como água. Assim, ele considerou que uma máquina térmica era análoga a uma roda
d’água. Entendendo que a água (isto é, a substância de trabalho) se conservava ao passar através de
uma roda d’água, realizando trabalho útil, Carnot conceituou a conservação da quantidade de calóricos
ao longo da máquina a vapor (aqui, a substância de trabalho era o calórico, que era transportado pela
água!). A água cai de uma elevação maior para uma menor, realizando trabalho no caminho. Na
máquina térmica, os calóricos cairiam da fonte quente rumo à fonte fria e no caminho haveria a
realização de trabalho.
Desse modo, ele acreditava que a quantidade de calor seria conservada e que o trabalho seria
produzido na máquina térmica, pois o fluido iria da fonte quente à fonte fria. Parte do problema da
aceitação dos resultados dele talvez também tenha sido o engano conceitual. Carnot acreditava que a
teoria calórica de Joseph Black e de Antoine Lavoisier estava correta. Era impossível para ele acreditar
de forma diferente, porque era o entendimento da comunidade científica naquela época.
6
Esta foi outra importante contribuição. Afinal, as máquinas funcionam utilizando a capacidade de expansão do volume
dos combustíveis (para impulsioná-las). Mas isto não afeta a eficiência máxima!
7
Por exemplo, a primeira frase do seu trabalho é: “Todo mundo sabe que calor pode produzir movimento”. O texto é
bastante fácil de ser lido.
8
Ele seguiu os caminhos de Galileu, o primeiro dos grandes cientistas. Em vez de redigir em latim, como era comum a
sua época, Galileu escreveu em italiano.
. 6 . Sala de Leitura A Segunda Lei da Termodinâmica Este “pequeno” engano talvez tenha evitado que Carnot atingisse a fama e a
glória - como o descobridor das leis da Termodinâmica - à semelhança de
outros cientistas famosos, tais como Galileu e Newton. Porém, as suas
contribuições são tão importantes que ele é considerado um dos pais da
Termodinâmica.
Curiosamente, logo após a publicação do seu trabalho, Carnot começou a duvidar das suas hipóteses.
Entre o que restou dos seus escritos9, havia notas em que ele rejeitava a teoria do calórico baseando-se
nos trabalhos de Benjamin Thompson (Conde de Rumford10), chegando até mesmo a estimar o
equivalente mecânico do calor - em um experimento similar ao de Joule - cerca de 20 anos antes das
contribuições de Mayer e Joule.
Mas Carnot via contradições entre as duas teorias. Se a energia precisa ser conservada, então o calor11
produzido pelo fogo é convertido no trabalho, que é realizado pela máquina. Se, por outro lado, a
produção de trabalho era apenas devido à queda do calórico de um reservatório para outro, não
poderia haver alteração na quantidade de calor. Era uma questão de conversão de calor ou da sua
conservação?
Pelo que indicam seus escritos, Carnot - após formular a 2ª Lei da
Termodinâmica - estava prestes a descobrir a primeira, cerca de 20 ou
30 anos antes de Helmholtz!
3.2 Removendo as barreiras
Não foi simples a remoção das barreiras impostas pelo engano de Carnot. Foi necessário o
aparecimento de alguns grandes homens para que isso se tornasse possível e a ciência progredisse em
seu caminho. O primeiro deles foi Julius Robert Mayer, que apenas seis anos após a morte de Carnot,
publicou seu famoso (e totalmente ignorado à época) trabalho sobre a conservação de energia12 e a
transformação de formas de energia em outras (o que era impossível segundo a teoria do calórico).
James P. Joule, outro dos grandes cientistas, um ano depois de Mayer - em 1840 - foi capaz de calcular,
após brilhante experimento, o equivalente mecânico do calor, um novo conceito que tornava calor e
trabalho13 mutuamente conversíveis e que fortaleceria a ideia que calor não era uma substância como a
água. Calor simplesmente não se conservava.
9
Carnot morreu de um surto de cólera com 36 anos de idade. Como era comum à época, quase todas as suas roupas,
livros, escritos, mobília etc. foram queimados.
10
Você deve ter lido sobre ele no Capítulo que trata da Primeira Lei da Termodinâmica.
11
Energia Térmica, seria dito hoje.
12
Embora não com este mesmo nome.
13
À época, isso talvez fosse equivalente a argumentar hoje que pedra e água têm a mesma natureza.
. 7 . Sala de Leitura A Segunda Lei da Termodinâmica Em vez de calor, o termo “energia térmica” deveria ser usado, pois a
energia que é conservada. O termo calor costuma gerar grande confusão
entre estudantes, porque usamos frequentemente expressões como
“fulano está com calor”, o que é incorreto.
Calor é a energia térmica
transferida de um corpo a outro por conta da diferença de temperaturas.
Como a transferência da energia térmica se dá nas máquinas térmicas em
presença de uma diferença de temperaturas, não há erro aqui.
Após um encontro com Joule em um evento da Associação Britânica para o Progresso da Ciência, em
1847, Lorde Kelvin (William Thompson) saiu impressionado com os rigorosos resultados experimentais
do colega, mas acreditava que todo o trabalho de Carnot (e seus relevantes resultados) seria
defenestrado sem a hipótese da conservação do calor (ou que se não houvesse um fluido como o
calórico).
A semelhança entre uma máquina térmica e uma roda d’água, tão
inteligentemente proposta por Carnot, não poderia ser mais considerada.
Isso o incomodou muito14. Após algum tempo, sua mente privilegiada encontrou um caminho e, em
1851, ele publicou um trabalho no qual indicou sua suspeita de que talvez a natureza tivesse duas
linhas de ação (que se traduziram nas duas leis que hoje conhecemos) e que assim, o trabalho de Carnot
poderia sobreviver sem contradizer o trabalho de Joule. Oficialmente, esse foi o começo da ciência da
Termodinâmica, ou seja, a ciência da ação mecânica do calor.
A formulação proposta por Kelvin para os argumentos levantados anteriormente por Carnot é expressa
como:
Nenhum processo cíclico pode ser realizado a partir do recebimento de
calor de uma única fonte quente e com a sua conversão integral em
trabalho.
Observe que esta é uma declaração negativa: “nenhum processo...” Por trás dessa frase, há a informação
de que ela é resultado do que pode ser observado. Se a formulação estivesse errada, poderíamos
construir um avião (ou um automóvel) que iria funcionar retirando energia do ar ambiente (não
importando sua temperatura) ou de um navio, retirando energia dos oceanos, sempre com eficiência
14
Uma possível explicação para este “incômodo”: Kelvin foi um dos revisores de um trabalho de Joule sobre o
aquecimento de um fio resultante da circulação de uma corrente elétrica sobre ele, o hoje famoso efeito Joule. Pelo que
se sabe, os comentários de Kelvin não foram muito elogiosos.
. 8 . Sala de Leitura A Segunda Lei da Termodinâmica igual a 100%. Com a energia contida em um kg de ar - à temperatura ambiente - é maior do que 210
000 J15, isso terminaria com os problemas das crises de energia.
Para completar o tanque de combustível de um automóvel
nessa situação, bastaria abrir a tampa do tanque. Não mais
seriam necessários os postos de gasolina etc. Infelizmente,
sem chances de acontecer.
Quem garante isto? A Primeira Lei da Termodinâmica.
O próximo cientista a entrar nessa história foi o alemão Rudolf Julius Emmanuel Clausius, cujas
contribuições veremos na próxima seção.
3. 3 As contribuições de Rudolf Clausius
Clausius considerou que a proposta fundamental de Carnot, na qual o calor precisava ser descarregado
em uma fonte fria, era uma condição necessária e inevitável. Carnot deduziu esse conceito a partir da
indestrutibilidade do calórico, mas Clausius corrigiu este engano e chamou a teoria resultante de
Segunda Lei da Termodinâmica: todas as máquinas térmicas precisam rejeitar certas quantidades de
calor.
Ele entendeu que a polêmica entre Carnot e Joule seria resolvida se: a) houvesse duas leis da Natureza e
b) se houvesse o cancelamento da teoria do Calórico. Clausius teve uma inquestionável vantagem sobre
Carnot, pois por volta de 1850 - quando publicou seu tratado sobre a teoria do calor - a teoria calórica já
tinha sido refutada por cientistas como Mayer e Joule. Além disso, o grande cientista alemão Hermann
von Helmholtz já havia postulado a Lei da Conservação da Energia (que seria generalizada como a
Primeira Lei da Termodinâmica).
Clausius unificou os conceitos propondo que uma máquina a vapor deveria ser entendida como um
equipamento que absorve calor de uma fonte quente e converte parte deste calor em trabalho
(proposta de Joule). Ao mesmo tempo, a máquina térmica transfere o restante para a fonte fria
(proposta de Carnot), conservando-a, portanto. Carnot foi incapaz de perceber isso, pois a quantidade
de energia liberada para a fonte fria era imensa (por conta das baixas eficiências alcançadas).
Mas a questão importante para Clausius agora era provar seus argumentos. Claro, as leis da Natureza
não podem ser provadas ou mesmo deduzidas. Elas são comprovadas. Mesmo assim, como fazer isso?
Clausius sabia que a versão de Carnot / Kelvin era mais interessante para a prática da engenharia, mas
ela estava longe da realidade, pois, afinal, a maioria da população não se interessava por máquinas
térmicas e pela produção de trabalho. Ele observou o calor trocado entre dois corpos com temperaturas
15
Isto é evidentemente menor que a energia contida em um kg de gasolina (44 000 kJ) mas não tem nenhum efeito
nocivo de poluição etc. É equivalente à energia cinética de um automóvel pequeno (pesando uma tonelada) a 70 km/h.
Ou seja, não é nada desprezível.
. 9 . Sala de Leitura A Segunda Lei da Termodinâmica diferentes, algo relevante para as máquinas refrigeradoras. Reconheceu em um fenômeno corriqueiro
que tanto a sopa quente como a xícara de café ou de chá se esfriam enquanto o calor é trocado (“flui”)
espontaneamente entre o líquido e o ambiente.
Espontaneamente16 aqui significa “por si só”, sem agentes externos (tais como a colher agitando a sopa,
um sopro ou um ventilador). Para Clausius, a tendência da energia é fluir do corpo de alta temperatura
para o corpo de baixa temperatura. Essa tendência é controlada por um isolante térmico conveniente,
pois este afeta a taxa de troca de calor. Assim, a espontaneidade não está envolvida com o tempo,
como se pensa.
Entretanto, o processo inverso, o aquecimento adicional da sopa quente, isto é, a passagem de energia
térmica do corpo frio ao corpo quente não é espontâneo. Existe, portanto, uma falta de simetria (ou
assimetria) na Natureza. Isso será retomado adiante. Este argumento é hoje conhecido como a
Formulação (ou Postulado) de Clausius para a 2ª. Lei:
Calor não passa de um corpo em baixa temperatura para outro em alta
temperatura sem que haja outros efeitos, ou seja, não passa
espontaneamente.
Dito de forma mais informal:
Para que calor possa passar de um corpo frio para um corpo quente será
preciso ceder trabalho. O refrigerador deve ser ligado à rede elétrica.
Deve ser registrado que os dois Postulados, o de Kelvin e o de Clausius, são resultados de observações.
Ninguém até hoje conseguiu construir uma máquina com eficiência 100% e nem transferir energia
térmica de um corpo de baixa temperatura a um de alta temperatura espontaneamente. Mas, como já
foi comentado, não são duas novas leis. Elas são absolutamente equivalentes, como veremos no
próximo parágrafo.
Considere a existência de um motor que não precise liberar energia para uma fonte fria (ou seja, o
motor produz trabalho W a partir do calor Q de uma única fonte de calor, com eficiência 100%). O
trabalho produzido nessa máquina será utilizado para acionar um refrigerador, que retira energia QF da
fonte fria e o libera na fonte quente como QQ.
16
Isto acontece também com um sorvete gelado (corpo em baixa temperatura) que irá espontaneamente derreter se
deixado fora da geladeira recebendo energia térmica da fonte quente (o ar ambiente). Como a massa do sorvete não é lá
muito grande, ele não consegue manter sua temperatura constante. Não pode ser considerado como uma fonte (fria).
. 10 . Sala de Leitura A Segunda Lei da Termodinâmica Utilizando a Primeira Lei da Termodinâmica, pode-se escrever para a máquina térmica:
W=Q
A máquina refrigeradora recebe trabalho WR (negativo), retira calor QF da fonte fria e libera calor QQ à
fonte quente. Da Primeira Lei, tem-se:
− WR = Q F − QQ
⇒ QQ = Q F + WR
A equação acima indica que a quantidade de energia transferida para a fonte quente é igual à retirada
da fonte fria, mais a que entra na forma de trabalho17. Como tais equipamentos podem sempre ser
regulados, podemos ajustá-los de forma que a quantidade de trabalho produzido pela primeira
máquina seja igual à necessária para mover o refrigerador. Com isto:
W = WR
Isso é equivalente ao uso de uma única fonte quente, como indicado na figura:
17
Isto explica porque não é possível refrigerar a cozinha se deixarmos a porta da geladeira aberta: a soma da energia que
é retirada da fonte fria (espaço da geladeira) mais a energia elétrica que é consumida pelo compressor é igual à energia
liberada na serpentina (na verdade, no condensador) que fica atrás da geladeira.
. 11 . Sala de Leitura A Segunda Lei da Termodinâmica Pelo acoplamento das duas máquinas em um único recipiente, isto é, considerando as duas máquinas
como se fossem uma única, para todos os efeitos possíveis, a transferência de energia da fonte fria para
a fonte quente se dá sem o consumo de trabalho externo, ou seja, sem nenhum efeito externo. Pela
Primeira Lei da Termodinâmica, QF + Q = QQ. Com isso, a fonte quente libera energia Q para a máquina
da esquerda e recebe de volta energia Q pela máquina refrigeradora. Na prática, é uma operação inútil
que pode ser descartada. Em consequência, o que sobra é apenas a transferência de energia QF da fonte
fria para a fonte quente. Claramente, esse equipamento não pode funcionar (ou existir), pois a
experiência indica que o calor flui naturalmente de uma fonte quente para uma fonte fria, nunca ao
contrário.
Nos livros de Termodinâmica, prova-se que a negação do Postulado de Clausius implica na negação do
Postulado de Kelvin, mas isso não será feito aqui.
Se alguém construir uma máquina térmica com 100% de eficiência, este
alguém poderá usar a mesma máquina para transferir energia de uma
fonte fria para outra - sem gastar trabalho (ou dinheiro). Ficará
imensamente milionário instantaneamente... vendendo geladeiras,
aparelhos de ar condicionado etc.
4 Segunda Lei: Reconhecendo a Assimetria
A Literatura destaca uma grande diferença entre as duas leis. A Primeira Lei sinaliza a possibilidade da
(inter) conversão de calor e trabalho, ou seja, a existência de uma simetria. Já a Segunda Lei é mais
restritiva: um corpo quente perderá energia no contato com o corpo frio sem nenhum efeito extra (no
resto do Universo), mas não ganhará energia (e com isto, se aquecer ainda mais) no mesmo contato e
nas mesmas condições. Isso constitui uma assimetria, permitindo que determinados fenômenos e
processos inversos aconteçam.
. 12 . Sala de Leitura A Segunda Lei da Termodinâmica Querem um exemplo? Bem, sabemos que ao frearmos um automóvel, sua
energia cinética é transferia aos freios. Estes se aquecem e após algum
tempo, a energia térmica é transferida ao meio ambiente, pois notamos que
os freios se resfriam, retornando à temperatura ambiente inicial. A energia
térmica que foi transferida ao ambiente é absorvida por ele. Não notamos
nenhum aumento na sua temperatura, porque a quantidade de massa do
ambiente é muito grande.
Transformar energia cinética em energia térmica é algo costumeiro na nossa vida. Porém, até hoje,
ninguém conseguiu pôr o citado automóvel em movimento através de um aquecimento direto, ou seja,
transformar energia térmica em energia cinética não é algo natural.
Imagine, por um momento, que isso seja possível. Teríamos um maior
problema com o trânsito caótico de pedras (e tudo mais), que entrariam
em movimento após terem recebido energia térmica do nosso Sol!
Para que isso aconteça, isto é, para que as coisas entrem em movimento, é necessário a queima de
combustível, o uso de um motor - causando uma série de danos ao meio ambiente. Em resumo: não é
possível converter energia térmica em cinética sem outros efeitos.
Dizemos, então, que o processo é irreversível ou de forma mais conceitual, assimétrico. Essa assimetria
é observada em inúmeras outras situações. Considere, por exemplo, um recipiente com uma partição
interna, dividida em dois. No espaço da esquerda, coloque um corante vermelho (ou água). No espaço
da direita, coloque um corante azul (ou óleo). A experiência indica que ao se retirar a partição, o corante
vermelho invade o espaço da direita e vice-versa (esta é a tendência espontânea). Há uma mistura e, ao
final, uma tonalidade única é obtida. Até esta data, nunca foi observada a situação na qual a separação
ocorre, e cada corante retoma espontaneamente (lembre-se, sem a realização de trabalho de
bombeamento) para o seu lado. A condição mais provável é, obviamente, aquela na qual os dois
corantes encontram-se misturados.
Observe que algo foi perdido. Antes da retirada da partição havia certa organização e, para descrevê-la,
podia-se dizer algo como “a tinta vermelha está no espaço esquerdo e a tinta azul está no espaço da
direita”. Após a mistura, a descrição ficou mais simples. Em suma, havia uma ordem que foi perdida
com a mistura. Para que a condição inicial seja recuperada, será preciso gastar trabalho (energia). Isso
será discutido novamente adiante, mas lembre-se de que esse conceito não é restrito a tintas e que é
muito mais fácil encontrar as tintas misturadas do que separadas.
. 13 . Sala de Leitura A Segunda Lei da Termodinâmica Considere seu próprio quarto. Após a arrumação, você poderá encontrar
as meias na primeira gaveta do seu armário, as calças na segunda, os
pijamas na terceira e assim por diante. Todas as roupas ordenadas.
Entretanto, após alguns dias, não mais será possível identificar a ordem,
pois algumas meias serão encontradas na quinta gaveta, outras sobre a
cama, algumas camisas dentro da segunda gaveta etc. Uma grande
desordem. Novamente, a ordem foi perdida. Para a recuperarmos
precisaremos gastar energia rearrumando o quarto. Mas não é mais fácil
encontrar o quarto desarrumado?
Outros exemplos dessa situação são a mistura espontânea de dois gases, a secagem de roupas em um
varal, gotas de tinta derramadas em copos com água, a perda do CO2 de um refrigerante etc. Os
processos inversos nunca são vistos ocorrendo naturalmente. É claro que isso não é uma prova. Mas,
exatamente por isso, o feito de Clausius foi notável. Ele indica que todos os processos espontâneos são
descritos por uma lei e que há uma propriedade indicando a direção em que os fenômenos ocorrem.
Essa propriedade é a entropia, que será definida adiante.
5 O Ciclo Proposto por Carnot
Considere um recipiente de volume V contendo um fluido (líquido ou gás) qualquer. A parte superior
do recipiente (digamos, um cilindro) é selada pelo uso de um pistão móvel. Esse sistema é a máquina
térmica mais simples que podemos imaginar.
O recipiente está inicialmente no estado termodinâmico (definido pela pressão e
temperatura do fluido) que chamaremos de Estado 1. Nessa condição, o cilindro e o
pistão estão isolados termicamente, ou seja, não podem trocar calor com o ambiente
externo, não importando as temperaturas. Suponha que a temperatura nessa
situação seja T1 = 0 oC.
. 14 . Sala de Leitura A Segunda Lei da Termodinâmica O Ciclo proposto por Carnot começa colocando-se um peso sobre o
pistão. Em consequência da ação da gravidade, há a compressão do
fluido, resultado da diminuição do volume. A pressão dentro do
cilindro aumenta rapidamente. Como o conjunto está isolado
termicamente do exterior, esta compressão é dita adiabática. Como
o peso faz parte do ambiente exterior ao sistema, dizemos que
trabalho foi realizado no sistema. A compressão acontece até que um novo estado
termodinâmico (novamente definido por uma pressão e uma temperatura do fluido)
seja alcançado. Este novo estado será chamado de Estado 2. A temperatura nesse
estado é T2. Suponha T2 = 95 oC.
O ciclo continua e para o próximo processo, retiramos parte do isolamento do sistema
(cilindro + pistão) e o colocamos sobre um reservatório externo de calor. Esse
reservatório é essencialmente outro recipiente que contém uma massa muito grande
de matéria mantida a uma temperatura ligeiramente superior aos 95 oC. Digamos
que T(fonte quente) = 100 oC. Chamamos isso de uma fonte térmica. Ela é capaz de
liberar energia (por conta de uma diferença de temperaturas) sem que a sua própria
temperatura seja afetada.
Como há contato térmico entre os dois corpos mantidos a diferentes temperaturas, a energia térmica
irá fluir da fonte quente para a máquina térmica. Considerando que a massa da fonte seja bem maior
do que a massa do sistema, após o tempo necessário ao equilíbrio, a temperatura do sistema será
eventualmente igual à da fonte.
Como o fluido dentro do cilindro pode se expandir, pois o pistão é móvel, o volume interno aumenta
(pois energia está sendo transferida a ele). A pressão dentro do sistema vai caindo à
medida que o volume aumenta. Nesse processo, o pistão é empurrado pela expansão
do fluido e, assim, dizemos que o fluido realiza trabalho
sobre o pistão. Esse trabalho pode ser utilizado para girar as
rodas do carro, por exemplo. Com isso, atingimos o Estado
Termodinâmico que chamaremos de Estado 3.
Nessa
expansão, o sistema absorveu energia na forma de calor.
. 15 . Sala de Leitura A Segunda Lei da Termodinâmica Nesse ponto, o isolamento térmico é colocado de volta e o peso é retirado, provocando uma posterior
expansão do fluido. O Estado 4 é alcançado. Suponha que a temperatura neste ponto seja T4 = 5 oC.
Como é desejado que a produção de trabalho seja contínua18, há necessidade de completar o ciclo. Para
isso, coloca-se o sistema em contato com uma segunda fonte térmica, com características semelhantes
às da fonte quente, mas de temperatura T(fonte fria) = 0 oC. Após um tempo suficiente, a temperatura
do sistema cai também para o mesmo valor.
Se a sequência de processos acima (formando o ciclo) for feita muito lentamente, obteremos o
chamado Ciclo de Carnot. Se isso for possível, poderemos aumentar a temperatura do estado
termodinâmico E2 - igualando-a com a temperatura da fonte quente (100 oC), e reduzir ou aumentar a
temperatura do estado E4 - igualando-a com a temperatura da fonte fria (0 oC). Em resumo: os
processos de troca do ciclo de Carnot são realizados sem diferença de temperaturas entre as fontes e o
sistema. Isso só é possível se forem realizados lentamente e com trocadores de calor de área muito
grande (o que não é nada prático).
Na idealização de Carnot, o ciclo básico é então composto por dois processos isotérmicos (durante os
quais há troca de calor) e dois processos adiabáticos (sem troca de calor). Em um diagrama indicador
(pressão x volume), esse ciclo é representado como mostrado adiante (considerando Tq = 100 oC, P1 =
120 kPa, Tf = 0oC e P3 = 120 KPa).
18
Afinal, não faz sentido que o automóvel ande só 10 metros, não é mesmo?
. 16 . Sala de Leitura A Segunda Lei da Termodinâmica Como temos um ciclo termodinâmico, a área interna limitada pelas curvas representativas dos
processos é indicativa do trabalho líquido realizado19. Como é possível ver, a área útil no caso das
máquinas que seguem o Ciclo de Carnot é muito pequena, o que não é nada interessante sob o ponto
de vista do trabalho útil. A eficiência do ciclo mostrado na figura anterior é de 27%. Se aumentarmos a
temperatura da fonte quente para 300 oC, P3 = 300 kPa, a eficiência aumenta para 52,3%, mas a área útil
continua mínima, como mostra a próxima figura. Este é o grande problema do Ciclo de Carnot: máxima
eficiência, porém baixíssimo trabalho útil disponível no eixo.
19
Pela Primeira Lei da Termodinâmica,
também o calor líquido trocado.
Q = ΔU + W .
Como temos um ciclo,
. 17 . ΔU = 0 .
Portanto, a área representa
Sala de Leitura A Segunda Lei da Termodinâmica Assim, na prática, utilizam-se outros ciclos, tais como: OTTO (nos motores dos automóveis), DIESEL,
RANKINE etc., que não têm eficiência máxima como o de Carnot, mas têm área útil maior - propiciando
a realização de uma grande quantidade de trabalho útil.
Nem sempre
vantajoso.
ter
eficiência
máxima
é
6 Entropia: uma nova Propriedade Termodinâmica
Ao aceitar a comprovação experimental feita por Joule - da equivalência entre calor e trabalho - e após
corrigir os argumentos de Carnot, Clausius formulou em 1850 que: a) a energia é conservada e b) o calor
flui naturalmente de uma fonte quente para uma fonte fria. De uma forma breve, essa conclusão
constitui as duas principais leis da Termodinâmica. Porém, Clausius não estava confortável com o
segundo argumento, por conta da desigualdade no tratamento (ou seja, da assimetria). O
primeiro definia um argumento matemático enquanto que o segundo, um argumento qualitativo.
Alguns anos após, em 1854, Clausius abandonou seu argumento para a Segunda Lei e retomou o
conceito da máquina térmica reversível - capaz de receber calor de uma fonte fria, produzir trabalho e
rejeitar calor para uma fonte fria (pelo comum, o ambiente), seguindo sempre processos sem atrito,
reversíveis. Mas quanto de calor poderia ser convertido em trabalho ou quanto de calor teria de ser
liberado para a fonte fria? Clausius sabia que a Primeira Lei indicava claramente que a parcela de
energia convertida em trabalho mais a parcela de energia liberada para a fonte fria era igual à parcela
de energia absorvida da fonte quente, ou seja:
QQ = W + QF
⇒ W = QQ − Q F
Mas quanto deveria valer cada parcela, isto é, QQ e QF?
Faltava uma equação para relacionar QQ com QF!
Graças a sua capacidade intelectual, Clausius observou que a razão entre a grande quantidade de calor
liberado pela fonte quente (QQ) e pela temperatura da câmara de combustão (TQ) era sempre igual ao
muito menor calor liberado pela máquina à fonte fria (QF) dividido pela sua temperatura20 (TF). Essa
igualdade, para ele, significa que havia algo por trás: não poderia ser uma simples coincidência, afinal,
20
Esta razão só é igual se a temperatura for definida segundo a escala absoluta de temperaturas, estabelecida havia
pouco tempo (1848), por Kelvin. A razão não vale se outra escala for usada, como por exemplo, a escala Celsius.
. 18 . Sala de Leitura A Segunda Lei da Termodinâmica no equilíbrio térmico, a variação de temperatura era nula; em processos isotérmicos de gases perfeitos,
a variação de energia interna era nula. Assim....
Clausius finalmente definiu a variação da entropia de um sistema como sendo a fração entre o calor
trocado reversivelmente pela sua temperatura (absoluta), ou seja:
Variação de Entropia =
Calor Trocado Reversivelmente
T
O nome entropia significa transformação em grego. Foi escolhido
por Clausius por ser parecido com energia, que indica o estado
termodinâmico do sistema. Para Clausius, a nova propriedade
refere-se à mudança do estado.
É, em uma visão macrocósmica, uma medida da qualidade da energia armazenada, como será visto
adiante. Por ora, vamos apenas associá-la à desordem. Se a matéria e a energia estiverem distribuídas
de uma forma desordenada, como em um gás, então a entropia é alta. Porém, se o armazenamento for
feito de forma ordenada, como em um cristal, a entropia é baixa. Se você estiver em uma biblioteca e
bater palmas, o resultado poderá ser desastroso: grande aumento de desordem, grande aumento de
entropia. Porém, se você estiver em um jogo de futebol, para causar o mesmo aumento de desordem e
de entropia, você deverá fazer muito mais. Visto de outra forma, o mesmo bater de palmas irá causar
um pequeno, desprezível, aumento de desordem e de entropia. De qualquer forma, após a definição
formal da entropia, uma nova formulação da Segunda Lei da Termodinâmica pode ser apresentada:
A entropia do Universo aumenta no decorrer de qualquer ocorrência
espontânea.
O Universo aqui significa o sistema termodinâmico e a sua vizinhança (ou meio que o envolve). Com
isso, surge a possibilidade de haver diminuição de entropia do sistema ou da vizinhança, mas não dos
dois simultaneamente.
Esse novo conceito teve consequências diversas na ciência e questionamentos sérios em religião (afinal,
alguma coisa era ilimitada), mas Clausius sabia que as duas leis não eram coincidentes. A entropia tinha
um comportamento assimétrico, ao contrário da energia.
Como a energia térmica só pode fluir do quente para o frio, em escala Universal, isso significa que as
zonas quentes ficariam mais frias, e as frias, mais quentes. No final dos tempos, não mais existiriam
. 19 . Sala de Leitura A Segunda Lei da Termodinâmica áreas quentes e frias: todo o Universo ficará à mesma temperatura, em equilíbrio térmico. Claro, se os
conceitos de Clausius puderem ser generalizados para a escala do Universo, o que é questionável.
A entropia de um sistema isolado cresce até um valor máximo
característico das condições existentes. Atingido este patamar, não
haverá mais crescimento, tampouco decrescimento – de acordo com a
Segunda Lei. Assim, a única possibilidade é o término de todos os
processos termodinâmicos.
É importante agora verificar o Postulado de Kelvin para a Segunda Lei em termos da entropia. Para isso,
supõe-se a existência de uma máquina térmica - produtora de trabalho - que não precisa de uma fonte
fria: a eficiência desta máquina será 100%.
Quando a energia sai da fonte quente, há uma diminuição da entropia dela. A transferência desta
energia ao ambiente - sob a forma de trabalho - não produz variação de entropia, pois não há troca de
calor (veja a definição de entropia). Portanto, a única variação de entropia que existe é o decréscimo
que ocorre na fonte. Isto claramente contraria o enunciado mostrado anteriormente. Logo, uma
máquina trabalhando sem uma fonte fria não pode produzir trabalho.
Se, entretanto, uma fonte fria estiver presente - como em uma máquina real, então a situação é
plausível. Como antes, haverá decréscimo na entropia da fonte quente e - como será preciso liberar
energia para a fonte fria - haverá um aumento de entropia associada a ela. Como a temperatura desta
última fonte é baixa, necessariamente baixa, mesmo uma pequena quantidade de calor poderá resultar
em um grande aumento de entropia, tal que cancele a diminuição anterior e dê um resultado positivo,
exatamente como previsto pela Segunda Lei. Veja a relação abaixo:
Considere que QQ saia da fonte quente. Então, a entropia cai de QQ / TQ. A energia liberada à fonte fria
(QF) resulta em um aumento de entropia QF / TF. Para que a variação líquida de entropia seja positiva, é
preciso que:
. 20 . Sala de Leitura A Segunda Lei da Termodinâmica QQ
TQ
≥
QF
TF
Na condição limite, podemos ter:
QQ
TQ
=
QF
T
⇒ QF = QQ × F
TF
TQ
Assim, o trabalho realizado (W), que é determinado pela Primeira Lei da Termodinâmica, escreve-se:
W = QQ − Q F = QQ − QQ ×
⎡
TF
T ⎤
= Q Q × ⎢1 − F ⎥
TQ
⎢⎣ TQ ⎥⎦
A eficiência de uma máquina térmica, genericamente falando, pode ser definida como sendo a razão
entre o trabalho obtido pelo preço de se adquirir este trabalho. No caso, este preço se traduz na
quantidade QQ (que está associada à queima do combustível). Portanto:
η=
W
QQ
Assim, na condição limite, a eficiência térmica da Máquina proposta por Carnot é recuperada pelo
argumento de Clausius:
η = 1−
TF
TQ
Deve ficar claro que o conceito envolvendo essa nova propriedade tem aplicação muito mais ampla do
que para as máquinas térmicas! Considere, por exemplo, uma xícara de café esfriando: o calor (Q) é
trocado com o ambiente. Como a temperatura do café é bastante superior à do ambiente, o decréscimo
da entropia do café (Q / TQ) é inferior ao aumento da entropia do ambiente (Q / TF). Como resultado, a
entropia do Universo aumenta completamente de acordo com a nova formulação da Segunda Lei da
Termodinâmica.
Clausius examinou inúmeros processos e acabou concluindo que a fração Q / T é constante ao longo
dos processos reversíveis e aumenta ao longo dos processos irreversíveis. Finalmente, em 1865,
Clausius apresenta a sua formulação definitiva para as duas principais leis da Termodinâmica:
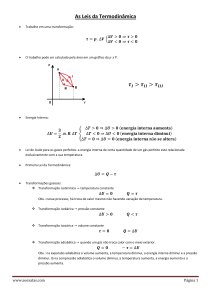
. 21 . Sala de Leitura A Segunda Lei da Termodinâmica 1. A energia se conserva, ΔE Universo = 0
2. A entropia do Universo tende a um máximo, ΔS Universo ≥ 0
Apesar de toda esta extensa contribuição, fato é que Clausius não conseguiu responder a uma questão
fundamental: o que é a entropia? Sua definição (razão entre calor reversivelmente trocado e
temperatura absoluta) era conhecida, mas o que ela significava? Esta pergunta só começou a ser
respondida com as análises e contribuições estatísticas de Maxwell, por certo. Porém, certamente foi
Boltzmann - como veremos adiante, que forneceu a explicação mais clara e evidente.
7 Entendendo o significado da Entropia21
Uma das ideias mais antigas da Fisica é aquela que trata do modelo (ou ideia) atômico da matéria. Já na
Grécia antiga (com a proposta de Demócrito), há mais de 2 mil anos, o conceito já era conhecido.
Apesar da aparência contínua, o mundo consiste de inúmeras particulas de matéria dentro de vazios.
Essa ideia não vigorou muito, de tão revolucionária que era, pois contradizia os sentidos. Era apenas
uma especulação dos gregos nos desígnios da Natureza. Mas que especulação!
No século XVIII, Daniel Bernoulli (1738) recuperou esse conceito e introduziu o modelo das bolas de
bilhar, obtendo um modelo cujos resultados podiam ser testados.
O modelo não era adequado para líquidos e sólidos, por conta das forças internas (chamadas de
intermoleculares) que mantêm as moléculas juntas. Porém, o modelo funcionava bem para gases.
Como os átomos, nesses casos, estavam bastante afastados - pouco influenciando uns aos outros - as
forças internas eram irrelevantes. Somente as colisões com as paredes dos recipientes que os contêm
eram importantes para a definição das propriedades mecânicas, óticas e térmicas. Usando ar como
exemplo, Bernoulli considerou que o gás era composto por partículas diminutas, infinitas, com
movimentos rápidos e nunca colidindo umas com as outras. Por serem duras e elásticas, elas podiam
ser imaginadas como bolas de bilhar em miniatura.
De acordo com o modelo de Bernoulli, a pressão - definida como a força exercida pelo gás em cada
unidade de área da parede - é causada pelo contínuo bombardeamento das bolas de bilhar contra as
paredes do recipiente. Esse modelo simples, que pode ser representado em qualquer laboratório por
bolas de “ping-pong”, constituiu e ainda constitui um trampolim entre o mundo onde vivemos e o
mundo inacessível dos átomos. Explicação análoga forneceu uma bela descrição de outra propriedade:
a temperatura. Por exemplo, a existência do zero absoluto é uma condição termodinâmica na qual a
energia cinética associada às flutuações de velocidades das moléculas é zero.
Nesse contexto, calor era simplesmente a soma das energias cinéticas de todas as moléculas. Calor era
uma característica macroscópica, envolvendo trilhões de moléculas; enquanto que temperatura era
microscópica, uma propriedade de molécula comum.
21
Esta seção contém material que talvez seja avançado para alunos. Entretanto, como se entende hoje que a Entropia só
pode ser explicada a partir da percepção atomística da matéria, a inclusão desta discussão é algo fundamental. O autor
recomenda que os exercícios citados sejam feitos pelos alunos com acompanhamento.
. 22 . Sala de Leitura A Segunda Lei da Termodinâmica O conceito atomístico de matéria acabou gerando uma grande transformação no pensamento e no
entendimento das questões da Física. Desde sempre, podia ser dito, o foco era a aplicação das leis do
movimento (a mecânica) aos objetos visíveis, observados e até manipulados. Havia uma grande dose de
previsibilidade. Mas com a visão atomística voltando à cena com grande e positivo impacto, a visão era
nas moléculas, “coisas” cuja existência era questionada - por serem muito pequenas para serem vistas e
muito numerosas para serem contadas individualmente. Porém, infelizmente, esse conceito veio muito
cedo. Era necessário que a humanidade aprendesse mais sobre o comportamento dos gases reais: a
teoria do calórico precisava ser derrubada; a conservação de energia, descoberta; e a equivalência entre
trabalho e calor precisava ser determinada. Assim, a teoria de Bernoulli voltou ao esquecimento,
aguardando momentos mais férteis.
Este esquecimento é parcialmente explicado, pois os gases - como ar não eram importantes, e sim, o café quente, os banhos frios. As
correntes convectivas de aquecimento e resfriamento do ar não eram
muito importantes.
O brilhante cientista James Clerk Maxwell, um sujeito que se orgulhava em manter os pés do chão dos
laboratórios, uniu a eletricidade e o magnetismo formando uma área unificada do conhecimento.
Quando se enveredou para a Termodinâmica, procurou descobrir como ela poderia ser entendida a
partir dos átomos e moléculas, percebendo as limitações do seu método de trabalho. Ele precisava
perder o contato com a realidade e entrar em um mundo novo. Seguiu-se, então, para a Estatística
(teoria das probabilidades) para tentar entender calor e entropia.
Ele não conseguiu ir muito adiante com a Termodinâmica. Entretanto,
sem as suas descobertas sobre o potencial da Estatística - como grande
arma no arsenal da Física - talvez a entropia continuasse obscura, ainda
que fosse uma grande ferramenta por causa da sua relação com os
processos reais e os reversíveis.
7. 1 A contribuição da Estatística
A contribuição do cálculo de probabilidades à ciência pode ser entendida mediante o uso de algumas
poucas moedas (ou dados), paciência, lápis e papel, além de alguns experimentos simples. O primeiro
deles, muito conhecido, é o “cara ou coroa”.
Popularmente é dito que se a moeda for jogada, a probabilidade de sair uma “cara” é de 50%. Porém, se
ela for jogada uma única vez, esta afirmação perde sentido (pois poderá sair coroa). O conceito da
probabilidade só tem sentido se a moeda for jogada repetidamente. Para 100 jogadas, teremos
. 23 . Sala de Leitura A Segunda Lei da Termodinâmica aproximadamente 50 caras. Apenas quando o número de jogadas for imensamente grande é que se
pode garantir os 50% de probabilidade das caras.
Comece o experimento com apenas duas moedas, jogadas uma única vez. O resultado pode ser uma
das situações abaixo:
Situação 1:
Moeda 1: cara
Moeda 2: cara
Situação 2:
Moeda 1: coroa
Moeda 2: coroa
Situação 3:
Moeda 1: cara
Moeda 2: coroa
Situação 4:
Moeda 1: coroa
Moeda 2: cara
São, em princípio, quatro situações. Entretanto, se as duas moedas forem absolutamente iguais, será
impossível diferenciar a situação três da situação quatro. Como as moléculas são indistinguíveis,
considere que sejam apenas três situações (podem ser chamadas de estados):
Estado 1: duas moedas mostrando a mesma face = cara;
Estado 2: duas moedas mostrando a mesma face = coroa;
Estado 3: uma moeda mostrando a face cara e a outra mostrando a face coroa.
Jogue as duas moedas em um determinado número de vezes, por exemplo, dez. A cada jogada, anote
o resultado em uma tabela. Se duas caras forem obtidas, faça uma anotação na coluna correspondente.
Após dez jogadas, some o número de vezes que o Estado 1 (caracterizado pelas duas caras) foi
observado. Faça algo semelhante para as demais situações.
Deve ser observado que o Estado 3 (uma face “cara” e a outra face “coroa”)
pode ser alcançado de duas maneiras: a primeira moeda tira “cara” e a
segunda, “coroa”, e vice-versa. Isso não acontece com os outros Estados.
Assim, podemos dizer que há mais variedade no Estado 3 do que nos
demais.
. 24 . Sala de Leitura A Segunda Lei da Termodinâmica Em um experimento realizado, o seguinte panorama foi obtido:
Ou seja, em 40% das vezes (quatro ocorrências em dez jogadas), o estado observado foi o Estado 1, ou
seja, “duas caras” foram encontradas. Em 30% das vezes (três ocorrências em dez jogadas), o Estado 2
(duas coroas) e o Estado 3 (uma coroa e uma cara) foram observados. Nada muito interessante. Porém,
após ter jogado mais vezes22, os resultados foram:
Faça um teste: jogue duas moedas e anote o número de caras e
coroas. Registre como indicado anteriormente e depois faça um
gráfico das ocorrências.
22
Infelizmente, a teoria não tem meios de fornecer o número de vezes a ser jogado para que se obtenha o resultado
esperado.
. 25 . Sala de Leitura A Segunda Lei da Termodinâmica Assim, após um número muito grande de jogadas, os resultados indicados mostram que é mais
provável encontrar “cara e coroa” do que “2 caras” ou “2 coroas”. Pode ser dito que aquela condição é a
mais provável. Mas é claro que as outras situações podem ser encontradas, ainda que essas sejam
improváveis. Em um gráfico, os resultados acima são:
Considere agora o mesmo jogo. Pegue dessa vez quatro moedas. Os estados possíveis serão:
Estado 1: quatro moedas mostrando a mesma face = cara;
Estado 2: três moedas mostrando a face cara e a outra mostrando a face coroa;
Estado 3: duas moedas mostrando a face cara e outras 2 mostrando a face coroa;
Estado 4: uma moeda mostrando a face cara e outras 3 mostrando a face coroa;
Estado 5: quatro moedas mostrando a mesma face = coroa.
A experiência indica que se as moedas forem jogadas em um número muito grande de vezes, a
condição mais encontrada será aquela definida pelo Estado 3, no qual metade das moedas está
mostrando a face “caras” e a outra metade está mostrando a face “coroa”. Lembre-se: as moedas
continuam sendo absolutamente idênticas.
Nesse ponto, deve ser observado que o número de possibilidades aumenta com o número de moedas
e, ao mesmo tempo, o valor dos percentuais diminui (o que é razoável pois o número de estados ou
possibilidades aumenta).
. 26 . Sala de Leitura A Segunda Lei da Termodinâmica Novamente, observe que há mais variedade no Estado 3 (duas moedas
mostrando “cara” e as demais mostrando “coroa”) do que nos demais
Estados.
Com 150 moedas, o resultado será parecido com o gráfico a seguir:
Dessa forma, é muito mais fácil encontrar 75 caras e 75 moedas do que qualquer outra combinação.
Esse é sempre o estado mais provável, metade em cada situação. Em suma, a Natureza prefere a
variedade23.
23
O estudante perspicaz poderá se perguntar se há, de fato, diferença entre os estados representativos de 74, 75 ou 76
caras, por exemplo. A resposta é simples: não há muita diferença. A situação fica ainda mais patente quando lidarmos
com números imensamente grandes de partículas: há estados em que, embora conceitualmente diferentes, são
praticamente indistinguíveis.
. 27 . Sala de Leitura A Segunda Lei da Termodinâmica Antes de concluir que o conceito é limitado, veja um novo exemplo. Considere apenas três letras do
alfabeto: “S”, “L” e “A”. Pegue três dados comuns. Comece com um deles. Nas faces indicativas dos
números 1 e 6, cole uma pequena etiqueta com a letra “S”, por exemplo. Nas faces indicativas dos
números 2 e 5, cole a letra “L”; e nas duas outras faces, cole a letra “A”. Assim, ao jogar o dado, você irá
recuperar uma das três letras. Trabalhe com os dois outros dados de forma semelhante.
Jogue os três dados ao mesmo tempo. Combinando as três letras, você deverá obter uma das
combinações:
Jogando-se os três dados em um número imenso de vezes, todas as possibilidades irão aparecer.
Entretanto, o conceito estatístico das moléculas indica que elas são absolutamente indistinguíveis.
Assim, antes da análise do experimento, os resultados devem ser agrupados devidamente.
Por exemplo, note que não há diferença alguma se o primeiro dado indicar a letra S, o segundo a letra L
e o terceiro a letra A; ou se o primeiro indicar A, o segundo indicar L e o terceiro indicar S. Os dois
estados (podem ser chamados assim, não?) são indistinguíveis. Portanto, tem-se apenas 10
possibilidades (ou estados) diferentes:
Estado Um:
composto pelas letras LSA
3 letras diferentes
Estado Dois:
composto pelas letras SSA
2 letras iguais
Estado Três:
composto pelas letras LLA
Estado Quatro: composto pelas letras SSL
Estado Cinco: composto pelas letras LLS
. 28 . Sala de Leitura A Segunda Lei da Termodinâmica Estado Seis:
composto pelas letras AAL
Estado Sete:
composto pelas letras AAS
Estado Oito:
composto pelas letras LLL
Estado Nove:
composto pelas letras SSS
Estado Dez:
composto pelas letras AAA
3 letras iguais
Com essas considerações, os dados devem ser jogados em um grande número de vezes. Os resultados
são mostrados na tabela adiante:
Como pode ser visto, o estado (ou se você preferir, a configuração) mais provável é aquele no qual cada
um dos dados indica uma letra diferente (ou seja, a diversidade é a maior possível). Esse é o estado mais
provável, o de maior probabilidade. Observe ainda que a porcentagem indicativa do número de vezes
que aparecem os estados “LLL”, “AAA” e “SSS” são praticamente iguais (teoricamente, são idênticos),
ambos sendo os mais improváveis.
Pode-se concluir, desses dois experimentos, que há estados (ou
situações) mais prováveis (mais frequentes) e outros menos prováveis.
7. 2 A contribuição de Boltzmann
A relevância das contribuições de Ludwig Eduard Boltzmann pode ser explicitada pelo fato,
comumente aceito, de que sem ele, a Segunda Lei da Termodinâmica (ou o conceito da entropia) ficaria
para sempre sem explicação. Em resumo, é a visão atômica da matéria que permite um adequado
entendimento das propriedades termodinâmicas, tais como: pressão, temperatura, energia e entropia.
. 29 . Sala de Leitura A Segunda Lei da Termodinâmica Essa visão é fundamentada em dois grandes argumentos: o número imensamente gigantesco destas
partículas e a total identidade delas. As moléculas são absolutamente indistinguíveis24.
Boltzmann, já reconhecido como o último dos físicos clássicos, fez a ligação entre as propriedades
macroscópicas da matéria e o comportamento das partículas individuais - os seus átomos. Havia já um
estoque de fatos experimentais, mas a compreensão destas relações só poderia ser obtida quando uma
explicação em termos das partículas e de suas propriedades tivesse sido estabelecida. Faltava uma
explicação mecânica. Claro, Boltzmann foi muito criticado, pois a existência de átomos ainda não era
algo aceito por todos. Quando morreu, em 1906, novos conceitos e técnicas já estavam disponíveis e
terminaram por estabelecer o nome de Boltzmann como um grande físico teórico.
Para finalizar este estudo, vale lembrar que as chances de se obter metade das moedas mostrando a
face “caras” é bem maior do que nas demais situações (que chamamos de estados). Foi dito que a
probabilidade desta situação é bastante alta. Como a entropia mede, segundo Boltzmann, a
probabilidade e esta denota desordem, a entropia é associada à desordem. O fato de a entropia
aumentar continuamente ao longo dos processos espontâneos, é um indicativo de que a Natureza opta
sempre pela maior variedade e isto significa desordem. O estado no qual as “N” moedas mostram a
mesma face - “caras, digamos - é único, de baixíssima probabilidade e, portanto, de baixíssima entropia.
O mesmo tipo de análise pode ser feito para as cartas de um jogo de baralho. O estado inicial, na qual
as cartas estão ordenadas sequencialmente e por naipes, é um estado único, de baixíssima
probabilidade e, portanto, de baixíssima entropia. Após as cartas terem sido misturadas, sai-se de um
estado ordenado para estados desordenados, de maior entropia. A volta ao estado ordenado original
requer trabalho: não é um evento espontâneo.
Boltzmann aplicou o seu novo conceito de entropia às diversas situações que já tinham sido estudadas,
como: na expansão livre de um gás em um recipiente anteriormente evacuado, na mistura de dois
gases etc. Em todas as situações, ele encontrou os mesmos resultados previstos por Clausius (veja as
próximas figuras). Passo a passo, ele seguiu o aumento de entropia no Universo e recuperou a Segunda
Lei da Termodinâmica. O conceito era bom:
A Segunda Lei da Termodinâmica é essencialmente uma lei de
probabilidade.
24
Como as moedas, nos exemplos anteriores.
. 30 . Sala de Leitura A Segunda Lei da Termodinâmica Situações de Baixas Entropias
Situações de Altas Entropias
(ou probabilidades)
(ou probabilidades)
A relação entre entropia, ordem e organização continua sendo boa. Porém, é preciso tomar cuidado
com o que é chamado comumente de ordem e desordem ou de organização e desorganização.
Considere, por exemplo, um saco com 5 bolas exatamente iguais, à exceção das cores. A bola 1 é
branca, a 2 é azul, a 3 é verde, a quarta é roxa e a quinta é preta. O experimento consiste na retirada de
. 31 . Sala de Leitura A Segunda Lei da Termodinâmica uma bola por vez. Na primeira rodada, a sequência retirada é, digamos: bolas Preta, Azul, Branca, Roxa,
Verde e Cinza. Chame essa sequência de Estado 1. Outras rodadas poderiam indicar:
Você percebe alguma ordem aqui? Isto é, em cada um desses estados? Aparentemente, são todos
desordenados, não havendo nada que distinga um dos outros. Conceitualmente, para que seja possível
indicar que determinado estado é ordenado, precisa-se descobrir uma maneira pela qual a ordem pode
ser referenciada, ou seja, é preciso ser possível fazer uma distinção ordenada entre os estados
desordenados.
A discussão detalhada desse novo conceito pode ser feita, mas requer outros conhecimentos que não
cabem neste texto. Por ora, vale registrar apenas que o Estado 2 pode ser facilmente definido como
ordenado (ou selecionado), se for notado que a sequência das bolas segue a ordem alfabética. Veja: a
primeira bola retirada foi a Azul, depois a Branca, seguida pela Cinza, pela Preta, pela Roxa e finalmente,
pela Verde. Nesse sentido, o critério que distingue o estado 2 é o alfabético. Assim, pode ser afirmado
que o estado 2 é ordenado. Sendo ordenado, tem uma probabilidade menor de ocorrer e, portanto, tem
entropia pequena.
Você consegue descobrir outro critério para algum outro estado?
Importante: a ordem precisa ser definida de forma clara, não é uma questão de ponto de vista.
8 Conclusões
Neste capítulo, a propriedade termodinâmica entropia foi apresentada tanto em sua visão histórica,
fenomenológica e, finalmente, em uma visão estatística, com o objetivo de desmistificá-la.
A partir de uma série de observações inteligentes de Sadi Carnot - sobre o funcionamento das
máquinas térmicas existentes - ele e outros cientistas chegaram à conclusão da existência de alguns
postulados. Estes foram definidos em termos absolutamente abstratos, que impunham (como ainda
impõem) limites à realização de processos e de ciclos (sequência de processos a serem realizados por
máquinas) - capazes de produzir trabalho ou de refrigerar ambientes.
O primeiro desses princípios, o da Conservação de Energia, traduz-se em:
. 32 . Sala de Leitura A Segunda Lei da Termodinâmica ΔE Universo = 0
Este princípio resultou na derrubada definitiva da teoria calórica, que tratava o calor como substância, e
também na equivalência entre calor e trabalho, reconhecidos como formas de energia (como tantas
outras). Se a variação total da Energia do Universo é sempre igual a zero, a energia total do Universo
será sempre uma constante. A energia não pode ser criada e nem destruída: só transformações são
possíveis. Um processo era proibido (a criação), mas o outro também era (a destruição). Detalhes desse
Primeiro Princípio (ou Lei) da Termodinâmica foram apresentados no capítulo anterior.
Carnot reconhecia que a existência de eficiências máximas (inferiores a 100%), de processos
(irreversíveis) que só poderiam acontecer de uma determinada forma - mas não de outra, indicando
assimetrias na Natureza - eram manifestações de ordem diferente. A passagem espontânea do calor de
um corpo quente para um corpo frio ou a transformação integral (isto é, com eficiência 100%) do
Porém, os processos inversos jamais foram
trabalho em calor são perfeitamente possíveis25.
observados.
Clausius definiu uma nova propriedade: a entropia, indicativa destas e de todas as outras assimetrias da
Natureza. Seu princípio resumia-se (e ainda resume-se) à expressão matemática:
ΔS Universo ≥ 0
Esta expressão indica que a variação total da entropia do Universo é sempre maior do que zero.
Uma versão popular desses dois princípios é:
1. Não há almoço de graça;
2. Você não pode escolher o prato a ser consumido.
25
Um aquecedor elétrico, por exemplo, converte o trabalho elétrico - recebido da tomada - em energia térmica, sem
outra perda.
. 33 . Sala de Leitura A Segunda Lei da Termodinâmica São quatro as leis da Termodinâmica. A terceira delas, na sua sequência
numérica, é a Segunda Lei, que foi a primeira a ser descoberta. A primeira
delas, a Lei Zero, foi a última a ser formulada. A Primeira Lei foi a segunda a
ser formulada e a Terceira Lei da Termodinâmica talvez nem seja mesmo uma
lei... Uma grande confusão!
Porém, a Física e o entendimento por trás dessas leis são, felizmente, mais
fáceis de serem entendidos. A Primeira Lei da Termodinâmica é conhecida
como a lei que diz: “a Energia se conserva”. A Segunda Lei da
Termodinâmica reconhece a existência de uma assimetria fundamental na
Natureza (coisas acontecem de uma nova forma, mas não de outra).
A entropia, como proposto matematicamente por Boltzmann, é uma medida do caos, da
desorganização, ainda que esta precise de uma conceituação clara. Maior probabilidade de ocorrência,
maior desorganização, maior caos são indicativos do crescimento da entropia. A lei da não-conservação
da entropia significa que o Universo tem se tornado gradativamente (ainda que muito lentamente para
a escala humana) um lugar mais caótico, mais calmo, ou seja, tem saído de um estado extremamente
organizado, de entropia mínima: a corda dada inicialmente está sendo gradualmente aliviada. O
engenheiro e o cientista podem se unir em uma busca importante: se todos os processos reais implicam
um aumento de entropia, os melhores processos reais são aqueles que reduzem a taxa de aumento.
. 34 .