P á g i n a | 162
Prof. Wagnner Melo, Leonardo, Tadeu, Willy Castro
ENEM
CIÊNCIAS DA NATUREZA E SUAS TECNOLOGIAS
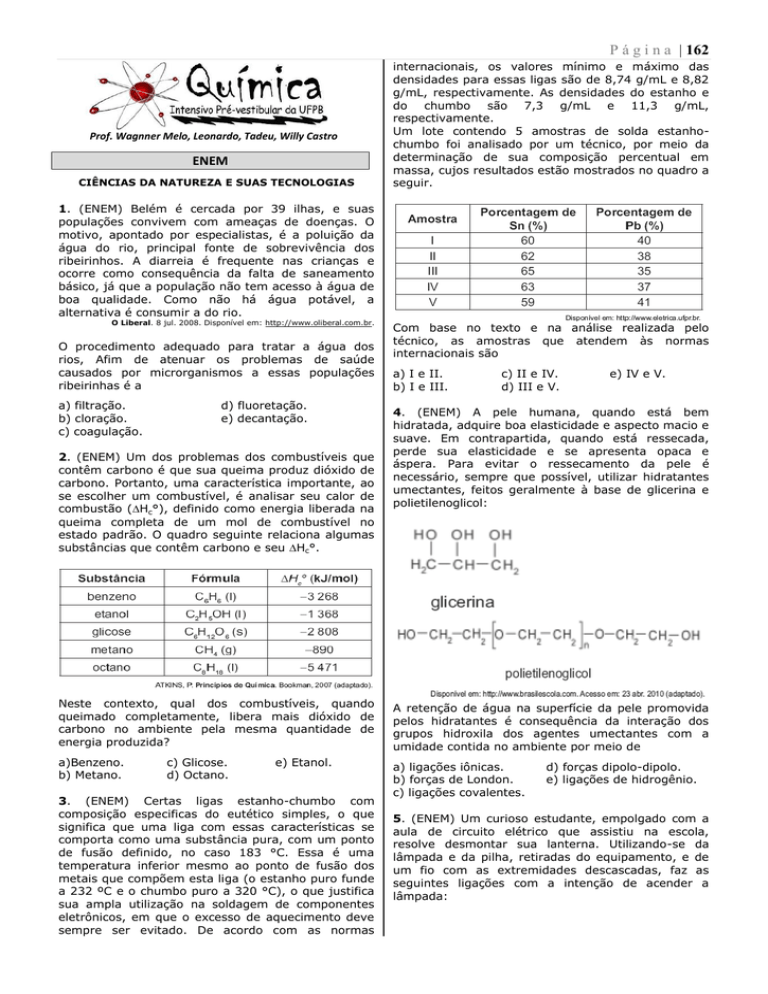
internacionais, os valores mínimo e máximo das
densidades para essas ligas são de 8,74 g/mL e 8,82
g/mL, respectivamente. As densidades do estanho e
do chumbo são 7,3 g/mL e 11,3 g/mL,
respectivamente.
Um lote contendo 5 amostras de solda estanhochumbo foi analisado por um técnico, por meio da
determinação de sua composição percentual em
massa, cujos resultados estão mostrados no quadro a
seguir.
1. (ENEM) Belém é cercada por 39 ilhas, e suas
populações convivem com ameaças de doenças. O
motivo, apontado por especialistas, é a poluição da
água do rio, principal fonte de sobrevivência dos
ribeirinhos. A diarreia é frequente nas crianças e
ocorre como consequência da falta de saneamento
básico, já que a população não tem acesso à água de
boa qualidade. Como não há água potável, a
alternativa é consumir a do rio.
O Liberal. 8 jul. 2008. Disponível em: http://www.oliberal.com.br.
O procedimento adequado para tratar a água dos
rios, Afim de atenuar os problemas de saúde
causados por microrganismos a essas populações
ribeirinhas é a
a) filtração.
b) cloração.
c) coagulação.
d) fluoretação.
e) decantação.
2. (ENEM) Um dos problemas dos combustíveis que
contêm carbono é que sua queima produz dióxido de
carbono. Portanto, uma característica importante, ao
se escolher um combustível, é analisar seu calor de
combustão (Hc°), definido como energia liberada na
queima completa de um mol de combustível no
estado padrão. O quadro seguinte relaciona algumas
substâncias que contêm carbono e seu Hc°.
Com base no texto e na análise realizada pelo
técnico, as amostras que atendem às normas
internacionais são
a) I e II.
b) I e III.
c) II e IV.
d) III e V.
e) IV e V.
4. (ENEM) A pele humana, quando está bem
hidratada, adquire boa elasticidade e aspecto macio e
suave. Em contrapartida, quando está ressecada,
perde sua elasticidade e se apresenta opaca e
áspera. Para evitar o ressecamento da pele é
necessário, sempre que possível, utilizar hidratantes
umectantes, feitos geralmente à base de glicerina e
polietilenoglicol:
Neste contexto, qual dos combustíveis, quando
queimado completamente, libera mais dióxido de
carbono no ambiente pela mesma quantidade de
energia produzida?
A retenção de água na superfície da pele promovida
pelos hidratantes é consequência da interação dos
grupos hidroxila dos agentes umectantes com a
umidade contida no ambiente por meio de
a)Benzeno.
b) Metano.
a) ligações iônicas.
b) forças de London.
c) ligações covalentes.
c) Glicose.
d) Octano.
e) Etanol.
3. (ENEM) Certas ligas estanho-chumbo com
composição especificas do eutético simples, o que
significa que uma liga com essas características se
comporta como uma substância pura, com um ponto
de fusão definido, no caso 183 °C. Essa é uma
temperatura inferior mesmo ao ponto de fusão dos
metais que compõem esta liga (o estanho puro funde
a 232 ºC e o chumbo puro a 320 °C), o que justifica
sua ampla utilização na soldagem de componentes
eletrônicos, em que o excesso de aquecimento deve
sempre ser evitado. De acordo com as normas
d) forças dipolo-dipolo.
e) ligações de hidrogênio.
5. (ENEM) Um curioso estudante, empolgado com a
aula de circuito elétrico que assistiu na escola,
resolve desmontar sua lanterna. Utilizando-se da
lâmpada e da pilha, retiradas do equipamento, e de
um fio com as extremidades descascadas, faz as
seguintes ligações com a intenção de acender a
lâmpada:
P á g i n a | 163
7. (ENEM) A bile é produzida pelo fígado,
armazenada na vesícula biliar e tem papel
fundamental na digestão de lipídeos. Os sais biliares
são esteroides sintetizados no fígado a partir do
colesterol, e sua rota de síntese envolve várias
etapas. Partindo do ácido cólico representado na
figura, ocorre a formação dos ácidos glicólico e
taurocólico; o prefixo glico- significa a presença de
um resíduo do aminoácido glicina e o prefixo tauro- ,
do aminoácido taurina.
Tendo por base os esquemas mostrados, em quais
casos a lâmpada acendeu?
a) (1), (3), (6)
b) (3), (4), (5)
c) (1), (3), (5)
d) (1), (3), (7)
e) (1), (2), (5)
6. (ENEM) Os biocombustíveis de primeira geração
são derivados da soja, milho e cana-de-açúcar e sua
produção
ocorre
através
da
fermentação.
Biocombustíveis derivados de material celulósico ou
biocombustíveis
de
segunda
geração
—
coloquialmente chamados de “gasolina de capim” —
são aqueles produzidos a partir de resíduos de
madeira (serragem, por exemplo), talos de milho,
palha de trigo ou capim de crescimento rápido e se
apresentam como uma alternativa para os problemas
enfrentados pelos de primeira geração, já que as
matérias-primas são baratas e abundantes.
DALE, B. E.; HUBER, G. W. Gasolina de capim e
outros vegetais.
Scientific American Brasil, Ago. 2009, nº 87 (adaptado).
O texto mostra um dos pontos de vista a respeito do
uso dos biocombustíveis na atualidade, os quais
a) são matrizes energéticas com menor carga de
poluição para o ambiente e podem propiciar a
geração de novos empregos, entretanto, para serem
oferecidos com baixo custo, a tecnologia da
degradação da celulose nos biocombustíveis de
segunda geração deve ser extremamente eficiente.
b) oferecem múltiplas dificuldades, pois a produção é
de alto custo, sua implantação não gera empregos, e
deve-se ter cuidado com o risco ambiental, pois eles
oferecerem os mesmos riscos que o uso de
combustíveis fósseis.
c) sendo de segunda geração, são produzidos por
uma tecnologia que acarreta problemas sociais,
sobretudo decorrente do fato de a matéria-prima ser
abundante e facilmente encontrada, o que impede a
geração de novos empregos.
d) sendo de primeira e segunda geração, são
produzidos por tecnologias que devem passar por
uma avaliação criteriosa quanto ao uso, pois uma
enfrenta o problema da falta de espaço para plantio
da matéria-prima e a outra impede a geração de
novas fontes de emprego.
e) podem acarretar sérios problemas econômicos e
sociais, pois a substituição do uso de petróleo afeta
negativamente toda uma cadeia produtiva na medida
em que exclui diversas fontes de emprego nas
refinarias, postos de gasolina e no transporte de
petróleo e gasolina.
ácido cólico
UCKO, D. A. Química para as Ciências da Saúde: uma Introdução à Química
Geral, Orgânica e Biológica. São Paulo: Manole,1992 (adaptado).
A combinação entre o ácido cólico e a glicina ou
taurina origina a função amida, formada pela reação
entre o grupo amina desses aminoácidos e o grupo
a) carboxila do ácido cólico.
b) aldeído do ácido cólico.
c) hidroxila do ácido cólico.
d) cetona do ácido cólico.
e) éster do ácido cólico.
8. (ENEM) Os refrigerantes têm-se tornado cada vez
mais o alvo de políticas públicas de saúde. Os de cola
apresentam ácido fosfórico, substância prejudicial à
fixação de cálcio, o mineral que é o principal
componente da matriz dos dentes. A cárie é um
processo dinâmico de desequilíbrio do processo de
desmineralização dentária, perda de minerais em
razão da acidez. Sabese que o principal componente
do esmalte do dente é um sal denominado
hidroxiapatita. O refrigerante, pela presença da
sacarose, faz decrescer o pH do biofilme (placa
bacteriana), provocando a desmineralização do
esmalte dentário. Os mecanismos de defesa salivar
levam de 20 a 30 minutos para normalizar o nível do
pH, remineralizando o dente. A equação química
seguinte representa esse processo:
Considerando que uma pessoa consuma refrigerantes
diariamente, poderá ocorrer um processo de
desmineralização dentária, devido ao aumento da
concentração de
a) OH-, que reage com os íons Ca2+, deslocando o
equilíbrio para a direita.
b) H+, que reage com as hidroxilas OH-, deslocando o
equilíbrio para a direita.
c) OH-, que reage com os íons Ca2+, deslocando o
equilíbrio para a esquerda.
P á g i n a | 164
d) H+, que reage com as hidroxilas OH-, deslocando o
equilíbrio para a esquerda.
e) Ca2+, que reage com as hidroxilas OH-, deslocando
o equilíbrio para a esquerda.
9. (ENEM) Segundo dados do Balanço Energético
Nacional de 2008, do Ministério das Minas e Energia,
a matriz energética brasileira é composta por
hidrelétrica (80%), termelétrica (19,9%) e eólica
(0,1%). Nas termelétricas, esse percentual é dividido
conforme o combustível usado, sendo: gás natural
(6,6%), biomassa (5,3%), derivados de petróleo
(3,3%), energia nuclear (3,1%) e carvão mineral
(1,6%). Com a geração de eletricidade da biomassa,
pode-se considerar que ocorre uma compensação do
carbono liberado na queima do material vegetal pela
absorção desse elemento no crescimento das plantas.
Entretanto, estudos indicam que as emissões de
metano
(CH4)
das
hidrelétricas
podem
ser
comparáveis às emissões de CO2 das termelétricas.
MORET, A. S.; FERREIRA, I. A. As hidrelétricas do Rio Madeira e os impactos
socioambientais da eletrificação no Brasil. Revista Ciência Hoje. V. 45, n° 265,
2009 (adaptado).
No Brasil, em termos do impacto das fontes de
energia no crescimento do efeito estufa, quanto à
emissão
de
gases,
as
hidrelétricas
seriam
consideradas como uma fonte
a) limpa de energia, contribuindo para minimizar os
efeitos deste fenômeno.
b) eficaz de energia, tomando-se o percentual de
oferta e os benefícios verificados.
c) limpa de energia, não afetando ou alterando os
níveis dos gases do efeito estufa.
d) poluidora, colaborando com níveis altos de gases
de efeito estufa em função de seu potencial de
oferta.
e) alternativa, tomando-se por referência a grande
emissão de gases de efeito estufa das demais fontes
geradoras.
10. (ENEM) O peróxido de hidrogênio é comumente
utilizado como antisséptico e alvejante. Também
pode ser empregado em trabalhos de restauração de
quadros enegrecidos e no clareamento de dentes. Na
presença de soluções ácidas de oxidantes, como o
permanganato de potássio, este óxido decompõe-se,
conforme a equação a seguir:
praticamente igual a zero. Entretanto, esse não é o
único ciclo biogeoquímico associado à produção de
etanol. O plantio da canade- açúcar, matéria-prima
para a produção de etanol, envolve a adição de
macronutrientes como enxofre, nitrogênio, fósforo e
potássio,
principais
elementos
envolvidos
no
crescimento de um vegetal.
Revista Química Nova na Escola. no 28, 2008.
O nitrogênio incorporado ao solo, como conseqüência
da atividade descrita anteriormente, é transformado
em nitrogênio ativo e afetará o meio ambiente,
causando
a) o acúmulo de sais insolúveis, desencadeando um
processo de salinificação do solo.
b) a eliminação de microrganismos existentes no solo
responsáveis pelo processo de desnitrificação.
c) a contaminação de rios e lagos devido à alta
solubilidade de íons como NO3- e NH4+ em água.
d) a diminuição do pH do solo pela presença de NH3,
que reage com a água, formando o NH4OH (aq).
e) a diminuição da oxigenação do solo, uma vez que
o nitrogênio ativo forma espécies químicas do tipo
NO2, NO3-, N2O.
12. (ENEM) Um dos processos usados no tratamento
do lixo é a incineração, que apresenta vantagens e
desvantagens. Em São Paulo, por exemplo, o lixo é
queimado a altas temperaturas e parte da energia
liberada é transformada em energia elétrica. No
entanto, a incineração provoca a emissão de
poluentes na atmosfera.
Uma forma de minimizar a desvantagem da
incineração, destacada no texto, é
a) aumentar o volume do lixo incinerado para
aumentar a produção de energia elétrica.
b) fomentar o uso de filtros nas chaminés dos
incineradores para diminuir a poluição do ar.
c) aumentar o volume do lixo para baratear os custos
operacionais relacionados ao processo.
d) fomentar a coleta seletiva de lixo nas cidades para
aumentar o volume de lixo incinerado.
e) diminuir a temperatura de incineração do lixo para
produzir maior quantidade de energia elétrica.
13. (ENEM)
De acordo com a estequiometria da reação descrita,
a quantidade de permanganato de potássio
necessária para reagir completamente com 20,0 mL
de uma solução 0,1 mol/L de peróxido de hidrogênio
é igual a
a) 2,0×100 mol.
b) 2,0×10-3 mol.
c) 8,0×10-1 mol.
d) 8,0×10-4 mol.
e) 5,0×10-3 mol.
11.
(ENEM)
O
etanol
é
considerado
um
biocombustível promissor, pois, sob o ponto de vista
do balanço de carbono, possui uma taxa de emissão
De acordo com o relatório “A grande sombra da
pecuária” (Livestock’s Long Shadow), feito pela
Organização das Nações Unidas para a Agricultura e
a Alimentação, o gado é responsável por cerca de
18% do aquecimento global, uma contribuição maior
que a do setor de transportes.
P á g i n a | 165
Disponível em: www.conpet.gov.br. Acesso em: 22 jun. 2010.
A criação de gado em larga escala contribui para o
aquecimento global por meio da emissão de
a) metano durante o processo de digestão.
b) óxido nitroso durante o processo de ruminação.
c) clorofluorcarbono durante o processo de
ruminação.
d) óxido nitroso durante o processo respiratório.
e) dióxido de enxofre durante o consumo de
pastagens.
14. (ENEM) As mobilizações para promover um
planeta melhor para as futuras gerações são cada
vez mais frequentes. A maior parte dos meios de
transporte de massa é atualmente movida pela
queima de um combustível fóssil. A título de
exemplificação do ônus causado por essa prática,
basta saber que um carro produz, em média, cerca
de 200 g de dióxido de carbono por km percorrido.
Um dos principais constituintes da gasolina é o
octano (C8H18). Por meio da combustão do octano é
possível a liberação de energia, permitindo que o
carro entre em movimento. A equação que
representa a reação química desse processo
demonstra que
quantidade de cádmio é volatilizada e emitida para o
meio ambiente quando as baterias gastas são
incineradas como componente do lixo. Com o
objetivo de evitar a emissão de cádmio para a
atmosfera durante a combustão é indicado que seja
feita a reciclagem dos materiais dessas baterias. Uma
maneira de separar o cádmio dos demais compostos
presentes na bateria é realizar o processo de
lixiviação ácida. Nela, tanto os metais (Cd, Ni e
eventualmente Co) como os hidróxidos de íons
metálicos Cd(OH)2(s), Ni(OH)2(s) , Co(OH)2(s)
presentes na bateria, reagem com uma mistura ácida
e são solubilizados. Em função da baixa seletividade
(todos os íons metálicos são solubilizados), após a
digestão ácida, é realizada uma etapa de extração
dos metais com solventes orgânicos de acordo com a
reação:
a) no processo há liberação de oxigênio, sob a forma
de O2.
b) O coeficiente estequiométrico para a água é de 8
para 1 do octano.
c) no processo há consumo de água, para que haja
liberação de energia.
d) o coeficiente estequiométrico para o oxigênio é
de12,5 para 1
e) o coeficiente estequiométrico para o gás carbônico
é de 9 para 1 do octano.
15. (ENEM) Ao colocar um pouco de açúcar na água
e mexer até a obtenção de uma só fase, prepara-se
uma solução. O mesmo acontece ao se adicionar um
pouquinho de sal à água e misturar bem. Uma
substância capaz de dissolver o soluto é denominada
solvente; por exemplo, a água é um solvente para o
açúcar, para o sal e para várias outras substâncias. A
figura a seguir ilustra essa citação.
Suponha que uma pessoa, para adoçar seu
cafezinho, tenha utilizado 3,42 g de sacarose (massa
molar igual a 342 g/mol) para uma xicara de 50 mL
do líquido. Qual a concentração final, em mol/L, de
sacarose nesse cafezinho?
a) 0,02
b) 0,2
c) 2
d) 200
e) 2000
16. (ENEM) As baterias de Ni – Cd muito utilizadas
no nosso cotidiano não devem ser descartadas em
lixos comuns uma vez que uma considerável
A reação descrita no texto mostra o processo de
extração dos metais por meio da reação com
moléculas orgânicas, X e Y. Considerando-se as
estruturas de X e Y e o processo de separação
descrito, pode-se afirmar que:
a) as moléculas X e Y atuam como extratores
catiônicos uma vez que a parte polar da molécula
troca o íon H+ pelo cátion do metal.
b) as moléculas X e Y atuam como extratores
aniônicos uma vez que a parte polar da molécula
troca o íon H+ pelo cátion do metal.
c) as moléculas X e Y atuam como extratores
catiônicos uma vez que a parte apolar da molécula
troca o íon pelo cátion do metal.
d) as moléculas X e Y atuam como extratores
aniônicos uma vez que a parte polar da molécula
troca o íon pelo cátion do metal.
e) as moléculas X e Y fazem ligações com os íons
metálicos resultando em compostos com caráter
apolar o que justifica a eficácia da extração.
17. (ENEM) O lixão que recebia 130 toneladas de lixo
e contaminava a região com o seu chorume (líquido
derivado da decomposição de compostos orgânicos)
foi recuperado, transformando-se em um aterro
P á g i n a | 166
sanitário controlado, mudando a qualidade de vida e
a paisagem e proporcionando condições dignas de
trabalho para os que dele subsistiam.
Quais procedimentos técnicos tornam o aterro
sanitário mais vantajoso que o lixão, em relação às
problemáticas abordadas no texto?
a) O lixo é recolhido e incinerado pela combustão a
altas temperaturas.
b) O lixo hospitalar é separado para ser enterrado e
sobre ele, colocada cal virgem.
c) O lixo orgânico e inorgânico é encoberto, e o
chorume canalizado para ser tratado e neutralizado.
d) O lixo orgânico é completamente separado do lixo
inorgânico, evitando a formação de chorume.
e) O lixo industrial é separado e acondicionado de
forma adequada, formando uma bolsa de resíduos.
18. (ENEM) A composição média de uma bateria
automotiva esgotada é de aproximadamente 32% Pb,
3% PbO, 17% PbO2 e 36% PbSO4. A média de massa
da pasta residual de uma bateria usada é de 6 kg,
onde 19% é PbO2, 60% PbSO4 e 21% Pb. Entre todos
os compostos de chumbo presentes na pasta, o que
mais preocupa é o sulfato de chumbo (II), pois nos
processos pirometalúrgicos, em que os compostos de
chumbo (placas das baterias) são fundidos, há a
conversão de sulfato em dióxido de enxofre, gás
muito poluente. Para reduzir o problema das
emissões de SO2, a indústria pode utilizar uma planta
mista, ou seja, utilizar o processo hidrometalúrgico,
para a dessulfuração antes da fusão do composto de
chumbo. Nesse caso, a redução de sulfato presente
no PbSO4 é feita via lixiviação com solução de
carbonato de sódio (Na2CO3) 1M a 45ºC, em que se
obtém o carbonato de chumbo (II) com rendimento
de 91%.
Após esse processo, o material segue para a fundição
para obter o chumbo metálico.
Dados: massas molares em g/mol, Pb = 207; S =
32; Na = 23; O = 16; C = 12.
Segundo as condições do processo apresentado para
a obtenção de carbonato de chumbo (II) por meio da
lixiviação por carbonato de sódio e considerando uma
massa de pasta residual de uma bateria de 6 kg, qual
quantidade aproximada, em quilogramas, de PbCO3
que é obtida?
a) 1,7 kg
b) 1,9 kg
c) 2,9 kg
d) 3,3 kg
e) 3,6 kg
19. (ENEM) Os pesticidas modernos são divididos em
várias classes, entre as quais se destacam os
organofosforados, materiais que apresentam efeito
tóxico agudo para os seres humanos. Esses
pesticidas contêm um átomo central de fósforo ao
qual estão ligados outros átomos ou grupo de átomos
como oxigênio, enxofre, grupos metoxi ou etoxi, ou
um
radical
orgânico
de
cadeia
longa.
Os
organofosforados são divididos em três subclasses:
Tipo A, na qual o enxofre não se incorpora na
molécula; Tipo B, na qual o oxigênio, que faz dupla
ligação com fósforo, é substituído pelo enxofre; e
Tipo C, no qual dois oxigênios são substituídos por
enxofre. Um exemplo de pesticida organofosforado
Tipo B, que apresenta grupo etoxi em sua fórmula
estrutural, está representado em:
a)
b)
c)
d)
e)
20. (ENEM) Deseja-se instalar uma estação de
geração de energia elétrica em um município
localizado no interior de um pequeno vale cercado de
altas montanhas de difícil acesso. A cidade é cruzada
por um rio, que é fonte de água para consumo,
irrigação das lavouras de subsistência e pesca. Na
região, que possui pequena extensão territorial, a
incidência solar é alta o ano todo. A estação em
questão
irá
abastecer
apenas
o
município
apresentado.
Qual forma de obtenção de energia, entre as
apresentadas, é a mais indicada para ser implantada
nesse município de modo a causar o menor impacto
ambiental?
a) Termelétrica, pois é possível utilizar a água do rio
no sistema de refrigeração.
b) Eólica, pois a geografia do local é própria para a
captação desse tipo de energia.
c) Nuclear, pois o modo de resfriamento de seus
sistemas não afetaria a população.
d) Fotovoltaica, pois é possível aproveitar a energia
solar que chega à superfície do local.
e) Hidrelétrica, pois o rio que corta o município é
suficiente para abastecer a usina construída.
21. (ENEM) Em nosso cotidiano, utilizamos as
palavras “calor” e “temperatura” de forma diferente
de como elas são usadas no meio científico. Na
linguagem corrente, calor é identificado com “algo
quente” e temperatura mede a “quantidade de calor
de um corpo”. Esses significados, no entanto, não
conseguem explicar diversas situações que podem
ser verificadas na prática.
Do ponto de vista científico, que situação prática
mostra a limitação dos conceitos corriqueiros de calor
e temperatura?
a) A temperatura da água que pode ficar constante
durante o tempo em que estiver fervendo.
b) Uma mãe coloca a mão na água da banheira do
bebê para verificar a temperatura da água.
P á g i n a | 167
c) A chama de um fogão pode ser usada para
aumentar a temperatura da água em uma panela.
d) A água quente que está em uma caneca é passada
para outra caneca a fim de diminuir sua temperatura.
e) Um forno pode fornecer calor para uma vasilha de
água que está em seu interior com menor
temperatura do que a dele.
22. (ENEM) Os lixões são o pior tipo de disposição
dos resíduos sólidos de uma cidade, representando
um grave problema ambiental e de saúde pública.
Nesses locais, o lixo é jogado diretamente no solo e a
céu aberto, sem nenhuma norma de controle, o que
causa, entre outros problemas, a contaminação do
solo e das águas pelo chorume (líquido escuro com
alta carga poluidora, proveniente da decomposição
da matéria orgânica presente no lixo).
RICARDO, B.; CANPANILLI, M. Almanaque Brasil Socioambiental 2008.
São Paulo, Instituto Socioambiental, 2007.
Considere um município que deposita os resíduos
sólidos produzidos por sua população em um lixão.
Esse procedimento é considerado um problema de
saúde porque os lixões
a) causam problemas respiratórios, devido ao mau
cheiro que provém da decomposição.
b) são locais propícios a proliferação de vetores de
doenças, além de contaminarem o solo e as águas.
c) provocam o fenômeno da chuva ácida, devido aos
gases oriundos da decomposição da matéria
orgânica.
d) são instalados próximos ao centro das cidades,
afetando toda a população que circula diariamente na
área.
e) são responsáveis pelo desaparecimento das
nascentes na região onde são instalados, o que leva
à escassez de água.
23. (ENEM) Em visita a uma usina sucroalcooleira,
um grupo de alunos pôde observar a série de
processos de beneficiamento da cana-de-açúcar,
entre os quais se destacam:
1. A cana chega cortada da lavoura por meio de
caminhões e é despejada em mesas alimentadoras
que a conduzem para as moendas. Antes de ser
esmagada para a retirada do caldo açucarado, toda a
cana é transportada por esteiras e passada por um
eletroimã para a retirada de materiais metálicos.
2. Após se esmagar a cana, o bagaço segue para as
caldeiras, que geram vapor e energia para toda a
usina.
3. O caldo primário, resultante do esmagamento, é
passado por filtros e sofre tratamento para
transformar em açúcar refinado e etanol.
Com base nos destaques da observação dos alunos,
quais as operações físicas de separação de materiais
foram realizadas nas etapas de beneficiamento da
cana-de-açúcar?
a) Separação mecânica, extração, decantação.
b) Separação magnética, combustão, filtração.
c) Separação magnética, extração, filtração.
d) Imantação, combustão, peneiração.
e) Imantação, destilação, filtração.
24. (ENEM) As cidades industrializadas produzem
grandes proporções de gases como o CO2, o principal
gás causador do efeito estufa. Isso ocorre por causa
da quantidade de combustíveis fósseis queimados,
principalmente no transporte, mas também em
caldeiras industriais. Além disso, nessas cidades
concentram-se as maiores áreas com solos asfaltados
e concretados, o que aumenta a retenção de calor,
formando o que se conhece por “ilhas de calor”. Tal
fenômeno ocorre porque esses materiais absorvem o
calor e o devolvem para o ar sob a forma de radiação
térmica.
Em áreas urbanas, devido à atuação conjunta do
efeito estufa e das “ilhas de calor”, espera-se que o
consumo de energia elétrica
a) diminua devido à utilização de caldeiras por
indústrias metalúrgicas.
b) aumente devido ao bloqueio da luz do sol pelos
gases do efeito estufa.
c) diminua devido à não necessidade de aquecer a
água utilizada em indústrias.
d) aumente devido à necessidade de maior
refrigeração de indústrias e residências.
e) diminua devido à grande quantidade de radiação
térmica reutilizada.
25. (ENEM) Sob pressão normal (ao nível do mar), a
água entra em ebulição à temperatura de 100ºC.
Tendo por base essa informação, um garoto
residente em uma cidade litorânea fez a seguinte
experiência:
• colocou uma caneca metálica contendo água no
fogareiro do fogão de sua casa.
• Quando a água começou a ferver, encostou
cuidadosamente a extremidade mais estreita de uma
seringa de injeção, desprovida de agulha, na
superfície do líquido e, erguendo o êmbolo da
seringa, aspirou certa quantidade de água para seu
interior, tapando-a em seguida.
• Verificando após alguns segundos que a água da
seringa havia parado de ferver, ele ergueu o êmbolo
da seringa, constatando, intrigado, que a água voltou
a ferver após um pequeno
deslocamento do êmbolo.
Considerando o procedimento anterior, a água volta a
ferver porque esse deslocamento
a) permite a entrada de calor do ambiente externo
para o interior da seringa.
b) provoca, por atrito, um aquecimento da água
contida na seringa.
c) produz um aumento de volume que aumenta o
ponto de ebulição da água.
d) proporciona uma queda de pressão no interior da
seringa que diminui o ponto de ebulição da água.
e) possibilita uma diminuição da densidade da água
que facilita sua ebulição.
26. (ENEM) O despejo de dejetos de esgotos
domésticos e industriais vem causando sérios
problemas aos rios brasileiros. Esses poluentes são
ricos em substâncias que contribuem para a
eutrofização
de
ecossistemas,
que
é
um
enriquecimento da água por nutrientes, o que
provoca um grande crescimento bacteriano e, por
fim, pode promover escassez de oxigênio. Uma
P á g i n a | 168
maneira de evitar a diminuição da concentração de
oxigênio no ambiente é:
a) Aquecer as águas dos rios para aumentar a
velocidade de decomposição dos dejetos.
b) Retirar do esgoto os materiais ricos em nutrientes
para diminuir a sua concentração nos rios.
c) Adicionar bactérias anaeróbicas às águas dos rios
para que elas sobrevivam mesmo sem o oxigênio.
d) Substituir produtos não degradáveis por
biodegradáveis para que as bactérias possam utilizar
os nutrientes.
e) Aumentar a solubilidade dos dejetos no esgoto
para que os nutrientes fiquem mais acessíveis às
bactérias.
27. (ENEM) As misturas efervescentes, em pó ou em
comprimidos, são comuns para a administração de
vitamina C ou de medicamentos para azia. Essa
forma farmacêutica sólida foi desenvolvida para
facilitar o transporte, aumentar a estabilidade de
substâncias e, quando em solução, acelerar a
absorção do fármaco pelo organismo. As matériasprimas que atuam na efervescência são, em geral, o
ácido tartárico ou o ácido cítrico que reagem com um
sal de caráter básico, como o bicarbonato de sódio
(NaHCO3), quando em contato com a água. A partir
do contato da mistura efervescente com a água,
ocorre uma série de reações químicas simultâneas:
liberação de íons, formação de ácido e liberação do
gás carbônico — gerando a efervescência.
As equações a seguir representam as etapas da
reação da mistura efervescente na água, em que
foram omitidos os estados de agregação dos
reagentes, e H3A representa o ácido cítrico.
A ionização, a dissociação iônica, a formação do ácido
e a liberação do gás ocorrem, respectivamente, nas
seguintes etapas:
a) IV, I, II e III
b) I, IV, III e II
c) IV, III, I e II
d) I, IV, II e III
e) IV, I, III e II
28. (ENEM) O crescimento da produção de energia
elétrica ao longo do tempo tem influenciado
decisivamente o progresso da humanidade, mas
também tem criado uma séria preocupação: o
prejuízo ao meio ambiente. Nos próximos anos, uma
nova tecnologia de geração de energia elétrica
deverá ganhar espaço: as células a combustível
hidrogênio/oxigênio.
Com base no texto e na figura, a produção de
energia elétrica por meio da célula a combustível
hidrogênio/oxigênio diferencia-se dos processos
convencionais porque
a) transforma energia química em energia elétrica,
sem causar danos ao meio ambiente, porque o
principal subproduto formado é a água.
b) converte a energia química contida nas moléculas
dos componentes em energia térmica, sem que
ocorra a produção de gases poluentes nocivos ao
meio ambiente.
c) transforma energia química em energia elétrica,
porém emite gases poluentes da mesma forma que a
produção de energia a partir dos combustíveis
fósseis.
d) converte energia elétrica proveniente dos
combustíveis fósseis em energia química, retendo os
gases poluentes produzidos no processo sem alterar
a qualidade do meio ambiente.
e) converte a energia potencial acumulada nas
moléculas de água contidas no sistema em energia
química, sem que ocorra a produção de gases
poluentes nocivos ao meio ambiente.
29. (ENEM) A eletrólise é muito empregada na
indústria com o objetivo de reaproveitar parte dos
metais sucateados. O cobre, por exemplo, é um dos
metais com maior rendimento no processo de
eletrólise,
com
uma
recuperação
de
aproximadamente 99,9%. Por ser um metal de alto
valor de alto valor comercial e de múltiplas
aplicações,
sua
recuperação
torna-se
viável
economicamente. Suponha que, em um processo de
recuperação de cobre puro, tenha-se eletrolisado
uma solução de sulfato de cobre (II) (CuSO4) durante
3 h, empregando-se uma corrente elétrica de
intensidade igual a 10 A. A massa de cobre puro
recuperada é de aproximadamente
Dados: Constante de Faraday = 96500 C; Cu = 63,5
g/mol.
a) 0,02 g.
b) 0,04 g.
c) 2,40 g.
d) 35,5 g.
e) 71,0 g.
30. (ENEM) O abastecimento de nossas necessidades
energéticas futuras dependerá certamente do
desenvolvimento de tecnologias para aproveitar a
energia solar com maior eficiência. A energia solar é
a maior fonte de energia mundial. Num dia
ensolarado, por exemplo, aproximadamente 1 kJ de
energia solar atinge cada metro quadrado da
superfície terrestre por segundo. No entanto, o
aproveitamento dessa energia é difícil porque ela é
diluída (distribuída por uma área muito extensa) e
oscila com o horário e as condições climáticas. O uso
efetivo da energia solar depende de formas de
estocar a energia coletada para uso posterior.
Atualmente, uma das formas de se utilizar a energia
solar tem sido armazená-la por meio de processos
químicos endotérmicos que mais tarde podem ser
revertidos para liberar calor. Considerando a reação:
CH4(g) + H2O(v) + calor → CO(g) + 3 H2(g) e
analisando-a como potencial mecanismo para o
aproveitamento posterior da energia solar, conclui-se
que se trata de uma estratégia
P á g i n a | 169
a) insatisfatória, pois a reação apresentada não
permite que a energia presente no meio externo seja
absorvida
pelo
sistema
para
ser
utilizada
posteriormente.
b) insatisfatória, uma vez que há formação de gases
poluentes e com potencial poder explosivo, tornandoa uma reação perigosa e de difícil controle.
c) insatisfatória, uma vez que há formação de gás CO
que não possui conteúdo energético passível de ser
aproveitado posteriormente e é considerado um gás
poluente.
d) satisfatória, uma vez que a reação direta ocorre
com absorção de calor e promove a formação das
substâncias combustíveis que poderão ser utilizadas
posteriormente para obtenção de energia e realização
de trabalho útil.
e) satisfatória, uma vez que a reação direta ocorre
com liberação de calor havendo ainda a formação das
substâncias combustíveis que poderão ser utilizadas
posteriormente para obtenção de energia e realização
de trabalho útil.
31. (ENEM) No que tange à tecnologia de
combustíveis alternativos, muitos especialistas em
energia acreditam que os alcoóis vão crescer em
importância em um futuro próximo. Realmente,
álcoois como metanol e etanol têm encontrado
alguns nichos para uso doméstico como combustíveis
há muitas décadas e, recentemente, vêm obtendo
uma aceitação cada vez maior como aditivos, ou
mesmo como substitutos para gasolina em veículos.
Algumas
das
propriedades
físicas
desses
combustíveis são mostradas no quadro seguinte.
Dados: massas molares em g/mol C = 12 g/mol; O =
16 g/mol; H = 1 g/mol.
Considere que, em pequenos volumes, o custo de
produção de ambos os alcoóis seja o mesmo. Dessa
forma, do ponto de vista econômico, é mais
vantajoso utilizar
a) metanol, pois sua combustão completa
aproximadamente 22,7 kJ de energia por
combustível queimado.
b) etanol, pois sua combustão completa
aproximadamente 29,7 kJ de energia por
combustível queimado.
c) metanol, pois sua combustão completa
aproximadamente 17,9 MJ de energia por
combustível queimado.
d) etanol, pois sua combustão completa
aproximadamente 23,5 MJ de energia por
combustível queimado.
e) etanol, pois sua combustão completa
aproximadamente 33,7 MJ de energia por
combustível queimado.
fornece
litro de
fornece
litro de
fornece
litro de
fornece
litro de
fornece
litro de
32. (ENEM) O lixo radioativo ou nuclear é resultado
da manipulação de materiais radioativos, utilizados
hoje na agricultura, na industria, na medicina, em
pesquisas científicas, na produção de energia, etc.
Embora a radioatividade se reduza com o tempo, o
processo de decaimento radioativo de alguns
materiais pode levar milhões de anos. Por isso, existe
a necessidade de se fazer um descarte adequado e
controlado de resíduos dessa natureza. A taxa de
decaimento radioativo é medida em termos de um
tempo necessário para que uma amostra perca
metade de sua radioatividade original. O gráfico
seguinte representa a taxa de decaimento radioativo
do rádio – 226, elemento químico pertencente à
família dos metais alcalinos terrosos e que foi
utilizado durante muito tempo na medicina.
As informações fornecidas mostram que
a) Quanto maior a meia – vida de uma substância
mais rápido ela se desintegra.
b) Apenas 1/8 de uma amostra de rádio – 226 terá
decaído ao final de 4860 anos.
c) Metade da quantidade original de rádio – 226, ao
final de 3240 anos, ainda estará por decair.
d) Restará menos de 1% de rádio – 226 em qualquer
amostra dessa substância após decorridas 3 meias –
vidas.
e) A amostra de rádio – 226 diminui a sua
quantidade pela metade a cada intervalo de 1620
anos devido à desintegração radioativa.
33. (ENEM) Vários combustíveis alternativos estão
sendo procurados para reduzir a demanda por
combustíveis fósseis, cuja queima prejudica o meio
ambiente devido à produção de dióxido de carbono
(massa molar 44 g/mol). Três dos mais promissores
combustíveis alternativos são o hidrogênio, o etanol e
o metano. A queima de 1 mol de cada um desses
combustíveis libera uma determinada quantidade de
calor, que estão apresentadas na tabela a seguir.
Combustível
H2
CH4
C2H5OH
Massa molar
(g/mol)
2
16
46
Calor liberado na
queima (kJ/mol)
270
900
1350
Considere
que
foram
queimadas
massas,
independentemente, desses três combustíveis, de
forma tal que em cada queima foram liberados 5400
kJ. O combustível mais econômico, ou seja, o que
teve menor massa consumida, e o combustível mais
poluente, que é aquele que produziu a maior massa
de dióxido de carbono foram, respectivamente.
P á g i n a | 170
a) O etanol, que teve apenas 46g de massa
consumida, e o metano, que produziu 900g de CO2.
b) O hidrogênio, que teve apenas 40g de massa
consumida, e o etanol, que produziu 352g de CO2.
c) O hidrogênio, que teve apenas 20g de massa
consumida, e o metano, que produziu 264g de CO2.
d) O etanol, que teve apenas 96g de massa
consumida, e o metano que produziu 176g de CO2.
e) O hidrogênio, que teve apenas 2g de massa
consumida, e o etanol, que produziu 1350g de CO2.
34. (ENEM) Pilhas e baterias são dispositivos tão
comuns em nossa sociedade que, sem percebermos,
carregamos vários deles junto ao nosso corpo; elas
estão presentes em aparelhos de MP3, relógios,
rádios, celulares, etc. As semirreações descritas a
seguir ilustram o que ocorre em uma pilha de óxido
de prata
Pode-se afirmar que esta pilha
a) É uma pilha ácida.
b) Apresenta o óxido de prata como o ânodo.
c) Apresenta o zinco como agente oxidante.
d) Tem como reação de célula a seguinte reação: Zn
(s) + Ag2O (s) → ZnO (s) + 2 Ag (s).
e) Apresenta fluxo de elétrons na pilha do eletrodo de
Ag2O para o Zn.
35. (ENEM) Os exageros do final de semana podem
levar o individuo a um quadro de azia. A azia pode
ser descrita como uma sensação de queimação no
esôfago, provocada pelo desbalanceamento do pH
estomacal (excesso de ácido clorídrico). Um dos
antiácidos comumente empregados no combate à
azia é leite de magnésia. O leite de magnésia possui
64,8g de hidróxido de magnésio [Mg(OH)2] por litro
da solução. Qual a quantidade de ácido neutralizado
ao se ingerir 9 mL de leite de magnésia?
Dados: Massas molares (em g/mol): Mg = 24,3; Cl =
35,4; O = 16; H = 1.
a) 20 mol.
b) 0,58 mol.
c) 0,2 mol.
d) 0,02 mol.
e) 0,01 mol.
36. (ENEM) A atmosfera terrestre é composta pelos
gases nitrogênio (N2) e oxigênio (O2), que somam
cerca de 99%, e por gases traços, entre eles o gás
carbônico (CO2), vapor de água (H2O), metano (CH4),
ozônio (O3) e o óxido nitroso (N2O), que compõem o
restante 1% do ar que respiramos. Os gases traços,
por serem constituídos por pelo menos três átomos,
conseguem absorver o calor irradiado pela Terra,
aquecendo o planeta. Esse fenômeno, que acontece
há bilhões de anos, é chamado de efeito estufa. A
partir da Revolução Industrial (século XIX), a
concentração de gases traços na atmosfera, em
particular o CO2, tem aumentado significativamente,
o que resultou no aumento da temperatura em escala
global. Mais recentemente, outro fator tornou-se
diretamente envolvido no aumento da concentração
de CO2 na atmosfera: o desmatamento.
Considerando o texto, uma alternativa viável para
combater o efeito estufa é
a) reduzir o calor irradiado pela Terra mediante a
substituição
da
produção
primária
pela
industrialização refrigerada.
b) promover a queima da biomassa vegetal,
responsável pelo aumento do efeito estufa devido à
produção de CH4.
c) reduzir o desmatamento, mantendo-se, assim, o
potencial da vegetação em absorver o CO2 da
atmosfera.
d) aumentar a concentração atmosférica de H2O,
molécula capaz de absorver grande quantidade de
calor.
e) remover moléculas orgânicas polares da
atmosfera, diminuindo a capacidade delas de reter
calor.
37. (ENEM) Sabões são sais de ácidos carboxílicos de
cadeia longa utilizados com a finalidade de facilitar,
durante processos de lavagem, a remoção de
substâncias de baixa solubilidade em água, por
exemplo, óleos e gorduras. A figura a seguir
representa a estrutura de uma molécula de sabão.
Em solução, os ânions do sabão podem hidrolisar a
água e, desse modo, formar o ácido carboxílico
correspondente. Por exemplo, para o estearato de
sódio, é estabelecido o seguinte equilíbrio:
Uma vez que o ácido carboxílico formado é pouco
solúvel em água e menos eficiente na remoção de
gorduras, o pH do meio deve ser controlado de
maneira a evitar que o equilíbrio acima seja
deslocado para a direita. Com base nas informações
do texto, é correto concluir que os sabões atuam de
maneira
a) mais eficiente em pH básico.
b) mais eficiente em pH ácido.
c) mais eficiente em pH neutro.
d) eficiente em qualquer faixa de pH.
e) mais eficiente em pH ácido ou neutro.
38. (ENEM) O processo de industrialização tem
gerado sérios problemas de ordem ambiental,
econômica e social, entre os quais se pode citar a
chuva ácida. Os ácidos usualmente presentes em
maiores proporções na água da chuva são o H2CO3,
formado pela reação do CO2 atmosférico com a água,
o HNO3, o HNO2, o H2SO4 e o H2SO3. Esses quatro
últimos são formados principalmente a partir da
reação da água com os óxidos de nitrogênio e de
enxofre gerados pela queima de combustíveis fósseis.
A formação de chuva mais ou menos ácida depende
não só da concentração do ácido formado, como
também do tipo de ácido. Essa pode ser uma
informação útil na elaboração de estratégias para
minimizar esse problema ambiental. Se consideradas
concentrações idênticas, quais dos ácidos citados no
texto conferem maior acidez às águas das chuvas?
a) HNO3 e HNO2.
b) H2SO4 e H2SO3.
c) H2SO3 e HNO2.
d) H2SO4 e HNO3.
e) H2CO3 e H2SO3.
P á g i n a | 171
39. (ENEM) Para que apresente condutividade
elétrica adequada a muitas aplicações, o cobre bruto
obtido
por
métodos
térmicos
é
purificado
eletroliticamente. Nesse processo, o cobre bruto
impuro constitui o ânodo da célula, que está imerso
em uma solução de CuSO4. À medida que o cobre
impuro é oxidado no ânodo, íons Cu2+ da solução são
depositados na forma pura no cátodo. Quanto às
impurezas
metálicas,
algumas
são
oxidadas,
passando à solução, enquanto outras simplesmente
se desprendem do ânodo e se sedimentam abaixo
dele. As impurezas sedimentadas são posteriormente
processadas, e sua comercialização gera receita que
ajuda a cobrir os custos do processo. A série
eletroquímica a seguir lista o cobre e alguns metais
presentes como impurezas no cobre bruto de acordo
com suas forças redutoras relativas.
Entre
as
impurezas
metálicas que constam
na série apresentada, as
que
se
sedimentam
abaixo do ânodo de
cobre são
a) Au, Pt, Ag, Zn, Ni e Pb.
b) Au, Pt e Ag.
c) Zn, Ni e Pb.
d) Au e Zn.
e) Ag e Pb.
40. (ENEM – 2009.V) Umidade relativa do ar é o
termo usado para descrever a quantidade de vapor
de água contido na atmosfera. Ela é definida pela
razão entre o conteúdo real de umidade de uma
parcela de ar e a quantidade de umidade que a
mesma parcela de ar pode armazenar na mesma
temperatura e pressão quando está saturada de
vapor, isto é, com 100% de umidade relativa. O
gráfico representa a relação entre a umidade relativa
do ar e sua temperatura ao longo de um período de
24 horas em um determinado local.
c) a presença de umidade relativa do ar é
diretamente proporcional à temperatura do ar.
d) a umidade relativa do ar indica, em termos
absolutos, a quantidade de vapor de água existente
na atmosfera.
e) a variação da umidade do ar se verifica no verão,
e não no inverno, quando as temperaturas
permanecem baixas.
41. (ENEM) Cerca de 1% do lixo urbano é constituído
por resíduos sólidos contendo elementos tóxicos.
Entre esses elementos estão metais pesados como o
cádmio, o chumbo e o mercúrio, componentes de
pilhas e baterias, que são perigosos à saúde humana
e ao meio ambiente. Quando descartadas em lixos
comuns, pilhas e baterias vão para aterros sanitários
ou lixões a céu aberto, e o vazamento de seus
componentes contamina o solo, os rios e o lençol
freático, atingindo a flora e a fauna. Por serem
bioacumulativos e não biodegradáveis, esses metais
chegam de forma acumulada aos seres humanos, por
meio da cadeia alimentar. A legislação vigente
(Resolução CONAMA no 257/1999) regulamenta o
destino de pilhas e baterias após seu esgotamento
energético e determina aos fabricantes e/ou
importadores a quantidade máxima permitida desses
metais em cada tipo de pilha/bateria, porém o
problema ainda persiste. Uma medida que poderia
contribuir para acabar definitivamente com o
problema da poluição ambiental por metais pesados
relatado no texto seria
a) deixar de consumir aparelhos elétricos que
utilizem pilha ou bateria como fonte de energia.
b) usar apenas pilhas ou baterias recarregáveis e de
vida
útil
longa
e
evitar
ingerir
alimentos
contaminados especialmente peixes.
c) devolver pilhas e baterias, após o esgotamento da
energia armazenada, à rede de assistência técnica
especializada para repasse a fabricantes e/ou
importadores.
d) criar nas cidades, especialmente naquelas com
mais de 100 mil habitantes, pontos estratégicos de
coleta de baterias e pilhas, para posterior repasse a
fabricantes e/ou importadores.
e) exigir que fabricantes invistam em pesquisa para a
substituição desses metais tóxicos por substâncias
menos nocivas ao homem e ao ambiente, e que não
sejam bioacumulativas.
42. (ENEM) Nas últimas décadas, o efeito estufa
tem-se intensificado de maneira preocupante, sendo
esse efeito muitas vezes atribuído à intensa liberação
de CO2 durante a queima de combustíveis fósseis
para geração de energia. O quadro traz as entalpiaspadrão de combustão a 25 ºC (H) do metano, do
butano e do octano.
Considerando-se as informações do texto e do
gráfico, conclui-se que
a) a insolação é um fator que provoca variação da
umidade relativa do ar.
b) o ar vai adquirindo maior quantidade de vapor de
água à medida que se aquece.
À medida que aumenta a consciência sobre os
impactos ambientais relacionados ao uso da energia,
cresce a importância de se criar políticas de incentivo
ao uso de combustíveis mais eficientes. Nesse
P á g i n a | 172
sentido considerando-se que o metano, o butano e o
octano sejam representativos do gás natural, do gás
liquefeito de petróleo (GLP) e da gasolina,
respectivamente, então, a partir dos dados
fornecidos, é possível concluir que, do ponto de vista
da quantidade de calor obtido por mol de CO2
gerado, a ordem crescente desses três combustíveis
é
a) gasolina, GLP e gás natural.
b) gás natural, gasolina e GLP.
c) gasolina, gás natural e GLP.
d) gás natural, GLP e gasolina.
e) GLP, gás natural e gasolina.
sistemas são capazes de absorver a radiação
ultravioleta mais nociva aos seres humanos. A
conjugação é definida como a ocorrência de
alternância entre ligações simples e duplas em uma
molécula. Outra propriedade das moléculas em
questão
é
apresentar,
em
uma
de
suas
extremidades, uma parte apolar responsável por
reduzir a solubilidade do composto em água, o que
impede sua rápida remoção quando do contato com a
água. De acordo com as considerações do texto, qual
das moléculas apresentadas a seguir é a mais
adequada para funcionar como molécula ativa de
protetores solares?
43. (ENEM) Os núcleos dos átomos são constituídos
de prótons e nêutrons, sendo ambos os principais
responsáveis pela sua massa. Nota-se que, na
maioria dos núcleos, essas partículas não estão
presentes na mesma proporção. O gráfico mostra a
quantidade de nêutrons (N) em função da quantidade
de prótons (Z) para os núcleos estáveis conhecidos.
45. (ENEM) Suponha que um agricultor esteja
interessado em fazer uma plantação de girassóis.
Procurando informação, leu a seguinte reportagem:
Solo ácido não favorece plantio
O antimônio é um elemento químico que possui 50
prótons e possui vários isótopos _ átomos que só se
diferem pelo número de nêutrons. De acordo com o
gráfico, os isótopos estáveis do antimônio possuem
a) entre 12 e 24 nêutrons a menos que o número de
prótons.
b) exatamente o mesmo número de prótons e
nêutrons.
c) entre 0 e 12 nêutrons a mais que o número de
prótons.
d) entre 12 e 24 nêutrons a mais que o número de
prótons.
e) entre 0 e 12 nêutrons a menos que o número de
prótons.
44. (ENEM) O uso de protetores solares em situações
de grande exposição aos raios solares como, por
exemplo, nas praias, é de grande importância para a
saúde. As moléculas ativas de um protetor
apresentam,
usualmente,
anéis
aromáticos
conjugados com grupos carbonila, pois esses
Alguns cuidados devem ser tomados por quem
decide iniciar o cultivo do girassol. A oleaginosa deve
ser plantada em solos descompactados, com pH
acima de 5,2 (que indica menor acidez da terra).
Conforme as recomendações da Embrapa, o
agricultor deve colocar, por hectare, 40 kg a 60 kg
de nitrogênio, 40 kg a 80 kg de potássio e 40 kg a
80 kg de fósforo. O pH do solo, na região do
agricultor, é de 4,8. Dessa forma, o agricultor
deverá fazer a “calagem”.
(Folha de S. Paulo, 25/09/1996)
Suponha que o agricultor vá fazer calagem (aumento
do pH do solo por adição de cal virgem – CaO). De
maneira simplificada, a diminuição da acidez se dá
pela interação da cal (CaO) com a água presente no
solo, gerando hidróxido de cálcio (Ca(OH)2), que
reage com os íons H+ (dos ácidos), ocorrendo, então,
a formação de água e deixando íons Ca2+ no solo.
Considere as seguintes equações:
P á g i n a | 173
O processo de calagem descrito acima pode ser
representado pelas equações:
a) I e II.
b) I e IV.
c) II e III.
d) II e IV.
e) III e IV.
46. (ENEM) A panela de pressão permite que os
alimentos sejam cozidos em água muito mais
rapidamente do que em panelas convencionais. Sua
tampa possui uma borracha de vedação que não
deixa o vapor escapar, a não ser através de um
orifício central sobre o qual assenta um peso que
controla a pressão. Quando em uso, desenvolve-se
uma pressão elevada no seu interior. Para a sua
operação segura, é necessário observar a limpeza do
orifício central e a existência de uma válvula de
segurança, normalmente situada na tampa.
O esquema da panela de pressão e um diagrama de
fase da água são apresentados abaixo.
a) será maior porque a panela “esfria”.
b) será menor, pois diminui a perda de água.
c) será maior, pois a pressão diminui.
d) será maior, pois a evaporação diminui.
e) não será alterado, pois a temperatura não varia.
48. (ENEM) O ciclo da água é fundamental para a
preservação da vida no planeta. As condições
climáticas da Terra permitem que a água sofra
mudanças de fase e a compreensão dessas
transformações é fundamental para se entender o
ciclo hidrológico. Numa dessas mudanças, a água ou
a umidade da terra absorve calor do sol e dos
arredores. Quando já foi absorvido calor suficiente,
algumas das moléculas do líquido podem ter energia
necessária para recomeçar a subir para a atmosfera.
A transformação mencionada no texto é a:
a) Fusão.
b) Liquefação.
c) Evaporação.
d) Solidificação.
e) Condensação. Cc
49. (ENEM) O gráfico abaixo refere-se às variações
das concentrações de poluentes na atmosfera, no
decorrer de um dia útil, em um grande centro
urbano.
(Adaptado de NOVAIS, Vera. Ozônio: aliado ou inimigo. São Paulo: Scipione,1998)
As seguintes explicações foram dadas para essas
variações:
A vantagem do uso de panela de pressão é a rapidez
para o cozimento de alimentos e isto se deve à
a) pressão no seu interior, que é igual à pressão
externa.
b) temperatura de seu interior, que está acima da
temperatura de ebulição da água no local.
c) quantidade de calor adicional que é transferida à
panela.
d) quantidade de vapor que está sendo liberada pela
válvula.
e) espessura da sua parede, que é maior que a das
panelas comuns.
47. (ENEM) Se, por economia, abaixarmos o fogo sob
uma panela de pressão logo que se inicia a saída de
vapor pela válvula, de forma simplesmente a manter
a fervura, o tempo de cozimento...
I A concentração de NO diminui, e a de NO2 aumenta
em razão da conversão de NO em NO2.
II A concentração de monóxido de carbono no ar
está ligada à maior ou à menor intensidade de
tráfego.
III Os veículos emitem óxidos de nitrogênio apenas
nos horários de pico de tráfego do período da manhã.
IV Nos horários de maior insolação, parte do ozônio
da estratosfera difunde-se para camadas mais baixas
da atmosfera.
Dessas explicações, são plausíveis somente:
a) I e II.
b) I e III.
c) II e III.
d) II e IV.
e) III e IV.
50. (ENEM) Em setembro de 1998, cerca de 10.000
toneladas de ácido sulfúrico (H2SO4) foram
derramadas pelo navio Bahamas no litoral do Rio
Grande do Sul. Para minimizar o impacto ambiental
de um desastre desse tipo, é preciso neutralizar a
acidez resultante. Para isso pode-se, por exemplo,
lançar calcário, minério rico em carbonato de cálcio
(CaCO3), na região atingida. A equação química que
representa a neutralização do H2SO4 por CaCO3, com
a proporção aproximada entre as massas dessas
substâncias é:
P á g i n a | 174
de “fumaças
fenômeno de:
Pode-se avaliar o esforço de mobilização que deveria
ser empreendido para enfrentar tal situação,
estimando a quantidade de caminhões necessária
para carregar o material neutralizante. Para
transportar certo calcário que tem 80% de CaCO3,
esse número de caminhões, cada um com carga de
30 toneladas, seria próximo de
a) 100.
b) 200.
c) 300.
d) 400.
e) 500.
Prof. Wagnner Melo, Leonardo, Tadeu, Willy
a) evaporação.
b) sublimação.
Observou-se
c) fusão.
d) gaseificação.
então
o
e) liquefação.
4. (UFSM-RS) Com relação aos processos de
mudança de estado físico de uma substância, podese afirmar que são endotérmicos, isto é, absorvem
energia:
a) vaporização, solidificação, liquefação.
b) liquefação, fusão, vaporização.
c) solidificação, fusão, sublimação.
d) solidificação, liquefação, sublimação.
e) sublimação, fusão, vaporização
5. (Fuvest) Ácido acético (CH3COOH) e bromo (Br2),
sob pressão de 1 atm, estão em recipientes imersos
em banhos, como mostrado na figura adiante. Nessas
condições, qual é o estado físico preponderante de
cada uma dessas substâncias?
PSS 1 e 2
1. (Unicamp-SP) Três frascos de vidro transparente,
fechados, de formas e dimensões iguais, contêm
cada um a mesma massa de líquidos diferentes. Um
contém água, o outro, clorofórmio e o outro etanol.
Os três líquidos são incolores e não preenchem
totalmente os frascos, os quais não têm nenhuma
identificação. Sem abrir os frascos, como você faria
para identificar as substâncias?
brancas”.
Substância
Temperatura de
Fusão (°C)
Temperatura de
Ebulição (°C)
CH3COOH
Br2
17
-7
118
59
A densidade (d) de cada
um
dos
líquidos,
à
temperatura ambiente, é:
Os frascos A, B e C possuem as densidades:
a) ácido acético sólido e bromo líquido.
b) ácido acético líquido e bromo gasoso.
c) ácido acético gasoso e bromo sólido.
d) ácido acético sólido e bromo gasoso.
e) ácido acético gasoso e bromo líquido.
a) 1,4 , 1,0 e 0,8.
b) 0,8 , 1,4 e 1,0.
c) 0,8 , 1,4 e 1,0.
6. (Mackenzie-SP) Constitui um sistema heterogêneo
a mistura formada de:
d(etanol) = 0,8 g/cm3
d(água) = 1,0 g/cm3
d(clorofórmio) = 1,4 g/cm3
d) 1,4 , 0,8 e 1,0.
e) 1,0 , 0,8 e 1,4.
2. (UFPB) Elementos, compostos e misturas
constituem a essência da Química, uma vez que é
com estes que se trabalha no laboratório. Face ao
exposto, considere os sistemas abaixo:
I. óleo-água
II. sal dissolvido em água
III. enxofre
IV. cloreto de sódio
É correto afirmar que o(s) sistema(s):
a) I e II são monofásicos.
b) II e IV são substâncias puras.
c) III e IV mudam de estado físico à temperatura
constante.
d) I e II podem ter seus componentes separado
apenas por destilação.
e) IV é constituído por uma fase e dois componentes.
3. (PUC-MG) Numa praia, em pleno verão, um
estudante de Química observou que o carrinho de
picolé usava “gelo-seco” para retardar o degelo dos
picolés. Pediu à vendedora um pedaço do gelo e
colocou-o num copo com água, ocorrendo formação
a) cubos de gelo e solução aquosa de açúcar (glicose)
b) gases N2 e CO2
c) água e acetona
d) água e xarope de groselha
e) querosene e óleo diesel
7. (Ufes) Em um sistema, bem misturado, constituído
de areia, sal, açúcar, água e gasolina, o número de
fases é:
a) 2
b) 3
c)4
d)5
e) 6
8. Dois copos, A e B, contendo respectivamente 100
mL e 200 mL de água destilada, são aquecidos
uniformemente com a mesma fonte de calor.
P á g i n a | 175
Sendo tA e tB os tempos gastos para se iniciar a
ebulição nos copos A e B; TEA e TEB as temperaturas
de ebulição nos copos A e B, podemos afirmar:
a) tA = tB; TEA = TEB
b) tA < tB; TEA < TEB
c) tA < tB; TEA = TEB
d) tA > tB; TEA = TEB
e) tA > tB; TEA > TEB
9. (Mackenzie-SP) O valor do ponto de ebulição
determinado experimentalmente numa amostra de
uma certa substância mostrou-se maior do que o
valor encontrado em tabelas. Essa diferença pode ser
atribuída ao fato de que, no experimento, usou-se:
b) À temperatura de 100°C, a amostra A encontra-se
no estado líquido.
c) A amostra C não constitui substância pura por não
manter as temperaturas de fusão e ebulição
constantes.
d) A amostra B aquece mais rápido do que a amostra
A.
e) A amostra B apresenta temperatura de ebulição de
40°C.
13. O gráfico abaixo apresenta a massa e o volume
de cinco substâncias Z, Y, X, W e V.
a) um combustível de alto poder calorífico.
b) uma quantidade de substância muito grande.
c) uma quantidade de substância muito pequena.
d) uma substância composta.
e) uma substância contendo impurezas.
10. (Mackenzie-SP) Necessitou-se retirar o conteúdo
do tanque de combustível de um carro. Para isso,
fez-se sucção com um pedaço de mangueira
introduzido no tanque, deixando-se escorrer o líquido
para um recipiente colocado no chão. Esse processo é
chamado de:
a) decantação
b) filtração
c) sifonação
d) centrifugação
e) destilação
11. (FATEC-SP) Uma barra de certo material, de
massa igual a 37,8g, foi introduzida num cilindro
graduado contendo água. O nível da água contida no
cilindro, antes (1) e após (2) a imersão da barra
metálica, é mostrado na figura.
A densidade de “W” é:
a) 2,5 g/mL.
b) 2,0 g/mL.
c) 1,5 g/mL.
d) 1,0 g/mL.
e) 0,5 g/mL.
14. (UFRGS-RS) O granito consiste em quatro
minerais:
feldspato, magnetita, mica e quartzo. Se um desses
minerais pode ser separado dos demais, pode-se
afirmar que o granito é:
a) um elemento
b) uma substância simples
c) uma substância composta
d) um composto iônico
e) uma mistura
15. (UFV-MG) A água que abastece a população das
cidades passa antes por uma estação de tratamento,
onde vários produtos químicos são adicionados para
torná-la própria para o consumo (água potável). Essa
água tratada é um exemplo de:
Analisando-se a figura, pode-se afirmar que o metal
da barra metálica é provavelmente:
a) Ag, d = 10,50g/mL.
b) Au, d = 2,70g/mL.
c) Fe, d = 7,87g/mL.
d) Mg, d = 1,74g/mL.
e) Pb, d = 11,30g/mL.
12. (UFV-MG) A figura a seguir mostra as curvas de
temperatura versus tempo para a mesma massa de
três amostras dos materiais A, B e C, partindo do
estado sólido no tempo zero. Observe a figura e
marque a alternativa correta:
a) substância pura simples.
b) substância pura composta.
c) mistura homogênea.
d) mistura heterogênea.
e) mistura alotrópica.
16. (UFRGS-RS) Os símbolos
representam, respectivamente:
Cl,
Cl2
e
Cl-1
a) o átomo do elemento cloro, a molécula da
substância simples cloro e o ânion cloreto.
b) a molécula da substância simples cloro, o
elemento cloro e o átomo de cloro eletronegativo.
c) a molécula da substância simples cloro, a molécula
da substância cloro e o átomo do elemento cloro.
d) o átomo do elemento cloro, a molécula da
substância composta cloro e o cátion cloreto.
e) o elemento químico cloro, átomos do elemento
cloro e o átomo do elemento cloro eletronegativo.
17. (PUC-MG) Dos processos abaixo, o que não
envolve reação química é:
a) As amostras A, B e C são exemplos de substâncias
puras.
a) a planta clorofilada produzindo alimentos a partir
de gás carbônico e água em presença de luz solar.
b) obtenção de sal a partir de água do mar.
c) enferrujamento de um prego exposto ao ar.
P á g i n a | 176
d) a combustão da
umautomóvel.
e) azedamento do leite.
gasolina
no
motor
de
18. (PUC-MG) Observe atentamente os processos
cotidianos abaixo:
I. a secagem da roupa no varal;
II. a fabricação caseira de pães;
III. a filtração da água pela vela do filtro;
IV. o avermelhamento da palha de aço umedecida;
V. a formação da chama do fogão, a partir do gás de
cozinha.
Constituem fenômenos químicos:
a) II e V apenas
b) II, IV e V apenas
c) I, III e IV apenas
d) I, II e III apenas
e) I, II, III, IV e V
19. (Ceeteps-SP) A queima de uma amostra de palha
de aço produz um composto pulverulento de massa:
a) menor que a massa original da palha de aço.
b) igual à massa original da palha de aço.
c) maior que a massa original da palha de aço.
d) igual à massa de oxigênio do ar que participa da
reação.
e) menor que a massa de oxigênio do ar que
participa a reação.
20. (Uespi) Qualquer que seja a procedência ou
processo de preparação do NaCl, podemos afirmar
que sua composição é sempre 39,32% de sódio e
60,68%de cloro, com base na lei de:
a) Lavoisier
b) Dalton
c) Proust
d) Richter
e) Avogadro
21. (Unifor-CE) Os átomos:
I. diferem de elemento para elemento.
II. são as unidades envolvidas nas transformações
químicas.
III. são indivisíveis.
IV. consistem de unidades com umnúcleo e uma
eletrosfera onde se localizam os elétrons.
Dessas afirmações, estão incluídas na teoria atômica
de Dalton (1808), somente:
a) I
b) I e II
c) III e IV
d) II, III e IV
e) I, II e III
22. (Fuvest-SP) Thomson determinou, pela primeira
vez, a relação entre a massa e a carga do elétron, o
que pode ser considerado como a descoberta do
elétron. É reconhecida como uma contribuição de
Thomson ao modelo atômico,
a) o átomo ser indivisível.
b) a existência de partículas subatômicas.
c) os elétrons ocuparem níveis discretos de energia.
d) os elétrons girarem em órbitas circulares ao redor
do núcleo.
e) o átomo possuir um núcleo com carga positiva e
uma eletrosfera.
23. (UCB-DF) Rutherford, ao fazer incidir partículas
radioativas em lâmina metálica de ouro, observou
que a maioria das partículas atravessava a lâmina,
algumas desviavam e poucas refletiam. Identifique,
dentre as afirmações a seguir, aquela que não reflete
as conclusões de Rutherford sobre o átomo.
a) Os átomos são esferas maciças e indestrutíveis.
b) No átomo há grandes espaços vazios.
c) No centro do átomo existe um núcleo pequeno e
denso.
d) O núcleo do átomo tem carga positiva.
e) Os elétrons giram ao redor do núcleo para
equilibrar a carga positiva.
24. (UFMG) Na experiência de espalhamento de
partículas alfa, conhecida como “experiência de
Rutherford”, um feixe de partículas alfa foi dirigido
contra uma lâmina finíssima de ouro, e os
experimentadores (Geiger e Marsden) observaram
que um grande número dessas partículas atravessava
a lâmina sem sofrer desvios, mas que um pequeno
número sofria desvios muito acentuados. Esse
resultado levou Rutherford a modificar o modelo
atômico de Thomson, propondo a existência de um
núcleo de carga positiva, de tamanho reduzido, e
com praticamente toda massa do átomo.
Assinale a alternativa que apresenta o resultado que
era previsto para o experimento.
a) A maioria das partículas atravessaria a lâmina de
ouro sem sofrer desvios e um pequeno número
sofreria desvios muito pequenos.
b) A maioria das partículas sofreria grandes desvios
ao atravessar a lâmina.
c) A totalidade das partículas atravessaria a lâmina
de ouro sem sofrer nenhum desvio.
d) A totalidade das partículas ricochetearia ao se
chocarem contra a lâmina de ouro, sem conseguir
atravessá-la.
e) Os elétrons giram em torno do núcleo juntamente
com os nêutrons.
25. (PUC-MG) Observe as duas colunas abaixo:
1. Dalton A. Descoberta do núcleo e seu tamanho
relativo.
2. Rutherford B. Átomos esféricos, maciços,
indivisíveis.
3. Niels Bohr C. Modelo semelhante a um “pudim de
passas” com cargas positivas e negativas em igual
número.
4. J. J. Thomson D. Os elétrons giram em torno do
núcleo em determinadas órbitas.
Qual das seqüências traz a relação correta entre os
nomes dos cientistas e os modelos atômicos?
a) 1A — 2B — 4C — 3D
b) 1A — 4B — 3C — 2D
c) 2A — 1B — 4C — 3D
d) 3A — 4B — 2C — 1D
e) 4A — 1B — 2C — 3D
26. (UFPB) Os fogos de artifício coloridos são
fabricados, adicionando-se à pólvora elementos
químicos metálicos como o sódio (cor amarela),
estrôncio (vermelho escuro), potássio (violeta), etc.
Quando a pólvora queima, elétrons dos metais
presentes
sofrem
excitação
eletrônica
e,
posteriormente, liberação de energia sob a forma de
luz, cuja cor é característica de cada metal. O
fenômeno descrito:
P á g i n a | 177
a) é característico dos elementos dos grupos 6A e 7A
da tabela periódica.
b) ocorre, independentemente, da quantidade de
energia fornecida.
c) está em concordância com a transição eletrônica,
conforme o modelo de Bohr.
d) mostra que a transição de elétrons de um nível
mais interno para um mais externo é um processo
que envolve emissão de energia.
e) mostra que um elétron excitado volta ao seu
estado fundamental, desde que absorva energia.
27. (FMTM-MG) Fogos de artíficio utilizam sais de
diferentes íons metálicos misturados com um
material explosivo. Quando incendiados, emitem
diferentes colorações. Por exemplo: sais de sódio
emitem cor amarela, de bário, cor verde e de cobre,
cor azul. Essas cores são produzidas quando os
elétrons excitados dos íons metálicos retornam para
níveis de menor energia. O modelo atômico mais
adequado para explicar esse fenômeno é o modelo
de:
a) Rutherford
b) Rutherford-Bohr
c) Thomson
d) Dalton
e) Millikan
28. (UFV-MG) O sal de cozinha (NaCl) emite luz de
coloração amarela quando colocado numa chama.
Baseando-se na teoria atômica, é correto afirmar
que:
a) os elétrons do cátion Na", ao receberem energia
da chama, saltam de uma camada mais externa para
uma mais interna, emitindo luz amarela.
b) a luz amarela emitida nada tem a ver com o sal de
cozinha, pois ele não é amarelo.
c) a emissão da luz amarela se deve a átomos de
oxigênio.
d) os elétrons do cátion Na", ao receberem energia
da chama, saltam de uma camada mais interna para
uma mais externa e, ao perderem a energia ganha,
emitem-na sob a forma de luz amarela.
e) qualquer outro sal também produziria a mesma
coloração.
29. (UFRGS-RS) Uma moda atual entre as crianças é
colecionar figurinhas que brilham no escuro. Essas
figuras apresentam em sua constituição a substância
sulfeto de zinco. O fenômeno ocorre porque alguns
elétrons que compõem os átomos dessa substância
absorvem energia luminosa e saltam para níveis de
energia mais externos. No escuro, esses elétrons
retornam aos seus níveis de origem, liberando
energia luminosa e fazendo a figurinha brilhar.
Essa característica pode ser explicada considerando
o modelo atômico proposto por:
a) Dalton.
b) Thomson.
c) Lavoisier.
d) Rutherford.
e) Bohr.
30. (FMTM-MG) Sobre a tabela periódica,
estudante formulou as proposições abaixo:
um
I. Átomos de um mesmo período possuem o mesmo
número de camadas ocupadas.
II. Átomos de um mesmo período possuem o mesmo
número de elétrons na camada de valência.
III. Um átomo, cujo número atômico é 18, está
classificado na tabela periódica como gás nobre.
IV. Na tabela periódica atual, os elementos estão
ordenados em ordem crescente de massa atômica.
São corretas apenas as afirmações:
a) I e II
b) II e III
c) III e IV
d) II e IV
e) I e III
31. (CEFET-PR) Complete os parênteses a seguir com
elementos
constantes
da
Tabela
Periódica
apresentada e indique a seqüência correta:
(
) Dentre os elementos A, Y, D e E, o de menor
energia de ionização.
(
) O elemento que pertence ao 3º período do
grupo 5A.
(
) O elemento mais eletronegativo.
(
) Entre os semi-metais, o de maior raio atômico.
(
) O elemento de maior densidade
a) A – L – T – D – J
b) E – L – T – R – Q
c) A – L – E – R – J
d) A – D – E – R – Q
e) E – R – T – L – J
32. (UFCG) Na identificação de um átomo ou íon
inclui se o seu símbolo (X), o número de massa (A),
o número atômico (Z) e o número de carga (n+ ou n). Na tabela abaixo são dados exemplos de
identificação de seis átomos/íons.
Com base nestas informações, assinale dentre as
alternativasabaixo a afirmação INCORRETA.
a) R tem um número de nêutrons igual a 82 e um
número de elétrons igual a 54.
b) Y tem um elétron e G não tem elétrons.
c) T tem um próton.
d) M e Q são isótonos.
e) Q e G são isóbaros.
33. (UFTM-MG) A água pesada é quimicamente
formada por átomos de hidrogênio e oxigênio, tal
como a água comum. No entanto, a água pesada
contém predominantemente átomos de 2H (deutério)
e 16O. Ela é utilizada em reatores nucleares para
moderar nêutrons emitidos em reações nucleares que
ocorrem no núcleo do reator e geram energia
térmica. Os átomos de hidrogênio e deutério são
classificados como ___________. Em uma molécula
de água pesada, o número total de nêutrons é igual a
_______.
P á g i n a | 178
As
lacunas
são
respectivamente por
a) isômeros … 10
b) isômeros … 18
c) isótopos … 10
preenchidas
correta
e
d) isótopos … 18
e) isótopos … 20
34. (UFPE) Isótopos radioativos de iodo são
utilizados no diagnóstico e tratamento de problemas
da tireóide, e são, em geral, ministrados na forma de
sais de iodeto. O número de prótons, nêutrons e
elétrons no isótopo 131 do iodeto 131I53- são,
respectivamente:
a) 53, 78 e 52
b) 53, 78 e 54
c) 53, 131 e 53
d) 131, 53 e 131
e) 52, 78 e 53
35. (FGV-SP) Um certo íon negativo, X3-, tem carga
negativa -3, sendo seu número total de elétrons 36 e
seu número de massa 75. Podemos dizer que seu
número atômico e número de nêutrons são,
respectivamente:
a) 36 e 39
b) 36 e 42
c) 33 e 42
d) 33 e 39
e) 36 e 75
40. (FEI-SP) Sendo o subnível 4s1 (com um elétron)
o mais energético de um átomo, podemos afirmar
que:
I. o número total de elétrons deste átomo é igual a
19;
II. este átomo apresenta 4 camadas eletrônicas;
III. sua configuração eletrônica é: 1s2; 2s2; 2p6; 3s2;
3p6; 3d 10; 4s1
a) Apenas a afirmação I é correta.
b) Apenas a afirmação II é correta.
c) Apenas a afirmação III é correta.
d) As afirmações I e II são corretas.
e) As afirmações I e III são corretas.
41. (Unigranrio-RJ) O átomo de magnésio tem
número atômico 12 e número de massa 24. Qual é a
alternativa correta relativa ao Mg que perdeu 2
elétrons?
a) Tem 12 elétrons.
b) Tem 10 nêutrons.
c) Tem 10 prótons.
d) Tem configuração eletrônica 1s2 2s2 2p6 3s2.
e) Tem configuração idêntica à do Na (Z = 11) que
perdeu 1 elétron.
36. (UFSM-RS) Analise as seguintes afirmativas:
I. Isótopos são átomos de um mesmo elemento que
possuem mesmo número atômico e diferente número
de massa.
II. O número atômico de um elemento corresponde
ao número de prótons no núcleo de um átomo.
III. O número de massa corresponde à soma do
número de prótons e do número de elétrons de um
elemento.
Está(ão) correta(s):
a) apenas I.
b) apenas II.
c) apenas III.
d) apenas I e II.
e) apenas II e III.
37. (UFPA) Os isótopos do hidrogênio receberam os
nomes de prótio (1H1), deutério (2H1) e trítio (3H1).
Nesses átomos os números de nêutrons são,
respectivamente, iguais a:
a) 0, 1 e 2
b) 1, 1 e 1
c) 1, 1 e 2
d) 1, 2 e 3
e) 2, 3 e 4
38. (ITE Bauru-SP) Sabendo que o número atômico
do ferro é 26, responda: na configuração eletrônica
do íon Fe3", o último subnível ocupado e o número
de elétrons desse íon são respectivamente:
a) 3d, com 6 elétrons
b) 3d, com 5 elétrons
c) 3d, com 3 elétrons
d) 4s, com 2 elétrons
39. (UECE) A distribuição eletrônica do átomo de
Ferro, 26Fe, é 1s2 2s2 2p6 3s2 3p6 4s2 3d6. O conjunto
de números quânticos para o 5º elétron do subnível
2p6 é dado por: n = 2; l = 1; m = 0 e s = – 1/2.
Segundo esse modelo, o conjunto dos números
quânticos para o 8° elétron do 3d10 é:
a) 3, 2, –1, – 1/2.
b) 3, 2, – 2, + 1/2.
c) 3, 2, 0, – 1/2.
d) 3, 2, + 1, – 1/2.
e) 3, 2, 0, + 1/2.
42. (UFRGS-RS) Ao se compararem os íons K+ e Br com os respectivos átomos neutros de que se
originaram, pode-se verificar que:
a) houve manutenção da carga nuclear de ambos os
íons.
b) o número de elétrons permanece inalterado.
c) o número de prótons sofreu alteração em sua
quantidade.
d) ambos os íons são provenientes de átomos que
perderam elétrons.
e) o cátion originou-se do átomo neutro a partir do
recebimento de um elétron.
43. (Unifor-CE) Quando se comparam as espécies
químicas CH4, NH3 e NaCl, pode-se afirmar que os
átomos estão unidos por ligações covalentes somente
no:
a) CH4 e no NH3
b) NH3 e no NaCl
c) CH4 e no NaCl
d) CH4
e) NH3
44. (CEFET-PB) Determine a geometria molecular e a
polaridade das substâncias na ordem em que
aparece: amônia (NH3), metanal (CH2O) e dióxido de
carbono (CO2).
a) trigonal piramidal, polar; trigonal plana, polar;
linear, apolar.
b) tetraédrica, apolar; trigonal plana, polar; linear,
polar.
c) linear, apolar; linear, polar; trigonal plana, apolar.
d)
bipirâmide
trigonal, polar; linear,
polar;
tetraédrica, apolar.
e) linear, polar; trigonal piramidal, polar; bipirâmide
trigonal, polar.
45. (UNAMA-AM)
O planeta está em chamas!
P á g i n a | 179
O efeito estufa já está elevando
a temperatura da terra a níveis
quase insuportáveis para o
homem. A emissão dos gases
causadores deste efeito só faz
aumentar de ano a ano e o
maior vilão é a quantidade,
cada vez maior, de
veículos
automotivos queimando
combustíveis derivados do petróleo, como a gasolina
e o diesel. Esta queima contínua lança na atmosfera
quantidades enormes de gás carbônico e de vapor
d’água. Uma outra substância que contribui bastante
para
o aumento da temperatura da terra é o
metano, produzido, principalmente, pelos rebanhos
de gado bovino e ovino.
Em termos de ligação química, as três substâncias
citadas no texto apresentam, na ordem destacada:
a) 4 ligações covalentes normais; 2 ligações
covalentes normais; 4 ligações covalentes normais.
b) 2 ligações covalentes normais e 1 dativa; 3
ligações covalentes normais; 4 ligações covalentes
normais.
c) 4 ligações covalentes normais e 1 dativa; 2
ligações covalentes normais; 4 ligações covalentes
normais.
d) 2 ligações covalentes normais; 2 ligações
covalentes normais; 4 ligações covalentes normais.
46. (UFPB) Numa amostra de ar atmosférico, além
dos gases oxigênio, nitrogênio e argônio, encontram
se também, dentre outros, CO2, H2O, SO2 e SO3. A
geometria
molecular
desses
compostos
é,
respectivamente,
a) linear, angular, linear, trigonal plana.
b) linear, angular, angular, trigonal plana.
c) linear, tetraédrica, angular, piramidal.
d) angular, linear, angular, trigonal plana.
e) linear, tetraédrica, angular, trigonal plana.
47. (Uepi) Observe as colunas abaixo.
I. SO3
II. PCl5
III. H2O
IV. NH4 +
V. CO2
A. Tetraédrica
B. Linear
C. Angular
D. Trigonal planar
E. Bipirâmide trigonal
Qual das alternativas traz a relação correta entre a
espécie química e a respectiva geometria?
a) IIA, VB, IIIC, ID, IVE
b) IVA, VB, IIIC, ID, IIE
c) IIA, IIIB, VC, ID, IVE
d) IVA, IIIB, VC, ID, IIE
e) IVA, VB, IIIC, IID, IE
48. (Unesp-SP) O gráfico a seguir foi construído com
dados dos hidretos dos elementos do grupo 16. Com
base neste gráfico, são feitas as afirmações
seguintes.
I — Os pontos P, Q, R e S, no gráfico, correspondem
aos
compostos
H2Te,
H2S,
H2Se
e
H2O,
respectivamente.
II — Todos estes hidretos são gases à temperatura
ambiente, exceto a água, que é líquida.
III — Quando a água ferve, as ligações covalentes se
rompem antes das intermoleculares.
Indique quais afirmações estão corretas:
a) I
b) II e III
c) III
d) II
e) I e II
49. (UFC-CE) O fósforo branco é usado na fabricação
de bombas de fumaça. A inalação prolongada de seus
vapores provoca necrose dos ossos. Já o fósforo
vermelho, usado na fabricação do fósforo de
segurança, encontra-se na tarja da caixa e não do
palito. A opção correta é:
a) Essas duas formas de apresentação do fósforo são
chamadas de formas alotrópicas.
b) Essas duas formas de apresentação do fósforo são
chamadas de formas isotérmicas.
c) A maneira como o fósforo se apresenta exemplifica
o fenômeno de solidificação.
d) O fósforo se apresenta na natureza em duas
formas isobáricas.
e) A diferença entre as duas formas do fósforo é
somente no estado físico.
50. (Fesp-SP) Indicar a ordem correta de
eletronegatividade dos elementos flúor, cloro,
oxigênio, bromo e carbono.
a) F < Cl < O < Br <C
b) O < F < Cl < Br <C
c) F <O < Cl < Br < C
d) O < C < F < Cl < Br
e) F < C < O < Cl < Br
51. (UFPE) As ligações químicas nas substâncias
K(s), HCl(g), KCl(s) e Cl2(g), são, respectivamente:
a) metálica, covalente polar, iônica, covalente apolar.
b) iônica, covalente polar, metálica, covalente apolar.
c) covalente apolar, covalente polar, metálica,
covalente apolar.
d) metálica, covalente apolar, iônica, covalente polar.
e) covalente apolar, covalente polar, iônica, metálica.
52. (Ceeteps-SP) Para os compostos HF e HCl, as
forças de atração entre as moléculas ocorrem por
a) ligações de hidrogênio para ambos.
b) dipolo-dipolo para ambos.
c) ligações de Van der Waals para HF e ligações de
hidrogênio para HCl.
d) ligações de hidrogênio para HF e dipolo-dipolo
para HCl.
e) ligações eletrostáticas para HF e dipolo induzido
para HCl.
P á g i n a | 180
53. (Ceeteps-SP) Um iceberg é composto por
moléculas de água que se mantêm fortemente unidas
por meio de interações do tipo:
a) dipolo induzido-dipolo permanente.
b) dipolo instantâneo-dipolo induzido.
c) ligações covalentes dativas.
d) ligações covalentes.
e) ligações de hidrogênio.
a) NaOH.
b) K2O.
B : 1s2 2s2 2p3
D : 1s1
Em relação às substâncias formadas, a partir de
combinações desses elementos, é INCORRETO
afirmar que:
a) A2 e D2 são substâncias onde predomina o
covalente.
b) CD é uma substância onde predomina o
iônico.
c) CA é uma substância onde predomina o
iônico.
d) DA é uma substância onde predomina o
covalente.
e) B2 é uma substância onde predomina o
iônico.
caráter
caráter
caráter
caráter
caráter
55. (Cesgranrio-RJ) Analise o tipo de ligação química
existente nas diferentes substâncias: Cl2, HI, H2O e
NaCl. A alternativa que as relaciona em ordem
crescente de seu respectivo ponto de fusão é:
a) Cl2 < HI < H2O < NaCl
b) Cl2 < NaCl < HI <H2O
c) NaCl < Cl2 < H2O < HI
d) NaCl < H2O < HI < Cl2
e) HI < H2O < NaCl < Cl2
56. (UFPB) Considere as equações representadas
abaixo.
Com base nessas equações, é correto afirmar que os
compostos
H3PO4(l),
MgO(s),
Ca(OH)2(s)
e
NH4HSO3(s),
pertencem,
respectivamente,
às
funções:
a) ácido, base, óxido, sal
b) base, óxido, sal, ácido
c) ácido, óxido, base, sal
c) Li2CO3.
d) H2SO4.
e) H3BO3.
58. (UECE) Considere os seguintes ácidos, com seus
respectivos graus de ionização, a 18°C e usos:
54. (UFPB) A configuração eletrônica do elemento é
importante na previsão de propriedades das
substâncias formadas, como é o caso do tipo de
ligação química envolvida. Considere, por exemplo,
as
configurações
eletrônicas
dos
elementos
simbolizados por A, B, C e D.
A : 1s2 2s2 2p6 3s2 3p5
C : 1s2 2s2 2p6 3s1
internas e de cores, formatos e tamanhos variados.
São animais capazes de se adaptar tanto a ambientes
aquáticos como terrestres. Alguns moluscos, para
defender-se dos predadores, liberam um diácido,
cuja fórmula é:
d) sal, ácido, base, óxido
e) óxido, base, sal, ácido
57. (MACKENZIE adp.) Os moluscos são animais de
corpo mole que, em sua grande maioria, apresentam
uma concha de calcário, podendo ser externas ou
I.
H3PO4 (27%), usado na preparação de
fertilizantes e como acidulante em bebidas e
refrigerantes.
II. H2S (7,6 x 10 –2 %), usado como redutor.
III. HClO4 (97%), usado na medicina, em análises
químicas e como catalisador em explosivos.
IV.
HCN (8,0 x 10–3 %), usado na fabricação de
plásticos, corantes e fumigantes para orquídeas e
poda de árvores.
Podemos afirmar que é correto:
a) HClO4 e HCN são triácidos.
b) H3PO4 e H2S são hidrácidos.
c) H3PO4 é considerado um ácido moderado.
d) H2S é um ácido ternário.
e) O HCN é o mais forte de todos os ácidos citados.
59. No processo de produção de sal refinado, a
lavagem do sal marinho provoca a perda do iodo
natural, sendo necessário, depois, acrescenta-lo na
forma de iodeto de potássio. Outra perda
significativa é a de íons magnésio, presentes no sal
marinho na forma de cloreto de magnésio e
sulfato de magnésio. Durante este processo são
também adicionados alvejantes, como o carbonato
de sódio. As fórmulas representativas das
substâncias destacadas no texto anterior são,
respectivamente:
a) KI, MgCl, MgSO4 e NaCO3.
b) K2I, MgCl2, Mg2SO4 e Na2CO3.
c) K2I, Mg2Cl, MgSO4 e Na(CO3)2.
d) KI, MgCl2, MgSO4 e Na2CO3.
e) KI2, Mg2Cl, Mg(SO4)2 e Na3CO3.
60. (MACKENZIE-SP.adp) O ferro é um dos
elementos mais abundantes na crosta terrestre, a
ematita é o principal minério de ferro. O nome vem
do fato de que este mineral é vermelho ocre quando
transformado em pó (cor do traço). No Brazil temos
grandes jazidas em Minas Gerais (Quadrilátero
Ferrífero) e Pará (Serra dos Carajás), sendo o país
grande produtor mundial. Etimologia: O nome
hematita vem do grego: hemos= sangue, em
referência à cor vermelha do traço do mineral. Em
Carajás, o minério de ferro de maior relevância é a
hematita, substância óxido de ferro III, cuja fórmula
è:
a) FeO.
b) Fe3O.
c) FeO3.
d) Fe2O3.
e) Fe3O2.
61. (UFPB) Os compostos de enxofre encontram
ampla aplicação na indústria, medicina e agricultura.
P á g i n a | 181
Em tais compostos, o enxofre pode ser encontrado
em diversos estados de oxidação como ocorre, por
exemplo, no ácido sulfúrico, no ácido sulfídrico e no
sulfito de sódio.
Em relação ao enxofre presente nestes compostos, é
correto afirmar que seu estado de oxidação é:
a) +4 no ácido sulfúrico.
b) +6 no sulfito de sódio.
c) –6 no ácido sulfúrico.
d) –2 no ácido sulfídrico.
e) +6 em todos os
compostos.
62. (UCS-RS) Submetida a um tratamento médico,
uma pessoa ingeriu um comprimido contendo 45 mg
de ácido acetilsalicílico (C9H8O4). Considerando a
massa molar do C9H8O4 180 g/mol, e o número de
Avogadro 6,0 x 1023, é correto afirmar que o número
de moléculas da substância ingerida é:
a) 1,5x 1020
b) 2,4 x1023
c) 3,4 x 1023
d) 4,5 x 1020
c) 4,6 x 1019
d) 12,0 x 1024
e) 1,6 x 1023
64. (Ufac) Três mols de benzeno (C6H6) contêm uma
massa de:
a) 78g
b) 39g
c) 156g
67. (FACIC-BA) A octanagem é uma medida do grau
da capacidade de a gasolina queimar nos motores,
sem explodir. O grau de octanagem 100 é atribuído
ao composto representado pela fórmula estrutural
e) 6,0 x 1023
63. (Mackenzie-SP) Se um dentista usou em seu
trabalho 30 mg de amálgama de prata, cujo teor em
prata é de 72% (em massa), o número de átomos de
prata que seu cliente recebeu em sua arcada dentária
é de aproximadamente (massa atômica: Ag = 108;
constante de Avogadro = 6,0 x 1023):
a) 4,0 x 1023
b) 12,0 x 1019
b) Geraniol é um álcool insaturado, com ligações
duplas conjugadas.
c) Mirceno é um trieno que possui ligações duplas
conjugadas.
d) Civetona possui cadeia cíclica, homogênea e
insaturada.
e) Mirceno e Geraniol são, respectivamente, apolar e
polar.
d) 72g
e) 234 g
Com base nessa
composto é:
estrutura,
o
nome
oficial
do
a) 2, 3, 4, 5-tetrametil-butano.
b) 2, 2, 3-trimetil-pentano.
c) 2, 3, 5-trimetil-pentano.
d) 2, 2, 4, 4-tetrametil-butano.
e) 2, 2, 4-trimetil-pentano.
68. (ACR-2007) O isopreno, composto de fórmula
abaixo, é produzido por muitos vegetais e é utilizado
para a síntese de várias substâncias encontradas em
planas, tais como a vitamina E, o licopeno (que dá
cor vermelha a tomates e pimentões) e o β caroteno (que dá cor alaranjada às cenouras).
Segundo a IUPAC, o isopreno chama-se:
65. (UFSE) 1,8 x 1023 moléculas de uma substância
A têm massa igual a 18,0 g. A massa molar de A, em
g/mol, vale:
a) 18,0
b) 60,0
c) 75,0
d) 90,0
e) 120
66. (UFPB) Os químicos, com o objetivo de diminuir
impactos negativos para o meio ambiente, têm
produzido compostos sintéticos para usá-loscomo
essências na produção de perfumes, substituindo os
aromas
naturais.
Dentre
esses
compostos,
encontram-se o MIRCENO, o CITRAL, o GERANIOL e
a CIVETONA, conforme estruturas abaixo. Esses
compostos
substituem
essências
extraídas,
respectivamente, da verbena, do limão, de rosas e de
glândulas de um gato originário do Egito.
a) 3 – metil – buta – 1, 3 – dieno.
b) 3 – metil – buta – 1, 3 – diino.
c) 2 – metil – buta – 1, 3 – dieno.
d) 2 – metil – buta – 1, 3 – diino.
e) penta – 1, 3 – dieno.
69. (UFPB) A respeito da nomenclatura e fórmula
molecular dos compostos, numere a segunda coluna
de acordo com a primeira:
1. Metanol
2. Etanol
(
(
) HCHO
) CH CHO
3. Propan-1-ol
(
) C H OH
4. Etanal
(
) CH COOH
5. Ácido Etanóico
(
) CH OH
6. Metanal
a) 6, 3, 2, 5, 4
b) 5, 4, 2, 6, 1
c) 3, 2, 4, 6, 5
Em relação às estruturas desses
INCORRETO afirmar:
compostos, é
a) Civetona e Citral são compostos carbonílicos.
3
3
7
3
3
d) 1, 5, 3, 4, 6
e) 6, 4, 3, 5, 1
70. (UFPB) Uma das substâncias líquidas cristalinas
mais eficientes, empregadas na produção de Visores
de Cristal Líquido (LCD), é o composto
P á g i n a | 182
transmissão de sinais de uma célula nervosa a outra.
A fórmula estrutural da tirosina é
Em relação a esse composto, é INCORRETO afirmar:
a) A fórmula molecular é C18H29N.
b) O número de átomos de carbono primário,
secundário e terciário é, respectivamente, 2, 12 e 4.
c) O número de átomos de carbono com hibridização
sp3, sp2 e sp é, respectivamente, 15, 2 e 1.
d) O número de ligações pi (p) é igual a 3.
e) Apenas os átomos de carbono terciários possuem
geometria tetraédrica.
Os grupos funcionais presentes nessa molécula são:
71. (Unisinos-RS) considere as seguintes afirmações:
75. (UFSM-RS) O mirceno, responsável pelo “gosto
azedo da cerveja”, é representado pela estrutura:
I. O dimetilpropano apresenta cinco carbonos em sua
estrutura molecular.
II. O propino possui três átomos de carbono e quatro
átomos de hidrogênio na molécula.
III. O eteno apresenta dois hidrogênios em cada
carbono.
a) fenol, anilina e aldeído. b) álcool, amida e cetona.
c) fenol, amina e ácido.
d) álcool, amina e ácido.
e) fenol, amina e aldeído.
Considerando
o
composto
indicado, assinale a alternativa
correta quanto à classificação
da cadeia.
Dessas afirmações estão corretas, apenas:
a) I.
b) I, II e III.
c) I e III.
d) I e II.
e) II e III.
72. (UFPB) O índigo blue, corante azul usado no
tingimento de tecidos para produção de jeans, é
representado pela fórmula estrutural ao lado.
Com relação à estrutura do índigo blue, analise as
seguintes proposições:
a) acíclica, homogênea, saturada e normal.
b) acíclica, heterogênea, insaturada e ramificada.
c) cíclica, heterogênea, insaturada e ramificada.
d) aberta, homogênea, saturada e normal.
e) aberta, homogênea, insaturada e ramificada.
76. Qual o volume ocupado por 8,0 g de gás
hidrogênio a 127 °C e 0,82 atm (dados: R=0,082
atm.L.mol-1.K-1)
a) 160 L
b) 168 L
I. Sua fórmula molecular é C16H14O2N2.
II. Sua cadeia carbônica é classificada como fechada,
heterogênea, insaturada e aromática.
III. Sua estrutura é plana, porque todos os átomos
de carbono possuem hibridização do tipo sp2.
IV. Sua massa molar é 262 g/mol.
c) 180 L
d) 150 L
e) 158 L
77. Determine a massa de amônia que ocupa o
volume de 8,2 a 2 atm e 127 °C. (dados: R=0,082
atm.L.mol-1.K-1)
a) 10,50 g
b) 5,50 g
c) 8,50 g
d) 7,50 g
e) 9,50 g
Estão corretas apenas:
a) I, II e IV
d) II e III
b) I e II
e) I, III e IV
c) II, III e IV
73. (USC-SP) Ácido acrílico líquido de cheiro irritante,
solúvel em água e em solventes orgânicos é
empregado na síntese de resinas acrílicas, cuja
fórmula:
também conhecida com o nome de ácido acroléico,
possui nome oficial:
a) ácido prop-3-enóico.
b) ácido prop-2-enóico.
c) ácido prop-1-enóico.
d) ácido propenol.
e) ácido propiônico.
74. (FEI) A molécula de tirosina é utilizada pelo
corpo humano para a formação de várias outras
moléculas e, entre elas, algumas responsáveis pela
78. Sabe-se que a pressão parcial da amônia é ¼ da
pressão parcial do gás sulfídrico. Qual a relação entre
a massa de amônia e gás sulfídrico? Dados: N = 14;
H = 1; S = 32
a)
b)
1
1/2
c)
d)
1/3
1/4
e)
1/8
79. (UNIMEP – SP) 15 litros de uma determinada
massa gasosa encontram-se a uma pressão de 8,0
atm e à temperatura de 30º C. Ao sofrer uma
expansão isotérmica, seu volume passa a 20 litros.
Qual será a nova pressão do gás?
a) 7,0 atm
b) 7,5 atm
c) 5,0 atm
d) 6,0 atm
e) 4,0 atm
80. Considere 32 g de gás oxigênio e 32 g de dioxido
de enxofre em um recipiente com 8,2 L de
capacidadeà temperatura de 27 °C. Qual a pressão
parcial para cada gás?
P á g i n a | 183
a) P(O2) = 1,5 atm
b) P(O2) = 2,0 atm
c) P(O2) = 3,0 atm
d) P(O2) = 1,5 atm
e) P(O2) = 2,5 atm
e
e
e
e
e
P(SO2) = 3,0 atm
P(SO2) = 1,5 atm
P(SO2) = 1,5 atm
P(SO2) = 2,0 atm
P(SO2) = 2,5 atm
81. (UFPB) A atmosfera é uma preciosa camada de
gases considerada vital, protegendo os seres vivos de
radiações
nocivas
e
fornecendo
substâncias
importantes como oxigênio, nitrogênio, dióxido de
carbono, água, dentre outras. Além disso, os gases
têm ampla aplicabilidade: o N2O é usado como
anestésico; o CO2, no combate a incêndios; o CH4,
como combustível; o O2, em equipamentos de
mergulho
etc.
Considerando
os
conceitos
relacionados com a Teoria dos Gases Ideais, numere
a segunda coluna de acordo com a primeira.
83. (FEI-SP) Um cilindro munido de êmbolo contém
um gás ideal representado pelo ponto 1 no gráfico. A
seguir o gás é submetido sucessivamente à
transformação isobárica (evolui do ponto 1 para o
ponto 2), isocórica (evolui do ponto 2 para o ponto 3)
e isotérmica (evolui do ponto 3 para o ponto 1). Ao
representar os pontos 2 e 3 nas isotermas indicadas,
conclui-se que:
a) a temperatura do gás no estado 2 é 450 K.
b) a pressão do gás no estado 3 é 2 atm.
c) a temperatura do gás no estado 3 é 600 K.
d) o volume do gás no estado 2 é 10 L.
e) a pressão do gás no estado 2 é 2 atm.
84. (UFRS) Se o sistema representado abaixo for
mantido a uma temperatura constante e se os três
recipientes possuírem o mesmo volume, após
abrirem as válvulas A e B, a pressão total nos três
recipientes será:
a) 3 atm.
b) 4 atm.
c) 6 atm.
d) 9 atm.
e) 12 atm.
85. (Mackenzie – SP) Têm-se cinco recipientes
contendo soluções aquosas de cloreto de sódio.
A sequência correta é:
a) 6, 1, 4, 2, 5
b) 6, 2, 4, 1, 3
d) 3, 4, 2, 1, 6
c) 3, 2, 4, 1, 5
e) 3, 1, 4, 2, 6
82. (Cefet-MG) A figura a seguir mostra dois
recipientes unidos por um tubo de volume
desprezível provido de uma torneira. Inicialmente o
recipiente A contém 1 mol de um gás inerte e em B
há vácuo. Os dois recipientes são mantidos à mesma
temperatura (TA = TB). A torneira é aberta durante
um certo tempo. Ao se fechar a torneira, observou-se
que a pressão em A e B são iguais, ou seja, PA = PB.
Com base nessas informações, pode-se afirmar que o
número de mol gasoso transferido para B é:
a) 1,00 mol.
b) 0,25mol.
c) 0,20 mol.
d) 0,40 mol.
e) 0,75 mol.
É correto afirmar que:
a) o recipiente 5 contém a solução mais concentrada
b) somente os recipientes 3 e 4 contêm soluções de
igual concentração
c) as cinco soluções têm a mesma concentração
d) o recipiente 1 contém a solução mais concentrada
e) o recipiente 5 contém a solução menos
concentrada
86. (Puccamp-SP) Evapora-se totalmente o solvente
de 250 mL de uma solução aquosa de cloreto de
magnésio, 8,0g/L. Quantos gramas de soluto são
obtidos ?
P á g i n a | 184
a) 8,0 g.
b) 6,0 g.
c) 4,0 g.
d) 2,0 g.
e) 1,0 g.
87. (UFF-RJ) A massa de butanol, C4H10O, necessária
para o preparar 500 mL de solução 0,20 mol/L é:
Dados: H = 1 u; C = 12 u; O = 16u.
a) 14,8g.
b) 7,4g.
c) 3,7g.
d) 37,7g.
e) 18,5g.
88. Um químico preparou uma solução de carbonato
de sódio (Na2CO3) pesando 53g do sal, dissolvendo e
completando o volume para 2 litros. A molaridade da
solução preparada foi de:
Dados: C = 12 u; O = 16 u; Na = 23 u
a) 1,00 mol/L.
b) 0,50 mol/L.
c) 0,25 mol/L.
d) 0,125 mol/L.
e)0,625 mol/L.
89. (UEPG-PR) Muitos compostos dos metais
alcalinos, em particular os de sódio e potássio, são
industrialmente importantes, como é o caso do
hidróxido de sódio, cujo nome comum é soda
cáustica. Soluções contendo NaOH podem ser
preparadas utilizando-se a água como solvente,
devido à sua solubilidade em meio aquoso.
Considerando essas informações, calcule a massa,
em gramas, necessária para preparar 200 mL de
solução de soda cáustica com concentração igual a
0,5 mol/L.
Dados: Na=23; O=16; H=1
90. (UNIMEP) Uma massa de 160g deNaOH foi
dissolvida em 216g de água. A fração molar do NaOH
e do H2O nessa solução é, respectivamente.
Dados: MM: Na = 23; O = 16; H = 1
91. (U. F. Viçosa-MG) A substância na qual o
manganês apresenta maior número de oxidação é:
a) K2MnO4 c) MnO2 e) MnSO4
b) KMnO4 d) Mn
92. (UEFS-BA) Considere-se a reação:
Pode-se afirmar que:
a) Zn sofre oxidação; portanto, é agente oxidante.
b) Zn sofre redução; portanto, é agente redutor.
c) Pb sofre redução; portanto, é agente oxidante.
d) Pb sofre oxidação; portanto, é agente redutor.
e) Zn é agente oxidante e Pb é agente redutor.
93. (UFRS) Por efeito de descargas elétricas, o
ozônio pode ser formado, na atmosfera, a partir da
seqüência de reações representadas a seguir:
Considerando as reações no sentido direto, pode se
afirmar que ocorre oxidação do nitrogênio:
a) apenas em I.
b) apenas em I e II.
d) apenas em I e III.
e) em I, II e III.
c) apenas em II.
94. (UCS-RS) Submetida a um tratamento médico,
uma pessoa ingeriu um comprimido contendo 45 mg
de ácido acetilsalicílico (C9H8O4 = 180 g/mol). Sendo
a constante de Avogrado 6,0.1023, é correto afirmar
que o número de moléculas da substancia ingerida é:
a) 1,5 . 1020
d) 4,5. 1020
b) 2,4 . 1023
e) 6,0 . 1023
c) 3,4 . 1023
95. (Unesp-SP) Considere
representada pela equação:
a
reação
química
Al(OH)3 + H2SO4 → Al2(SO4)3 + H2O
Calcule a quantidade (em mols) de Al2(SO4)3 que
pode ser produzida a partir de 4,0 mol de Al(OH)3.
96. (UFRJ) Um balão de oxigênio contendo 3,01 x
1026 átomos foi completamente utilizado por uma
equipe médica durante uma cirurgia. Admitindo-se
que havia apenas gás oxigênio (O2) nesse balão, a
massa utilizada do referido gás foi equivalente a:
(dado: O2 = 32g/mol.)
a) 8,0 kg.
b) 4,0 kg.
c) 12,0 kg.
d) 16,0 kg.
e) 24,0 kg
97. (UFPB) A produção de vinho resulta da
fermentação do suco de uva (rico em glicose) pela
ação de enzimas, que promovem uma série de
reações que levam à formação de álcool e CO ,
2
conforme a equação abaixo:
Considerando-se uma amostra de suco de uva que
contém 360g de glicose, é correto afirmar que, nas
CNTP, o volume de CO obtido é:
a) 22,4L
d) 89,6L
2
b) 44,0L
e) 174,0L
c) 88,0L
98. (POUSO ALEGRE-MG) Admitindo-se que 560
litros de CO2 pudessem apagar o incêndio de uma
sala, um extintor contendo 4,4 kg de gás carbônico,
nas CNTP, apagaria o incêndio de ________. (Dados:
C = 12g/mol; O = 16g/mol).
a) uma sala.
b) duas salas.
c) três salas.
e) cinco salas.
d) quatro salas.
100. 20g de uma amostra de oxido de ferro III, após
reagir com o hidrogênio, produziram 11,2 g de ferro
puro.
Fe2O3 + H2 → Fe + H2O
Determine o teor de pureza da amostra:
P á g i n a | 185
101. Na reação de formação da amônia, tem-se
112g de N2 reagindo com 40g de Hidrogênio, é
correto afirmar que:
N2
(g)
+
H2
(g)
→
NH3 (g)
Determine:
a) Qual é o reagente em excesso?
b) Qual é o reagente limitante?
c) Qual é a massa do reagente em excesso que foi
consumida?
d) Qual é a massa do reagente em excesso?
e) qual é a massa da amônia produzida?
102. (UFPB)Os compostos organometálicos são
reagentes muito importantes, uma vez que
participam de reações químicas úteis à síntese das
mais variadas substâncias orgânicas. Nesse sentido,
observe as reações abaixo.
Considere as proposições relacionadas aos compostos
I, II, III e IV, identificando a(s) verdadeira(s).
01. O composto II apresenta isomeria geométrica e o
composto IV, isomeria óptica.
02. Apenas os compostos I e III apresentam isomeria
geométrica.
04. Apenas o composto IV possui um átomo de
carbono quiral.
08. Os compostos II e III apresentam isomeria
geométrica,
com
geometria
TRANS
e
CIS
respectivamente.
16. Os compostos I e IV possuem atividade óptica.
A soma dos valores atribuídos à(s) proposição(ões)
verdadeira(s) é igual a [
]25
104. (UFPB – 2007) A isomeria óptica é uma
propriedade que ocorre em moléculas assimétricas,
por
exemplo,
no
ácido 3 - cloro - 2 hidroxibutanodióico, representado ao lado.
Em relação
proposições:
a
essas
reações,
considere
as
I. Todas são reações de adição à carbonila.
II. Y é um álcool em todas as reações.
III. Cloreto de metilmagnésio é um reagente de
Grignard.
Está(ão) correta(s):
a) todas
b) nenhuma
c) apenas I e II
d) apenas I e III
e) apenas II e III
f) apenas III
103. (UFPB) A cor e o odor das folhas de menta, das
rosas e de partes de muitos vegetais, como a
cenoura e o tomate, se devem a uma classe de
compostos naturais denominados TERPENOS. Esses
compostos existem como óleos essenciais e podem
pertencer às mais diversas funções orgânicas, como
hidrocarbonetos, aldeídos, cetonas,
álcoois etc. As fórmulas abaixo representam alguns
desses terpenos.
Em relação a esse ácido, considere as seguintes
proposições, identificando as verdadeiras.
(01)
A molécula é aquiral.
(02)
O número de isômeros ópticos ativos é igual
a 4.
(04)
O número racematos é igual a 2.
(08)
Enantiômeros possuem propriedades físicas
iguais, exceto o desvio da luz polarizada.
(16)
Diastereoisômeros
formam
mistura
racêmica.
A soma dos valores atribuídos às proposições
verdadeiras é igual a [
] 14
Prof. Wagnner Melo, Leonardo, Tadeu, Willy
PSS 3
Configuração eletrônica
1. (UFPB) Considere as seguintes informações sobre
a configuração eletrônica de cátions e de ânions.
_ A configuração eletrônica do último subnível da
espécie X + é 4s2.
_ O último subnível da espécie Y 2 + é 3d10.
_ A espécie Z – tem configuração eletrônica do último
subnível igual a 3p5.
P á g i n a | 186
Com base nestas informações e de acordo com a
classificação periódica, é correto afirmar que os
elementos X, Y e Z pertencem, respectivamente, aos
grupos:
a ) 2 , 12 e 17
d) 16 , 13 e 12
b) 13 , 15 e 14
e) 13 , 12 e 16
c) 14 , 12 e 13
2. (UFPB) O uso inadequado de defensivos agrícolas
pode trazer danos para o meio ambiente, pois esses
materiais são constituídos de substâncias químicas de
elevada toxicidade, a exemplo do Na3 As O3 e do
Cu 3(As O3)2. Em relação a esses compostos, é correto
afirmar:
a) Os elétrons mais energéticos do íon Na + do
Na3 As O3 possuem números quânticos principal n = 3
e secundário l = 0.
b) O íon Cu2+ do Cu3(As O3)2 possui configuração
eletrônica 1s 2 2s 2 2p 6 3s 2 3p 6 3d 9.
c) O íon As 3+ do Na3As O3 possui 33 elétrons.
d) O íon Na+ do Na3As O3 possui 12 prótons e 11
nêutrons.
e) O raio atômico do íon O 2– do Cu3(As O3)2 é menor
que o raio do átomo de oxigênio.
3. (UNAERP) O fenômeno da supercondução de
eletricidade, descoberto em 1911, voltou a ser objeto
da atenção do mundo científico com a constatação de
Bednorz e Müller de que materiais cerâmicos podem
exibir esse tipo de comportamento, valendo um
prêmio Nobel a esses dois físicos em 1987. Um dos
elementos químicos mais importantes na formulação
da cerâmica supercondutora é o ítrio: 1s2 2s2 2p6
3s2 3p6 4s2 3d10 4p6 5s2 4d1, o número de
camadas e o número de elétrons mais energéticos
para o ítrio, serão respectivamente:
a) 4 e 1.
b) 5 e 3
c) 4 e 2.
d. ) 5 e 1.
e) 4 e 3.
4. (CEFET-PB) Os números quânticos têm o objetivo
de caracterizar qualquer elétron de um átomo. Quais
os números quânticos do último elétron “d” da
espécie química de carga nuclear 29? Considerar
Spin: + = ↑; - = ↓
a) 3, 0, +2, +1/2
b) 4, 0, 0, +1/2
c) 4, 0, 0, -1/2
d) 4, 2, -2, -1/2
e) 3, 2, +1, -1/2
5. (UEL) Dentre os números atômicos 23, 31, 34, 38,
54, os que correspondem a elementos químicos com
dois elétrons de valência são:
a) 38 e 54
d) 34 e 54
b) 31 e 34
e) 23 e 38
c) 31 e 38
6. (UFCG) Um estudante, estudando distribuição
eletrônica, de acordo com as suas regras e
convenções, como o princípio de exclusão de Pauling
e a regra de Hund, montou a tabela abaixo, que
mostra algumas alternativas de valores dos números
quânticos para um elétron de um átomo que se
encontra no estado fundamental. Dentre as
alternativas presentadas, quais indicam o conjunto
de números quânticos corretos?
a) A e D.
d) C, D e E.
b) B, C e D.
e) A, D e E.
c) C e E.
O texto abaixo serve de suporte às questões 7:
O conhecimento da configuração eletrônica do
elemento é muito importante para o químico. Isto
porque, a partir dessa configuração, além de saber a
posição do elemento na Tabela Periódica, pode-se
fazer uma previsão das propriedades químicas e
físicas. Como exemplo, as configurações eletrônicas
I, II, III e IV representam elementos contidos em
maior proporção ou no diamante, ou no aço, ou no ar
ou nos chips.
I – 1s2, 2s2, 2p2
II -1s2, 2s2, 2p6, 3s2, 3p2
III -1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d6
IV-1s2, 2s2, 2p3
7. (UFPB) Com relação às configurações eletrônicas
apresentadas no texto, é INCORRETO afirmar:
a) Os elétrons mais energéticos do nitrogênio têm
número quântico principal, n = 2.
b) Os elétrons mais energéticos do carbono têm
número quântico secundário, l = 1.
c) Os elétrons de valência do silício têm números
quânticos secundário, l = 0 e l = 1.
d) O elemento representado pela configuração
eletrônica III está localizado no grupo 8B e no
terceiro período da Tabela Periódica.
e) Os elétrons mais energéticos dos elementos
representados pelas configurações I e IV têm o
mesmo número quântico principal (n) e secundário
(l).
8. (UFPB) O elemento químico X é um não-metal que
está presente no hormônio regulador do crescimento,
a tiroxina, produzido pela glândula tireóide. X é
também muito usado como anti-séptico e germicida.
O último elétron de X apresenta o seguinte conjunto
de números quânticos: n = 5 , l = 1 , m = 0 e s =
+1/2. Convencionando-se que, para l = 1 , o
preenchimento eletrônico do número quântico m
segue a ordem 1 − , 0 e 1 + e que o primeiro elétron
a ocupar um orbital possui número quântico de spin
igual a –1/2, pode-se afirmar que o elemento X:
a) pertence ao grupo 17 da tabela periódica e tem
número atômico igual a 53.
b) pertence ao grupo 14 da tabela periódica e tem
número atômico igual a 50.
c) pertence ao 5° período da tabela periódica e tem
cinco elétrons na última camada.
d) pertence ao 5° período da tabela periódica e tem
dois elétrons na última camada.
e) é um halogênio do 5° período e tem cinco elétrons
na última camada.
Ligações Químicas
P á g i n a | 187
9. (UFPB) As Teorias da Repulsão dos Pares
Eletrônicos da Camada de Valência e da Hibridização
do átomo são importantes na previsão da geometria
das moléculas. Neste sentido, considere as moléculas
abaixo e as proposições a seguir:
CHCl3
PCl3
H2S
A
B
C
I. A hibridização do átomo central em A, B e C é,
respectivamente, sp3 , sp2 e sp.
II. O átomo central nas moléculas A, B e C tem
hibridização sp3 .
III. A, B e C têm geometria tetraédrica.
IV. A geometria das moléculas é, respectivamente,
tetraédrica, piramidal e angular.
Estão corretas:
a) apenas I e III
b) apenas II e III
c) apenas II e IV
d) apenas I e IV
e) I, II, III e IV
10. (UFPB) Considerando-se o dióxido de carbono,
CO2, afirma-se que é:
a) linear, polar, apresentando duas ligações sigma e
duas ligações pi.
b) angular, polar, apresentando duas ligações sigma
e duas ligações pi.
c) linear, apolar, apresentando duas ligações sigma e
duas ligações pi.
d) linear, apolar, apresentando quatro ligações
sigma.
e) angular, apolar, apresentando duas ligações sigma
e duas ligações pi.
11. (OSEC) As hibridações de orbitais sp, sp2 e sp3
possuem, respectivamente, os seguintes ângulos:
a) 120°, 109°, 180°
b) 120°, 180°, 109°
c) 109°, 180°, 120°
d) 180°, 120°, 109°
e) 180°, 109°, 120°
12. (UFMG) NH3, H2O
explicáveis por hibridação:
a) sp
b) sp2
e
CH4
c) sp3
d) dsp3
são
moléculas
e) d2sp3
13. (UEMT – UFRS) Qual dos elementos a seguir,
cujas estruturas eletrônicas são apresentadas, teria
capacidade de ligação nula, se não ocorresse
hibridização?
a) 1s1
b) 1s2 2s2
c) 1s2 2s2 2p2
d)
e)
1s2 2s2 2p4
1s2 2s2 2p5
14. Se não houvesse hibridação, a fórmula do
composto de boro (Z = 5) e flúor (Z = 9) seria:
a) BF
b) BF2
c) BF3
d) BF4
e) BF5
Eletroquímica
15. (UEFS-BA) Considere-se a reação:
Pode-se afirmar que:
a) Zn sofre oxidação; portanto, é agente oxidante.
b) Zn sofre redução; portanto, é agente redutor.
c) Pb sofre redução; portanto, é agente oxidante.
d) Pb sofre oxidação; portanto, é agente redutor.
e) Zn é agente oxidante e Pb é agente redutor.
16. (UFU-MG) Entende-se por corrosão
material a sua deterioração ou destruição,
por uma reação química com o meio no
encontra. Essas reações são de oxidação e
Na reação química de oxidação e
representada pela equação
de um
causada
qual se
redução.
redução,
Al + 3 AgNO3 → Al(NO3)3 + 3 Ag
a) o alumínio é o oxidante, porque é oxidado;
b) o alumínio é o redutor, porque é oxidado;
c) a prata do nitrato de prata é o oxidante, porque
ela é oxidada;
d) a prata do nitrato de prata é o redutor, porque ela
é reduzida;
e) o alumínio e a prata do nitrato de prata são
redutores, porque eles são oxidados.
17. Considere o esquema referente à pilha a seguir:
A afirmativa correta:
a) O eletrodo B está sofrendo uma redução.
b) A concentração (quantidade) de íons A2+ diminui.
c) O eletrodo B é o pólo positivo.
d) O eletrodo B é denominado cátodo.
e) A concentração (quantidade) de íons B3+ diminui.
18. (PUC-MG) O valor do
representada pela equação:
ddp
para
a
célula
conhecendo-se os potenciais-padrão de redução:
é igual a:
a) +3,17 v.
b) +1,57 v.
c) +0,77 v.
d) –3,17 v.
e) –0,77 v.
19. (Cesgranrio-RJ) Nas espécies químicas HF, HIO3,
HClO, ClO4– e BrO3– , os números de oxidação dos
halogênios são, respectivamente:
a) +1, +5, +1, +4, +3.
b) +1, +5, +1, –5, –1.
c) –1, +5, +1, +7, +5.
d) –1, –5, +1, –7, –3.
e) 0, +6, –1, +7, –5.
20. (Cesgranrio-RJ) Dada a equação:
P á g i n a | 188
os coeficientes, na ordem em que aparecem após o
balanceamento, são:
a) 1; 4; 2; 1; 2; 2.
b) 1; 4; 1; 1; 1; 2.
c) 2; 4; 2; 2; 2; 2.
d) 1; 2; 1; 1; 1; 2.
e) 2; 4; 1; 2; 1; 4.
21. (PUC-RIO) O trabalho produzido por uma pilha é
proporcional à diferença de potencial (ddp) nela
desenvolvida quando se une uma meia-pilha onde a
reação
eletrolítica
de
redução
ocorre
espontaneamente (catodo) com outra meia pilha
onde a reação eletrolítica de oxidação, ocorre
espontaneamente (anodo).
Com base nas semi-reações eletrolíticas acima,
colocadas no sentido da oxidação, e seus respectivos
potenciais, assinale a opção que indica os metais que
produzirão maior valor de ddp quando combinados
para formar uma pilha.
a) cobre como catodo e prata como anodo.
b) prata como catodo e zinco como anodo.
c) zinco como catodo e cádmio como anodo.
d) cádmio como catodo e cobre como anodo.
e) ferro como catodo e zinco como anodo.
atenua o processo de corrosão dos metais, sendo
bastante usada na proteção de gasodutos e tanques
de combustíveis. Nesse sentido, uma barra metálica
que se oxida antes do metal de que é feito o tanque
é a esse conectado, garantindo assim proteção
catódica.
A
figura
abaixo
representa,
esquematicamente, esse procedimento.
Com base nas informações sobre os potenciais
padrão de redução, é correto afirmar que a
combinação apropriada de metais, para a construção
de um tanque de combustível com proteção catódica,
corresponde a:
a) Tanque de ferro e barra de cobre
b) Tanque de ferro e barra de magnésio
c) Tanque de magnésio e barra de ferro
d) Tanque de zinco e barra de níquel
e) Tanque de níquel e barra de cobre
24. (UFPB) É antigo o desejo de substituir a energia
oriunda de combustíveis fósseis por uma outra fonte,
cuja forma de obtenção seja mais eficiente, mais
barata e não cause danos ambientais. Uma boa
alternativa vem da célula combustível do tipo
hidrogênio-oxigênio (figura abaixo), que gera
eletricidade através de um processo eletroquímico
sem emissão de qualquer poluente, sem barulho ou
vibração.
O texto, a seguir, serve de suporte às questões 22 e 23.
22. (UFPB) Os potenciais padrão de redução também
são bastante úteis para se obter informações sobre o
caminho de uma reação. Dentre as reações abaixo
equacionadas,
a
que
representa
o
sentido
espontâneo da reação é:
a) FeCl2(aq) + Ni(s) → NiCl2 (aq) + Fe(s)
b) MgCl2(aq) + Cu(s) → Mg(s) + CuCl2(aq)
c) Zn(NO3)2 (aq) + Fe(s) → Fe(NO3)2 (aq) + Zn(s)
d) CuCl2(aq) + Ni(s) → Cu(s) + NiCl2 (aq)
e) Mg(NO3)2 (aq) + Zn(s) → Mg(s) + Zn(NO3)2 (aq)
23. (UFPB - PSS 2007) A técnica de proteção
catódica é um procedimento eletroquímico que
De acordo com as informações sobre essa célula, é
correto afirmar:
a) A oxidação de O2 (g) ocorre no cátodo.
b) A redução do H2 (g) ocorre no ânodo.
c) O potencial padrão da célula é igual a 0,43V.
d) A reação eletroquímica da célula é espontânea nas
condições padrão.
e) A reação global do processo eletroquímico é
2H2 (g) + O2 (g) → 2H2O(l) + 4e-.
25. (UFPB) Na reação acima, as substâncias oxidante
e redutora são respectivamente:
P á g i n a | 189
a) K Cr O e CH CH OH
d) K Cr O e CH COOH
b) CH COOH e K Cr O
e) H SO e CH COOH
2
2
7
3
3
2
3
2
2
2
c) CH COOH e H SO
7
2
2
2
7
4
3
3
4
26. (UFPB - 2006) Na produção de filmes finos,
amplamente usados na fabricação de condutores,
resistores, circuitos microeletrônicos, dispositivos
fotovoltaicos, dentre outros, é conveniente empregar
conhecimentos básicos a respeito de células
eletroquímicas. Nesse contexto, com respeito às
células voltaicas e às células eletrolíticas, é
INCORRETO afirmar:
a) O eletrodo no qual ocorre o processo de oxidação
é denominado cátodo, tanto para as células voltaicas
quanto para as células eletrolíticas.
b) A ocorrência espontânea de uma reação de óxidoredução, na célula voltaica, promove a geração de
corrente elétrica.
c) Uma reação química, na célula eletrolítica, é
provocada pela passagem de corrente elétrica.
d) A eletrólise ígnea é o nome da reação química
provocada pela passagem de corrente elétrica,
através de um composto iônico fundido.
e) A eletrólise aquosa é o nome da reação química
provocada pela passagem de corrente elétrica,
através da solução aquosa de um eletrólito.
27. (UFF-RJ) Os esquemas
transformações químicas:
I
e
II
ilustram
Por eletrólise da água, feita com eletrodos inertes
adequados, obtém-se os gases hidrogênio e oxigênio,
se for adicionado um eletrólito que pode ser:
a) KBr.
b) NaCl.
c) Fe(NO3)2.
d) MgSO4.
e) AgCl.
29. (Fesp-PE) Na eletrólise de uma solução aquosa
de NaCl, a solução:
a) torna-se ácida devido à formação de HCl.
b) torna-se básica devido à formação de NaOH.
c) permanece neutra devido à formação de H2 e Cl2.
d) permanece neutra devido à formação de H2 e O2.
e) permanece neutra devido à formação de O2 e Cl2.
30. (UEPB) Os produtos que podem ser obtidos nas
eletrólises das soluções aquosas de cloreto de sódio e
nitrato de cálcio são, respectivamente,
a) gases hidrogênio e cloro; gases hidrogênio e
oxigênio.
b) gases hidrogênio e cloro; gás hidrogênio e cálcio.
c) gás cloro e sódio; gases nitrogênio e oxigênio.
d) gás hidrogênio e sódio; cálcio e nitrogênio.
e) apenas gás cloro; apenas oxigênio.
31. (Fuvest-SP) Uma solução aquosa de iodeto de
potássio, KI, foi eletrolisada, usando-se aparelhagem
esquematizada na figura. Após algum tempo de
eletrólise, adicionaram-se algumas gotas de solução
de fenolftaleína na região do eletrodo “A” e algumas
gotas de amido na região do eletrodo “B”. Verificouse o aparecimento da cor rosa na região “A” e da cor
azul (formação de iodo) na região “B”.
Observando-se os esquemas, pode-se assegurar que:
a) no esquema I ocorre uma reação não espontânea
de oxirredução;
b) no esquema I a energia elétrica é convertida em
energia química;
c) o esquema II os eletrodos de carbono servem para
manter o equilíbrio iônico;
d) no esquema II a energia elétrica é convertida em
energia química;
e) no esquema II ocorre uma reação espontânea de
oxirredução.
28. (Mack-SP) Considere as tabelas
decrescente
de
prioridade
de
respectivamente do ânodo e do cátodo.
de ordem
descarga,
Nessa eletrólise,
I. no pólo negativo, ocorre redução da água com
formação de OH– e de H2.
II. no pólo positivo, o iodeto ganha elétrons e forma
iodo.
III. a grafite atua como condutora de elétrons.
Das afirmações, apenas a:
a) I é correta.
b) II é correta.
c) III é correta.
d) I e a III são corretas.
e) II e a III são corretas.
Termoquímica
P á g i n a | 190
32. (Fuvest) Considere a reação de fotossíntese
(ocorrendo em presença de luz e clorofila) e a reação
de combustão da glicose representadas a seguir:
A variação de entalpia, aproximada, para a reação
Sabendo-se que a energia envolvida na combustão
de um mol de glicose é de 2,8x106J, ao sintetizar
meio mol de glicose, a planta:
calculada a partir dos dados é:
a) libera 1,4 x 106 J.
b) libera 2,8 x 106 J.
c) absorve 1,4 x 106 J.
a) –181,5 kcal/mol
b) –24,2 kcal/mol
c) +338,8 kcal/mol
d) absorve 2,8 x 106 J.
e) absorve 5,6 x 106 J.
33. (UMC-SP) Considere as reações escritas abaixo,
em que A e B são reagentes e C é produto, e suas
variações de entalpia (ΔH), cujos valores estão
representados por x, y e z.
I. A(g) + B(g) → C(g) + H2O(g). ΔH = - x cal.
II. A(g) + B(g) → C(g) + H2O( l ). ΔH = - y cal.
III. A(g) + B(g) → C(g) + H2O(s). ΔH = - z cal.
CH4 (g) + Cl2 (g) → H3CCl(g) + HCl(g)
d) +181,5 kcal/mol
e) +24,2 kcal/mol
37. (PUC – SP) dadas as entalpia de ligação:
H — H = 435 kJ/mol
N — H = 390 kJ/mol
A reação de síntese da amônia, processo industrial de
grande relevância para a indústria de fertilizantes e
de explosivos, é representada pela equação
N2(g) + 3 H2(g) → 2 NH3(g) H = – 90 kJ
Com relação à energia envolvida nas reações, qual é
a afirmação INCORRETA?
A partir dos dados fornecidos, determina-se que a
entalpia de ligação contida na molécula de N2 é igual
a
a) A reação II libera mais calor do que a l.
b) A reação III libera mais calor do que a II.
c) O calor de fusão do gelo pode ser calculado por z y.
d) O calor de vaporização da água pode ser calculado
por y - x.
e) O calor de sublimação do gelo pode ser calculado
por x - z.
a) – 645 kJ/mol
b) 0 kJ/mol
c) 645 kJ/mol
34. Numa reação exotérmica, há [1] de calor, a
entalpia final (produtos) é [2] que a entalpia inicial
(reagentes) e a variação de entalpia é [3] que zero.
Completa-se corretamente essa frase substituindo-se
[1], [2] e [3], respectivamente, por:
d) 945 kJ/mol
e) 1125 kJ/mol
38. (UFPB) A variação de entalpia da reação de
produção de metanol pode ser calculada a partir das
entalpias das ligações químicas envolvidas. A tabela
abaixo apresenta alguns valores de entalpias de
ligação.
a) liberação, maior, maior.
b) absorção , maior, menor.
c) liberação, menor, menor.
d) absorção, menor, maior.
e) liberação, maior, menor.
Com base na tabela, a variação de entalpia, ΔH, em
kJ/mol, para essa reação é:
35. Considere as seguintes transformações:
a) –208
d) –572
I . Dióxido de carbono sólido (gelo seco) → dióxido de
carbono gasoso.
II . Ferro fundido → ferro sólido.
III . Água líquida → vapor d’água.
b) –644
e) –468
c) –228
39. Nos gráficos a seguir estão representadas cinco
transformações:
Dessas transformações, no sentido indicado e à
temperatura constante, apenas:
a) I é exotérmica.
b) II é exotérmica.
c) III é exotérmica.
d) I e II são exotérmicas.
e) II e III são exotérmicas.
36. (UFMG) Os seguintes valores de energia de
ligação são conhecidos,a 25°C.
Quais dessas transformações estão representadas
corretamente:
a) I, III e IV
b) II, III e V
d) II e IV
e) III e V
P á g i n a | 191
c) III e IV
40. Considere a reação de combustão das variedades
alotrópicas do carbono, representadas no gráfico:
I — As duas combustões do grafite e do diamante
são exotérmicas.
II — O ∆H de combustão do grafite é -394 kJ e o ∆H
de combustão do diamante é -395,9 kJ .
III — O processo que ocorre maior liberação de calor
é a queima do grafite.
IV — A transformação de grafite em diamante é um
processo endotérmico.
V - A transformação de diamante em grafite é um
processo endotérmico.
42. (UFPB) As reações químicas acontecem no nível
molecular. Por isso, modelos cinéticos são propostos
para que se possa entender, microscopicamente, o
que ocorre durante o curso de uma reação química.
Um desses modelos é chamado de Teoria do
Complexo Ativado, como pode ser observado na
figura abaixo.
Sobre a Teoria do Complexo Ativado, considere as
seguintes proposições, identificando as verdadeiras.
As afirmativas verdadeiras são:
a) I, II e IV
b) I, II e III
c) II, III e IV
d) I, II e V
e) I, III e IV
41. (UFPB) O etanol, um biocombustível, no Brasil,
obtido da cana-de-açúcar, tem a seguinte reação de
combustão:
C H OH(l) + 3O (g) → 2CO (g) + 3H O(g)
2
5
2
2
2
ΔH< 0
A respeito dessa reação, identifique as afirmativas
corretas:
I. A reação de combustão do etanol é endotérmica.
II. A variação de entalpia da reação não depende da
quantidade de reagente, pois é uma constante.
III. A energia interna total dos reagentes é menor do
que a energia interna total dos produtos.
IV. A quebra das ligações nos reagentes é um
processo endotérmico.
V. O diagrama de energia correspondente à reação é:
A
soma
dos
valores
proposições verdadeiras é igual a [
atribuídos
]
às
43. (UFPB) A Química Verde é uma iniciativa
internacional,
para
tornar
os
produtos
industrializados, os processos e as reações químicas
compatíveis com uma sociedade e um meio ambiente
sustentáveis. Nesse contexto, conhecer a cinética da
reação química, assim como os fatores que a
influenciam, é de fundamental importância. Com
respeito ao estudo da cinética de uma reação
química, é INCORRETO afirmar:
a) O aumento da temperatura de uma reação
provoca um aumento da freqüência de choques entre
as moléculas reagentes.
b) A velocidade de uma reação corresponde à razão
entre a mudança de concentração de reagentes ou
produtos e o tempo no qual ocorre essa mudança.
c) A velocidade de uma reação aumenta com o
aumento da temperatura.
d) A velocidade de uma reação aumenta, quando se
adiciona um catalisador a essa reação.
e) A adição de um catalisador a uma reação química
provoca um aumento na sua energia de ativação.
Cinética química
44. (UFPB – 2007) Em um experimento de cinética
química, foram realizados cinco ensaios para uma
P á g i n a | 192
reação hipotética do tipo A + 2B C, cujos
resultados são apresentados na tabela abaixo.
Ensaio
[A]inicial
(mol L–1)
[B]inicial
(mol L–1)
Vinicial
(mol L–1 s –1)
1
0,1
0,1
5,50 × 10 –6
2
0,2
0,1
2,20 × 10 –5
3
0,4
0,1
8,80 × 10 –5
4
0,1
0,3
1,65 × 10 –5
5
0,1
0,6
3,30 × 10 –5
Com base na tabela, é correto afirmar que a
equação correspondente à Lei de Velocidade para
essa reação é:
a) V
k
d) V k[ A ] 2 [ B ]
b) V k[ A ][ B ]
e) V k
4 - lasca de madeira queimando mais rapidamente
que uma tora de madeira.
COLUNA 2
A - superfície de contato
B - catalisador
C - concentração
D – temperatura
A alternativa que contem a associação correta entre
as 2 coluna é:
a) 1-C;2-D;3-B;4-A
b) 1-D;2-C;3-B; 4-A
c) 1-A;2-B;3-C;4-D
d) 1-B;2-C;3-D;4-A
e) 1-C;2-D;3-A;4-B
O texto, a seguir, serve de suporte para as questões
de 47 e 48.
c) V k[ A ][ B ] 2
[ A ]2
[ B]
Uma das grandes preocupações das indústrias de
refinamento de petróleo é obter combustíveis
automotivos com baixo teor de enxofre. Isso,
porque combustíveis com enxofre, ao serem
queimados, liberam SO na atmosfera, que pode ser
45. (UFPE) No início do século XX, a expectativa da
Primeira Guerra Mundial gerou uma grande
necessidade de compostos nitrogenados. Haber foi o
primeiro na produção de amônia, a partir do
nitrogênio do ar. Se a amônia for colocada num
recipiente fechado, sua decomposição ocorrerá de
acordo com a seguinte equação química nãobalanceada:
2
oxidado a SO , que se precipita como chuva ácida,
3
ao reagir com a umidade do ar. Essa oxidação
acontece mais facilmente na presença do poluente
NO , cujo mecanismo catalítico está descrito abaixo.
2
As variações das concentrações com o tempo estão
ilustradas na figura abaixo.
47. (UFPB) Considere o gráfico abaixo, que
representa o andamento da oxidação do SO , e as
2
informações nele contidas.
A partir da análise da figura cima, podemos afirmar
que as curvas A, B e C representam a variação
temporal
das
concentrações
dos
seguintes
componentes da reação, respectivamente:
a) H2, N2 e NH3.
b) NH3, H2 e N2.
c) NH3, N2 e H2.
d) N2, H2 e NH3.
e) H2, NH3 e N2.
46. (PUC – RS) Para responder à questão ,relacione
os fenômenos descritos na coluna 1 com os fatores
que
influenciam
a
velocidade
dos
mesmos,mencionados na coluna2.
COLUNA I
1 - Queimadas se alastrando rapidamente quando
esta ventando.
2 - Conservação dos alimentos no refrigerador.
3 - efervescência da água oxigenada na higiene de
ferimentos.
A partir dessas informações, identifique a(s)
afirmativa(s) verdadeira(s) com V e com F, a(s)
falsa(s).
(
) A energia de ativação da reação, na ausência
de NO , é indicada pela letra w.
(
(
2
) A letra v indica que a reação é exotérmica.
) A função do NO é aumentar a energia de
2
ativação da reação.
(
) A energia de ativação da reação, na presença
de NO , é indicada pela letra x.
2
(
) A energia de ativação da etapa II é indicada
pela letra z.
A seqüência correta é:
a) VFVVF
b) FFVFF
c) VFFFV
d) VVVVF
e) FFFVV
P á g i n a | 193
48. (UFPB) A reação global da oxidação do SO , na
2
condição de temperatura padrão, tem constante de
24
equilíbrio igual a 3,4×10 . Nesse contexto,
considerando um sistema formado por um balão de
1L, contendo 3 mols de cada um dos três gases
dessa reação global, pode-se afirmar:
I. O sistema estará em equilíbrio.
II. O sistema não estará em equilíbrio e reagirá para
formar produtos.
III. O sistema não estará em equilíbrio e reagirá para
formar reagentes.
Está(ão) correta(s):
a) Apenas II
b) Apenas I
c) Apenas III
d) Apenas II e III
e) I, II e III
O metanol é uma importante matéria-prima da
indústria. Além disso, é usado como combustível
puro ou misturado à gasolina em alguns países,
como a China e os Estados Unidos. Recentemente,
esse álcool vem sendo empregado em células de
combustível gerando energia para o funcionamento
de notebooks e celulares.
A síntese do metanol envolve o seguinte equilíbrio:
CO(g) + 2H (g)
49. (UFG-GO) Os seguintes gráficos representam
variáveis de uma reação química:
3
51. (UFPB) Em um reator de 5L, são colocados 10
mols de CO e 15mols de H . Quando a reação atinge
2
o equilíbrio, tem-se a formação de 5mols de metanol.
Considerando que o reator é um sistema fechado, as
concentrações de equilíbrio de CO e H (em mol/L)
b) 1 e 1
e) 2 e 3
2
a) não será alterada.
b) será duplicada.
c) será quadruplicada.
a) No instante t1, a velocidade da reação direta é
igual à da inversa.
b) Após t2, não ocorre reação.
c) No instante t1, a reação atingiu o equilíbrio.
d) A curva 4 corresponde à velocidade da reação
inversa.
e) No ponto de intersecção das curvas 3 e 4, a
concentração de produtos é igual à de reagentes.
c) 2 e 1
52. (UFPB) Considere que a reação de produção do
metanol é uma reação elementar que ocorre a certa
velocidade nas CNTP. Se, nessas condições, apenas a
concentração de H for duplicada, a velocidade dessa
reação
Os gráficos indicam:
2
são respectivamente:
a) 1 e 2
d) 5 e 5
Equilíbrio químico
CH OH(g) ΔH<0
2
d) será reduzida à metade
e) será triplicada.
53. (UFPB) Um estudante de Química, por meio de
titulação ácido-base, determinou as concentrações de
20mL de solução aquosa de um monoácido e de
20mL de solução aquosa de uma monobase, e
montou os seguintes gráficos:
50. (PUC-SP) Em determinadas condições de
temperatura e pressão, existe 0,5 mol / L de N2O4
em equilíbrio com
2,0 mols/ L de NO2, segundo a reação
Então, a constante de equilíbrio, Kc, deste equilíbrio,
nas condições da experiência,numericamente igual a:
a) 0,125.
d) 4.
b) 0,25.
e) 8.
c) 1.
O texto a seguir serve de suporte às questões 51 e
52.
Com base nesses gráficos, é correto afirmar:
a) O gráfico II corresponde à titulação de uma
solução de um ácido fraco por uma base forte.
b) O gráfico II corresponde à titulação de uma
solução 0,1 mol/L do ácido por uma solução 0,2
mol/L da base.
c) O ponto destacado pela letra X, no gráfico I, indica
que houve neutralização completa dos íons hidrônios
pelos íons hidroxilas.
d) O gráfico I corresponde à titulação de uma solução
0,1 mol/L da base por uma solução 0,2 mol/L do
ácido.
e) O ponto destacado pela letra Y no gráfico II, cujo
pH é igual a 6,04, corresponde a uma solução
tampão.
P á g i n a | 194
54.
(UFPB) Quando 25mL de uma solução
desconhecida foram titulados, obteve-se o gráfico
ao lado, onde o pH do ponto de equivalência da
curva de titulação é 5,28.
equilíbrio acima, pode ser obtido
a) com a diminuição da quantidade de CHCl3.
b) com o aumento da pressão total, a temperatura
constante.
c) com a diminuição da quantidade de Cl2.
d) com o decréscimo da pressão total, a temperatura
constante.
e) com a diminuição da quantidade de HCl.
57.
(UFPB)
O
estudo
da
síntese
da
amônia,
, bem como o
seu controle, é de fundamental importância, tendo
em vista a crescente demanda de fertilizantes à base
de nitrogênio, um nutriente essencial ao crescimento
dos vegetais.
Com respeito à síntese da amônia, é correto afirmar:
Com base nesse gráfico, considere as
seguintes proposições.
I.
A titulação feita envolveu uma base forte e
um ácido forte.
II.
Um indicador apropriado para essa titulação
seria o vermelho de metila, que muda de cor
(vermelho para amarelo), na faixa de pH entre 4,8 e
6,0.
III.
A substância titulada é uma base fraca, e a
titulante é um ácido forte.
IV.
As primeiras gotas do titulante, ao serem
adicionadas, provocam a formação de uma solução
tampão.
Está(ão) correta(s):
a) apenas I, II e III
c) apenas II, III e IV
e) I, II, III e IV
a) O aumento da pressão total aumenta a produção
de nitrogênio.
b) A diminuição da pressão total aumenta a produção
de amônia.
c) O aumento da pressão total desloca o equilíbrio
para a direita.
d) O aumento da pressão total desloca o equilíbrio
para o lado de maior volume.
e) A pressão não exerce nenhuma influência sobre o
equilíbrio da reação.
f) A diminuição da pressão total desloca o equilíbrio
para o lado da menor quantidade de mols.
58. (PUC-RS) Dada a expressão da constante de
equilíbrio em termos de concentração de produtos e
reagentes.
b) apenas I , II e IV
d) apenas I, III e IV
55. (UFPB) A qualidade das águas existentes nos
mananciais é associada aos diferentes tipos de
materiais (sais, ácidos, bases, óxidos), presentes no
ambiente onde elas se encontram. A dissolução
desses materiais acarreta alterações em suas
propriedades físico-químicas, a exemplo da acidez e
da basicidade. Nesse sentido, considerando a solução
aquosa de um ácido e a de uma base, face à adição
do respectivo sal solúvel, é correto afirmar:
a) O pH diminui quando acetato de sódio é
adicionado à solução de ácido acético.
b) O pH se mantém inalterado, quando acetato de
sódio é adicionado à solução de ácido acético.
c) A adição de acetato de sódio à solução de ácido
acético desloca o equilíbrio para a esquerda.
d) O pH aumenta, quando cloreto de amônio é
adicionado à solução de amônia.
e) O pH se mantém inalterado, quando cloreto de
amônio é adicionado à solução de amônia.
f) A adição de cloreto de amônio à solução de amônia
desloca o equilíbrio para a direita.
56. (MARK-SP)
O aumento da produção de CCl4, no sistema em
59. Dentro de um recipiente contendo inicialmente
apenas NO2, ocorre o seguinte processo, a
temperatura constante:
P á g i n a | 195
61. Com base no gráfico a seguir, calcule o valor de
Kc para a reação
marque a alternativa
correspondente:
a) 81,0.
b) 20,25.
c) 2,25.
d) 9,0.
e) 4,0.
(
)
(
)
(
)
(
)
(
)
A curva “A” corresponde à variação da
concentração molar do NO(g).
O equilíbrio químico tem início a partir de 12
minutos do início da reação.
Decorridos 12 minutos do início da reação, as
concentrações molares dos participantes da
reação terão concentrações molares iguais.
As curvas “A” e “B” correspondem aos
reagentes da reação.
A variação da concentração molar do NO2(g) é
representada pela curva “C”.
60. (UFSCAR-SP) Um dos produtos envolvidos no
fenômeno da precipitação ácida, gerado pela queima
de
combustíveis fósseis, envolve o SO2 gasoso.Ele reage
com o O2 do ar, numa reação no estado gasoso
catalisada por monóxido de nitrogênio, NO. No
processo, é gerado SO3, segundo a reação global
representada pela equação química balanceada
62. (Uespi-PI) Se 1 mol de H2 e 1 mol de I2 em um
recipiente de 1 L atingirem a condição de equilíbrio a
500°C, a concentração de HI no equilíbrio será:
Dado: Kc = 64.
a) 1,60.
b) 1,80.
c) 3,60.
d) 2,54.
e) 0,80.
63. (UFRN) Observe o gráfico a seguir, relativo ao
estabelecimento do equilíbrio de uma reação, a 298K,
do tipo:
No gráfico a seguir estão representadas as variações
das concentrações dos componentes da reação em
função do tempo de reação, quando a mesma é
estudada em condições de laboratório, em recipiente
fechado contendo inicialmente uma mistura de SO2,
O2 e NO gasosos.
O valor da constante de equilíbrio (Kc) para essa
reação, a 298K, é:
a) 3
b) 6
c) 12
d) 24
e) 108
As curvas que representam as concentrações de SO2,
SO3, O2 e NO são, respectivamente:
a) I, II, III, IV.
b) II, I, III, IV.
c) III, I, II, IV.
d) III, II, I, IV.
e) IV, III, II, I.
64. (ITA) Numa solução aquosa 0,100 mol/L de um
ácido monocarboxílico, a 25 ºC, o ácido está 3,7%
dissociado após o equilíbrio ter sido atingido. Indique
a opção que contém o valor correto da constante de
dissociação desse ácido nesta temperatura.
a) 1,4
d) 3,7 · 10–2
b) 1,4 · 10–3
e) 3,7 · 10–4
c) 1,4 · 10–4
P á g i n a | 196
65. (UFMG) O hidróxido de amônio, NH4OH(aq), em
solução 10 –2 mol/L, apresenta grau de dissociação
1% à temperatura ambiente. Sua constante de
dissociação
valerá,
aproximadamente,
nessa
temperatura:
a) 10 –6.
d) 10 3.
b) 10 –3.
e) 10 6.
c) 10
–2
.
66. (Fuvest-SP)
d) A urina é neutra.
e) A solução de bicarbonato de sódio é mais ácida
que o suco gástrico.
72. A bile, segregada pelo fígado, é um líquido
amargo, esverdeado e muito importante na digestão.
Sabendo que a concentração de H+ na bile é de 1,0 x
10– 8 mol/L, pode-se afirmar que o pH e o caráter da
bile, são respectivamente:
a) 8 e básica.
b) 8 e ácida.
Dada amostra de vinagre foi diluída com água até se
obter uma solução com [H+] = 10–3 M. Nessa
solução, as concentrações, em mol/L, de CH3COO– e
de CH3COOH são, respectivamente, da ordem de:
a) 3 · 10–1 e 5 · 10–10.
b) 3 · 10–1 e 5 · 10–2.
c) 1 · 10–3 e 2 · 10–5.
d) 1 · 10–3 e 5 · 10–12.
e) 1 · 10–3 e 5 · 10–2.
69. (Cefet-PR) A constante de ionização do ácido
acético, a 25 ºC, numa solução 2 · 10–2 molar,
sabendo que nessas condições o seu grau de
ionização é 30%, é:
a) 2,5 · 10–3.
d) 3,2 · 10–4.
b) 3,7 · 10–2.
e) 3,1 · 10–1.
c) 1,4 · 10–3.
70. O ácido acetilsalicílico (AAS), mais conhecido
como aspirina, é um ácido orgânico fraco, cuja
fórmula será representada por HAsp. Uma solução
aquosa é preparada dissolvendo-se 0,1 mol de HAsp
por litro. A concentração de H+ nessa solução é 0,004
M. Calcule o Ka da aspirina.
71. (Mack-SP) Consultando a tabela abaixo, verificase que:
a) A urina é mais ácida que o suco gástrico.
b) A concentração hidroxiliônica é igual a 10 – 6 mol/L
na solução de bicarbonato de sódio.
c) O preparado usado na tintura de cabelos é neutro.
c) 8 e neutra.
d) 6 e ácida.
e) 6 e básica.
76. Um refrigerante é uma solução saturada de CO2
e apresenta uma concentração de íons OH – igual a
10– 10 íons - grama por litro a 25°C. O pH e o caráter
da solução são, respectivamente:
a) 10 e básico.
b) 10 e ácido.
c) 4 e básico.
d) 4 e ácido.
e) 7 e neutro.
77. O pH do suco gástrico, a 25°C, tem valor médio
igual a 2. Logo, o pOH e a concentração do íons H+
em mol/L, nesse suco são, respectivamente:
a) 2 e 10– 2.
b) 12 e 10– 2.
c) 2 e 10–12.
d) 12 e 102.
e) 12 e 1012.
78. O vinagre pode ser considerado uma solução de
concentração 0,72 mol/L em relação ao ácido acético.
Esse ácido é fraco e possui constante de ionização
(Ka) igual a 1,8 x 10 –5, a 25°C. Nessa temperatura,
o grau de ionização do ácido acético é igual a:
a) 0,5 %.
b) 0,05 %.
c) 0,005 %.
d) 5,0 %.
e) 0,0005 %.
P á g i n a | 197