INSTITUTO DE QUÍMICA – UFG 1
Físico-Química Experimental
Concentraçao Micelar Crítica (CMC)
Introdução
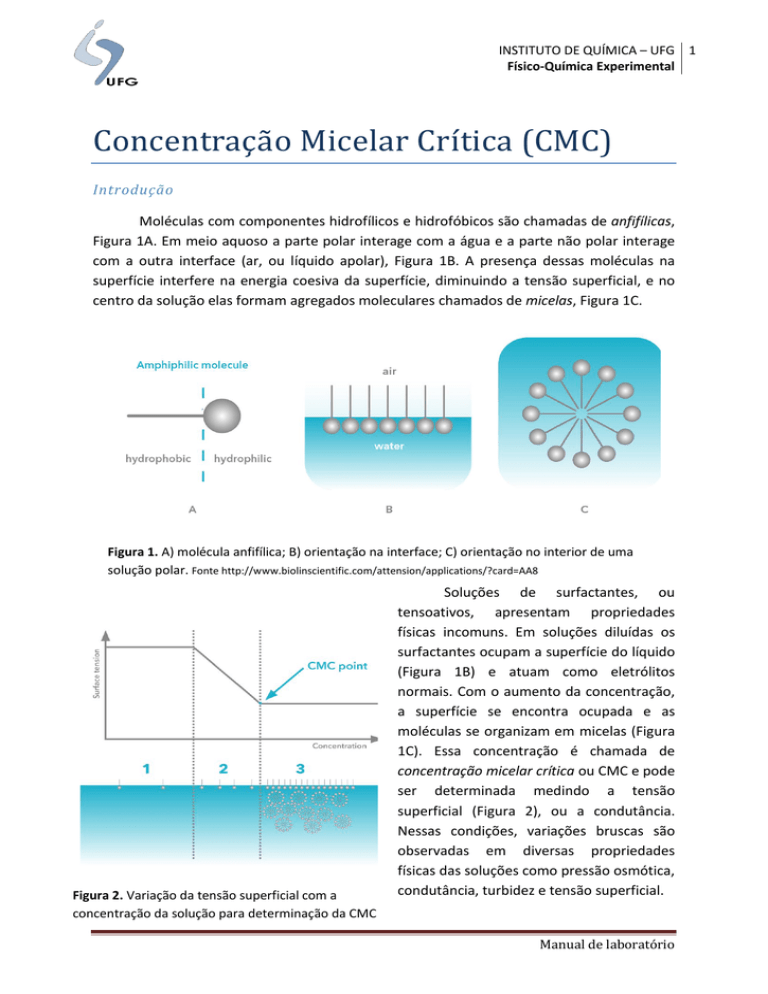
Moléculas com componentes hidrofílicos e hidrofóbicos são chamadas de anfifílicas,
Figura 1A. Em meio aquoso a parte polar interage com a água e a parte não polar interage
com a outra interface (ar, ou líquido apolar), Figura 1B. A presença dessas moléculas na
superfície interfere na energia coesiva da superfície, diminuindo a tensão superficial, e no
centro da solução elas formam agregados moleculares chamados de micelas, Figura 1C.
Figura 1. A) molécula anfifílica; B) orientação na interface; C) orientação no interior de uma
solução polar. Fonte http://www.biolinscientific.com/attension/applications/?card=AA8
Figura 2. Variação da tensão superficial com a
concentração da solução para determinação da CMC
Soluções de surfactantes, ou
tensoativos, apresentam propriedades
físicas incomuns. Em soluções diluídas os
surfactantes ocupam a superfície do líquido
(Figura 1B) e atuam como eletrólitos
normais. Com o aumento da concentração,
a superfície se encontra ocupada e as
moléculas se organizam em micelas (Figura
1C). Essa concentração é chamada de
concentração micelar crítica ou CMC e pode
ser determinada medindo a tensão
superficial (Figura 2), ou a condutância.
Nessas condições, variações bruscas são
observadas em diversas propriedades
físicas das soluções como pressão osmótica,
condutância, turbidez e tensão superficial.
Manual de laboratório
INSTITUTO DE QUÍMICA – UFG 2
Físico-Química Experimental
Determinar a CMC é de fundamental importância nos processos envolvendo
tensoativos, pois o efeito desses compostos é maior quando uma quantidade significante de
micelas encontra-se presente. A formação de micelas diminui a condutância molar de
soluções de substâncias tensoativas.
Objetivos
Determinar a CMC de um surfactante.
Procedimento Experimental
Adicione 160,0 mL de água destilada em um béquer apropriado e meça a
condutância da água pura;
Adicione alíquotas de 2 mL de solução 0,08 mol L-1 de Lauril Sulfato de Sódio à água,
e meça a condutância. Faça, no mínimo, 20 medidas de condutância.
Resultados a Apresentar
Gráfico: Condutância Molar versus Concentração de Lauril Sulfato de Sódio;
Valor da CMC;
Manual de laboratório