Infectologia
Manifestações Orais em Pacientes
Portadores da Síndrome da
Imunodeficiência Adquirida
(Sida/Aids): Uma Revisão Atualizada
Dra. Laura Ferreira Pinheiro Nicolielo1 • Dr. José Endrigo Tinôco-Araújo2 • Prof. Dr. Luiz Eduardo
Montenegro Chinellato3 • Prof. Dr. Paulo Sérgio da Silva Santos4
Divulgação
A
Prof. Dr. Paulo Santos (à esq.),
Dra. Laura Nicolielo e Dr. José
Tinôco-Araújo.
infecção pelo vírus
da imunodeficiência
humana (HIV) pode
levar ao desenvolvimento da
Síndrome da Imunodeficiência
Adquirida (Sida/Aids), caracterizada pelo comprometimento
do sistema imunológico e
aumento da suscetibilidade a
infecções oportunistas.(1,2) A
falência da barreira mucosa
imune funcional propicia a
ocorrência de infecções secundárias e ocorre
pela depleção ou bloqueio funcional dos linfócitos
TCD4+ das mucosas, alteração na secreção de
citocinas, alteração de fluxo salivar e das concentrações de IgA, lisozima e lactoferrina.(3-5)
Lesões orais são comuns em pacientes
HIV+. Estima-se que mais de 90% dos pacientes
portadores da Sida/Aids apresentam uma ou
mais manifestações orais durante o curso da
doença,(6) podendo indicar alteração no estado
de saúde geral do paciente.(7) Em alguns casos,
as lesões orais podem ser os primeiros sinais
1 - Cirurgiã-Dentista, Mestranda do Departamento de Estomatologia da Faculdade de
Odontologia de Bauru, Universidade de São Paulo. CRO 99.251.
2- Cirurgião-Dentista, Mestrando do Departamento de Estomatologia da Faculdade de
Odontologia de Bauru, Universidade de São Paulo. CRO 97.028.
3 -Professor Titular do Departamento de Estomatologia da Faculdade de Odontologia de Bauru,
Universidade de São Paulo. CRO 16.256.
4 -Professor Doutor do Departamento de Estomatologia da Faculdade de Odontologia de Bauru,
Universidade de São Paulo. Coordenador do Depto. de Odontologia da ABRALE. CRO 51.737.
24 Prática Hospitalar • Ano XV • Nº 85 • Jan-Fev/2013
da infecção, o que pode contribuir para o diagnóstico do HIV+.
Desde o início da epidemia do HIV, a boca
tem tido um importante papel na monitoração da
progressão da doença, através do aparecimento
de lesões específicas – candidíase oral (CO) e
leucoplasia pilosa (LP) – as quais possuem correlação com a baixa contagem de linfócitos TCD4+
e alta carga viral no plasma sanguíneo.(8-10)
A importância do cirurgião-dentista no diagnóstico de manifestações orais de pacientes
HIV+ e os protocolos de atendimento destes
pacientes são muito discutidos na literatura,
mas a repercussão destas informações ainda é
deficiente na formação da equipe multidisciplinar
de saúde.
Esta revisão de literatura tem como objetivo
caracterizar as principais infecções orais que
acometem o paciente HIV+, analisando os
aspectos inerentes ao diagnóstico, tratamento
e a importância que estas lesões têm com
relação à progressão da Sida/Aids no paciente
soropositivo.
Candidíase oral (CO)
A ocorrência de candidíase oral (CO) varia
de 6 a 45%,(11) sendo a doença fúngica oral
mais comum em pacientes HIV+.(12) É uma micose superficial produzida por cepas do gênero
Candida, sendo a espécie Candida albicans a
mais frequentemente associada às lesões,
porém já tendo sido relatadas espécies
não albicans (C. tropicalis, C. glabrata e C.
krusei) associadas, implicando na escolha
do tratamento.(12-15)
Das micoses que acometem a boca, a
candidíase é a de maior valor diagnóstico,
podendo ser a primeira manifestação da
Sida/Aids, especialmente quando a forma agressiva e/ou crônica da candidíase
manifesta-se em indivíduos jovens e/ou
sem indícios de um quadro clínico que
justifique seu surgimento.(16) O aumento
de sua prevalência relaciona-se com a
queda na contagem de linfócitos TCD4+,
usualmente uma contagem menor que
300/μl, e por isso está hoje incluída na
maioria dos sistemas de estadiamento da
infecção pelo HIV.(17)
Os achados clínicos incluem dor e,
ocasionalmente, úlceras ou faringite. As
candidíases orofaríngea e laríngea normalmente ocorrem em conjunto com a candidíase oral (fig. 1), e os pacientes relatam
dor, sensação de queimação, disfagia e
odinofagia.(18,19)
Outros fatores que favorecem seu desenvolvimento são tabagismo, xerostomia
e precária higiene oral.(18) Em pacientes
HIV+ podem apresentar-se nas formas
eritematosa, pseudomembranosa e de
queilite angular. Além disso, diferentes
apresentações da lesão podem coexistir
num mesmo paciente.(20)
Desde a introdução dos antirretrovirais,
especialmente a terapia antirretroviral
altamente ativa (TARAA), a prevalência
de candidíase oral em pacientes HIV+
diminuiu drasticamente. Dois mecanismos
potenciais contribuem para este achado: a
reconstituição imunológica e o efeito antifúngico. A TARAA resulta em um aumento
nos níveis de linfócitos T CD4+, resgatando
o sistema imunológico, e os inibidores de
protease presentes no coquetel de drogas
poderiam interferir com proteinases aspárticas, principais proteases secretadas por
C. albicans, impedindo sua proliferação e
patogenicidade.(21)
Figura 1. Candidíase eritematosa.
Apresenta intensa atrofia papilar central.
Leucoplasia pilosa (LP)
A leucoplasia pilosa (LP) é uma infecção oportunista invariavelmente relacionada ao vírus Epstein-Barr (EBV), da família
herpes-vírus.(22) É mais comum em homens
do que em mulheres e caracteriza-se por
lesões de tamanhos variáveis, que podem
aparecer como estrias brancas verticais,
ondulações ou como placas planas ou
elevadas, não destacáveis, com prolongamentos de superfície ou projeções semelhantes a pelos, daí sua denominação.
Na maioria dos casos, a LP é bilateral e
assintomática. É mais comum nas bordas e/ou face inferior da língua, com uma
superfície corrugada. Em pacientes HIV+
pode localizar-se em outras áreas da
boca, como mucosa jugal e face superior
da língua.(19,23)
O surgimento desta lesão tem sido
relacionado à replicação viral do EBV nos
queratinócitos.(1,23) A presença de gosto metálico desagradável na boca, e a sensação
de queimação da língua pode estar associada à presença de candidíase oral.(19,23)
A ocorrência é de 50% em indivíduos
não tratados pela TAR, particularmente
naqueles em que a contagem de linfócitos T CD4+ está menos de 0,3 x 109/L.
A LP tem valor prognóstico claro para o
desenvolvimento posterior da Sida/Aids,
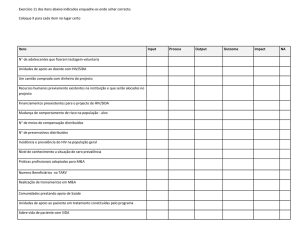
Tipo clínico
Apresentação e sintomas
Localizações comuns
Tratamento das formas
leves e moderadas*
Tratamento das formas
graves*
Eritematosa ou atrófica
Manchas vermelhas, podendo se observar
pontos brancos ou placas, sensação de
queimação
Palato duro e/ou mole e
dorso da língua
Aplicação tópica de agentes
antifúngicos, como nistatina,
miconazol, cetoconazol e
clotrimazol
O tratamento da forma grave
deve ser feito com anfotericina
B tópica e/ou fluconazol
sistêmico
Pseudomembranosa
Placas brancas ou “amarelo-esbranquiçadas” Mucosa jugal, palato,
que podem ser raspadas, deixando sob si um orofaringe e borda da
leito eritematoso possivelmente sangrante e
língua
ocasionalmente dolorido
Idem
Idem
Queilite angular
Eritema ou fissuras, pode levar à formação de Comissura labial
ulcerações e sangramento.
Está frequentemente associada às outras
formas
Cremes de clotrimazol 1%,
miconazol ou cetoconazol a
2%, e pomada de nistatina
Idem
*Devem durar pelo menos duas semanas para reduzir as unidades formadoras de colônias a níveis baixos suficientes para prevenir a recorrência.
Prática Hospitalar • Ano XV • Nº 85 • Jan-Fev/2013 25
com 10% dos indivíduos apresentando
Sida/Aids no momento do diagnóstico e
20% podendo desenvolver nos oito meses
seguintes.(10,24,25)
O diagnóstico diferencial inclui candidíase, líquen plano, leucoplasia associada
ao uso de tabaco, neoplasia intraepitelial
induzida por vírus do papiloma humano e
carcinoma espinocelular. Na maioria dos
casos a LP pode ser diagnosticada clinicamente e não requer biópsia para confirmação. Não requer tratamento específico
e muitas vezes a TAR é eficaz se a lesão
estiver associada à infecção pelo HIV.(26)
As características histológicas revelam hiperplasia epitelial típica sugestiva
de infecção por EBV. Para o diagnóstico
definitivo, é preciso que se demonstre
a presença do vírus na lesão, que pode
ser determinada através de citologia esfoliativa e microscopia eletrônica, além de
hibridização in situ, imuno-histoquímica
e técnicas de PCR. Caso isto não seja
possível, a ausência de resposta ao tratamento antiviral ou a comprovação de
um estado de imunodeficiência proverão
maior peso aos dados obtidos no diagnóstico presuntivo.(12,20,27,28)
A regressão espontânea é comum e
frequentemente ocorre quando o estado
geral da doença no paciente se encontra
em remissão. Afirma-se na literatura que a
observação seria a melhor conduta, visto
que a remoção cirúrgica e tratamento antiviral não erradicam permanentemente a
lesão, que tende a recidivar na maioria dos
casos.(1,19) No entanto, o uso de aciclovir,
resina de podofilina, retinoides e remoção
cirúrgica também têm sido relatados como
tratamentos bem-sucedidos.(14)
expressão de genes celulares associados
com a regulação do ciclo celular, apoptose,
resposta inflamatória e angiogênese. Se
estas várias populações reativas de células
monoclonais são benignas, sua transformação maligna, sob certas circunstâncias,
continua sem esclarecimento.(29)
Clinicamente, o SK é caracterizado
pela presença de lesões mucocutâneas
(sarcomas) vermelho-violetas, frequentemente localizadas na pele, mas também
em mucosas, sistema linfático e outros
órgãos, principalmente pulmões, fígado,
intestino e estômago. Sua transmissão
ocorre principalmente por via sexual, mas
também se dá através do contato com
sangue e saliva. Ocorre em 20% dos indivíduos afetados pela doença, com cerca de
3.970 casos associados com Sida/Aids registrados pela CDC até o final de 1986.(7) O
risco de contrair SK em pacientes com HIV
é de 5 a 10 vezes maior em homossexuais
masculinos do que em outros grupos com
HIV. Antes do advento da TAR, o SK era a
doença mais prevalente associada a Sida/
Aids. A redução na incidência de SK tem
sido atribuída aos inibidores da protease.
O SK apresenta envolvimento localizado, regional ou generalizado. Sua
manifestação oral frequentemente envolve
palato, gengiva e língua (fig. 2). A biópsia
é necessária para o diagnóstico definitivo,
embora um diagnóstico presuntivo seja, às
vezes, feito com base na história médica
e apresentação clínica. O diagnóstico
clínico está associado às características
histopatológicas através de três estágios:
macular, placa e nodular.(30)
Sarcoma de Kaposi (SK)
É uma doença angioproliferativa
indicativa de Sida/Aids que pode surgir
a partir de uma célula mesenquimal
progenitora infectada pelo vírus herpes
humano-8 (HHV-8). O HHV-8 induz vias de
sinalização intracelulares que modulam a
Figura 2. Sarcoma de Kaposi em palato
duro, palato mole e gengivas.
26 Prática Hospitalar • Ano XV • Nº 85 • Jan-Fev/2013
O tratamento está relacionado com
a distribuição das lesões. Se elas estão
limitados à boca, a terapia local ou regional
pode ser considerada. Se estas lesões
são generalizadas, quimioterapia pode ser
usada. O início das lesões na boca pode
ser a primeira manifestação clínica da Sida/
Aids, indicando o início imediato de TAR
nesses pacientes. No entanto, apesar do
efeito terapêutico da TAR no SK, a doença
continua a progredir em alguns pacientes
e o tratamento específico do tumor com
antraciclinas lipossomais (daunorrubicina e
doxorrubicina) é necessário. A associação
de TAR com paclitaxel (Taxol ®, Bristol-Myers Squibb Company, Nova York, EUA)
é uma terceira opção terapêutica quando
a doença progride, apesar do tratamento
com TAR, e envolve outros órgãos. (31)
Uma série de drogas com altos efeitos
antiangiogênicos que estão emergindo
podem ser relevantes a curto prazo, tais
como talidomida e metaloproteinases de
matriz. Outras drogas em estudo incluem
retinoides, cidofovir e IM-862 (dipeptídeo
de L-glutamina l-triptofano com atividade
angiogênica).(31) Desde a introdução das
terapias acima comentadas, a proporção
de pacientes com SK na mucosa oral caiu
cerca de um terço para menos de 20% em
países desenvolvidos.(31,32)
Papiloma
O vírus do papiloma humano (HPV)
causa hiperplasia no tecido epitelial focal
e conjuntivo, formando uma verruga oral.
Em pacientes infectados pelo HIV, lesões
orais relacionadas com HPV têm aparência
papilomatosa, pedunculada ou séssil, e
estão localizadas principalmente no palato,
mucosa jugal e comissura labial.
A imuno-histoquímica ou a hibridização
in situ do DNA são usadas para confirmar a
presença e o tipo do HPV nos espécimes
histopatológicos. Os genótipos mais comuns encontrados na boca de pacientes
com infecção por HIV são 2, 6, 11, 13, 16 e
32. Histologicamente, as lesões podem ser
Infectologia
sésseis ou papilares e recobertas por um
epitélio escamoso estratificado acantótico
ou mesmo hiperplásico. O epitélio afetado
frequentemente mostra vacuolização de
várias células epiteliais (coilocitose) e pode,
ocasionalmente, exibir uma leve variação
no tamanho do núcleo. Alterações microscópicas de aparência displásica foram
relatadas em pacientes com HIV/Sida/
Aids, devendo ser feito acompanhamento
para que não se desenvolva carcinoma
espinocelular.(30,33)
A remoção cirúrgica, com ou sem
irrigação intraoperatória com resina podofilina, é o tratamento de escolha.(14) Entretanto, as recidivas são comuns. Outras
opções de tratamento são: imiquimode,
interferon, criocirurgia, ablação com laser
e eletrocoagulação.(30)
Amornthatree et al. relatam que a
prevalência da infecção do HPV-16 é aumentada pela infecção do HIV. A TAR não
afeta o vírus, podendo ocorrer verrugas e
papilomas durante a TAR.(34)
Linfoma não-Hodgkin (LNH)
É o linfoma mais comum associado à
infecção pelo HIV e é geralmente visto nos
estágios finais, quando a contagem de linfócitos T CD4+ é menor que 100/mm3. Na
boca tem incidência de 3% em pacientes
com Sida/Aids.(35) Os linfomas relacionados
à Sida/Aids podem ser divididos em três
grupos de acordo com sua localização
em sistêmicos (80% dos linfomas relacionados a Sida/Aids, primários do sistema
nervoso central (ponto extranodal mais
afetado) e os raros linfomas de cavidades
corporais. (36) O linfoma plasmablástico é um
tipo de linfoma de células B e ocorre na
cavidade bucal de pacientes HIV positivos,
representa 2% dos LNH entre os portadores do HIV.(37) A característica clínica
tem aparência de massa de crescimento
rápido (menos comum que uma úlcera ou
placa) mais comum no palato ou gengiva.
O linfoma plasmablástico apresenta as
mesmas características de progressão
rápida do linfoma de células B, porém devido a seu grau de diferenciação citológica
para uma célula precursora do plasmócito,
este linfoma tende a ser classificado como
entidade distinta.(37) O prognóstico é pobre,
com tempo médio de sobrevida de menos
de 1 ano, apesar do tratamento com quimioterapia. Pacientes com Sida/Aids têm
altos níveis de várias citocinas, inclusive
IL-6, que são fatores de crescimento para
células B. Além disso, o EBV e outros vírus
e micróbios podem iniciar a proliferação de
células B policlonais.
A imunodeficiência aumenta o risco
de alguns tipos de câncer, especialmente
malignos, que estão etiologicamente
relacionados com agentes virais. (13,14)
Suspeita-se que o EBV tem importante
papel na causa primária do linfoma não-Hodgkin (LNH) e linfoma Hodgkin em
pacientes infectados por HIV, porque a
maioria desses tumores contém DNA do
EBV e genes virais expressivos.(13-16) EBV
é também considerado um cofator no desenvolvimento de LNH sistêmico durante
infecção por HIV. O desenvolvimento de
linfomas em indivíduos infectados por
HIV é um processo complexo de várias
etapas, não exclusivamente determinado
pela presença de EBV.(13,14,34,38). O linfoma
de Burkitt associado à imunodeficiência
representa de 30% a 40% dos LNH em
pacientes HIV positivos, podendo ser uma
manifestação da Sida/Aids. Manifestações
bucais incluem dor de dente atípica e intensa, mobilidade dentária, expansão óssea,
massas de tecidos mole ou neuropatia
craniofacial inexplicável.(37)
Figura 3. Gengivite linear eritematosa.
Gengivite linear eritematosa
Esta manifestação se caracteriza por
uma faixa extensa de eritema na região
marginal das gengivas, muitas vezes
apresentando petéquias (fig. 3). É uma
alteração oral tipicamente assintomática
ou apenas com leve sangramento gengival
e dor discreta. Em paciente HIV+ está comumente associada a elevada carga viral e
a baixa contagem de linfócitos T CD4+.(39)
Histologicamente não apresenta resposta inflamatória significativa, sugerindo
que as lesões representem uma resposta
inflamatória incompleta, principalmente com
a presença apenas de eritema. Resultados
microbiológicos mostraram semelhança da
gengivite com a periodontite convencional,
porém é diferente da gengivite convencional.(40) Segundo Portela et al., esta condição
gengival pode estar associada à infecção
fúngica por Candida spp.(41)
O tratamento é feito com bochechos
de solução à base de gluconato de clorexidina 0,12% ou antifúngicos tópicos, os
quais muitas vezes reduzem ou eliminam
o eritema, além de poderem ser utilizados
para prevenir recidivas.(42)
Doença periodontal
Pacientes HIV+ estão sob risco de
doenças periodontais caracterizadas por
dor, inflamação extensa e rápida destruição
de tecido, que podem predispor ao surgimento de lesões necróticas que devastam
a gengiva e o tecido ósseo subjacente(43)
(fig. 4). As doenças periodontais podem
Figura 4. Periodontite ulcerativa
necrosante.
Prática Hospitalar • Ano XV • Nº 85 • Jan-Fev/2013 27
estar exacerbadas devido ao quadro de
imunossupressão,(20) visto que o desenvolvimento de necroses depende de interação
entre a microbiota oral e o sistema imune
do paciente.(10) As necroses periodontais
são altamente preditivas do diagnóstico de
Sida/Aids, se apresentando como indicador
primário de deterioração da imunidade em
diversos casos e, também, de progressão
rápida da infecção por HIV.(9)
Estudos microbiológicos não encontraram micro-organismos específicos que
se relacionam com problemas periodontais
em pacientes HIV+, o que suscita o questionamento da influência que a resposta do
hospedeiro tem neste colapso do tecido
periodontal independente da quantidade
de placa bacteriana dentária presente.
A microbiota periodontal encontrada é a
mesma, ou muito próxima, daquela presente em indivíduos não infectados que
apresentam o quadro clássico de periodontite, exceto pelo número aumentado
de Candida spp.(44-46)
A doença periodontal no paciente aidético pode-se manifestar como gengivite
ulcerativa necrosante (GUN), principalmente
em crianças desnutridas e imunossuprimidas. Os sintomas clássicos são halitose,
sangramento à escovação, necrose das
margens gengivais e papilas, conferindo
aspecto de ulcerações acinzentadas com
os tecidos gengivais adjacentes avermelhados, edematosos e exsudativos, sem
que, no entanto, haja perda de inserção
periodontal.(30,47) A periodontite ulcerativa
necrosante (PUN) caracteriza-se por ulcerações localizadas, eritema, muitas vezes
associado à hemorragia espontânea e
necrose de tecido gengival, com exposição e destruição do tecido ósseo alveolar
subjacente que se estendem além da linha
mucogengival, resultando em perda de toda
a inserção dentária.(9,10,20,30,43) É uma lesão
muito dolorosa e pode afetar negativamente
a ingestão de alimentos, resultando em
significativa e rápida perda de peso. A progressão apical rápida desta necrose pode
expor cristas ósseas e levar à ocorrência
de sequestros ósseos.(20,43) Dor profunda
acompanha o quadro e não responde ao
tratamento periodontal convencional e
higiene oral rigorosa.(30,43)
O tratamento da GUN e PUN consiste
em bochecho duas vezes ao dia com solução de gluconato de clorexidina 0,12%,
metronidazol sistêmico, desbridamento
periodontal, que é realizado após o início
da terapia antibiótica, acompanhamento
odontológico frequente e orientações de
higiene oral rigorosa.(14)
Lesões ulceradas
As manifestações orais da Sida/Aids
surgem, muitas vezes, sob a forma de
úlceras e, clinicamente, pode haver problemas na identificação de sua etiologia devido às inúmeras possibilidades de causas e
agentes etiológicos.(48-52) Alguns exemplos
destas manifestações orais são as neoplasias com áreas extensas de destruição e
necrose, reações locais a terapias medicamentosas, como durante quimioterapias,
e infecções oportunistas provocadas por
fungos, bactérias e vírus.(52)
Com relação às úlceras causadas por
vírus, encontram-se entre os possíveis
agentes de maior importância o herpesvírus tipos 1 (HSV-1) e 2 (HSV-2), citomegalovírus (CMV), vírus varicela-zóster (VZV),
e até mesmo associação de mais de um
vírus numa única lesão.(30,33,50) A permanência do quadro por mais de quatro semanas
aponta para uma possível infecção oportunista e, no paciente HIV+, pode ocorrer
com frequência, duração e agressividade
aumentadas. (1,52) As ulcerações orais
geralmente são acompanhadas de febre,
mal-estar e linfadenopatia cervical.
As infecções recorrentes pelo HSV em
pacientes HIV+ são amplamente disseminadas e podem persistir por meses. Herpes
intraorais recorrentes caracterizam-se por
aglomerados de pequenas vesículas que se
rompem e produzem dolorosas úlceras que
se coalescem.(30,53) As lesões geralmente
ocorrem na mucosa ceratinizada, como o
28 Prática Hospitalar • Ano XV • Nº 85 • Jan-Fev/2013
palato duro e a gengiva; no entanto, em pacientes HIV+, as lesões podem aparecer em
mucosa não ceratinizada. O herpes labial
pode estender-se para a pele da face e exibir um comprometimento lateral extenso. A
persistência de locais ativos de infecção pelo HSV por mais de 1 mês, em um paciente
infectado pelo HIV, é uma condição aceita
para a Sida/Aids. As células epiteliais infectadas exibem acantólise (células de Tzanck),
núcleo claro e aumentado, alterações denominadas degeneração balonizante.(30) A
biópsia do tecido e o esfregaço citológico
são dois dos procedimentos diagnósticos
mais utilizados. Estudos imunocitoquímicos
para CMV também devem ser realizados,
com o objetivo de afastar a possibilidade
de uma coinfecção.
O contato com o VZV pode resultar
em catapora como infecção primária e
herpes-zóster como infecção reativada. No
paciente HIV+, o VZV frequentemente apresenta prematuro envolvimento dos nervos
cranianos, levando a um mau prognóstico.
As características clínicas são vesículas
ou úlceras unilaterais na mucosa ou pele
correspondente à área de inervação dos
ramos do nervo trigêmeo.(40) As lesões são
extremamente dolorosas e a lesão pode se
estender para o osso adjacente, levando a
um quadro de osteonecrose.(54) Pode haver
envolvimento de múltiplas dermatoses e
estas lesões podem ficar secundariamente
infectadas e associadas a graves nevralgias
pós-herpéticas.
As alterações citológicas são idênticas
às descritas para o HSV. O vírus causa
acantólise, com formação de diversas
células de Tzanck livre-flutuantes, as quais
exibem marginação nuclear da cromatina
e multinucleação ocasional. O diagnóstico
pode ser feito com base na história de
exposição ao VZV e confirmado através da
demonstração de efeitos citopatológicos
virais, observados nas células epiteliais
colhidas do líquido vesicular.(30)
A associação do CMV com lesões orais
não é frequente, mas está relacionada ao
HIV+. As características clínicas são com-
Infectologia
postas por lesões ulcerativas crônicas com
intensidade de dor variada, geralmente
únicas e frequentemente associadas à
linfadenopatia regional.(30) O diagnóstico
microscópico revela grandes inclusões intranucleares de CMV e menores inclusões
citoplasmáticas nas células endoteliais na
base das ulcerações.
Estas infecções geralmente se manifestam quando há imunossupressão
avançada, com uma contagem de linfócitos T CD4+ abaixo de 50 células/mm3. O
diagnóstico, que pode ser baseado nas características clínicas associadas à história
médica do paciente, deve ser confirmado
por microscopia eletrônica, histoquímica
ou exame microbiológico da lesão, além
de análise por PCR.(23,55,56)
Por serem estas lesões de origem viral,
o aciclovir é a terapêutica mais frequentemente utilizada. Nos casos mais graves,
principalmente nos casos de infecções
sistêmicas envolvendo risco de morte,
ganciclovir intravenoso é o tratamento de
escolha.(19,23)
As ulcerações aftosas recorrentes aparecem em mucosa não ceratinizada, como
mucosa jugal, assoalho de boca, superfície
superior da língua e orofaringe. Sua causa
é desconhecida. As lesões são caracterizadas por um halo inflamatório e uma pseudomembrana amarelo-cinzenta cobrindo
a lesão. São muito dolorosas, principalmente quando alimentos apimentados,
salgados ou ácidos são consumidos. O
tratamento envolve corticoide tópico em
casos moderados, já em casos graves são
utilizados corticoides sistêmicos, como a
prednisona. A dor é geralmente tratada
com anestésicos tópicos ou sistêmicos.(53)
A estomatite necrosante é uma ulceração que muitas vezes expõe o osso
subjacente e leva à destruição tecidual
dolorosa. Esta lesão pode ser uma variante
da ulceração aftosa maior, mas ocorre em
áreas que cobrem o osso e está associada com grave deterioração imunológica.
Estas lesões podem também ocorrer em
áreas edêntulas. Como em uma ulceração
aftosa maior, o tratamento de escolha é
corticoide sistêmico ou bochecho com
corticosteroide tópico.(14)
Doença das glândulas
salivares
A infecção pelo HIV está associada com aumento da glândula parótida
e diminuição do fluxo das secreções.
Histologicamente pode haver infiltração
linfoepitelial, síndrome da linfocitose de
células T CD8+(11) e formação de cistos
benignos. O aumento envolve tipicamente
a extremidade da glândula ou, de modo
menos frequente, a glândula submandibular, e pode-se apresentar uni ou bilateral
com períodos de tamanho aumentado ou
diminuído. Esse aumento pode ser confundido com um tumor maligno, mas, nesses
casos, a aspiração pode dar o diagnóstico.
Inchaço ocasional pode ser solucionado
de forma simples através de aspirações
repetidas e raramente deve-se remover
a glândula. O mecanismo fisiopatológico
da doença é desconhecido, embora o
citomegalovírus e o EBV tenham sido
relacionados.(57)
Outras lesões orais
Outras lesões orais associadas à infecção por HIV incluem hiperpigmentação
melânica, queratose friccional e granuloma
piogênico.(7) A hiperpigmentação melânica
ocorre possivelmente devido ao aumento
da liberação do hormônio estimulador de
α-melanócito, devido a uma desregulada
liberação de citocinas relacionada ao HIV e
ao uso de medicamentos estimuladores de
melanócito, como certos agentes antivirais
ou antifúngicos e à doença de Addison.
Relação com
antirretrovirais
A terapia antirretroviral (TAR) pode ser
dividida em duas fases. A primeira começou com a aprovação da zidovudina (AZT)
em 1987 pelo FDA(58) e muitos pacientes
recebiam dois tipos de drogas antirretrovirais (ARV). A segunda fase era uma
combinação de duas ou três classes de
drogas, incluindo inibidores da protease.
Desde a introdução da TAR, a frequência e as características das lesões orais
relacionadas aos pacientes HIV+ sofreram mudanças notórias. Muitos estudos
realizados em grupos de pacientes HIV+,
submetidos e não submetidos à TAR, mostram que as prevalências das lesões como
candidíase oral (CO), leucoplasia pilosa
(LP) e sarcoma de Kaposi (SK) diminuíram
em pacientes tratados com esses medicamentos, enquanto lesões como papiloma
e desordens de glândulas salivares têm
aumentado em tais indivíduos. Devido a
isso, quando CO, LP e SK aparecem em
indivíduos que estão fazendo a terapia,
pode significar que a terapia utilizada não
está mais fazendo efeito ou que o paciente
não a está seguindo corretamente.
Atualmente, a TAR inclui mais de 30
tipos diferentes de drogas separadas em
seis classes: nucleosídeos inibidores da
transcriptase reversa (NRTIs), inibidores
não nucleosídeos da transcriptase reversa (NNRTIs), inibidores da protease (PIs),
inibidores de fusão, inibidores de entrada,
e inibidores da integrase do HIV.(59) Normalmente três combinações são comumente
usadas: 1 NNRTI + 2 NRTI; 1 ou 2 PIs +
2 NRTIs; e 3 NRTIs.(60) Eles são administrados simultaneamente para produzir um
bloco de sustentação da replicação viral e
restaurar a função imune, bem como para
minimizar a resistência viral às drogas.(61)
O uso de inibidores de protease em
combinação com a terapia-alvo da enzima
transcriptase reversa está associado com
uma diminuição a longo prazo da replicação
viral e estabilização ou mesmo um aumento
na contagem das células T CD4+.(62)
Estudos mostram que a TAR a curto
prazo melhora a condição das lesões orais,
enquanto o uso a longo prazo causa outras adversidades, como redução do fluxo
salivar e reação liquenoide oral (RLO). RLO
Prática Hospitalar • Ano XV • Nº 85 • Jan-Fev/2013 29
induzida por AZT é possivelmente causada
pelas células T CD8+ previamente vacinadas a partir de antígenos anteriores. As
células T CD8+ ficam presas e persistem
no local da mucosa, e, mais tarde, tornam-se causadores da lesão na mucosa após
uma reação cruzada com o fármaco.(58)
Outros estudos mostram aumento na
prevalência de cáries, mas talvez esteja
relacionada ao baixo fluxo salivar.(63,64) Nittayananta et al. encontraram maior risco
de desenvolvimento de cárie cervical em
pacientes não submetidos à TAR e em
pacientes que fazem a TAR a longo prazo,
do que naqueles submetidos a TAR a curto
prazo. Em contraste com outros estudos
que não encontraram relação entre portadores de HIV que fazem TAR com aqueles
que não o fazem.
Nittayananta et al. ainda relataram que
pacientes HIV+ que fazem TAR possuem
baixa ocorrência de cárie dentária do que
aqueles pacientes que não utilizam esses
medicamentos. (64) O aumento da cárie
dentária relatado em alguns estudos pode
estar relacionado também à composição
dos medicamentos utilizados na TAR, os
quais contêm sacarose.(65)
Outra alteração é o aumento da prevalência de verrugas orais. Pressupõe-se
que este aumento ocorra devido à redução
da carga viral ou da contagem de células
CD4+, mas não se sabe ao certo qual
é o mecanismo relacionado com esta
alteração.(64)
Pacientes não submetidos à TAR
apresentam maior risco de terem bolsas
periodontais maiores ou iguais a 4 mm,
comparados àqueles que fazem a TAR, o
que pode estar associado ao aumento da
carga viral do HIV.(64)
Em pacientes que utilizam zidovudina
pode ser observada hiperpigmentação
oral. Já o eritema multiforme é um efeito
colateral conhecido do uso de NNRTIs.
Xerostomia também é observada em
pacientes submetidos à lamivudina, didanosina, indinavir e ritonavir. Lipodistrofia,
com perda de gordura subcutânea, tem
sido relatada extensivamente em pacientes que fazem uso de estavudina. Outros
efeitos orais como parestesias, edema de
lábio, queilite e distúrbios do paladar têm
sido observados em pacientes utilizando
inibidores de protease.(14)
Amornthatree et al. encontraram uma
diminuição na prevalência do EBV em
pacientes que utilizavam TAR.(66)
Considerações finais
Com uma ampla gama de doenças
oportunistas que acometem pacientes
imunossuprimidos pelo HIV, as lesões
orais, que caracterizam-se desde lesões
ulceradas a lesões nodulares e papulares
envolvendo tecido mole e ósseo, estão
entre os primeiros e mais importantes
indicadores de infecção pelo HIV.(67)
O processo de debilidade imunológica
que se instala nestes pacientes tem um forte impacto sobre sua qualidade de vida. As
associações de lesões orais que, em última
instância, comprometem funções básicas
como a nutrição, podem ter peso adicional
neste quadro já extenuante, dificultando o
manejo do paciente HIV+. Algumas destas lesões têm sido consideradas como
marcadoras da progressão da Sida/Aids
e do processo de deterioração do sistema
imune, principalmente a LP e a CO. Essas
lesões podem e devem ser precocemente
diagnosticadas e tratadas. No entanto,
a suspeita de infecção por HIV deve ser
manejada com extremo cuidado. Dados
como comportamento de risco devem ser
colhidos juntamente com a história médica,
para que se tenha uma maior objetividade
da avaliação.
Para a otimização dos cuidados de
saúde geral com o paciente HIV+ é importante para os profissionais da saúde
ter conhecimento da existência das manifestações orais e a atuação interdisciplinar
envolvendo a odontologia, preocupando-se com a detecção precoce e estar
atento aos marcadores de progressão
da doença. t
30 Prática Hospitalar • Ano XV • Nº 85 • Jan-Fev/2013
Referências
1. Aguirre-Urizar JM, Echebarria-Goicouria MA, Eguiadel-Valle A. Acquired immunodeficiency syndrome:
manifestations in the oral cavity. Med Oral Patol Oral
Cir Bucal 2004;9 Suppl:153-7;48-53. PubMed PMID:
15580133. Epub 2004/12/08. engspa.
2. Marques UR, Guimaraes VS, Sternberg C. Brazil’s
AIDS controversy: antiretroviral drugs, breaking
patents, and compulsory licensing. Food Drug Law J
2005;60(3):471-7. PubMed PMID: 16304752. Epub
2005/11/25. eng.
3. Lin HC, Corbet EF, Lo EC. Oral mucosal lesions in
adult Chinese. J Dent Res 2001 May;80(5):1486-90.
PubMed PMID: 11437225. Epub 2001/07/05. eng.
4. Challacombe SJ, Sweet SP. Oral mucosal immunity
and HIV infection: current status. Oral Dis 2002;8
Suppl 2:55-62. PubMed PMID: 12164661. Epub
2002/08/08. eng.
5. Sweet SP, Rahman D, Challacombe SJ. IgA subclas­
ses in HIV disease: dichotomy between raised levels
in serum and decreased secretion rates in saliva.
Immunology 1995 Dec;86(4):556-9. PubMed PMID:
8567021. Pubmed Central PMCID: 1384055. Epub
1995/12/01. eng.
6. Pindborg JJ. Classification of oral lesions associated
with HIV infection. Oral Surg Oral Med Oral Pathol
1989 Mar;67(3):292-5. PubMed PMID: 2648242.
Epub 1989/03/01. eng.
7. Pedreira EN, Cardoso CL, Barroso Edo C, Santos
JA, Fonseca FP, Taveira LA. Epidemiological and
oral manifestations of HIV-positive patients in a
specialized service in Brazil. J Appl Oral Sci 2008
Nov-Dec;16(6):369-75. PubMed PMID: 19082393.
Epub 2008/12/17. eng.
8. Shiboski CH, Patton LL, Webster-Cyriaque JY, Greenspan D, Traboulsi RS, Ghannoum M et al. The Oral
HIV/AIDS Research Alliance: updated case definitions
of oral disease endpoints. J Oral Pathol Med 2009
Jul;38(6):481-8. PubMed PMID: 19594839. Epub
2009/07/15. eng.
9. Glick M, Muzyka BC, Lurie D, Salkin LM. Oral mani­
festations associated with HIV-related disease as
markers for immune suppression and AIDS. Oral Surg
Oral Med Oral Pathol. 1994 Apr;77(4):344-9. PubMed
PMID: 8015797. Epub 1994/04/01. eng.
10.Patton LL, McKaig RG, Eron JJ, Jr., Lawrence HP,
Strauss RP. Oral hairy leukoplakia and oral candidiasis as predictors of HIV viral load. Aids 1999 Oct
22;13(15):2174-6. PubMed PMID: 10546876. Epub
1999/11/05. eng.
11.dos Santos Pinheiro R, Franca TT, Ribeiro CM, Leao
JC, de Souza IP, Castro GF. Oral manifestations in human immunodeficiency virus infected children in highly
active antiretroviral therapy era. J Oral Pathol Med
2009 Sep;38(8):613-22. PubMed PMID: 19614862.
Epub 2009/07/21. eng.
12. Greenspan D, Greenspan JS. HIV-related oral disease.
Lancet. 1996 Sep 14;348(9029):729-33. PubMed
PMID: 8806295. Epub 1996/09/14. eng.
13.Ellepola AN, Samaranayake LP. Oral candidal infections and antimycotics. Crit Rev Oral Biol Med
2000;11(2):172-98. PubMed PMID: 12002814. Epub
2002/05/11. eng.
14.Bajpai S, Pazare AR. Oral manifestations of HIV.
Contemp Clin Dent 2010 Jan;1(1):1-5. PubMed PMID:
22114368. Pubmed Central PMCID: 3220059. Epub
2010/01/01. eng.
15.Hodgson TA, Rachanis CC. Oral fungal and bacterial
infections in HIV-infected individuals: an overview in
Africa. Oral Dis 2002;8 Suppl 2:80-7. PubMed PMID:
12164666. Epub 2002/08/08. eng.
16.Ceballos-Salobrena A, Aguirre-Urizar JM, Bagan-Sebastian JV. Oral manifestations associated with
human immunodeficiency virus infection in a Spanish
population. J Oral Pathol Med 1996 Nov;25(10):523-6.
PubMed PMID: 8986962. Epub 1996/11/01. eng.
17.Guidelines for the performance of CD4+ T-cell determinations in persons with human immunodeficiency
virus infection. MMWR Recomm Rep. 1992 May
8;41(RR-8):1-17. PubMed PMID: 1350319. Epub
1992/05/08. eng.
Infectologia
18.Ramirez-Amador VA, Esquivel-Pedraza L, Ponce de
Leon S. Prognostic value of oral candidosis and hairy
leukoplakia in 111 Mexican HIV-infected patients. J
Oral Pathol Med 1996 May;25(5):206-11. PubMed
PMID: 8835816. Epub 1996/05/01. eng.
19.Truitt TO, Tami TA. Otolaryngologic manifestations of
human immunodeficiency virus infection. Med Clin
North Am 1999 Jan;83(1):303-15, xii. PubMed PMID:
9927976. Epub 1999/02/03. eng.
20.Classification and diagnostic criteria for oral lesions in
HIV infection. EC-Clearinghouse on Oral Problems Related to HIV Infection and WHO Collaborating Centre
on Oral Manifestations of the Immunodeficiency Virus.
J Oral Pathol Med 1993 Aug;22(7):289-91. PubMed
PMID: 8229864. Epub 1993/08/01. eng.
21.Pomarico L, Cerqueira DF, de Araujo Soares RM, de
Souza IP, de Araujo Castro GF, Socransky S et al. Associations among the use of highly active antiretroviral
therapy, oral candidiasis, oral Candida species and
salivary immunoglobulin A in HIV-infected children.
Oral Surg Oral Med Oral Pathol Oral Radiol Endod
2009 Aug;108(2):203-10. PubMed PMID: 19615660.
Pubmed Central PMCID: 2758816. Epub 2009/07/21.
eng.
22.Teo CG. Viral infections in the mouth. Oral Dis 2002;8
Suppl 2:88-90. PubMed PMID: 12164667. Epub
2002/08/08. eng.
23. Itin PH, Lautenschlager S. Viral lesions of the mouth in
HIV-infected patients. Dermatology. 1997;194(1):1-7.
PubMed PMID: 9031782. Epub 1997/01/01. eng.
24.Lifson AR, Hilton JF, Westenhouse JL, Canchola AJ,
Samuel MC, Katz MH et al. Time from HIV seroconversion to oral candidiasis or hairy leukoplakia among
homosexual and bisexual men enrolled in three pros­
pective cohorts. AIDS. 1994 Jan;8(1):73-9. PubMed
PMID: 8011239. Epub 1994/01/01. eng.
25.Kolokotronis A, Kioses V, Antoniades D, Mandraveli
K, Doutsos I, Papanayotou P. Immunologic status in
patients infected with HIV with oral candidiasis and
hairy leukoplakia. Oral Surg Oral Med Oral Pathol
1994 Jul;78(1):41-6. PubMed PMID: 8078662. Epub
1994/07/01. eng.
26.Kreuter A, Wieland U. Oral hairy leukoplakia: a clinical
indicator of immunosuppression. CMAJ 2011 May
17;183(8):932. PubMed PMID: 21398239. Pubmed
Central PMCID: 3091903. Epub 2011/03/15. eng.
27.Mabruk MJ, Flint SR, Toner M, Balluz I, Coleman D,
Sullivan D et al. In situ hybridization and the polymerase chain reaction (PCR) in the analysis of biopsies and exfoliative cytology specimens for definitive
diagnosis of oral hairy leukoplakia (OHL). J Oral Pathol
Med 1994 Aug;23(7):302-8. PubMed PMID: 7965885.
Epub 1994/08/01. eng.
28.Triantos D, Porter SR, Scully C, Teo CG. Oral hairy
leukoplakia: clinicopathologic features, pathogenesis,
diagnosis, and clinical significance. Clin Infect Dis 1997
Dec;25(6):1392-6. PubMed PMID: 9431384. Epub
1998/02/07. eng.
29. Wood NH, Feller L. The malignant potential of HIV-associated Kaposi sarcoma. Cancer Cell Int 2008;8:14.
PubMed PMID: 18976452. Pubmed Central PMCID:
2633277. Epub 2008/11/04. eng.
30. Neville BWDDD, Allen CM, Bouquot JE. Patologia Oral
e Maxilofacial. 3ª ed. 2009.
31. Campo-Trapero J, Del Romero-Guerrero J, Cano-Sanchez J, Rodriguez-Martin C, Martinez-Gonzalez JM,
Bascones-Martinez A. Relationship between oral
Kaposi ‘s sarcoma and HAART: contribution of two
case reports. Med Oral Patol Oral Cir Bucal 2008
Nov;13(11):E709-13. PubMed PMID: 18978711.
Epub 2008/11/04. eng.
32.Epstein JB. Oral malignancies associated with HIV.
J Can Dent Assoc 2007 Dec;73(10):953-6. PubMed
PMID: 18275699. Epub 2008/02/16. eng.
33. Regezi JA, Eversole LR, Barker BF, Rick GM, Silverman
S, Jr. Herpes simplex and cytomegalovirus coinfected
oral ulcers in HIV-positive patients. Oral Surg Oral Med
Oral Pathol Oral Radiol Endod 1996 Jan;81(1):55-62.
PubMed PMID: 8850485. Epub 1996/01/01. eng.
34.Amornthatree K, Sriplung H, Mitarnun W, Nittayananta W. Impacts of HIV infection and long-term use
of antiretroviral therapy on the prevalence of oral
human papilloma virus type 16. J Oral Pathol Med
2012 Apr;41(4):309-14. PubMed PMID: 22098553.
Pubmed Central PMCID: 3309118. Epub 2011/11/22.
eng.
35.Corti M, Villafane MF, Bistmans A, Campitelli A, Narbaitz M, Bare P. Oral cavity and extra-oral plasmablastic lymphomas in Aids patients: report of five cases
and review of the literature. International journal of
STD & Aids 2011 Dec;22(12):759-63. PubMed PMID:
22174064.
36.Kumar V AA, Fausto N, Aster JC. Robbins & Cotran
- Bases patológicas das doenças. 8ª ed. 2010.
37.Zen Filho EV T-AJ, Da Silva Santos PS, Coracin FL.
Linfomas - Manifestações orais e maxilofaciais. Prática
Hospitalar 2011;(78):32-7.
38.Ling PD, Vilchez RA, Keitel WA, Poston DG, Peng
RS, White ZS et al. Epstein-Barr virus DNA loads in
adult human immunodeficiency virus type 1-infected
patients receiving highly active antiretroviral therapy.
Clin Infect Dis 2003 Nov 1;37(9):1244-9. PubMed
PMID: 14557970. Epub 2003/10/15. eng.
39.Aleixo RQ, Scherma AP, Guimaraes G, Cortelli JR,
Cortelli SC. DMFT index and oral mucosal lesions
associated with HIV infection: cross-sectional study in
Porto Velho, Amazonian region - Brazil. Braz J Infect
Dis 2010 Sep-Oct;14(5):449-56. PubMed PMID:
21221472. Epub 2011/01/12. eng.
40.Narani N, Epstein JB. Classifications of oral lesions in
HIV infection. J Clin Periodontol 2001 Feb;28(2):13745. PubMed PMID: 11168738. Epub 2001/02/13.
eng.
41. Portela MB, Souza IP, Abreu CM, Bertolini M, Holandino C, Alviano CS et al. Effect of serine-type protease of
Candida spp isolated from linear gingival erythema of
HIV-positive children: critical factors in the colonization.
J Oral Pathol Med 2010 Nov;39(10):753-60. PubMed
PMID: 20618613. Epub 2010/07/14. eng.
42.Lugo RI, Fornatora ML, Reich RF, Freedman PD.
Linear gingival erythema in an HIV-seropositive man.
AIDS Read. 1999 Mar-Apr;9(2):97-9. PubMed PMID:
12728891. Epub 2003/05/06. eng.
43.Winkler JR, Robertson PB. Periodontal disease
associated with HIV infection. Oral Surg Oral Med
Oral Pathol 1992 Feb;73(2):145-50. PubMed PMID:
1532235. Epub 1992/02/01. eng.
44. Murray PA, Grassi M, Winkler JR. The microbiology of
HIV-associated periodontal lesions. J Clin Periodontol
1989 Nov;16(10):636-42. PubMed PMID: 2693496.
Epub 1989/11/01. eng.
45.Zambon JJ, Reynolds HS, Genco RJ. Studies of
the subgingival microflora in patients with acquired
immunodeficiency syndrome. J Periodontol. 1990
Nov;61(11):699-704. PubMed PMID: 2123926. Epub
1990/11/01. eng.
46.Moore LV, Moore WE, Riley C, Brooks CN, Burmeister JA, Smibert RM. Periodontal microflora of HIV
positive subjects with gingivitis or adult periodontitis.
J Periodontol 1993 Jan;64(1):48-56. PubMed PMID:
8426289. Epub 1993/01/01. eng.
47.Robinson PG. The significance and management of
periodontal lesions in HIV infection. Oral Dis 2002;8
Suppl 2:91-7. PubMed PMID: 12164669. Epub
2002/08/08. eng.
48.MacPhail LA, Greenspan D, Feigal DW, Lennette ET,
Greenspan JS. Recurrent aphthous ulcers in associa­
tion with HIV infection. Description of ulcer types and
analysis of T-lymphocyte subsets. Oral Surg Oral Med
Oral Pathol 1991 Jun;71(6):678-83. PubMed PMID:
1676501. Epub 1991/06/01. eng.
49.Phelan JA, Eisig S, Freedman PD, Newsome N, Klein
RS. Major aphthous-like ulcers in patients with AIDS.
Oral Surg Oral Med Oral Pathol 1991 Jan;71(1):68-72.
PubMed PMID: 1994326. Epub 1991/01/01. eng.
50.Ficarra G, Shillitoe EJ. HIV-related infections of the
oral cavity. Crit Rev Oral Biol Med 1992;3(3):207-31.
PubMed PMID: 1571472. Epub 1992/01/01. eng.
51. Muzyka BC, Glick M. Major aphthous ulcers in patients
with HIV disease. Oral Surg Oral Med Oral Pathol 1994
Feb;77(2):116-20. PubMed PMID: 8139826. Epub
1994/02/01. eng.
52.Ficarra G. Oral ulcers in HIV-infected patients: an
update on epidemiology and diagnosis. Oral Dis 1997
May;3 Suppl 1:S183-9. PubMed PMID: 9456686.
Epub 1997/05/01. eng.
53.Reznik DA. Oral manifestations of HIV disease. Top
HIV Med 2005 Dec-2006 Jan;13(5):143-8. PubMed
PMID: 16377852. Epub 2005/12/27. eng.
54.Schwartz O, Pindborg JJ, Svenningsen A. Tooth
exfoliation and necrosis of the alveolar bone following
trigeminal herpes zoster in HIV-infected patient. Tandlaegebladet 1989 Nov;93(16):623-7. PubMed PMID:
2635428. Epub 1989/11/01. eng.
55. Langford A, Kunze R, Schmelzer S, Wolf H, Pohle HD,
Reichart P. Immunocytochemical detection of herpes
viruses in oral smears of HIV-infected patients. J Oral
Pathol Med 1992 Feb;21(2):49-57. PubMed PMID:
1313501. Epub 1992/02/01. eng.
56.Tateishi K, Toh Y, Minagawa H, Tashiro H. Detection
of herpes simplex virus (HSV) in the saliva from 1,000
oral surgery outpatients by the polymerase chain
reaction (PCR) and virus isolation. J Oral Pathol Med
1994 Feb;23(2):80-4. PubMed PMID: 8164158. Epub
1994/02/01. eng.
57.Sontakke SA, Umarji HR, Karjodkar F. Comparison
of oral manifestations with CD4 count in HIV-infected
patients. Indian J Dent Res 2011 Sep-Oct;22(5):732.
PubMed PMID: 22406727. Epub 2012/03/13. eng.
58.Arirachakaran P, Hanvanich M, Kuysakorn P, Thongprasom K. Antiretroviral drug-associated oral lichenoid
reaction in HIV patient: A case report. Int J Dent
2010;2010:291072. PubMed PMID: 20671969.
Pubmed Central PMCID: 2909719. Epub 2010/07/31.
eng.
59.Cohen J. Thailand’s do-it-yourself therapy. Science
2003 Sep 19;301(5640):1662. PubMed PMID:
14500957. Epub 2003/09/23. eng.
60.Hammer SM, Eron JJ, Jr., Reiss P, Schooley RT,
Thompson MA, Walmsley S et al. Antiretroviral treatment of adult HIV infection: 2008 recommendations of
the International Aids Society-USA panel. JAMA 2008
Aug 6;300(5):555-70. PubMed PMID: 18677028.
Epub 2008/08/05. eng.
61.Ho DD. Time to hit HIV, early and hard. N Engl J Med
1995 Aug 17;333(7):450-1. PubMed PMID: 7616996.
Epub 1995/08/17. eng.
62. Sroussi HY, Epstein JB. Changes in the pattern of oral
lesions associated with HIV infection: implications for
dentists. J Can Dent Assoc 2007 Dec;73(10):949-52.
PubMed PMID: 18275698. Epub 2008/02/16. eng.
63.Sales-Peres SH, Mapengo MA, de Moura-Grec PG,
Marsicano JA, Sales-Peres Ade C, Sales-Peres A. Oral
manifestations in HIV+ children in Mozambique. Cien
Saude Colet 2012 Jan;17(1):55-60. PubMed PMID:
22218539. Epub 2012/01/06. eng.
64.Nittayananta W, Talungchit S, Jaruratanasirikul
S, Silpapojakul K, Chayakul P, Nilmanat A et al.
Effects of long-term use of HAART on oral health
status of HIV-infected subjects. J Oral Pathol
Med 2010 May;39(5):397-406. PubMed PMID:
20202089. Pubmed Central PMCID: 3217232. Epub
2010/03/06. eng.
65.Rwenyonyi CM, Kutesa A, Muwazi L, Okullo I,
Kasangaki A, Kekitinwa A. Oral manifestations in HIV/
Aids-infected children. Eur J Dent 2011 Jul;5(3):291-8.
PubMed PMID: 21769270. Pubmed Central PMCID:
3137442. Epub 2011/07/20. eng.
66. Amornthatree K, Sriplung H, Mitarnun W, Nittayananta
W. Effects of long-term use of antiretroviral therapy
on the prevalence of oral Epstein-Barr virus. J Oral
Pathol Med 2012 Mar;41(3):249-54. PubMed PMID:
21981060. Pubmed Central PMCID: 3303892. Epub
2011/10/11. eng.
67.Greenspan D, Komaroff E, Redford M, Phelan JA,
Navazesh M, Alves ME, et al. Oral mucosal lesions
and HIV viral load in the Women’s Interagency HIV
Study (WIHS). J Acquir Immune Defic Syndr 2000
Sep 1;25(1):44-50. PubMed PMID: 11064503. Epub
2000/11/07. eng.
Endereço para correspondência:
Al. Dr. Octavio Pinheiro Brisolla, 9-75, Vila
Universitária - CEP 17012-901 - Bauru - SP.
Prática Hospitalar • Ano XV • Nº 85 • Jan-Fev/2013 31