Lista – Termodinâmica
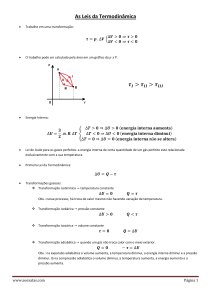
1. (Uern 2015) O gráfico representa um ciclo
termodinâmico:
!
Sabendo que o trabalho total associado a esse
processo é igual a ! 1050 J, qual o trabalho no
subprocesso ! BCD ?
a) ! 60 J
!
b) ! 340 J
c) ! 650 J
Os trabalhos realizados nas transformações ! AB,
! BC, ! CD e ! DA são, respectivamente:
a) Negativo, nulo, positivo e nulo.
b) Positivo, nulo, negativo e nulo.
c) Positivo, negativo, nulo e positivo.
d) Negativo, negativo, nulo e positivo.
d) ! 840 J
e) ! 990 J
2. (Uema 2015) No controle de qualidade de
produção de seringa, para aplicação de injeção,
fez-se o seguinte teste: escolheu-se uma amostra
−6 3
da seringa fabricada e colocou-se ! 3,0 × 10 m de
determinado gás. Em seguida, levou-se o sistema
para uma estufa em que o volume passou para
−6 3
! 3,5 × 10 m ao atingir o equilíbrio térmico.
5. (Ufg 2013) A figura a seguir ilustra a estrutura e
o funcionamento de uma cafeteira italiana. Na sua
parte inferior, uma fração do volume é preenchido
com água e o restante por um gás contendo uma
mistura de ar e vapor de água, todos à
temperatura ambiente. Quando a cafeteira é
colocada sobre a chama do fogão, o café
produzido é armazenado no compartimento
superior da cafeteira em poucos minutos.
Considerando que esse processo ocorreu sobre
5
pressão constante de ! 1,5 × 10 Pa, calcule, em
joule, o trabalho realizado pelo sistema.
3. (Uern 2015) Num sistema termodinâmico um
gás ideal, ao receber ! 300 J do meio externo,
realiza um trabalho de ! 200 J. É correto afirmar que
a) a transformação é adiabática.
b) a temperatura do sistema aumentou.
c) o volume do gás permanece constante.
d) a variação de energia interna é negativa.
4. (Upe 2015) Um gás ideal é submetido a um
processo termodinâmico ! ABCD, conforme ilustra
a figura a seguir.
!
O processo físico responsável diretamente pelo
funcionamento adequado da cafeteira é:
a) o isolamento adiabático da água.
b) a condensação do gás.
c) o trabalho realizado sobre a água.
d) a expansão adiabática do gás.
e) o aumento da energia interna do gás.
!1
www.tenhoprovaamanha.com.br
Lista – Termodinâmica
6. (Ufrgs 2012) A figura a seguir apresenta um
diagrama p x V que ilustra um ciclo termodinâmico
de um gás ideal. Este ciclo, com a realização de
trabalho de 750 J, ocorre em três processos
sucessivos. c) isotérmico, isobárico e isovolumétrico.
d) isovolumétrico, isotérmico e isobárico.
No processo AB, o sistema sofre um aumento de
pressão mantendo o volume constante; no
processo BC, o sistema se expande mantendo a
temperatura constante e diminuindo a pressão; e,
finalmente, no processo CA, o sistema retorna ao
estado inicial sem variar a pressão.
8. (Fuvest 2015) Certa quantidade de gás sofre
três transformações sucessivas, ! A → B, ! B → C e
! C → A, conforme o diagrama ! p − V apresentado
na figura abaixo.
!
A respeito dessas transformações, afirmou-se o
seguinte:
!
O trabalho realizado no processo BC e a relação
entre as temperaturas TA e TB são,
respectivamente,
a) 1310 J e TA = TB/8.
b) 1310 J e TA = 8TB.
c) 560 J e TA = TB/8.
d) 190 J e TA = TB/8.
e) 190 J e TA = 8TB.
7. (G1 - ifsul 2016) Abaixo temos o diagrama
! p × V onde estão representadas três
transformações que levam um gás ideal do estado
inicial ! (i) para o estado final ! (f).
I. O trabalho total realizado no ciclo ! ABCA é nulo.
II. A energia interna do gás no estado C é maior
que no estado A.
III. Durante a transformação ! A → B, o gás recebe
calor e realiza trabalho.
Está correto o que se afirma em:
a) I.
b) II.
c) III.
d) I e II.
e) II e III.
9. (Fgv 2015) O gráfico ilustra o comportamento
das pressões ! (p), em função dos volumes ! (V),
em duas transformações consecutivas, ! AB e ! BC
sofridas por certa massa de gás encerrada em um
recipiente dotado de êmbolo, como o cilindro de
um motor à explosão. Sabe-se que há uma
relação entre os volumes ocupados pelo gás na
transformação ! AB(VA = 2 ⋅ VB ), e também entre
as pressões ! (pc = 2 ⋅ pB = 4 ⋅ p A ).
!
Considerando o estudo das transformações
gasosas, os três processos aos quais o gás é
submetido são, respectivamente
a) isobárico, isotérmico e isovolumétrico.
b) isovolumétrico, isobárico e isotérmico.
!2
www.tenhoprovaamanha.com.br
Lista – Termodinâmica
!
!
É correto afirmar que as transformações ! AB e
! BC pelas quais o gás passou foram,
respectivamente,
a) isotérmica e isométrica.
b) isotérmica e isobárica.
c) adiabática e isométrica.
d) adiabática e isobárica.
e) isométrica e isotérmica.
No estado 1, o gás está submetido à pressão
10. (G1 - ifsul 2015) No gráfico temos a
representação da pressão ! "P" em função do
volume ! " V " para uma massa de gás perfeito.
P1 = 1,2 × 105 Pa e ocupa um volume V = 0,008
1
m3 à temperatura T1. Acende-se uma chama de
potência constante sob o cilindro, de maneira que
ao receber 500 J de calor o gás sofre uma
expansão lenta e isobárica até o estado 2, quando
o êmbolo atinge o topo do cilindro e é impedido de
continuar a se mover. Nesse estado, o gás passa
a ocupar um volume V2 = 0,012 m3 à temperatura
T2.
Nesse momento, o êmbolo é travado de maneira
que não possa mais descer e a chama é apagada.
O gás é, então, resfriado até o estado 3, quando a
temperatura volta ao valor inicial T1 e o gás fica
submetido a uma nova pressão P3.
Considerando que o cilindro tenha capacidade
térmica desprezível, calcule a variação de energia
interna sofrida pelo gás quando ele é levado do
estado 1 ao estado 2 e o valor da pressão final P3.
12. (Esc. Naval 2014) O estado inicial de certa
massa de gás ideal é caracterizado pela pressão
! P1 e volume ! V1. Essa massa gasosa sofre uma
!
As sucessivas transformações gasosas
representadas no gráfico ao lado: ! A → B; ! B → C
e ! C → A, são, respectivamente,
a) isocórica, isobárica e isotérmica.
b) isobárica, isocórica e isotérmica.
c) isotérmica, isobárica e isocórica.
d) isocórica, isotérmica e isobárica.
compressão adiabática seguida de um
aquecimento isobárico, depois se expande
adiabaticamente até que o seu volume retorne ao
valor inicial e, finalmente, um resfriamento
isovolumétrico faz com que o gás retorne ao seu
estado inicial. Qual o gráfico que melhor
representa as transformações sofridas pelo gás?
11. (Unesp 2014) A figura representa um cilindro
contendo um gás ideal em três estados, 1, 2 e 3,
respectivamente.
a) !
!3
www.tenhoprovaamanha.com.br
Lista – Termodinâmica
representada na figura abaixo, opera na sua
máxima eficiência, extraindo calor de um
T = 527 °C,
reservatório em temperatura ! q
e
liberando calor para um reservatório em
temperatura ! Tf = 327 °C.
b) !
c) !
Para realizar um trabalho ! (W) de ! 600 J, o calor
absorvido deve ser de
a) ! 2.400 J.
d) !
b) ! 1.800 J.
c) ! 1.581J.
d) ! 967 J.
e) ! 800 J.
e) !
13. (Imed 2016) Uma máquina térmica ideal opera
em um ciclo termodinâmico diferente do ciclo de
Carnot. Se essa máquina térmica operar entre as
temperaturas de ! 27°C e ! 477°C, fornecendo
trabalho através do calor gerado na fonte quente,
sua eficiência será:
a) Menor do que se a máquina operasse com base
no ciclo de Carnot.
b) De ! 60%.
c) A porcentagem do calor que chega à fonte fria.
d) De ! 75%.
e) A razão entre os calores das fontes fria e
quente.
14. (Ufrgs 2016) Uma máquina térmica,
15. (Ufsm 2015) Uma das maneiras de se obter
sal de cozinha é a sua extração a partir de sítios
subterrâneos. Para a realização de muitas das
tarefas de mineração, são utilizadas máquinas
térmicas, que podem funcionar, por exemplo,
como motores para locomotivas, bombas de água
e ar e refrigeradores. A respeito das propriedades
termodinâmicas das maquinas térmicas, qual das
alternativas é INCORRETA?
a) O rendimento de uma máquina térmica
funcionando como motor será máximo quando a
maior parte da energia retirada da fonte quente
for rejeitada, transferindo-se para a fonte fria.
b) Uma máquina térmica funcionando como
refrigerador transfere energia de uma fonte fria
para uma fonte quente mediante realização de
trabalho.
c) Máquinas térmicas necessitam de duas fontes
térmicas com temperaturas diferentes para
operar.
d) Dentre as consequências da segunda lei da
termodinâmica, está a impossibilidade de se
!4
www.tenhoprovaamanha.com.br
Lista – Termodinâmica
construir uma máquina térmica com rendimento
de ! 100%.
e) Todas as etapas de uma máquina térmica
operando no ciclo de Carnot são reversíveis.
gás ! 120 e ! 500 joules de calor, respectivamente,
a variação da energia interna do gás, em joules,
no processo ! ACD será igual a
16. (Imed 2015) Podemos considerar como
máquina térmica qualquer dispositivo que receba
uma quantidade de calor ! Q1 e converta parte da
energia recebida dessa maneira em trabalho
mecânico ! W. O calor não aproveitado, chamado
! Q2 = Q1 − W, é devolvido ao ambiente sem ser
aproveitado. Em relação a essas trocas de calor,
definimos como eficiência de uma máquina
térmica a razão entre o trabalho mecânico ! W
produzido e a quantidade de calor ! Q1 entregue à
máquina. Em particular, considere uma máquina
térmica que opera entre as temperaturas ! 300 K e
! 1200 K. Sobre as informações acima descritas,
assinale a alternativa INCORRETA.
a) Todas as máquinas térmicas devem satisfazer
igualmente a primeira e a segunda lei da
termodinâmica.
b) A eficiência máxima de uma máquina térmica
que opere entre as temperaturas citadas é de
! 75%.
c) Diminuindo pela metade as temperaturas
citadas, o rendimento máximo de uma máquina
térmica que opere entre essas temperaturas
não é alterado.
d) Com a tecnologia moderna, é possível construir
uma máquina térmica que opere entre as
temperaturas citadas com rendimento superior a
! 75%.
e) Devido à segunda lei da termodinâmica, é
impossível construir um dispositivo cujo único
efeito seja converter calor integralmente em
trabalho.
17. (Pucrs 2014) Numa turbina, o vapor de água é
admitido a 800K e é expulso a 400K. Se o
rendimento real dessa turbina é 80% do seu
rendimento ideal ou limite, fornecendo-se 100kJ
de calor à turbina ela poderá realizar um trabalho
igual a
a) 80kJ
b) 60kJ
c) 40kJ
d) 20kJ
e) 10kJ
18. (Efomm 2016) O diagrama PV da figura
mostra, para determinado gás ideal, alguns dos
processos termodinâmicos possíveis. Sabendo-se
que nos processos ! AB e ! BD são fornecidos ao
a) ! 105
b) ! 250
c) ! 515
d) ! 620
e) ! 725
19. (Uel 2015) Analise o gráfico a seguir, que
representa uma transformação cíclica ! ABCDA de
! 1mol de gás ideal.
!
a) Calcule o trabalho realizado pelo gás durante o
ciclo ! ABCDA.
b) Calcule o maior e o menor valor da temperatura
absoluta do gás no ciclo (considere
J
R=8
).
K mol
!
Justifique sua resposta
apresentando todos os cálculos realizados.
20. (Ufes 2015) A figura abaixo apresenta um
conjunto de transformações termodinâmicas
!5
www.tenhoprovaamanha.com.br
Lista – Termodinâmica
sofridas por um gás perfeito. Na transformação
! 1 → 2, são adicionados ! 200 J de calor ao gás,
levando esse gás a atingir a temperatura de ! 60°C
no ponto ! 2. A partir desses dados, determine
O volume de ! 1mol de gás ideal à pressão
atmosférica de ! 1 atm e à temperatura de ! 27°C é
! 25 .
Calor molar do ar a volume constante:
Cv = 30 J (mol K ).
!
Constante universal dos gases:
R = 0,08 atm (mol K ).
!
! 0°C = 273 K.
Devem ser desconsideradas a capacidade térmica
do recipiente e a variação da massa de gás no seu
interior devido à queima da vela.
!
22. (Ita 2013) Um mol de um gás ideal sofre uma
expansão adiabática reversível de um estado
inicial cuja pressão é Pi e o volume é Vi para um
estado final em que a pressão é Pf e o volume é
γ = Cp Cv
Vf. Sabe-se que
é o expoente de
Poisson, em que Cp e Cv são os respectivos
calores molares a pressão e a volume constantes.
Obtenha a expressão do trabalho realizado pelo
gás em função de Pi, Vi, Pf, Vf e γ.
a) a variação da energia interna do gás no
processo ! 1 → 2;
b) a temperatura do gás no ponto ! 5;
c) a variação da energia interna do gás em todo o
processo termodinâmico ! 1 → 5.
23. (Epcar (Afa) 2013) Uma máquina térmica
funciona fazendo com que 5 mols de um gás ideal
percorra o ciclo ABCDA representado na figura.
AVANÇADA
21. (Fuvest 2015) Um recipiente hermeticamente
fechado e termicamente isolado, com volume de
! 750 , contém ar inicialmente à pressão
atmosférica de ! 1 atm e à temperatura de ! 27°C.
No interior do recipiente, foi colocada uma
pequena vela acesa, de ! 2,5 g. Sabendo-se que a
massa da vela é consumida a uma taxa de
! 0,1 g min e que a queima da vela produz energia
4
à razão de ! 3,6 × 10 J g, determine:
a) a potência ! W da vela acesa;
b) a quantidade de energia ! E produzida pela
queima completa da vela;
c) o aumento ! ΔT da temperatura do ar no interior
do recipiente, durante a queima da vela;
d) a pressão ! P do ar no interior do recipiente, logo
após a queima da vela.
Note e adote:
O ar deve ser tratado como gás ideal.
!
Sabendo-se que a temperatura em A é 227 °C,
que os calores específicos molares do gás, a
volume constante e a pressão constante, valem,
respectivamente, 2 3R e 5 2R e que R vale
aproximadamente 8 J mol ⋅ K, o rendimento dessa
máquina, em porcentagem, está mais próximo de
a) 12
b) 15
c) 18
d) 21
!6
www.tenhoprovaamanha.com.br
Lista – Termodinâmica
24. (Upe 2011) Um recipiente cilíndrico, de área
2
de secção reta de ! 0,100m contém 20,0 g de gás
hélio. Esse recipiente contém um êmbolo que
pode se mover sem atrito. Uma fonte fornece calor
ao recipiente a uma taxa constante. Num
determinado instante, o gás sofre a transformação
termodinâmica representada no diagrama PV
abaixo, e o êmbolo se move com velocidade
−3
constante ! v = 8,31.10 m / s Considere que o
gás hélio (calor específico molar a volume
!
a) O trabalho realizado pelo gás ao longo do
processo ADC é maior do que o trabalho
realizado ao longo do processo ABC.
b) A energia interna do gás é maior no estado B.
c) O trabalho realizado pelo gás ao longo do
processo ABC é 4 P1V1.
d) A razão TA/TB, em que TA e TB representam as
temperaturas do gás nos estados A e B, é 1/8.
constante ! Cv = 1,5 R )se comporta como um gás
monoatômico ideal.
TEXTO PARA A PRÓXIMA QUESTÃO:
Quando necessário, use:
g = 10m s2
!
sen 37° = 0,6
!
cos 37° = 0,8
!
!
Dados: !
MMHe = 4,00g / mol;R = 8,31 J/mol.K
Depois de decorrido um intervalo de tempo de 25
s, analise as proposições a seguir e conclua.
( ) A variação de temperatura do gás durante o
26. (Epcar (Afa) 2014) Considere um gás ideal
que pode ser submetido a duas transformações
cíclicas reversíveis e não simultâneas, ! 1 e ! 2,
(
como mostrado no diagrama ! PV abaixo.
processo foi ! ΔT = 50 K .
) O calor específico molar à pressão
C = 2,5 R
(
(
constante do hélio é ! p
.
) A energia adicionada ao hélio sob a forma de
calor durante o processo foi Q = 375R.
) A variação na energia interna do hélio
ΔE
(
= 125 R
int
durante o processo foi !
.
) O trabalho realizado pelo hélio durante a
transformação foi W = 250R.
25. (Ufla 2010) O diagrama PV mostrado a seguir
ilustra dois processos termodinâmicos: 1 ABC e 2
ADC, em que um gás ideal é levado de um estado
A para outro C. considerando V2 = 2V1 e P2 = 4P1,
é CORRETO afirmar:
!
Na transformação ! 1 o gás recebe uma quantidade
de calor quantidade de calor ! Q1 para a fonte fria à
temperatura. ! T2 . Enquanto que, na transformação
! 2, as quantidades de calor recebida, ! Q'1, e
cedida, ! Q'2 , são trocadas respectivamente com
duas fontes às temperaturas ! T3 e ! T4 .
!7
www.tenhoprovaamanha.com.br
Lista – Termodinâmica
Nessas condições, é correto afirmar que
a) a variação da entropia nas transformações ! BC,
! DA, ! FG e ! HE é não nula.
b) nas transformações ! AB e ! EF, a variação da
entropia é negativa, enquanto que, nas
transformações ! CD e ! GH, é positiva.
c) na transformação !1, a variação da entropia é
5
Q1 = Q2 .
4
não nula e !
d) na transformação ! 2, a variação da entropia é
nula e ! Q'1 = 3Q'2 .
27. (Upe 2013) Uma máquina térmica opera de
acordo com o ciclo dado pela figura a seguir, onde
possui duas curvas adiabáticas, AB e CD. De B
para C, o calor é absorvido da fonte quente.
Considerando que o gás utilizado pela máquina é
ideal, assinale a alternativa que mostra o
rendimento dessa máquina.
Cp
γ=
Cv
Informações: !
!
⎡ ⎛ V ⎞γ ⎛ V ⎞
⎢⎜ C ⎟ − ⎜ B ⎟
1 ⎢ ⎝ V0 ⎠
⎝ V0 ⎠
1− ⎢
VC VB
γ⎢
−
⎢
V0 V0
⎣
a) !
⎡ ⎛ V ⎞γ ⎛ V ⎞
⎢⎜ C ⎟ − ⎜ B ⎟
⎢ V
⎝ V0 ⎠
1− γ ⎢ ⎝ 0 ⎠
V
C − VB
⎢
⎢
V0 V0
⎣
b) !
⎡
VC VB
⎢
−
⎢
V0 V0
1
1− ⎢
γ ⎢ ⎛ V ⎞γ ⎛ V ⎞
C
B
⎟ −⎜
⎟
⎢⎜
V
V
0
0
⎝
⎠
⎝
⎠
⎣
c) !
⎤γ
⎥
⎥
⎥
⎥
⎥
⎦
⎤γ
⎥
⎥
⎥
⎥
⎥
⎦
⎡
⎤
VC VB
⎢
⎥
−
⎢
⎥
V0 V0
1− γ ⎢
⎥γ
γ
⎛ VB ⎞ ⎥
⎢ ⎛ VC ⎞
⎟ −⎜
⎟ ⎥
⎢⎜
V0 ⎠
V0 ⎠ ⎦
⎝
⎝
⎣
d) !
1−
e) !
γ
γ
⎛ VC ⎞
⎛ VB ⎞
⎜
⎟ +⎜
⎟
⎝ V0 ⎠
⎝ V0 ⎠
γ
28. (Ufsc 2013) As máquinas a vapor foram um
dos motores da revolução industrial, que se iniciou
na Inglaterra no século XVIII e que produziu
impactos profundos, em nível mundial, nos meios
produtivos, na economia e no modo de vida da
sociedade. O estudo destas máquinas, em
particular de seu rendimento, deu sustentação à
formulação da Segunda Lei da Termodinâmica,
enunciada por diversos cientistas, de formas
praticamente equivalentes, no século XIX.
Com base na Segunda Lei da Termodinâmica,
assinale a(s) proposição(ões) CORRETA(S).
01) A maioria dos processos naturais é reversível.
02) A energia tende a se transformar em formas
menos úteis para gerar trabalho.
04) As máquinas térmicas que operam no ciclo de
Carnot podem obter rendimento de 100%.
08) A expressão “morte do calor do universo”
refere-se a um suposto estado em que as
reservas de carvão, de gás e de petróleo
teriam se esgotado.
16) O calor não transita naturalmente dos corpos
com temperatura menor para os corpos com
temperatura maior.
32) O princípio de funcionamento de uma
geladeira viola a Segunda Lei da
Termodinâmica.
64) A entropia de um sistema isolado tende
sempre a aumentar.
29. (Ita 2010) Uma máquina térmica opera
segundo o ciclo JKLMJ mostrado no diagrama T-S
da figura.
⎤
⎥
⎥
⎥γ
⎥
⎥
⎦
!8
www.tenhoprovaamanha.com.br
Lista – Termodinâmica
!
Pode-se afirmar que
a) processo JK corresponde a uma compressão
isotérmica.
b) o trabalho realizado pela máquina em um ciclo
é W = (T2 – T1)(S2 – S1).
T
η = 1− 2
T1
c) o rendimento da maquina é dado por !
.
d) durante o processo LM, uma quantidade de
calor QLM = T1(S2 – S1) é absorvida pelo
sistema.
e) outra máquina térmica que opere entre T2 e T1
poderia eventualmente possuir um rendimento
maior que a desta.
!9
www.tenhoprovaamanha.com.br
Lista – Termodinâmica
Gabarito:
!
U=
Resposta da questão 1:
[B]
3
n ⋅R ⋅ T
2
Sabendo que o trabalho realizado por um gás é
dado por:
! W = p ⋅ ΔV
E que pela primeira lei da termodinâmica temos
que:
! Q = τ + UΔ
Fica direto analisar que:
1) Na transformação AB ocorre uma expansão
! (ΔV > 0). Assim, o trabalho realizado é não nulo
Assim,
300 = 200 + ΔU
! ΔU = 100 J
Logo, a energia interna aumenta e a
temperatura também.
e positivo.
2) Nas transformações BC e AD não há variação
de volume. Logo o trabalho realizado nestas
transformações é nulo.
3) Na transformação CD ocorre uma contração
! (ΔV < 0). Assim, o trabalho realizado é não nulo e
[C] INCORRETA. Se o gás realiza trabalho, o
volume vai variar.
[D] INCORRETA. Como visto no item [B], a
variação de energia interna é positiva.
negativo.
Resposta da questão 2:
Sabe-se que o trabalho realizado por um gás a
pressão constante é dado por:
Resposta da questão 4:
[E]
! τ = p ⋅ VΔ
WAB + WBCD = Wtotal ⇒ 30 (4 − 2 ) + WBCD = 1050 ⇒ WBCD = 1050 − 60 ⇒
Sabendo-se os valores de volume inicial e final,
pode-se calcular a variação de volume.
τ = p ⋅ (Vf − Vi )
)(
)(
(
τ = (1,5 ⋅ 105 )⋅ (0,5 ⋅ 10−6 )
)
τ = 1,5 ⋅ 105 ⋅ ⎡⎢ 3,5 ⋅ 10−6 − 3,0 ⋅ 10−6 ⎤⎥
⎣
⎦
! τ = 0,075 J
Resposta da questão 3:
[B]
Sabendo da convenção de sinais com relação a
calor e trabalho em um sistema termodinâmico e
analisando o enunciado, podemos dizer que:
W = +200 J
! Q = +300 J
Ou seja, tanto o calor quanto o trabalho são
maiores que zero.
WBCD = 990 J.
!
Resposta da questão 5:
[C]
Ao ser aquecido, o sistema gasoso dilata-se,
empurrando a água para cima, realizando trabalho
sobre ela.
Resposta da questão 6:
[A]
Dados: Wciclo = 750 J; pA = pC = 80 N/m2; pB = 640
N/m2; VA = VB = 1 m3; VC = 8 m3.
O trabalho realizado (W) no ciclo é igual ao
somatório dos trabalhos nas transformações
parciais. O trabalho na transformação AB é nulo,
pois ela é isométrica.
WBC + WCA + WAB = Wciclo ⇒ WBC + p A (VA − VC ) + 0 = 750 ⇒
WBC + 80 (1 − 8 ) = 750 ⇒ WBC = 750 + 560 ⇒
! WBC = 1.310 J.
Assim, analisando as alternativas, temos que:
[A] INCORRETA. Uma transformação é dita
adiabática quando não existe troca de calor
com o meio externo. O próprio enunciado
afirma que existe uma troca de calor.
Como a transformação AB é isométrica, da lei
geral dos gases:
p A pB
T
p
TA
80
1
=
⇒ A = A ⇒
=
=
⇒
TA TB
TB pB
TB 640 8
[B] CORRETA. Se o meio recebeu calor e sabendo
que a energia interna é dada por:
T
TA = B .
8
!
!10
www.tenhoprovaamanha.com.br
Lista – Termodinâmica
Resposta da questão 7:
[B]
Resposta da questão 10:
[A]
(1) Volume constante: isométrico;
(2) Pressão constante: isobárico;
(3) Temperatura constante: isotérmico.
Observação: o enunciado não afirma que as duas
curvas mostradas são isotermas ou trechos de
hipérboles "equiláteras". Da forma como está não
podemos concluir que a transformação ! CA é
isotérmica.
Resposta da questão 8:
[E]
Analisemos cada uma das transformações.
- ! AB → Volume constante: isocórica.
- ! BC → pressão constante: isobárica.
- ! CA → Se a curva mostrada for um trecho de
hipérbole, a temperatura é constante:
isotérmica.
[I] Incorreta. Como o ciclo é anti-horário, o
trabalho é negativo e seu módulo é
numericamente igual a área do ciclo.
[II] Correta. A energia interna (U) é diretamente
proporcional ao produto pressão × volume.
p V > p A VA ⇒ UC > UA .
Assim: ! C C
[III] Correta. Na transformação ! A → B, ocorre
expansão, indicando que o gás realiza trabalho
! (W > 0). Como há também aumento da
Resposta da questão 11:
- Variação da Energia Interna !
na
transformação ! 1 → 2.
Dados:
energia interna ! (ΔU > 0).
Pela 1ª Lei da Termodinâmica:
Q
=
ΔU + W ⇒ Q > 0 ⇒ o gás recebe calor.
!
5
3
! P1 = P2 = 1,2 × 10 Pa; V1 = 0,008 m
= 8 × 10−3 m3 ; V2 = 0,012 m3 = 1,2 × 10−3 m3 ; Q12
, = 500 J.
Como a transformação é isobárica, o trabalho
realizado na transformação ! 1 → 2 é:
Resposta da questão 9:
[A]
W1,2 = P1 ΔV1,2 = 1,2 × 105 (12 − 8 )10−3 ⇒ W1,2 = 480 J.
!
Pela equação geral, tem-se que:
p⋅ V
= cte.
! T
Aplicando a Primeira Lei da Termodinâmica:
ΔU1,2 = Q1,2 − W1,2 ⇒ ΔU1,2 = 500 − 480 ⇒
ΔU1,2 = 20 J.
!
Assim, pode-se dizer que na situação descrita
teremos:
p A ⋅ VA pB ⋅ VB
=
TA
TB
Comentário: a banca examinadora cometeu um
deslize ao ar arbitrar em 500 J a quantidade de
calor absorvida pelo gás na transformação
!
isobárica ! 1 → 2. Calculemos o valor correto,
supondo gás monoatômico.
Substituindo as relações dadas no enunciado na
equação acima,
⎛V ⎞
2 ⋅ p A )⋅ ⎜ A ⎟
(
p A ⋅ VA
⎝ 2 ⎠
=
TA
TB
⎧
3
n R ΔT1,2
⎪ΔU1,2 =
2
⎨
⎪ W = P ΔV = n R ΔT = 480 J
1,2
1,2
⎩ 1,2
Q1,2 =
!
Ou seja,
! TA = TB
Q1,2 = ΔU1,2 + W1,2 =
3
n R ΔT1,2 + n R ΔT1,2 ⇒
2
5
5
5
n R ΔT1,2 ⇒ Q1,2 = W1,2 = (480 ) ⇒ Q1,2 = 1 200 J.
2
2
2
- Valor da pressão final (P3).
Dados:
! P1 = 1,2 × 10
Assim, podemos dizer que a transformação AB é
uma transformação isotérmica, pois não há
variação de temperatura.
Já na transformação BC, observando o gráfico
fornecido no enunciado, não há variação de
volume, ou seja, trata-se de uma transformação
isocórica ou isovolumétrica ou isométrica.
( ΔV1,2 )
5
Pa; V1 = 0,008 m3 = 8 × 10−3 m3 ; V3 = 0,012 m3 = 1,2 × 10−3 m3 ; T1 = T3 .
Aplicando a equação geral dos gases:
P1 V1
!
T1
=
P3 V3
T3
⇒ P3 =
P1 V1
V3
=
1,2 × 105 × 8 × 10−3
12 × 10−3
⇒
P3 = 8 × 104 Pa.
!11
www.tenhoprovaamanha.com.br
Lista – Termodinâmica
Mas o rendimento se relaciona com o trabalho e a
fonte quente:
Resposta da questão 12:
[D]
Para esta questão tem-se as seguintes
transformações:
1 ! → Compressão adiabática
2 ! → Aquecimento isobárico
3 ! → Expansão Adiabática
4 ! → Resfriamento isovolumétrico
Analisando os gráficos, chega-se à conclusão que
o único que pode ser a resposta é o gráfico da
alternativa [D]. Atentar aos sentidos (flechas) de
cada uma das transformações.
W
W
600 J
⇒ Qquente =
⇒ Qquente =
∴ Qquente = 2400 J
Qquente
η
0,25
!
η=
Resposta da questão 15:
[A]
O rendimento de uma máquina térmica é máximo
quando a menor parte da energia térmica retirada
da fonte quente for rejeitada para a fonte fria.
Resposta da questão 16:
[D]
Analisando as alternativas,
Resposta da questão 13:
[A]
A eficiência máxima de máquinas térmicas que
operam no ciclo de Carnot é calculada com a
expressão:
T
η = 1− 2
T1
!
em que:
! η é o fator de eficiência máxima (entre 0 e 1),e,
quando multiplicado por 100 têm-se a eficiência
em porcentagem;
! T1 e ! T2 são respectivamente as temperaturas da
[A] CORRETA. Toda máquina deve satisfazer as
duas leis da termodinâmica. A primeira que é
uma aplicação do princípio da conservação de
energia e a segunda que trata diretamente de
máquinas térmicas e seu rendimento.
[B] CORRETA. A eficiência máxima de uma
máquina térmica é quando esta opera em um
ciclo de Carnot. Desta forma,
T
300
ηCarnot = 1 − f = 1 −
TQ
1200
1
4
η
= 75 %
! Carnot
ηCarnot = 1 −
fonte quente e fria em Kelvin.
Então a eficiência máxima se fosse uma máquina
operando pelo ciclo de Carnot será:
300 K
η = 1−
⇒ η = 1 − 0,4 ∴ = η0,6
750 K
!
Como esta máquina não opera no ciclo de Carnot,
a eficiência será menor que 0,6 indicando que a
alternativa correta é da opção [A].
Resposta da questão 14:
[A]
Para calcular o rendimento de uma máquina
térmica ideal usa-se a equação:
Tfria
η = 1−
,
Tquente
!
com as temperaturas expressas na escala Kelvin
327 + 273
600
η = 1−
⇒η = 1 −
∴ = η0,25 ou 25%
527 + 273
800
!
[C] CORRETA. O rendimento do ciclo de Carnot
depende da razão entre as duas temperaturas
de operação da máquina. Se as duas forem
reduzidas pela metade, logo o rendimento será
o mesmo.
T
150
ηCarnot = 1 − f = 1 −
TQ
600
1
4
= 75 %
ηCarnot = 1 −
!
ηCarnot
[D] INCORRETA. O Rendimento da máquina
térmica operando no ciclo de Carnot é o
máximo rendimento que esta pode ter.
[E] CORRETA. A afirmação desta alternativa é a
própria segunda lei da termodinâmica, que diz que
"Nenhum motor térmico consegue transformar
integralmente calor em trabalho".
Resposta da questão 17:
[C]
!12
www.tenhoprovaamanha.com.br
Lista – Termodinâmica
O rendimento ideal é aquele dado pelo ciclo de
Carnot:
T
400
ηi = 1 − fria = 1 −
⇒ ni = 0,5.
Tquente
800
3
! ΔV = variação de volume do gás ! (m )
3
! τ BC = 15Pa ⋅ (6 − 2)m = 60J
e
ηr = 0,8 i = 0,8
η (0,5 ) ⇒ r =η0,4.
W
W
ηr =
⇒ 0,4 =
⇒ W = 40 kJ.
Q
100
!
3
! τ DA = 5Pa ⋅ (2 − 6)m = −20J
O trabalho do ciclo é
! τ ciclo = 60 − 20 = 40J
Resposta da questão 18:
[C]
Ou ainda pela área do retângulo
A variação da energia interna ! (ΔU), para os dois
caminhos ! ABD e ! ACD devem ser iguais:
ΔUABD = UACD
Δ (1)
!
De acordo com a primeira Lei da Termodinâmica:
3
! τ ciclo = (15 − 5)Pa ⋅ (6 − 2)m = 40J
b) Para calcularmos a maior e a menor
temperatura do sistema devemos lembrar os
gráficos de isotermas, através da Lei de BoyleMariotti
Q = ΔU + W ∴ U Δ= Q − W
ΔUABD = Q ABD − WABD (2 )
Q ABD = 120 J + 500 J = 620 J
!
WABD = pΔV ⇒ WABD = 70 ⋅ 103 Pa ⋅ (4000 − 2500 ) cm3 ⋅
1 m3
106 cm3
∴ WABD = 105 J
Logo, substituindo os valores na equação (2):
Δ = 515 J
! ΔUABD = 620 J − 105 J ∴ UABD
E, finalmente, pela igualdade em (1):
Δ = 515 J
! ΔUABD = UACD
Resposta da questão 19:
a) O trabalho do ciclo ! ABCDA representado na
figura corresponde à área da figura,
considerando o sentido horário teremos um
trabalho positivo. Os segmentos ! AB e ! CD em
que temos uma transformação isocórica
(volume constante) terão trabalho nulo. No
seguimento ! BC teremos uma expansão
volumétrica isobárica conduzindo a um trabalho
positivo (gás realizando trabalho sobre o meio
externo) e no seguimento ! DA teremos o gás
recebendo trabalho do meio externo, ou seja,
um trabalho negativo referente a uma contração
de volume à pressão constante.
A expressão do trabalho isobárico fica
! τ = p ⋅ VΔ
Onde
! τ = trabalho realizado ! ( + ) ou recebido pelo gás
! ( −) em joules ! (J)
2
! p = pressão do gás em Pascal ! (Pa = N m )
!
Observando o gráfico dado notamos que os
pontos de maior e menor temperaturas
absolutas são respectivamente ! C e ! A.
Para calcularmos estes valores de temperatura,
lançamos mão da equação de estados dos
Gases Ideais
! pV = nRT
Onde
2
! p = pressão do gás em Pascal ! (Pa = N m )
3
! V = volume do gás ! (m )
! n = número de mols do gás (mol)
! R = constante universal dos gases ideais
(fornecido no problema)
! T = temperatura absoluta ! (K)
Isolando ! T e calculando as temperaturas para
os pontos ! C e ! A, temos:
!13
www.tenhoprovaamanha.com.br
Lista – Termodinâmica
A maior temperatura
Usando os dados e resultados do item anterior
e análise dimensional, vem:
3.600 J
2,5 g
E=
×
⇒ E = 9 × 104 J.
g
min
0,1
min
!
3
TC =
!
15Pa ⋅ 6m
= 11,25K
J
1mol ⋅ 8
molK
E a menor temperatura
c) Dados:
5Pa ⋅ 2m3
TA =
= 1,25K
J
1mol ⋅ 8
molK
!
p0 = 1 atm; V0 = 750 ; Cv = 30
! T0 = 27 °C = 300
Calculando o número de mols:
- Pela equação de Clapeyron:
não temos variação de volume ! (ΔV = 0) não
haverá realização de trabalho ! (W = 0) e
tivemos absorção de calor ! (Q = +200 J), sendo
p5 V5 p2 V2
=
→
T5
T2
b) Dado: m = 2,5 g.
E = ΔU =
!
1× 750
⇒ n = 31,25 mol.
0,08 × 300
T=
Q
9 × 104
=Δ
⇒
n Cv 30 × 30
T Δ= 100 K = 100 ° C.
2 ΔU
5
9 × 104
n R T ⇒Δ T =
= Δ
⇒
2
5 n R 5 × 30 × 8
T Δ= 75 K = 75 ° C.
Nota: por comodidade, será usado nos
cálculos a seguir o primeiro resultado:
! ΔT = 100K.
Δ = 200 J.
! ΔU15 = U12Δ + U25 → Δ U15 = 200ΔJ + 0 → U15
W = 60 W.
=
- A queima da vela ocorre a volume constante,
portanto toda a energia liberada é usada para
aumentar a energia interna do gás. Como o ar
deve ser tratado como gás perfeito, usando a
expressão da variação da energia interna para
um gás diatômico, vem:
energia interna de ! 1 → 5 é igual à
transformação ! 1 → 2 já calculada
anteriormente.
Portanto,
!
E = Q = n Cv ΔT ⇒
!
c) Sabendo que a energia interna depende da
somente da temperatura para a condição de
gás ideal, para a transformação de ! 2 → 5
temos que a variação da energia interna é nula
! (ΔU25 = 0), pois ! T5 = T2 . Logo, a variação da
g
ΔE
EΔ m
J
J
3.600 J
=
×
⇒ P = 3,6 × 104
× 0,1
= 3.600
=
⇒
Δt
m
t Δ
g
min
min
60 s
RT
- A energia liberada pela queima da vela é
absorvida pelo ar na forma de calor,
aquecendo o ar do recipiente.
retirando os valores do gráfico
p0 2V0 2p0 V0
→
=
→ T5 = T2 → T5 = 60 C.
T5
T2
W=
p0 V
- Por proporção direta:
→ 1 mol
⎧25
750
n=
⇒ n = 30 mol.
⎨
25
750 → n
!⎩
Nota: por comodidade, será usado nos
cálculos a seguir o segundo resultado: n = 30
mol.
b) Neste caso, como dispomos da temperatura do
ponto 2, usaremos a Lei dos gases ideais para
os pontos 2 e 5. O sistema é fechado, logo não
há perdas de massa para o exterior.
Resposta da questão 21:
ΔE = 3,6 × 104 J/g; m = 0,1 g/min.
a) Dados: ! m
! Δt
Usando análise dimensional:
p0 V = n R T0 ⇒ n =
!
assim ! ΔU = Q, ou seja, ! ΔU = 200 J.
!
K; 1 mol ⇒ 25 .
O excesso de dados com valores aproximados
e inconsistentes permite duas resoluções que
chegam a diferentes resultados.
Resposta da questão 20:
a) Usaremos a 1ª Lei da Termodinâmica
! ΔU = Q − W e como na transformação ! 1 → 2
!
atm
J
J
; R = 0,08
=8
;
mol K
mol K
mol K
d) Aplicando a equação geral dos gases ideais:
p0 V
T0
!
=
pV
1
p
4
⇒
=
⇒ p = atm ⇒
T0 + ΔT
300 300 + 100
3
p ≅ 1,33 atm.
Resposta da questão 22:
Lembrando-se do primeiro princípio da
termodinâmica: ! Q = τ + U Δ
, onde Q=0, pois a
transformação é adiabática.
! Q = τ + UΔ→ 0 =τ + UΔ → =τ − U Δ
(eq.1)
!14
www.tenhoprovaamanha.com.br
Lista – Termodinâmica
γ=
Associando !
O trabalho no ciclo é numericamente igual à área
do ciclo, assim sendo, temos:
CP
CV
, que foi dado no enunciado,
com a relação de Mayer (! CP − CV = R ), teremos:
CP − CV = R
C
γ= P
CV
!
5
4
! W = (2 − 1).10 .(0,4 − 0,2) = 2.10 J
Calculando as temperaturas do gás no estado B,
C e D.
!
γ CV − CV = R → CV =
R
γ −1
(eq.2)
PA VA PB VB PC VC PD VD
=
=
=
θB
Cθ
D θ
! θA
Lembrando-se da equação de Clapeyron:
!
P.V = n.R.T → T =
PV
nR
Comparando o gás nos estados A e B:
(eq.3)
PA VA PB VB
1.105 VA
2.105 VB
=
→
=
θB
B θ
! θA
! (223 + 273)
=
θ
=
2.500
=
1000K
∴
θ
=
1000K
B
B
!
!
Neste caso, podemos escrever a variação da
energia interna como:
! ΔU = n.CV (Tf − Ti )
Comparando o gás nos estados B e C:
(eq.4)
PB VB PC VC
0,2
0,4
=
→
=
θB
θ
1000
θ C ∴ θ C = 2000K
C
!
!
!
Substituindo "eq.2" e "eq.3" em "eq.4", teremos:
⎛ nR ⎞ ⎛ Pf Vf Pi Vi ⎞
ΔU = n.CV (Tf − Ti ) → U Δ= ⎜
−
⎟.⎜
⎟
nR ⎠
⎝ γ − 1 ⎠ ⎝ nR
1
ΔU =
(Pf Vf − Pi Vi )
γ −1
!
Comparando o gás nos estados C e D:
Substituindo a equação acima em "eq.1":
Cálculo da quantidade de calor absorvido
(QABS.) pelo gás:
τ = − UΔ
PC VC PD VD
2.105 1.105
=
→
=
θD ∴ θD = 1000K
D θ
! θC
! (2000)
!
!
τ=
Processo A! → B:
! Q V = n.CV .Δ ABθ! → ! Q V = 5.(2 / 3).8.(1000 − 500)
1
(Pi Vi − Pf Vf )
γ −1
4
.104 J
3
Processo B! → C:
! QP = n.CP .Δ BCθ! → ! QP = 5.(5 / 2).8.(2000 − 1000)
∴ QV =
Resposta da questão 23:
Questão anulada no gabarito oficial.
!→ !
O enunciado apresenta um valor incorreto do calor
específico molar a volume constante. Segundo a
relação de Mayer CP – CV = R, e como podemos
observar, os valores apresentados não convergem
com essa relação.
5
! → ! ∴ QP = 10 J
!
CP − CV = R → (5/2 )R − (2/3 )R = (11/6 )R
Nos processos C! → D e D! → A o gás rejeita calor
para o ambiente (Q<0).
Por esse motivo a questão foi anulada. Porém,
devemos ressaltar que caso utilizássemos os
valores apresentados no enunciado
encontraríamos uma das alternativas. Vejamos
qual:
Assim, o calor absorvido (QABS.) é dado por:
!
Q ABS. =
4
34
.104 + 10.104 =
.104 J
3
3
Calculando o rendimento da máquina térmica:
Calculo do trabalho do gás no ciclo
!15
www.tenhoprovaamanha.com.br
Lista – Termodinâmica
η=
!
W
Q ABS. →
!
!
η=
2.104
(34 / 3).104
=
6
≅ 0,18
34
d) Errada. !
TA
T
1
= 1 =
TB 4T1 4
∴ η ≅ 18%
Resposta da questão 26:
[D]
Resposta da questão 24:
V V F F V.
[A] Falsa, pois a variação da entropia nas
transformações BC, DA, FG e HE é nula por
serem adiabáticas, isto é, ! Q = 0 e ! ΔS = 0
devido à variação da entropia ser dada por:
Q
ΔS = .
T
!
!
V) !
pΔV = nR ΔT → T Δ
=
pΔV pA xΔ pAv t Δ105 x0,1x8,31x10−3 x25
=
=
=
nR
nR
nR
5x8,31
! ΔT = 50K .
(V) Como sabemos:
! CP − C V = R → CP = C V + R = 2,5R
[B] Falsa, devido às transformações AB e EF
receberem calor da fonte quente, sendo
! ΔQ > 0, e, portanto, ! ΔS > 0. Já em relação às
transformações CD e GH temos a situação
inversa, havendo rejeito de calor, ! ΔQ < 0 e
! ΔS < 0.
(F) ! Q = nCP ΔT = 5x2,5Rx50 = 625R
(F)
= 625R − 5Tx50 = 375R
! ΔU = Q − W = Q − nR T Δ
(V) ! W = nRΔT = 5.R.50 = 250R
Resposta da questão 25:
[C]
a) Errada. Observe os gráficos abaixo
[C] Falsa, pois no ciclo a variação da entropia é
nula. ! ΔS = 0.
[D] Verdadeira, pois no ciclo a variação da entropia
é nula e a relação entre as temperaturas das
fontes quente e fria e seus calores no ciclo de
Carnot é dada por:
Q1 ' T3
300
=
⇒ Q1 ' =
⋅ Q2 ' ∴ Q1 ' = 3Q2 '
Q2 ' T4
100
!
Resposta da questão 27:
[A]
!
b) Errada. A energia interna é diretamente
proporcional à temperatura que por sua vez é
diretamente proporcional ao produto PV.
! PA .VA = P1.V1
! PB .VB = P2 .V1 = 4P1.V1
! PC .VC = P1.V2 = P1.2V1 = 2P1.V1
! PD .VD = P2 .V2 = 4P1.2V1 = 8P1.V1
! TB = 4T1 ; ! TC = 2T1 ; ! TD = 8T1
!
c) Certa. Calculemos a área do segundo gráfico
mostrado na letra a.
W
= (V2 − V1 ).P2 = (2V1 − V1 ).4P1 = 4P1V1
! ABC
!
η=
nCV (TA − TD )
Q + QDA
Q
W
= BC
= 1 + DA = 1 +
QBC
QBC
QBC
nCP (TC − TB )
!
η = 1+
CV (TA − TD )
CP (TC − TB )
Evolução BC
!16
www.tenhoprovaamanha.com.br
Lista – Termodinâmica
!
TC TB
V
=
→ TC = C TB
VC VB
VB
⎡ ⎛ V ⎞γ ⎛ V ⎞ ⎤ γ
⎢⎜ C ⎟ − ⎜ B ⎟ ⎥
1 ⎢ ⎝ V0 ⎠
⎝ V0 ⎠ ⎥
η = 1− ⎢
⎥
VC VB
γ⎢
⎥
−
⎢
⎥
V0 V0
⎣
⎦
!
(1)
Evolução CD
!
P1VCγ
γ
P1VCγ = PD V0 →
PD =
V0γ
!
P1VC PD VD
PV T
=
→ PD = 1 C D
TC
TD
VD TC
2=3→
!
(2)
Resposta da questão 28:
02 + 16 + 64 = 82.
(3)
P1VCγ
V V0γ
PV T
= 1 C D → TD = C
TC
VD TC
V0γ
VC V0 γ
1 em 4 → TD =
!
VCγ VD
VC V0γ
TC → TD =
(4)
VCγ VD VC
V V0γ
TB = C TB
VC V0γ VB
VB V0 γ
(5)
Evolução DA
!
TD TA
P
=
→ TA = A TD
PD PA
PD
(6)
Evolução AB
!
PA V0γ
γ
PA V0γ = P1VB →
P1 =
VBγ
!
PA V0 P1VB
P V
=
→ P1 = A 0 TB
TA
TB
VB TA
7=8→
!
!
η = 1+
PA V0γ
VBγ
(7)
(8)
CP (TC − TB )
→
⎛ Vγ V
⎞
Vγ V
⎜ B 0 TB − C 0 TB ⎟
γ
γ
⎟
VB V0
1 ⎜ V0 VB
⎠
= η1 + ⎝
γ
⎛ VC
⎞
TB − TB ⎟
⎜
⎝ VB
⎠
⎛ Vγ V
⎞
Vγ V
⎜ B 0 TB − C 0 TB ⎟
γ
γ
⎟
VB V0
1 ⎜ V0 VB
⎠→
η = 1+ ⎝
γ
⎛ VC
⎞
VB
TB −
T ⎟
⎜
VB B ⎠
⎝ VB
!
Para se obter rendimento ! η = 1 = 100%, a
temperatura absoluta da fonte fria deveria ser
! Tfria = 0K, o que é um absurdo.
VBγ V0
PA V0
=
TB → TA =
TB
VB TA
V0 VBγ
CV (TA − TD )
= η1 +
Justificando as incorretas:
[01] Incorreta.
As transformações reversíveis são
transformações ideais, pois devem ocorrer
num sistema em equilíbrio termodinâmico, o
que compreende:
- equilíbrio mecânico: as forças devem estar
equilibradas, tanto as interiores como as
trocadas com o meio;
- equilíbrio térmico: todas as partes do
sistema devem estar à mesma temperatura,
igual a temperatura do meio;
- equilíbrio químico: não há modificação
espontânea em sua estrutura interna.
[04] Incorreta.
Isso violaria a segunda lei da termodinâmica,
que afirma ser impossível uma máquina
térmica operando em ciclos transformar
integralmente calor em trabalho.
(η) de uma máquina
De fato, o rendimento !
térmica é dado pela expressão:
T
η = 1 − fria .
Tquente
!
⎛ V Vγ V Vγ ⎞
⎜ B 0 − C 0⎟
V0 γ⎟⎠
1 ⎝ V0
γ⎜
γ (VC − VB )
[08] Incorreta.
A morte térmica, ou morte do calor do
universo é um possível estado final do
universo, no qual ele "cai" para um estado de
nenhuma energia livre para sustentar
movimento ou vida.
[32] Incorreta.
Se essa lei fosse violada ela deixaria de ser uma
lei.
Resposta da questão 29:
[B]
No ciclo temos as seguintes transformações:
JK: expansão isotérmica. Se a entropia aumenta,
o sistema recebe calor e realiza trabalho;
KL: resfriamento adiabático. A temperatura diminui
sem variar a entropia, logo não há troca de calor;
!17
www.tenhoprovaamanha.com.br
Lista – Termodinâmica
LM: compressão isotérmica. A entropia diminui, o
sistema perde calor e recebe trabalho;
MJ: aquecimento adiabático. A temperatura
aumenta sem variar a entropia.
Nota-se, então, que se trata de um ciclo de
T
η = 1− 1
T2
Carnot, com rendimento: !
Calculemos o trabalho realizado no ciclo,
lembrando que a variação da entropia é:
Q
ΔS = ! T , onde Q é o calor trocado na
transformação.
A transformação JK é isotérmica, portanto a
variação da energia interna é nula. Da 1ª lei da
termodinâmica (! ΔU = Q − W ). Então:
0 = QJK – WJK ⇒
WJK = QJK. (equação 1)
QJK
⇒ QJK = (SJ − SK )T2
T2
Mas: ΔSJK =
⇒
QJK = (S2 – S1)T2 . Substituindo nessa expressão a
equação (1), obtemos:
WJK = (S2 – S1)T2.
Seguindo esse mesmo raciocínio para a
transformação LM, que também é isotérmica, mas
uma compressão, vem:
WLM = (S1 – S2)T1 ⇒ WLM = –(S2 – S1)T1.
Nas transformações KL e MJ o sistema não troca
calor. Novamente, pela 1ª lei da termodinâmica:
ΔUKL = – WKL e ΔUMJ = – WMJ.
Como ΔUMJ = – ΔUKL ⇒ WMJ = – WKL.
O trabalho no ciclo é o somatório desses
trabalhos, ou seja:
Wciclo = WJK + WKL + WLM + WMJ ⇒
Wciclo = (S2 – S1)T2 + WKL – (S2 – S1)T1 – WKL ⇒
Wciclo = (S2 – S1)T2 – (S2 – S1)T1 ⇒
Wciclo = (S2 – S1) (T2 – T1).
!18
www.tenhoprovaamanha.com.br