Físico-Química
Experimental
FQE001
Exp. 02
Propriedades Coligativas
1. Introdução
Algumas propriedades do solvente mudam quando um soluto é dissolvido nele para
formar uma solução. O ponto de congelamento da água salgada, por exemplo, é menor que para
a água pura. Propriedades deste tipo são chamadas de propriedades coligativas, e também
incluem a pressão de vapor, ponto de ebulição, e a pressão osmótica das soluções. Em soluções
diluídas, todas as propriedades coligativas dependem do número de partículas do soluto
presente na solução e não da natureza da partícula. Por isso o nome propriedades coligativas,
significando que são propriedades que dependem do conjunto, e não do indivíduo.
No estudo de propriedades coligativas, admite-se, normalmente, que o soluto não é
volátil (não contribui para a composição do vapor da solução), e que ele não se dissolve no
solvente sólido (o sólido puro se separa quando a solução é congelada). Estas hipóteses são
severas, mas corretas para muitas misturas.
Todas as propriedades coligativas vem da diminuição do potencial químico do solvente
líquido provocada pela presença do soluto. Quando um soluto é adicionado a um solvente puro
A, a fração molar de A passa de 1 para um valor menor, entre 0 e 1. Assim, o potencial químico
passa de 𝜇𝐴∗ , quando o solvente está puro (xA = 1), para 𝜇𝐴∗ + 𝑅𝑇𝑙𝑛𝑥𝐴 , quando o soluto está
presente. Como xA < 1, ln xA é negativo, ou seja, a adição de um soluto, a T e p constantes, diminui
o potencial químico do solvente na mistura (A).
Por outro lado, não há nenhuma influência do soluto sobre o potencial químico do
solvente na fase vapor ou do solvente sólido, pois não existe soluto no vapor ou no sólido, de
acordo com as hipóteses adotadas. Com isso, o equilíbrio de fases entre os estados sólido e
líquido, ou líquido e vapor, é afetado, causando alteração nas temperaturas em que estes
equilíbrios ocorrem (temperatura de fusão e de ebulição).
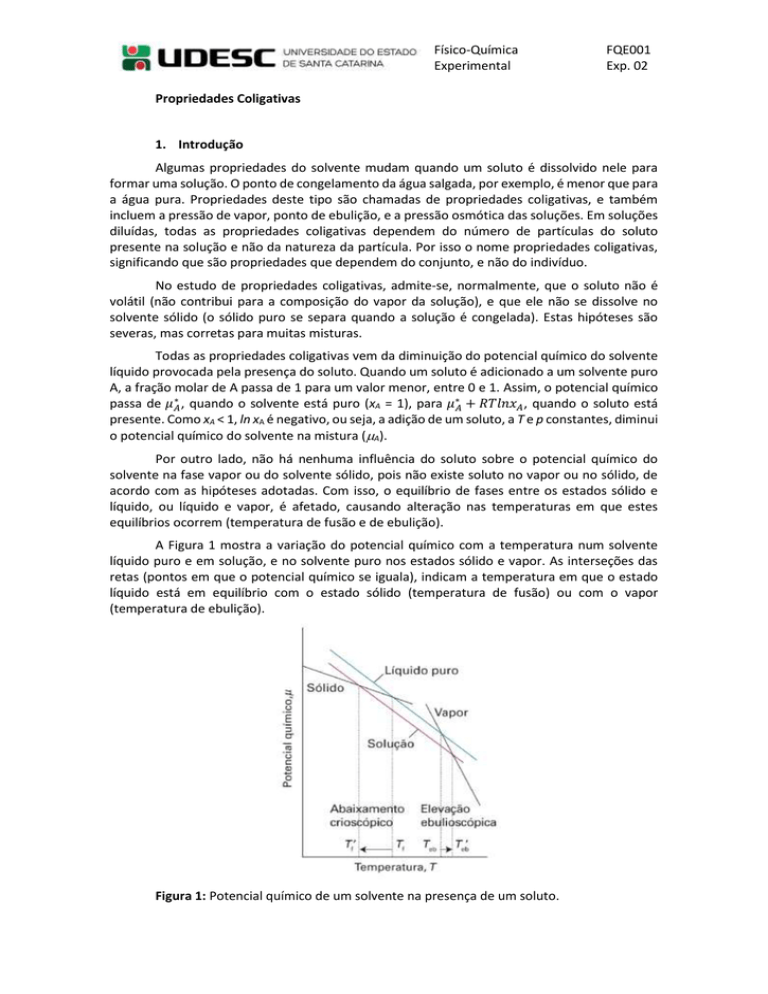
A Figura 1 mostra a variação do potencial químico com a temperatura num solvente
líquido puro e em solução, e no solvente puro nos estados sólido e vapor. As interseções das
retas (pontos em que o potencial químico se iguala), indicam a temperatura em que o estado
líquido está em equilíbrio com o estado sólido (temperatura de fusão) ou com o vapor
(temperatura de ebulição).
Figura 1: Potencial químico de um solvente na presença de um soluto.
Físico-Química
Experimental
FQE001
Exp. 02
Pela Figura 1, observa-se que a redução do potencial químico do solvente implica que o
equilíbrio entre as fases líquido / vapor ocorra numa temperatura maior (o ponto de ebulição
do solvente aumenta), enquanto que o equilíbrio entre as fases líquido / sólido ocorra numa
temperatura menor (o ponto de fusão do solvente diminui). O primeiro efeito é chamado de
ebulioscopia, ou elevação do ponto de ebulição. O segundo efeito é conhecido como crioscopia,
ou abaixamento do ponto de fusão. Outra observação que pode ser feita a partir da Figura 1 é
que o abaixamento do potencial químico do líquido tem um efeito maior sobre o ponto de fusão
que sobre o ponto de ebulição, em virtude dos ângulos de interseção das retas.
A origem molecular do abaixamento do potencial químico do solvente em solução é um
efeito da entropia do sistema. O potencial químico, A, é uma medida da tendência de A a
escapar da solução. Então, a diminuição de A significa que a pressão parcial pA no vapor em
equilíbrio com a solução é menor que a pressão de vapor de A puro, 𝑝𝐴∗ . Entretanto, a pressão
de vapor de um líquido puro reflete a tendência da solução em atingir maior entropia, que pode
ser alcançada quando o líquido passa para o estado gasoso. Quando o soluto está presente, há
uma contribuição adicional para a entropia do líquido. Como a entropia da solução já é maior
que a do líquido puro, a tendência à formação de gás fica reduzida, causado uma redução na
pressão de vapor e, consequentemente, sendo necessária uma temperatura maior para a
ebulição do solvente.
Analogamente, a maior desordem da solução se opõe à tendência ao congelamento.
Assim, é necessário alcançar uma temperatura mais baixa para que se consiga o equilíbrio entre
o sólido e a solução. Por isso, o ponto de congelamento (ou ponto de fusão) é reduzido, um
fenômeno conhecido como crioscopia.
Para entender o efeito do abaixamento da temperatura de fusão, precisamos considerar
o equilíbrio heterogêneo entre o solvente sólido e o solvente em solução. O equilíbrio ocorre
em uma temperatura em que: 𝜇𝐴∗ (𝑠) = 𝜇𝐴∗ (𝑙) + 𝑅𝑇 ln 𝑥𝐴 , onde * indica o potencial químico do
solvente puro nos estados sólido (s) ou líquido (l), e 𝑥𝐴 indica a fração molar do solvente na
solução.
O rearranjo da equação acima indica uma relação entre a variação de energia livre de
fusão e a composição da solução. Através de tratamento matemático, é possível mostrar que a
presença de um soluto, com fração molar 𝑥𝐵 = 1 − 𝑥𝐴 provoca uma diminuição no ponto de
fusão do solvente de 𝑇𝑓 para 𝑇𝑓 + Δ𝑇𝑓 , sendo que:
𝑀𝑀𝐴 𝑅𝑇𝑓∗2
𝜉
Δ𝑓𝑢𝑠 𝐻𝑚,𝐴 𝐵
Δ𝑇𝑓 = −𝑘𝑓 𝜉𝐵
Δ𝑇𝑓 = −
(1)
Nesta equação, 𝜉𝐵 é a concentração molal do soluto na solução, e 𝑘𝑓 é a constante
crioscópica do solvente, que pode ser definida por:
𝑀𝑀𝐴 𝑅𝑇𝑓∗2
𝑘𝑓 =
Δ𝑓𝑢𝑠 𝐻𝐴,𝑚
(2)
Para a água, fusHm = 6007 J/mol, Tf* = 273,15 K e MM = 18,015 g/mol, a constante
crioscópica é dada por:
𝑘𝑓 =
(18,015. 103 kg/mol)(8,3145 J.𝑚𝑜𝑙−1 𝐾 −1 )(273,15𝐾)2
= 1,860 K.kg/mol
6007 J.𝑚𝑜𝑙 −1
Físico-Química
Experimental
FQE001
Exp. 02
2. Objetivos
Medir o decréscimo do ponto de congelamento da água resultante da adição de um
soluto.
Utilizar uma solução salina para resfriar uma mistura de açúcar, gorduras e água e
transformá-la em “sorvete”.
3. Metodologia: A Química do Sorvete*
O sorvete é um prato que consegue intensificar as notáveis qualidades do creme.
Entretanto, creme simplesmente congelado é duro. É o açúcar que o torna macio e fluido, pois
abaixa seu ponto de congelamento: são as moléculas de açúcar dissolvido que impedem as
moléculas de água de formar cristais ordenados. Assim, o creme adoçado congela a uma
temperatura muito inferior ao ponto de congelamento da água pura, o que significa que não
pode congelar na massa semiderretida que se forma quando um objeto morno é colocado em
contato com a neve ou o gelo. O que tornou possível a existência do sorvete foi uma pitada de
engenhosidade química. Quando se acrescentam sais ao gelo, eles se dissolvem nele, abaixam
seu ponto de congelamento e permitem que ele se torne suficiente para congelar o creme
adoçado. Desta forma, pode-se dizer que o sorvete é feito de três elementos básicos: cristais de
gelo, creme concentrado que os cristais deixam para trás quando se formam e minúsculas
células de ar constituídas quando a mistura é agitada durante o congelamento.
Os cristais de gelo se formam a partir de moléculas de água quando a mistura congela.
São eles que dão ao sorvete sua solide; são sua espinha dorsal. É o tamanho deles que determina
se o sorvete vai ficar macio e suave ou áspero e grosseiro. Porém, o gelo só corresponde a uma
pequena fração do volume do sorvete.
O creme concentrado é o que resta da mistura quando os cristais de gelo se formam.
Graças ao açúcar dissolvido, cerca de um quinto da água da mistura não congela nem mesmo a
– 18 oC. O resultado é um fluido muito espesso que contem proporções mais ou menos iguais
de água líquida, gordura do leite e açúcar. Este fluido reveste cada um dos milhões de cristais
de gelo e os coliga entre si – mas não com muita força.
As células de ar ficam presas na mistura de sorvete quando esta é agitada durante o
congelamento. As células interrompem e enfraquecem a matriz de creme e cristais de gelo,
tornando-a mais leve e mais fácil de pegar na colher e mastigar. As células de ar dão ao sorvete
um volume maior que o da mistura original. Esse processo é chamado aeração e, num sorvete
fofo, pode resultar num aumento de volume de mais de 100%, o que significa que o sorvete final
é metade mistura, metade ar. Quanto menos aerado, mais denso é o sorvete.
A preparação do sorvete tem três etapas básicas: preparação da mistura, congelamento
e endurecimento. A primeira etapa consiste em escolher os ingredientes básicos e combiná-los.
Uma vez preparada a mistura ela é pré-gelada para acelerar o posterior congelamento. Então, é
congelada o mais rápido possível num recipiente com paredes refrigeradas. É mexida para que
seja exposta por igual às paredes frias e, acima de tudo, para produzir uma textura lisa. O
resfriamento lento de uma mistura não agitada propicia a formação de poucos cristais de gelo,
os quais atingem tamanhos grandes, agregam-se e produzem uma textura áspera e quebradiça.
O resfriamento acelerado com agitação da mistura provoca a rápida formação de muitos cristais
“sementes”. Os quais, por partilharem entre si as moléculas de água disponíveis, não atingem
tamanho tão grande. A agitação também impede que os cristais se liguem uns aos outros
enquanto crescem, formando agregados que seriam percebidos pela língua.
Físico-Química
Experimental
FQE001
Exp. 02
Quando a mistura se torna espessa e difícil de agitar, somente metade da sua água se
solidificou em cristais de gelo. Nesse momento, a agitação é interrompida e o sorvete passa por
um período de congelamento inerte, durante o qual 40% da água migra para os cristais de gelo
já existentes. Se o endurecimento for lento, alguns cristais de gelo absorverão mais água que
outros, tornando a textura áspera. Para garantir que o endurecimento ocorra o mais rápido
possível, o sorvete recém congelado é repartido em vários recipientes pequenos, cuja área
superficial maior perderá calor com mais rapidez que a de um único recipiente grande.
*Adaptado de: “Comida & Cozinha: Ciência e Cultura da Culinária” de Harold McGee; São Paulo:
Editora WMF Martin Fontes, 2011.
4. Experimental
Materiais
2 sacos com fecho (tipo Ziploc) grandes, com capacidade de 4 L
2 sacos com fecho (tipo Ziploc) pequenos, com capacidade de 500 mL
1 balança (opcional)
1 par de luvas térmicas
Frascos medidores
Colheres (para experimentar)
Ingredientes
90g (1/3 de xícara) de creme de leite com alto teor de gordura
100g (1/2 xícara) de leite integral
20g (1,5 colher de sopa)de açúcar
¼ de colher (chá) de essência de baunilha (ou outro sabor a sua escolha)
600g de gelo
200g (1 – 2 xícaras) de sal
Procedimento
1. Encha cerca de 1/3 de um dos sacos plásticos grande com gelo (~600 g de gelo).
Adicione o sal ao gelo.
2. Em um saco plástico menor, adicione o creme de leite, o leite, o açúcar e o extrato
de baunilha (ou outro sabor). Sele o plástico tentando tirar o máximo de ar para
maximizar o contato com o gelo. Verifique que esteja bem selado.
3. Coloque o saco menor com os ingredientes do sorvete dentro do saco com gelo.
Coloque todo este pacote dentro de outro saco para evitar vazamentos.
4. Amasse ou gentilmente bata com o pacote numa superfície até o sorvete ficar
sólido. Se possível, tente fazer isso numa superfície gelada para o gelo não derreter.
Use luvas térmicas ou proteja as mãos com um pano para não congelar. A mistura
constante é a chave para atingir uma boa textura!
5. Remova o saco menor com o sorvete do saco com gelo. Abra-o cuidadosamente e
teste a consistência do sorvete com uma colher. Se parecer sólido e delicioso, está
pronto! Se ainda não estiver sólido o suficiente antes do gelo derreter, adicione mais
gelo e sal e repita o passo 4 até ficar pronto.
Físico-Química
Experimental
FQE001
Exp. 02
6. Discussão dos Resultados
Neste experimento foi observado a transição de fase bem conhecida do gelo para água
líquida. Uma mistura de água líquida e gelo em equilíbrio sempre terá a temperatura de fusão
da água, ou seja, ~0 oC na pressão atmosférica. Ao misturar sal (NaCl) no gelo, observa-se que a
temperatura da mistura diminui, efeito conhecido como abaixamento crioscópico ou crioscopia.
O abaixamento crioscópico foi utilizado para resfriar uma mistura de água, leite/creme
de leite e açúcar para transformá-la em sorvete. Desta forma, utilizou-se o abaixamento do
ponto de fusão da água em uma mistura de água e sal para controlar o congelamento de outra
mistura de água e açúcar. Discuta os procedimentos realizados e os resultados obtidos com base
na crioscopia.
Físico-Química
Experimental
FQE001
Exp. 02
Propriedades Coligativas
Pré-Laboratório
Nome:
1. Outra propriedade coligativa importante é a osmose. Explique o que é osmose e qual sua
importância para a bioquímica.
2. A adição de 100g de um composto a 750g de CCl4 provocou um abaixamento crioscópico de
10,5 K. Calcule a massa molar do composto.
3. O abaixamento do ponto de fusão da água foi obtido utilizando uma solução de NaCl e depois
esta solução refrigerante foi utilizada para congelar uma mistura de água e açúcar. Qual a
característica diferente nestes dois solutos que deve-se levar em consideração na hora de
calcular a constante crioscópica da água?
4. Com base no experimento para produção de sorvete e na relação na forma como a água é
congelada (resfriamento rápido ou lento), explique por que se observa a formação de cristais
de gelo em potes de sorvete que não foram bem acondicionados. O que tem que ser feito
para evitar essa cristalização?