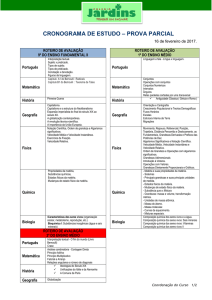
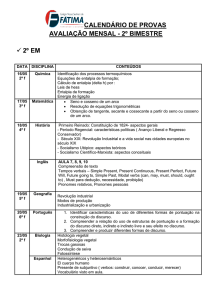
Aula 6 – Primeira Lei da Termodinâmica
1. Introdução
Como vimos na aula anterior, o calor e o trabalho são formas equivalentes de
transferência de energia para dentro ou para fora do sistema.
2. A Energia interna
A energia interna (U) mede as “reservas de energia” do sistema. A energia interna é
a soma de todas as contribuições de energia cinética e de energia potencial, de todos os
átomos, íons ou moléculas que formam o sistema, ou seja, é a energia total do sistema.
A energia interna é uma propriedade extensiva do sistema, por exemplo, 2 kg de ferro
tem duas vezes mais energia interna que 1 kg de ferro. Entretanto, a energia interna
molar, Um = U/n, ou seja, a energia interna por mol do material, é uma propriedade
intensiva que depende da temperatura e, em geral, da pressão (ou do volume).
Na prática não é possível medir a energia interna total de uma amostra, pois ela inclui
as energias cinética e potencial de todos os elétrons e de todos os componentes dos
núcleos atômicos. No entanto, é perfeitamente possível determinar variações de energia
interna, ∆U, pelo conhecimento da energia fornecida ou perdida como calor ou trabalho.
A variação de energia interna de um sistema é dada pela seguinte equação:
∆U = w + q
(7.1)
onde w é o trabalho e q é o calor trocados entre o sistema e a vizinhança.
Como já vimos nas aulas anteriores, uma característica de um gás ideal é ter a
energia total constante, com q = -w, numa expansão isotérmica. Ou seja, a energia
perdida como trabalho é recuperada com a entrada, na forma de calor, de energia no
sistema. Assim, podemos dizer que: Para a expansão isotérmica de um gás perfeito
∆U = 0.
63
Em outras palavras, a energia interna de uma amostra de um gás perfeito é
independente do volume que ele ocupa. Esta afirmação pode ser melhor compreendida se
observarmos que numa expansão isotérmica do gás, a distância média entre as moléculas
se modifica; entretanto, a velocidade média, portanto a energia cinética das moléculas, se
mantém constante. Como não há interação entre as moléculas, a energia total é
independente da separação média entre elas, e a energia interna permanece inalterada na
expansão.
Exemplo 1: Os nutricionistas estão interessados no uso da energia pelo corpo humano,
que pode ser considerado um “sistema termodinâmico”. Existem calorímetros construídos
para acomodar uma pessoa, a fim de medir a sua produção líquida de energia. Suponha
que, durante uma experiência, uma pessoa produz 622 kJ de trabalho numa bicicleta
ergométrica, e perde 82 kJ de energia sob a forma de calor. Qual é a variação de energia
interna da pessoa? Despreze qualquer perda de massa por transpiração.
Devemos inicialmente lembrar que quando o sistema perde energia, ou w ou q são
negativos. Quando o sistema ganha energia, ou w ou q são positivos.
Resp:
-622 kJ (622 kJ são perdidos como trabalho)
-82 kJ (82 kJ são perdidos como calor)
Assim:
∆U = w + q
∆U = (−622kJ ) + (−82kJ )
∆U = −704kJ
Podemos verificar então que a energia interna da pessoa diminui de 704 kJ. Essa
energia deverá ser reposta mais tarde, quando a pessoa se alimentar.
64
Exercício 1: Uma bateria elétrica é carregada pelo fornecimento de 250 kJ de energia na
forma de trabalho elétrico, mas há uma perda de 25 kJ de energia como calor, para as
vizinhanças, durante o processo. Qual a variação de energia interna na bateria?
Resp:
+250 kJ (entra no sistema “a bateria” como trabalho)
-25 kJ (são perdidos pelo sistema como calor)
∆U = w + q
Assim:
∆U = (+250kJ ) + (−25kJ )
∆U = +225kJ
Lembrar que é necessário colocar o sinal positivo antes do valor numérico, pois é
uma convenção que indica que o sistema está ganhando energia.
Uma importante característica da energia interna é que ela é uma função de
estado, ou seja, uma propriedade física que depende apenas do estado atual do sistema e
que é independente do caminho pelo qual o sistema atingiu esse estado. Assim, se
alterarmos inicialmente a temperatura do sistema, em seguida a sua pressão, e logo após
retornarmos aos valores iniciais de ambas as variáveis, a energia interna retorna ao seu
valor original.
O fato de a energia interna ser uma função de estado implica que a variação, ∆U,
da energia interna entre dois estados de um sistema é independente do caminho entre
eles.
Por exemplo: Ao comprimirmos um gás até que alcance uma certa pressão e depois o
resfriarmos até uma certa temperatura, a variação de energia interna tem um certo
valor. Por outro lado, se variarmos primeiro a temperatura e depois a pressão,
porém garantido que os valores finais das duas variáveis sejam os mesmos que no
primeiro experimento, então a variação de energia interna será exatamente a
mesma que no caso anterior.
65
Consideremos agora um sistema isolado. Como esse tipo de sistema não pode
realizar trabalho nem fornecer calor, a sua energia interna não pode ser modificada. Ou
seja: A energia interna de um sistema isolado é constante. Este é o enunciado da
Primeira Lei da Termodinâmica. Ele está intimamente relacionado à lei da conservação
da energia.
A evidência experimental da Primeira Lei é a impossibilidade de se construir um
“motor-contínuo de primeira espécie”, ou seja, um dispositivo que produz trabalho sem
consumo de combustível. Em outras palavras, não é possível produzir energia “do nada”.
A definição de ∆U em termos de w e q nos indica um método simples de se medir
a variação de energia interna de um sistema onde ocorre uma reação química. Já
discutimos que o trabalho feito por um sistema, quando a pressão externa é constante, é
proporcional a variação de volume. Portanto se realizarmos a reação em um recipiente de
volume constante, o sistema não consegue realizar qualquer trabalho de expansão, w = 0.
Assim a equação (7.1) é simplificada para:
A volume constante: ∆U= q
Segue-se então que para medirmos a variação de energia interna, devemos usar
um calorímetro que tenha um volume fixo, monitorando o calor liberado (q < 0) ou
fornecido (q > 0)
Exemplo 2: Uma reação em um calorímetro de volume constante que contém 0,100 L de
solução libera 1,78 kJ de calor e a temperatura aumenta de 3,65 ºC. Em seguida, 50 mL
de uma solução 0,20 mol/L de NaOH foram misturados no mesmo calorímetro e a
temperatura subiu 1,26 ºC. Qual é a energia interna da reação de neutralização?
Resp:
Primeira etapa: determinando a capacidade calorífica do calorímetro:
C=
q
1,78kJ
=−
= −0,488kJ .°C −1
∆T
3,65°C
66
Segunda etapa: determinar q para a reação de neutralização:
q = C ⋅ ∆T = −0,488kJ .°C −1 × 1,26°C = −0,614kJ
Como o processo ocorre a volume constante então ∆U = q = −0,614kJ e o sinal negativo
indica que a reação é exotérmica, ou seja, libera energia.
3. A Entalpia
A entalpia, H, de um sistema é definida por:
H = U + pV
(7.2)
Ou seja, a entalpia difere da energia interna pela adição do produto da pressão pelo
volume (pV) do sistema. Como o produto pV > 0, a entalpia é sempre maior que a energia
interna.
Assim como a energia interna, a entalpia é uma propriedade extensiva da
substância. A entalpia molar, Hm, é a razão da entalpia pelo número de moles: Hm=H/n.
A entalpia molar assim como a energia interna molar, Um, é uma propriedade intensiva da
substância e difere da energia interna molar por uma quantidade proporcional ao volume
molar, Vm. Assim:
H m = U m + pVm
(7.3)
Para um gás perfeito, podemos escrever: pVm = RT, de modo que:
H m = U m + RT (para um gás perfeito)
(7.4)
Essa relação mostra que a diferença entre a entalpia molar e a energia interna
molar de um gás perfeito aumenta com a temperatura.
Apesar de a entalpia e a energia interna de uma substância poderem ter valores
semelhantes, a introdução da entalpia tem conseqüências muito importantes na
67
termodinâmica. Primeiramente, notamos que H é definida em termos de funções de
estado (U, p e V), logo a entalpia é também uma função de estado. Isto significa que,
quando um sistema sofre uma mudança de estado, a variação de entalpia (∆H) é
independente do processo que liga o estado inicial ao estado final.
Exemplo 3: Um calorímetro, a volume constante, mostrou que a perda de calor que
acompanha a combustão de 1,0 mol de moléculas de glicose na reação:
C6H12O6 (s) + 6 O2 (g) → 6 CO2 (g) + 6 H2O (g)
é 2.559 kJ em 298 K, ou seja, ∆U = -2.559 kJ. Qual é a variação de entalpia da mesma
reação?
∆n gás = n final − ninicial
∆n gás = 12 − 6
∆n gás = +6mol
∆H = ∆U + ∆n gás RT
∆H = −2.559kJ + [6moles × 8,31451J .K −1 .mol −1 × 298K
∆H = −2.559kJ + 1,49 × 10 4 J = −2.559kJ + 14,9kJ
∆H = −2.544kJ
Transferência de calor a pressão constante;
Considerando um sistema aberto para a atmosfera, de modo que a sua pressão é
constante e igual à pressão externa, pex. Inicialmente a entalpia pode ser expressa como:
H i = U i + pVi
(7.5)
Após ter ocorrido uma reação química ou outro processo qualquer a pressão constante, a
energia interna e o volume do sistema são diferentes, e a entalpia pode ser expressa
como:
H f = U f + pV f
68
(7.6)
Assim, a variação de entalpia é a diferença entre essas duas quantidades:
∆H = H f − H i = U f − U i + p (V f − Vi )
(7.7)
ou
∆H = ∆U + p∆V
(7.8)
Entretanto, sabemos que a variação de energia interna é dada pela equação: ∆U = q + w ,
com w = − p ex ∆V . Quando substituímos essas expressões na equação (7.8) temos:
∆H = (− p ex ∆V + q ) + p∆V
(7.9)
Neste ponto, escrevemos pex = p (pois o sistema e a vizinhança estão na mesma pressão),
o que resulta em:
∆H = (− p∆V + q ) + p∆V = q
(7.10)
Podemos, portanto, concluir que, com a entalpia definida pela equação (7.2), a variação
de entalpia é igual ao calor absorvido a pressão constante:
A pressão constante: ∆H = q
(7.11)
O resultado expresso pela equação (7.11) nos diz que: a pressão constante, o calor
transferido pode ser identificado com a variação de entalpia do sistema. Esta informação
é de grande importância, pois relaciona algo que podemos medir (a transferência de calor
a pressão constante) com a variação de uma função de estado (a entalpia).
Assim, uma reação endotérmica (q > 0), que ocorra com uma pressão constante,
resulta em um aumento da entalpia (∆H > 0) porque a energia entra no sistema como
calor. Por outro lado, um processo exotérmico (q < 0) e que ocorra a pressão constante
corresponde a uma diminuição de entalpia (∆H < 0) porque a energia deixa o sistema
como calor.
69
4. A variação da entalpia com a temperatura
Como já vimos a energia interna de um sistema aumenta com o aumento da
temperatura e o mesmo acontece com a entalpia. Para encontrar a relação entre a variação
de entalpia e a variação de temperatura, combinamos o fato de que ∆H = q, a pressão
constante, com a definição da capacidade calorífica a pressão constante, Cp (a expressão:
q = Cp∆T). Se a capacidade calorífica for considerada constante na faixa de temperatura
de interesse, segue-se que:
∆H = C p ∆T
(7.12)
Exemplo 4: Quando a temperatura de 100 g de água (5,55 moles de H2O) aumenta de 20
ºC para 80 ºC (∆T = +60 K), a pressão constante, a entalpia da amostra varia de quanto?
Resp:
∆H = C p ∆T
∆H = nC p ,m ∆T
∆H = 5,55moles × 75,29 J .K −1 .mol −1 × 60 K = +25kJ
Relação entre as capacidades caloríficas:
A energia interna molar e a entalpia molar de um gás perfeito estão relacionadas
pela equação (7.4), que pode ser escrita como:
H m − U m = RT
(7.13)
Quando a temperatura aumenta de T, a entalpia molar aumenta de ∆Hm e a energia
interna molar de ∆Um, de modo que:
∆H m − ∆U m = R∆T
(7.14)
Dividindo ambos os lados da equação por ∆T, obtemos:
∆H m ∆U m
−
=R
∆T
∆T
70
(7.15)
O primeiro termo do lado esquerdo da equação é o coeficiente angular da curva que
representa a entalpia molar em função da temperatura, ou seja, é a capacidade calorífica
molar a pressão constante, Cp,m;
O segundo termo é o coeficiente angular da curva que representa a energia interna em
função da temperatura, a capacidade calorífica molar a volume constante, CV,m. Assim
essa relação pode ser escrita como:
C p , m − CV , m = R
(7.16)
A equação acima nos mostra que a capacidade calorífica molar de um gás perfeito
é maior a pressão constante que a volume constante. Essa diferença é esperada, uma vez
que, a volume constante, todo o calor fornecido ao sistema fica dentro dele, provocando
um aumento de temperatura, mas a pressão constante, uma parte da energia fornecida
como calor escapa para a vizinhança como trabalho, quando o sistema se expande.
Assim, o sistema fica com menos energia que no primeiro caso, de forma que sua
temperatura não se eleva tanto; isto corresponde a uma capacidade calorífica maior. Essa
diferença é significativa para os gases que sofrem grandes mudanças de volume quando
aquecidos, mas é desprezível para a maioria dos sólidos e líquidos.
71
Exercícios – Lista 5
Considere todos os gases como perfeitos, a menos que exista informação em contrário.
1. A capacidade calorífica do ar é muito menor do que a da água, e é necessária uma
pequena quantidade de calor para alterar a sua temperatura. Esta é uma das razões
de os desertos serem tão frios à noite, apesar de muito quentes durante o dia. A
capacidade calorífica do ar, a pressão e temperatura ambiente, é de
aproximadamente 21 J.K-1. mol-1. Que energia é necessária para elevar de 10 ºC a
temperatura de uma sala de 5,5 m x 6,5 m x 3,0 m? Quanto tempo levaria um
aquecedor com potência igual a 1,5 kW para provocar essa elevação de
temperatura ( 1 W = 1 J.s-1).?
2. Num experimento realizado para se determinar o valor calórico de um alimento,
uma amostra foi queimada numa atmosfera de oxigênio e a temperatura do
calorímetro subiu 2,89 ºC. A passagem de uma corrente de 1,27 A, a partir de uma
fonte de 12,5 V, no mesmo calorímetro, por um tempo de 157 s, elevou a
temperatura em 3,88 ºC. Qual o calor liberado pela combustão do alimento?
3. A transferência de energia de uma região da atmosfera para outra é de grande
importância em meteorologia, pois afeta as condições do tempo. Calcule o calor
que deve ser fornecido a uma parcela de ar contendo 1,00 mol de moléculas para
manter sua temperatura em 300 K durante uma ascensão, quando se expande,
reversível e isotermicamente, de 22,0 L para 30,0 L.
4. Um animal de laboratório é obrigado a se exercitar numa esteira ergométrica
acoplada a um sistema de roldanas. Durante o exercício o animal consegue erguer
uma massa de 200 g a uma altura de 1,55 m; para tanto, perde 5,0 J de energia
como calor. Desprezando-se outras perdas e considerando o animal como um
sistema fechado, qual é a variação de sua energia interna?
72
5. Um calorímetro de pequeno porte foi vedado para estudo do metabolismo de um
organismo. Na fase inicial do experimento, uma corrente de 15,22 mA, de uma
fonte de 12,4 V, passou por 155 s, por uma resistência existente dentro do
calorímetro. Qual é a variação da energia interna do calorómetro?
6. O dióxido de carbono, ainda que em pequena quantidade na atmosfera,
desempenha importante papel na determinação das condições do tempo e na
composição e temperatura da atmosfera. (a) Calcule a diferença entre a entalpia
molar e a energia interna molar do dióxido de carbono, considerando como gás
perfeito, a 298,15 K. (b) A entalpia molar aumenta ou diminui se considerarmos
as forças intermoleculares? Para esse cálculo, considere o dióxido de carbono
como um gás de Van der Vaals e use os dados da tabela abaixo:
Parâmetros de Van der Waals dos gases
a (L2.atm.mol-2)
Amônia
b (L.mol-1)
4,17
0,037
1,4
0,039
Argônio
1,35
0,032
Dióxido de carbono
3,59
0,043
Etano
5,49
0,064
Eteno
4,47
0,057
Hélio
0,034
0,024
Hidrogênio
0,244
0,027
Nitrogênio
1,39
0,039
Oxigênio
1,36
0,032
Xenônio
4,19
0,051
Ar
73
7. Uma amostra de soro sanguíneo, de massa igual a 25 g, é resfriada de 290 K a 275
K, a pressão constante, retirando-se dela 1,2 kJ de energia sob a forma de calor.
Calcule q e ∆H, e estime a capacidade calorífica da amostra.
8. Quando 3,0 moles de O2 (g) são aquecidos a pressão constante de 3,25 atm, sua
temperatura aumenta de 260 K para 285 K. A capacidade calorífica molar do
O2(g), a pressão constante, é de 29,4 J.K-1.mol-1. Calcule q, ∆H e ∆U.
9. A capacidade calorífica molar a pressão constante do dióxido de carbono é 29,14
J.K-1.mol-1. Quanto é sua capacidade calorífica molar a volume constante?
10. Use a informação do exercício anterior para calcular a variação (a) da entalpia
molar, (b) da energia interna molar, quando o dióxido de carbono é aquecido de
15 ºC (a temperatura média em que o ar é inalado) até 37 ºC (a temperatura do
sangue e dos pulmões).
Respostas:
1º) 6,1 x 102 s
2º) 1,86 x 103 J
3º) 773 J
4º) -8,0 J
5º) 29,3 J
6º) (a) 2,479 kJ.mol-1 ; (b) diminui
7º) q = ∆H =-1,2 kJ; e C = 80 J.K-1
8º) q = +2,2 kJ, ∆H = +2,2 kJ e ∆U = +1,6 kJ
9º) 20,83 J.K-1.mol-1
10º) ∆Hm = 641 J.mol-1; ∆Um = 458 J.mol-1
74