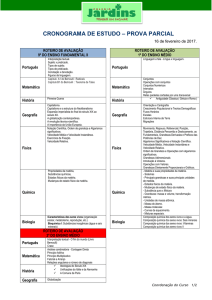
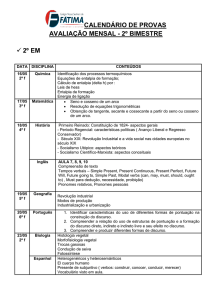
Entalpia
1
Entalpia
Entalpia, por vezes referida como entalpia
absoluta, é uma grandeza física definida no
âmbito da termodinâmica clássica de forma que
esta meça a máxima energia de um sistema
termodinâmico, teoricamente passível de ser deste
removida na forma de calor. É particularmente
útil na compreensão e descrição de processos
isobáricos [1]: à pressão constante as variações de
entalpia encontram-se diretamente associadas às
energias recebida pelo sistema na forma de calor,
estas facilmente mensuráveis em calorímetros.
Conforme definida, a entalpia engloba em si não
apenas a energia interna do sistema mas também
a
energia
armazenada
no
conjunto
sistema-vizinhança que, absorvida pelo sistema
via trabalho realizado pela vizinhança sobre este
em processos termodinâmicos que impliquem a
diminuição de seu volume, também integra uma
parcela de energia passível de ser extraída na
forma de calor a partir do referido sistema. A
entalpia mensura pois a totalidade de energia de
alguma forma atrelada ao sistema - incluindo-se
nesta não apenas a energia encerrada no sistema
como também a energia atrelada ao sistema em virtude das relações que este estabelece com a sua vizinhança.
Em acordo com o apresentado, a entalpia absoluta ou simplesmente entalpia, H, define-se por:
onde U representa a energia interna do sistema e PV mensura a quantidade de energia associada ao conjunto
sistema-vizinhança devido ao fato do sistema ocupar um volume V quando submetido à pressão constante P, ou seja,
o máximo trabalho executável pela vizinhança sobre o sistema.
Embora as entalpias absolutas - assim como as energias internas absolutas - não desempenhem papel de maior
relevância na análise prática de processos físico-químicos - sendo em verdade experimentalmente muito complicadas
suas precisas determinações - as variações de entalpia são contudo facilmente mensuráveis via aparelhos conhecidos
como calorímetros e estas sim desempenham papel o mais importante na análise dos citados processos. Na prática é
a variação de entalpia
em um dado processo termodinâmico - ou seja, a diferença entre as
entalpias do estado final
e do estado inicial
visto ser a entalpia uma função de estado -, e não a entalpia em
si, que retém real significado físico e prático: a variação de entalpia mensura o calor absorvido pelo sistema durante
os processos termodinâmicos provido que estes realizem-se à pressão constante.
A entalpia-padrão de um sistema corresponde à entalpia do sistema antes descrita subtraída de uma constante
adequadamente escolhida de forma a ter-se a entalpia-padrão de um sistema em particular - adequadamente
escolhido para constituir um padrão universal de referência - propositalmente definida como zero. A definição de
entalpia-padrão faz-se por razões práticas e não acarreta implicação alguma na determinação das variações de
entalpia em processos termodinâmicos visto serem as suas variações iguais às respectivas variações de entalpia
absoluta (
). Assim sendo, define-se de forma universalmente aceita que toda substância simples em
Entalpia
2
estado padrão - ou seja, no estado físico e alotrópico mais estável a 25°C e 1 atm., tem entalpia-padrão por definição
igual a zero - mesmo não sendo nula sua entalpia absoluta em tal estado. Determinar a entalpia-padrão de um estado
particular de um sistema consiste pois em determinar a variação de entalpia em um processo qualquer que tenha por
estado final o estado em consideração e que tenha por estado inicial sempre o estado padronizado associado. O
estado inicial padrão constitui uma referência para a medida de entalpia, e a partir desta referência determinam-se
doravante com facilidade as entalpias-padrão de todos os demais compostos químicos ou estados. Em particular,
dá-se o nome de entalpia de formação à entalpia-padrão de uma substância pura composta; o que corresponde, dada
a aplicação da definição de entalpia padrão ao caso, à variação de entalpia associada à reação que tem por estado
inicial os elementos necessários à produção do composto - este em sua forma padrão - e por estado final apenas a
substância composta em consideração - nas condições específicas à situação. As entapias-padrão das substâncias
compostas - as entalpias de formação - são as entalpias que encontram-se geralmente tabeladas em livros e manuais,
não raro figurando junto às variações de entalpias para reações químicas específicas.
No Sistema Internacional de Unidades a unidade da entalpia é o joule (J). Ao passo que na literatura a entalpia
absoluta é geralmente representada pelo símbolo H, a entalpia-padrão encontra-se geralmente representada pelo
símbolo H 0.
Quando expressa em função da entropia S, número de elementos N, e da pressão P - para o caso de sistemas
termodinâmicos mais simples - a entalpia
é, assim como o são as respectivas Transformadas de
Legendre associadas, a saber a Energia livre de Helmholtz
e a energia interna
, a Energia livre de Gibbs
, uma equação fundamental para os sistemas termodinâmicos
em consideração. A partir de uma equação fundamental é possível via formalismo matemático inerente à
termodinâmica obter-se qualquer informação física relevante para o sistema por ela descrito. Se a entalpia
encontrar-se expressa em função de outras grandezas que não as mencionadas, esta constituirá apenas uma equação
de estado e não em uma equação fundamental. Uma equação de estado não encerra em si todas as informações
acerca do sistema; contudo a partir de todas as equações de estado do sistema é possível deduzir-se uma equação
fundamental, e em consequência, via transformadas de Legendre, todas as demais [2].
Definição
Quando um sistema imerso em um ambiente à pressão constante sofre um processo qualquer, indo de um estado
inicial "i" para um estado final "f", a quantidade de energia trocada com a vizinhança na forma de trabalho é definida
apenas pela variação de volume
sofrida pelo sistema e pela pressão P do ambiente constate
durante todo o processo. A quantidade de trabalho W realizada pelo sistema sobre a vizinhança sob pressão
constante é determinável através da expressão:
É de interesse mensurar neste tipo de transformação a quantidade de calor trocada entre o sistema e sua vizinhança.
Ao ceder-se certa quantidade de calor ao sistema, este expande-se, realizando um trabalho W sobre a vizinhança. A
energia entregue à vizinhança - e que por tal abandona o sistema - é transferida às custas de parte do calor que entra
no sistema, de forma que apenas parte do calor transferido ao sistema implica real aumento na energia interna deste
sistema. A lei da conservação da energia fornece:
Como a energia interna e o volume do sistema são funções de estado, segue-se que nestes processos a quantidade de
calor trocada também é uma função de estado. A expressão acima permite a definição de uma grandeza física
conhecida por entalpia H de forma que:
Decorre que a entalpia pode ser definida pela função de estado introduzida por Josiah Willard Gibbs:
Entalpia
3
onde U é a energia interna do sistema e PV é o produto da pressão pelo volume do sistema (e da vizinhança), ou seja,
a energia armazenada no conjunto sistema vizinhança.
Conforme definida, a variação da entalpia implica pois a expressão antes apresentada para a conservação da energia:
A entalpia, por ser - assim como a energia interna e o trabalho - uma grandeza associada à medida de energia, é por
tal também medida em joules.
É aqui importante ressaltar-se que a variação da entalpia em um dado processo corresponde sempre à entalpia do
estado final menos a entalpia do estado inicial atrelados ao referido processo, e que em equações químicas esta
corresponde pois a entalpia do estado onde tem-se os produtos menos a entalpia do estado onde tem-se os reagentes (
).
Partindo-se do fato que a expressão da energia interna
é uma equação fundamental para o sistema e assim
o sendo encerra em si todas as informações acerca do comportamento deste, é de se esperar que seja possível,
partindo-se desta expressão, inferir o comportamento do correspondente sistema à pressão constante, e por tal
derivar-se da primeira a expressão para
aplicada à energia interna
. Em acordo com o estabelecido pela Transformada de Legendre
, a fim de constituir também uma equação funcamental, a entalpia
deve figurar em função, entre outras se houver, das grandezas extensivas entropia S, quantidade de matéria N, e da
grandeza intensiva pressão P, devendo a correspondente grandeza extensiva conjugada à pressão - o volume V - ser
substituída em
mediante a relação [3] :
.
Caso a entalpia figure em função de demais grandezas que não as citadas, a exmplo em função da temperatura T ou
mesmo do volume V, tal expressão não constituirá uma equação fundamental para o sistema, caracterizando-se então
apenas como uma equação de estado.
A tabela que se segue apresenta os passos a serem seguidos a fim de se obter a entalpia
interna
a partir da energia
, e vice versa mantidas as condições para que ambas figurem como equações fundamentais.
Transformadas de Legendre na Termodinâmica - Entalpia, partindo-se de
Determinar
e
Eliminação de U e V fornece:
Entalpia H
:
Entalpia
4
Transformadas de Legendre em Termodinâmica - Entalpia H - Para chegar-se a
Determinar
:
e
Eliminação de P e H fornece:
Energia Interna U
• Exemplo
A equação fundamental para a Entalpia de um gás monoatômico ideal é, com
sendo uma constante com dimensão
adequado ao ajuste correto da análise dimensional :
[4]
Esta equação pode ser obtida a partir da equação fundamental para a energia interna
seguindo-se os passos
na parte superior da tabela apresentada, ou a partir dela pode-se obter a energia interna seguindo-se os passos na
parte inferior da tabela em questão. Os cálculos associados são apresentados no artigo relacionado à Transformada
de Legendre na presente enciclopédia. A título ilustrativo a energia interna para o sistema em questão expressa-se
como:
A equação anterior pode facilmente ser reescrita a fim de tornar-se similar à encontrada em outros artigos da
wikipédia. Uma vez suprimindas constante(s) com unidade(s) definida(s) de forma a tornarem correta a análise
dimensional [5], esta apresentar-se-á como abaixo:
[6]
Variação de entalpia
A variação de entalpia (
) em transformações fisico-químicas é geralmente expressa de forma
proporcional à quantidade de matéria envolvida na reação, ou seja, proporcional ao número de mols envolvidos no
processo. A exemplo, na reação termoquímica a seguir, a variação da entalpia (-241,2 kJ/mol) corresponde à
variação de entalpia mensurada quando meio mol de
reage com um mol de
dando como resultado um mol
de
.
Quanto ao sinal do
, observar-se-á que, em:
• Reações exotérmicas:
• Reações endotérmicas:
. Há liberação de calor do sistema para a vizinhança.
. Há uma absorção de calor pelo sistema.
As variações de entalpia em reações químicas podem ser mensuradas via medida do calor absorvido ou liberado na
reação, sendo o procedimento experimentalmente levado a cabo em aparelhos conhecidos como calorímetros.
É importante mencionar que as variações de entalpia absoluta
e entalpia padrão
entalpia absoluta menos uma constante C adequadamente escolhida (
iguais. Tal igualdade é facilmente demonstrável a partir da definição desta última:
- esta definida como a
; ver próxima seção) - são
Entalpia
5
assim, ao falar-se em variação, tanto faz falar-se da variação da entalpia-padrão ou falar-se da variação da entalpia
absoluta. Fala-se pois simplesmente em variação de entalpia
.
Entalpia, e entalpias
Em fundamento tem-se apenas uma entalpia, a antes definida entalpia absoluta - ou simplesmente entalpia. Contudo,
dado um conjunto de situações específicas e similares, pode-se estabelecer "entalpias" também específicas ao
conjunto, que não obstante carregam em seu nome a descrição da característica comum. Assim tem-se por exemplo a
entalpia-padrão já discutida, a entalpia de formação, a entalpia de combustão, de vaporização, de dissolução, e quem
sabe outras mais. Contudo todas [7] remontam, em essência e sem restrições, à definição inicial de entalpia absoluta quando muito aparte alguma constante sem qualquer implicação prática - e à determinação das variações de entalpia
ao longo dos processos que levam do estado inicial ao final. Assim, a "entalpia de combustão" nada mais é do que a
variação de entalpia observada entre o estado inicial - neste caso definido como sendo um combustível + comburente
- e o estado final - neste caso o produto da combustão, geralmente gás carbônico e água no caso da queima de
hidrocarbonetos. As demais "entalpias" seguem o mesmo padrão.
Entalpia-padrão
Teoricamente, o cálculo do valor do
dos reagentes (
) e dos produtos (
só seria em princípio possível se fossem conhecidas as entalpias absolutas
) visto que
. Tais valores absolutos, entretanto,
são praticamente impossíveis de serem diretamente mensurados experimentalmente dado a utopia prática de um
sistema de referência em um estado de entalpia absoluta zero. Na prática tem-se em verdade não há ganho ou
obrigatoriedade alguma de que as entalpias a serem consideradas no cálculo sejam as entalpias absolutas dos estados
do sistema. Tal consideração decorre do fato que, experimentalmente, com o uso do calorímetro, só é possível
obterem-se os valores das variações
devido às transformações do sistema visto que o calorímetro permite
mensurar apenas o calor perdido ou recebido pelo sistema durante uma dada transformação, mas não a energia
interna e a energia associada ao volume sob pressão de um estado particular do sistema. As variações de entalpia
correspondem pois às grandezas experimentalmente mesuráveis e de relevância.
Em vista da situação há pois uma liberdade de escolha quanto ao "nível" de referência ao qual associar-se-á por
definição um valor de entalpia nulo visto que não há razão prática alguma que acarrete a necessidade da entalpia
"zero" encontrar-se obrigatoriamente associada - como encontra-se na definição de entalpia absoluta - a um estado
do sistema à temperatura de zero kelvins e cujos volume e energia interna clássicos sejam nulos - ou seja, ao estado
naturalmente determinado para o qual a entalpia absoluta é nula. De forma similar ao que ocorre com a determinação
de diferenças de alturas, onde o valor obtido para a espessura ("altura") de uma mesa - ou seja, a diferenças de
alturas entre o topo e o pé da mesa - independe do nível de referência escolhido para medirem-se as alturas a serem
subtraídas - podendo estas serem medidas tanto em relação o piso da sala como em relação o nível do mar sem
contudo afetar-se o resultado de interesse prático - pode-se em princípio também escolher um nível de referência
qualquer a partir do qual as entalpias serão mensuradas e a partir dos quais as variações de entalpia sejam sempre
corretamente determináveis.
Embora a escolha do "nível" de referência seja em princípio livre, é extremamente valioso que este estabeleça-se um
padrão experimentalmente bem definido e que seja por todos facilmente reprodutível e universalmente reconhecido,
de forma a permitir a fácil determinação dos valores de entalpia para as mais variadas substâncias puras compostas
visto que isso certamente facilitará muito o cálculo teórico do
nas milhares de transformações químicas
existentes bem como o intercâmbio de dados e resultados práticos entre profissionais dos mais diversificados ramos
de atividade pertinentes. A fim de estabelecer tal nível de referência padrão determinaram-se primeiramente, entre
outros, as condições físico-químicas de referência para os quais a entalpia - esta doravante nomeada entalpia-padrão
- será definida como zero. Convencionou-se, entre outros, que constituir-se-á o sistema de referência por todas
Entalpia
6
as substâncias simples, e que o estado padrão será o estado físico e alotrópico mais estável destas substâncias à
temperatura de 25°C e pressão de 1 atm.. A partir desta definição, mensurada a variação de entalpia em qualquer
processo que leve o sistema das condições de referência - a justaposição para reação da mistura de substâncias
simples - a um estado final em particular - a substância composta formada - foi e é possível determinar-se a
entalpia-padrão associada a qualquer estado final desejado, e de forma recorrente, as entalpias-padrão e variações de
entalpia para as mais diversas reações, mesmo para aquelas envolvendo várias substâncias puras ou mesmo
compostas atuando tanto como reagentes quanto como produtos. Tais entalpias-padrão, ou suas variações - cujos
valores coincidem com as variações de entalpia absoluta - encontram-se desta forma tabeladas em muitos livros de
química e física para as mais diversas substâncias e reações químicas.
Tem-se pois que pela definição as entalpias-padrão do hidrogênio (
), do oxigênio (
) ou do grafite (C)
quando nas condições padrão, ou seja, a 25°C de temperatura e 1 atm. de pressão, são por definição, zero. O mesmo
já não ocorre para o diamente (carbono em estado alotrópico menos estável),
(substância composta) e outras,
mesmo que nas condições padrão de temperatura e pressão.
É conveniente explicitar-se que, conforme definidas, a entalpia absoluta e a entalpia-padrão diferem entre si por uma
mera subtração de um valor adequadamente escolhido para cada situação:
onde C representa uma constante.
Uma vez estabelecido o padrão de referência e uma forma de mensurarem-se as entalpias-padrão dos sistemas nos
seus diversos estados, mostra-se também válido estabelecer alguns conceitos de utilidade prática derivados, a exmplo
os conceitos de entalpias de formação e de entalpia de combustão das substâncias.
Entalpia de formação
Refere-se à energia liberada ou absorvida quando um mol de um composto se forma a partir de substâncias simples
no estado padrão - as quais têm entalpia-padrão por definição igual a zero.[8]
Exemplo:
A equação acima indica que a entalpia de formação do etanol :
, é igual a -277,7 kJ. Repare que a
reação é exotérmica: energia é liberada na formação de etanol a partir das substâncias simples associadas.
Entalpia de combustão
Refere-se à energia liberada na combustão de um mol de um composto; desde que todos os participantes da reação
estejam no estado-padrão.
Exemplo:
A equação acima indica que a entalpia de combustão do metano :
, é igual a -889,5 kJ. Assim como o que
se observa na reação de formação do metano, a reação de combustão do metano também é exotérmica.
Entalpia
7
Entalpia de ligação
Outra forma de calcular a variação de entalpia de uma reação química envolve o conceito de energias de ligação, ou
seja, aquela relacionada à variação da energia potencial associada à força que une os átomos: entalpia de ligação é a
energia necessária para romper um mol de ligações químicas entre pares de átomos no estado gasoso.
É importante ressaltar que a entalpia de ligação será sempre positiva visto que, pela definição, a exemplo do
hidrogênio, tem-se a seguinte ordem entre reagente e produto:
e não o contrário
(incorreto)
.
Considerando que a quebra de ligações é um processo endotérmico, e que a formação de ligações é um processo
exotérmico, uma forma prática de calcular-se o
de uma reação química é a partir dos valores de energia
liberada na quebra de ligações e absorvida na formação de novas ligações. Para tanto, faz-se necessário conhecer as
entalpias de ligação para cada ligação específica entre cada par de átomos específico. Calcula-se, então, a variação de
entalpia pela diferença entre as entalpias de ligação das ligações rompidas e as entalpias de ligação das ligações
formadas [9]. Contudo é demonstrável que este método fornece resultados mais para aproximados do que para exatos
visto que a energia de uma dada ligação é influenciada pela existência ou não bem como pela natureza das demais
ligações sendo realizadas por um ou mesmo pelo par de átomos em consideração. Verifica-se que, por razões
práticas, as entalpias de ligação associadas a uma dada ligação refletem em verdade uma média para as diversas
situações tipicamente encontradas. Um tratamento via entalpias de ligação de um dado átomo a grupos
termoquímicos específicos melhora a situação mas não remove completamente a imprecisão [10].
Encontram-se com facilidade na literatura tabelas contendo as entalpias de ligação para as mais variadas ligações. A
partir das mesmas é possível fazer-se uma estimativa das variações de entalpia em processos envolvendo reagentes e
produtos definidos por tais ligações. A exemplo, pode-se determinar a variação de entalpia associada à reação
(∆H=?):
uma vez conhecidos as entalpias de ligação [11]:
Entalpias de Ligação HL
C-H
+413,4 KJ/mol
O=O +468,6 KJ/mol
C=O +804,3 KJ/mol (para CO2)
H-O +463,5 KJ/mol
Vistos que todos os elementos encontram-se no estado gasoso, assumidos nas condições normais de temperatura e
pressão, pode-se determinar a requisitada variação de entalpia, que corresponde à entalpia do estado final (produtos)
menos a entalpia do estado inicial (reagentes) de duas maneiras [12] :
1) Pela diferença entre as entalpias de formação ∆H 0F (= H0F) dos produtos e dos reagentes.
2) Pela diferença entre as entalpias de ligação ∆HL (= HL) das ligações rompidas e das ligações formadas.
Como dispõe-se das entalpias de ligação, sendo este o caso em consideração, aplicar-se-á a regra 2. Tem-se assim:
a) Ligações a serem quebradas: 4 mols de ligações C-H para desfazer-se o metano, 2 mols de ligações O=O para
desfazerem-se os dois mols de O2.
Tem-se que a soma das entalpias de ligação para as ligações a serem quebradas vale:
= 4 mols * (+413,4 KJ/mol) + 2 * + (468,6 KJ/mol) = 2590,8 KJ
Entalpia
8
b) Ligações a serem formadas: 2 mols de ligações C=O formam 1 mol de CO2 ; 4 mols de ligações H-O formando 2
mols de H2O.
Tem-se que a soma das entalpias de ligação associadas às ligações que serão formadas vale:
A variação de entalpia para a reação inicial de combustão do metano vale, segundo a regra 2, a diferença entre as
entalpias de ligação quebradas [
], cuja soma foi determinada no caso (a), e as entalpias de
ligações formadas [
], cuja soma foi determinada em (b). Tem-se pois que:
= 2590,8KJ – 3462,6 KJ = - 871,8 KJ
de onde
A reação é exotérmica visto que a variação de entalpia é negativa, conforme esperado por se tratar da combustão do
metano, e libera aproximadamente 871,8 KJ de energia via calor. A entalpia do estado final é cerca de 871,8 KJ
menor do que a entalpia do estado inicial.
Entendendo os cálculos
O mecanismo em questão para o cálculo de
, conforme apresentado, deriva, em verdade, da aplicação da lei de
Hess (ver seção a frente) a um conjunto de reações: para o presente exemplo, o primeiro somatório corresponde a
uma variação de entalpia associada à seguinte reação:
Em uma segunda etapa tem-se a reação:
cuja variação de entalpia é determinada pelo negativo do segundo somatório (-Σ HL(formadas)), visto que as ligações
são agora formadas e não quebradas.
Trata-se assim da decomposição da reação original em duas etapas levada a cabo via inserção de um estado
intermediário contendo elementos não ligados. Conforme esperado pelo fato da entalpia ser função de estado, a
variação de entalpia total será a soma das variações de entalpia associadas a cada etapa da reação, o que leva
corretamente, conforme esperado, a:
Entalpia de ligação ou energia de ligação?
Uma vez resolvido o problema conforme apresentado, de grande importância perceber que, embora seja verdade que
para determinarem-se as ligações a serem rompidas deva-se olhar sobretudo para o lado da equação correspondente
aos reagentes, e que para determinarem-se as reações a serem feitas deva-se olha prioritariamente para o lado da
equação correspondente aos produtos, a primeira somatória acima (a soma das entalpias de ligação para as ligações
quebradas,(Σ HL(rompidas)), não é um cálculo que fornece por resultado a entalpia HR - quer absoluta, quer padrão,
quer em relação a qualquer nível pré-estabelecido - do estado inicial (dos reagentes), ou seja, esta expressão não
representa o cálculo da entalpia do estado do sistema antes da reação; e que a segunda somatória em questão, (Σ
HL(formadas)), não é um cálculo válido acerca da determinação da entalpia do estado final HP - quer absoluta, quer
padrão, quer em relação a qualquer nível pré-estabelecido - ou seja, do estado associado aos produtos da reação,
quando já formados. A equação acima, por tal, não implica que esteja-se a fazer, a fim de determinar-se a variação de
entalpia ∆H na combustão do metano, “a diferença de entalpias dos reagentes e dos produtos (HR – HP)”, pois não se
está a determinar, com cada parcela da mesma, a entalpia dos reagentes, HR, e dos produtos, HP. Em verdade o
cálculo acima, após concluído, configura uma forma alternativa de determinar-se a variação da entalpia associada à
reação, ou seja, uma forma alternativa ao método tradicional onde faz-se - por definição de variação - o valor da
Entalpia
9
entalpia do estado final – dos produtos - menos a entalpia do estado inicial – dos reagentes.
Escreve-se corretamente pois que:
(correto)
e não que
(incorreto)
.
Poder-se-ia em princípio, contudo, a fim de evitar-se confusão certa quanto a não diferenciação explicita do "H" que
figura ante e dos "H" que figuram depois do sinal de igual na sentença anterior - e eles são diferentes, o primeiro
representando a entalpia do sistema e os demais entalpias de ligação - argumentar que embora a expressão anterior
não encontre-se escrita de forma correta, para uma dada reação qualquer esta contudo seria valida:
(inadequado,
embora
"aceita"
por
alguns
autores)
O problema com esta notação reside em um ponto bem simples: a ausência de referencial padrão teórico e
experimentalmente válio para a medida da "entalpia de ligação" a ser adotado em sua definição, ou seja, na tentativa
de definir-se uma nova função de estado para o sistema a ser nomeada "entalpia de ligação"
.
Não há dúvidas que a entalpia de ligação e tradicional devam ser definidas de formas distintas visto que, dados o
estado inicial e o estado final do sistema, o intuito é definir a entalpia de ligação de forma que um aumento em seu
valor (
implique necessariamente, conforme equação em parágrafo anterior, uma
diminuição da entalpia padrão (
), raciocínio pertinente visto que energia presa em uma
ligação é energia que não pode ser transferida na forma de calor.
Em hipótese a opção para referencial seria o estado intermediário inserido no processo a fim de suportar o raciocínio
sendo considerado, ou seja, seria o estado de referência um estado onde encontrar-se-iam apenas elementos isolados
- desprovidos de qualquer ligação. Definir-se a “entalpia de ligação” deste estado como zero, e por conseguinte, a
entalpia de ligação de um estado em particular seria definida, em acordo com a situação, como o negativo da
variação de entalpia (tradicional) associada à formação de um elemento via estabelecimento de ligações entre os
átomos avulsos em questão. Ter-se-ia pois a entalpia de ligação sempre positiva, e que
Ressalta-se que tal definição - que tenta ser condizente com a real definição de entalpia de ligação - seria contudo
apenas complicadora, visto que o estado contendo apenas átomos sem ligação, excetuado gases nobres, é
experimentalmente muito mais inacessível do que um sistema contendo elementos em estado padrão, e de forma
mais inquietante, que este estado, tipicamente embora não necessariamente, implica um estado do sistema fora de
seu equilíbrio termodinâmico. E para estados fora do equilíbrio não se definem os potenciais termodinâmicos, a
exemplo, uma entalpia.
Grosso modo, fazê-lo seria pois apenas - a menos de um sinal - dar nova definição à “entalpia-padrão” - mediante
mudança do nível de referência - de forma a apenas, em princípio, complicá-la teórica e experimentalmente.
Da forma que a entalpia de ligação é realmente definida - alguns autores mencionam apenas energia de ligação talvez
por esta razão - a entalpia de ligação não é propriedade de um estado em particular e sim uma propriedade de um
processo em específico onde há quebra de determinada ligação em particular, e em verdade, de forma mais detalhada
- onde há a quebra de ligação entre um radical e um elemento em particular. A proposta de notação
(inadequado, embora "aceita" por alguns autores)
é por tal, inadequada: busca expressar um raciocínio válido (a lei de Hess), contudo de forma infeliz.
Confirma-se tal afirmação observando que, embora uma variação na entalpia de ligação implique realmente uma
variação na entalpia-padrão do sistema, há diversos processos que implicam uma varaição da entalpia-padrão do
sistema sem que contudo estes impliquem uma variação na energia de ligação de seus componentes. A associação
conforme feita seria, pois, de mão única.
Entalpia
10
A alternativa para expressar-se o que realmente ocorre é definir-se uma energia de ligação - a nomear-se aqui por EL
de forma a nitidamente dissociar o conceito de energia de ligação do conceito de entalpia e conectá-lo ao conceito de
calor de reação, e afirmar que variações na energia de ligação, quando presentes, implicam variações
correspondentes na entalpia do sistema determináveis segundo a expressão:
(correto)
.
Não sendo a energia de ligação promovida ao status ou uma mera re-expressão de um potencial termodinâmico do
sistema, portanto.
Entalpia de dissolução
A dissolução de uma substância em água - principalmente para o caso das substâncias iônicas - ocorre sempre com
transferência de energia. Uma vez verificado que a maioria das reações químicas se processa em meio aquoso, a
compreensão acerca da entalpia de dissolução mostra-se importante à correta análise de tais processos.
Define-se a entalpia de dissolução como a variação de entalpia associada à dissolução de 1 mol de soluto em uma
quantidade de solvente maior ou igual à mínima necessária para que se tenha a máxima variação de entalpia no
processo, ou seja, para que se tenha a dissolução completa do soluto.
Um típico processo onde a entalpia de dissolução pode ser facilmente evidenciada refere-se à dissolução em água do
vulgo "percloreto de ferro" - corretamente cloreto férrico - frequentemente realizada por profissionais ou amantes de
eletrônica a fim de se obter uma solução adequadamente diluída de forma a poder ser utilizada no processo de
corrosão de placas de circuito impresso - placas de material isolante com uma fina camada de cobre em sua
superfície -, placas estas sobre as quais primeiro desenham-se e posteriormente à corrosão montam-se os circuitos
eletrônicos projetados. A dissolução deve ser feita vagarosamente tamanho é o aquecimento que a mesma provoca,
sempre jogando-se o percloreto na água, e nunca o contrário. A entalpia de dissolução para tal produto é
consideravelmente alta em módulo - contudo negativa em valor, visto que a dissolução é exotérmica.
Dependendo do espécime químico o processo de dissolução pode em si não ser muito simples, por vezes incluindo
várias etapas, as quais podem implicar em respectivas variações de entalpia com sinais trocados. A exemplo, durante
a dissolução de sólido iônico típico em água, em uma primeira etapa o cristal iônico é desfeito, e tal dissolução
requer energia, implicando que a etapa é endotérmica (
. Em uma segunda etapa cada um dos íons passa a
ser circundado por um número adequado de moléculas de água devidamente orientadas - processo conhecido como
hidratação das partículas - o qual é acompanhado de uma considerável liberação de energia, sendo por tal um
processo exotérmico que acarreta uma significativa diminuição da entalpia (
) [9]. O valor total da
entalpia de dissolução depende então de qual das partes irá predominar. Extrapolando o conceito, a exemplo, ao
contrário da dissolução de percloreto em água, a "dissolução" do sal de cozinha quando misturado com gelo
mostra-se consideravelmente endotérmica.
Entalpia de vaporização
A entalpia de vaporização ou calor de vaporização é a quantidade de energia necessária para que um mol de um
elemento ou de uma substância que encontre-se em equilíbrio com o seu próprio vapor passe completamente para o
estado gasoso. Supõe-se a pressão constante, por padrão 1 atmosfera ou em caso contrário conforme explicitamente
especificada. Maiores informações, e tabela de valores para as substâncias típicas encontram-se disponíveis no artigo
especialmente destinado ao assunto nesta enciclopédia eletrônica.
Entalpia
11
Entalpia de fusão
A entalpia de fusão ou calor de fusão é a quantidade de energia necessária para que um mol de um elemento ou
substância em equilíbrio com seu líquido passe do estado sólido para o estado líquido mantida a pressão constante,
usualmente definida como 1 atmosfera, ou conforme explicitamente especificada, em caso cantrário.
Maiores informações encontram-se disponíveis no artigo especialmente destinado ao assunto nesta enciclopédia
eletrônica.
Processos endotérmicos, exotérmicos, e espontaneidade
O processo endotérmico é aquele que ocorre com absorção de energia na forma de calor pelo sistema. Um exemplo
disso: se um pedaço de gelo for deixado sobre a mesa à temperatura ambiente, ele receberá energia na forma de calor
do ambiente e isso provocará a fusão do gelo. A transição da água no estado sólido para o estado líquido é um
processo em que há calor da vizinhança para o sistema, ou seja, é endotérmica.
Outro exemplo: quando um mol de óxido de mercúrio sólido se decompõe, à pressão constante, em um mol de
mercúrio líquido e meio mol de oxigênio gasoso, ocorre a absorção de 90,7 kJ de energia do ambiente.
Matematicamente:
Que também pode ser representada por:
O processo exotérmico é aquele que ocorre com liberação de energia na forma de calor para a vizinhança. Pode-se
citar o seguinte como exemplo: quando um sistema formado por água líquida é colocado em um congelador, ele
perde energia na forma de calor para esse ambiente e, em decorrência disso, ocorre a solidificação da água. Assim,
transição da água no estado líquido para o estado sólido é um processo em que há calor do sistema para a vizinhança:
é exotérmico.
Outro exemplo: quando um mol de hidrogênio gasoso reage, à pressão constante, com meio mol de oxigênio gasoso
para formar um mol de água líquida, ocorre a liberação de 285,8 kJ de energia para o meio ambiente.
Matematicamente:
Que também pode ser representada por:
Repare a correspondência entre os sinais das respectivas variações nas entalpias-padrão e a natureza da reação. Em
reações exotérmicas há calor do sistema para a vizinhança, o que implica que a entalpia final do sistema é sempre
menor do que a inicial; a diferença
será sempre negativa visto que
implica
. Raciocínio análogo acarreta que em reações endotérmicas a entalpia final é maior do que a inicial,
e a diferença
será sempre positiva em reações endotérmicas visto que
.
Relevante ao contexto é a falsa afirmação de que reações exotérmicas (
(
implica
) são espontâneas, e endotérmica
)não são espontâneas. A reação entre gelo e sal de cozinha é endotérmica, contudo espontânea. Embora
verdade para um grande número de situações, não é difícil encontrarem-se situações onde tal afirmação falha
drasticamente. Em condições ambientes o que determina a espontaneidade de uma reação ou processo não é o sinal
da variação da entalpia no processo e sim o sinal da variação da energia livre de Gibbs no processo a ser
desencadeado.
Entalpia
12
Fatores que influenciam o valor da variação de entalpia
• Quantidade de reagentes e produtos: o valor do
de uma reação varia em função da concentração de cada um
de seus participantes. O aumento da concentração provoca um aumento proporcional da variação de entalpia.
Exemplo:
• Os estados físicos dos reagentes e produtos: substâncias no estado sólido provocam variações de entalpia maiores
do que no estado líquido; e estas, maiores do que no estado gasoso.
Exemplo:
• Estado alotrópico de reagentes e produtos: cada estado alotrópico tem um valor de entalpia distinto.
Exemplo:
• Temperatura.
Uma reação exoenergética em uma dada temperatura pode mostrar-se endoenergética em outra temperatura, de
forma que as temperaturas dos reagentes e produtos devem - quando fora do padrão - serem especificadas.
Lei de Hess
Em 1840, um físico chamado Germain Henry Hess, com base em seus estudos sobre calores de reação, descobriu
que, de um modo geral, quando uma reação se dá em etapas, a soma dos calores de reação correspondentes aos
diversos estágios é igual ao calor de reação obtido quando a reação é realizada completamente em uma só etapa.
Então, enunciou sua lei: "Quando uma reação química apresenta etapas intermediárias, a variação de entalpia da
reação geral equivale à soma das variações de entalpia de cada uma das etapas intermediárias". A lei de Hess
implica a verificação experimental de que a entalpia é uma função de estado, ou seja, de que a variação da entalpia
depende em um sistema depende apenas dos estados inicial e final do sistema - sendo sempre determinável pela
diferença
- isto de forma independente de como o sistema evoluiu do estado inicial "i" para o
estado final "f". Dados os mesmos estados incial e final a variação de entalpia total observada será sempre a mesma,
quer a reação se dê por etapas, quer se dê via uma única etapa, quer rápida, quer lentamente.
Podemos utilizar como exemplo simples da aplicação da Lei de Hess a reação de oxidação do carbono. É possível
que o carbono se combine com um único átomo de oxigênio, formando o monóxido de carbono:
O monóxido de carbono é combustível, isto é, ele pode se combinar com outro átomo de oxigênio, produzindo
dióxido de carbono; por este motivo, ocorre a reação de combustão:
Se somarmos estas duas equações (como se elas fossem equações algébricas), poderíamos também, segundo a Lei de
Hess, somar as entalpias de reação:
Entalpia
13
Continuando a utilizar regras análogas às empregadas na álgebra, podemos eliminar todos os elementos que
aparecem nos dois membros da equação - neste caso, eliminamos o
.
Somando
e
, podemos anotar 1 mol deste gás, e o resultado final será:
que é exatamente a entalpia da reação se queimássemos diretamente o carbono a dióxido de carbono.
[1]
[2]
[3]
[4]
[5]
[6]
[7]
[8]
[9]
Assume-se o sistema em equilíbrio mecânico com sua vizinhança, ou seja, que as pressões do sistema e da vizinhança sejam sempre iguais.
Em acordo com Callen, Herbert B. - Thermodynamics and An Introduction to Thermostatics - John Wiley & Sons - ISBN 0-471-86256-8
Callen, Herbert B. - Thermodynamics and an Introduction to Thermostatics - John Wiley & Sons - 1985 - ISBN 0-471-86256-8
Ambas as expressões, H e U, conforme artigo sobre Gás Ideal na wikipédia lusófona, conforme publicado em 10 março 2010 às 19:06.]]
A saber, o expoente em funções exponenciais e o logaritmando em logaritmos devem ser adimensionais.
Conforme Salinas, Silvio R. A. - Introdução à Física Estatística - EdUSP - 1999 - ISBN 85-314-0386-3
A "entalpia de ligação" apresenta algumas particularidades próprias. Maiores detalhes, ver seção pertinente.
Entalpia padrão de formação (http:/ / www. unb. br/ iq/ lqc/ Joao/ calor/ entalpiapadraodeformacao. html). - www.unb.br.
Nóbrega, Olímpio Salgado ; Roberto da Silva, Eduardo ; Hashimoto da Silva, Ruth - Química - Volume único - editora Ática - São Paulo 2008 - ISBN:978-85-08-11059-9
[10] Atkins - Fisico-química.
[11] Mortimer, Eduardo Fleury at al. - Química para o ensino médio – Editora Scipione – ISBN 85-262-4456-6
[12] Nobrega, Olimpio Salgado; at al. - Química – Volume único – ISBN 978-85-08-11059-9, Pág. 435
Ligações externas
• ENTALPIA (http://educar.sc.usp.br/quimapoio/entalpia.html) - educar.sc.usp.br - Uma abordagem simples
e didática sobre entalpia.
• José Luis de Paula Barros Silva; Por que não estudar entalpia no Ensino Médio (http://qnesc.sbq.org.br/online/
qnesc22/a04.pdf); QUÍMICA NOVA NA ESCOLA; N° 22, NOVEMBRO 2005
Fontes e Editores da Página
Fontes e Editores da Página
Entalpia Fonte: http://pt.wikipedia.org/w/index.php?oldid=31666417 Contribuidores: 999, Agentei, Albmont, Alchimista, Anne Valladares, Belanidia, Bisbis, Bonás, ChristianH, Darwinius,
Dglsbr, Dylton, Ebalter, Edustefa, Epinheiro, Felipe arruda, Fidsneo, Finoto, Gil mnogueira, Gonçalo Veiga, Jbribeiro1, Jeferson, Jo Lorib, Jonatan sadan, JulioNather, Lauro Chieza de Carvalho,
Lechatjaune, Leonardo.stabile, Liakm, Lijealso, LipeFontoura, Ltkage, Luciaccoelho, Marcos Elias de Oliveira Júnior, Matheus-sma, Nice poa, OS2Warp, Quiumen, Rodrigozanatta,
SocratesFcup, Strgll, Sturm, Vanthorn, 124 edições anónimas
Fontes, Licenças e Editores da Imagem
Ficheiro:Entalpia H.png Fonte: http://pt.wikipedia.org/w/index.php?title=Ficheiro:Entalpia_H.png Licença: Creative Commons Attribution 3.0 Contribuidores: Lauro Chieza de Carvalho
Licença
Creative Commons Attribution-Share Alike 3.0 Unported
//creativecommons.org/licenses/by-sa/3.0/
14