Gabarito
Química C – Extensivo – V. 7
Resolva
Aula 25
25.01) E
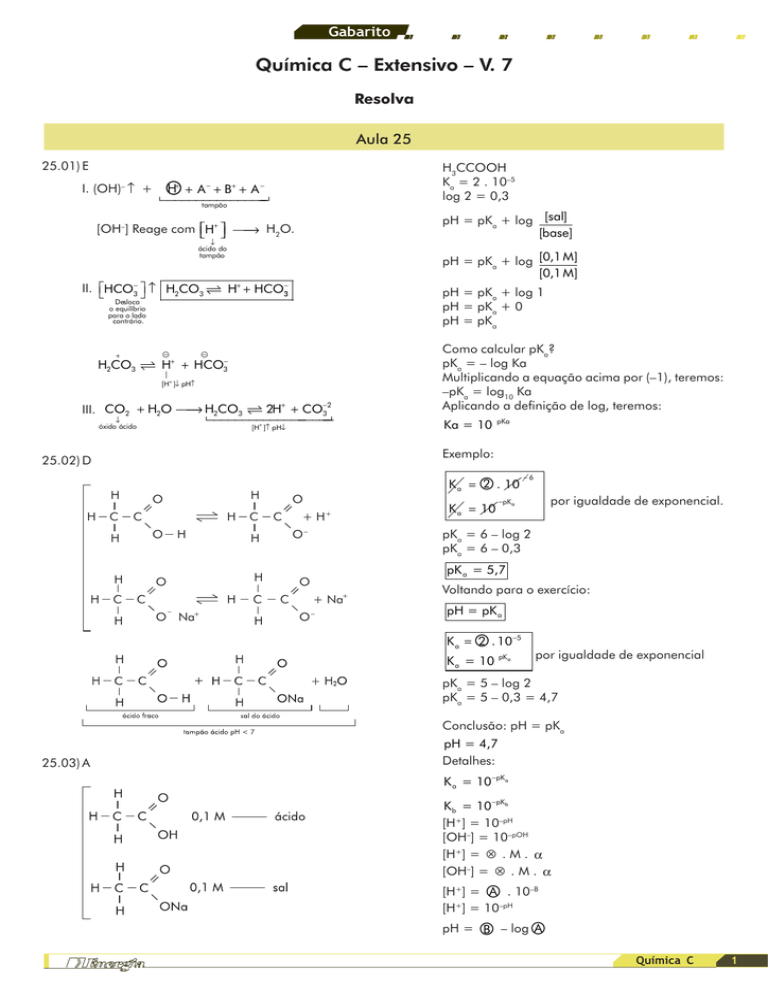
I. (OH)– ↑ +
○
+
−
+
H3CCOOH
Ka = 2 . 10–5
log 2 = 0,3
−
H + A +B + A
tampão
pH = pKa + log [sal]
[base]
[OH–] Reage com ⎡⎣H+ ⎤⎦ ⎯→
⎯ H2O.
↓
ácido do
tampão
pH = pKa + log [0,1 M]
[0,1 M]
II. ⎡⎣HCO3− ⎤⎦ ↑ H2CO3 H+ + HCO3−
pH = pKa + log 1
pH = pKa + 0
pH = pKa
Desloca
o equilíbrio
para o lado
contrário.
−
○
+
−
○
+
−
3
H2CO3 H + HCO
|
[H+ ]↓ pH↑
⎯ H2CO3 2H+ + CO3−2
III. CO2 + H2O ⎯→
↓
[H+ ]↑ pH↓
óxido ácido
H
H
Ka = 10
pKa
Exemplo:
25.02) D
H
Como calcular pKa?
pKa = – log Ka
Multiplicando a equação acima por (–1), teremos:
–pKa = log10 Ka
Aplicando a definição de log, teremos:
C
C
H
O
H
O
C
H
O
H
H
C
H
C
O Na+
O
C
+H
H
O–
H
O
C
–
H
2 . 10
Ka = ○
H
C
+
K a = 10
−6
por igualdade de exponencial.
−pK a
pKa = 6 – log 2
pKa = 6 – 0,3
pK a = 5,7
+ Na+
O–
Voltando para o exercício:
pH = pK a
2 . 10−5
Ka = ○
K a = 10
pK a
por igualdade de exponencial
pKa = 5 – log 2
pKa = 5 – 0,3 = 4,7
Conclusão: pH = pKa
25.03) A
pH = 4,7
Detalhes:
K a = 10−pKa
K b = 10−pKb
[H+] = 10–pH
[OH–] = 10–pOH
[H+] = ⊗ . M . α
[OH–] = ⊗ . M . α
A . 10–B
[H+] = ○
[H+] = 10–pH
A
pH = ○
B – log ○
Química C
1
Gabarito
Aula 26
26.01) B
H
H
caráter básico
−3
x = 2, 5 . 10 mol
HCOOH
+
NaOH
i 2,5 . 10
x
R
E (2,5 . 10 –3 – x)
Y
X
(Y – X)
–3
HCOONa + H2O
0
X
X
H azul
N
B)
25 mL
0,1 mol −−−− 1000 mL
0,1 molar
x −−−− 25 mL
HCOOH
C)
0
X
X
[HCOOH] = [HCOO–]
2,5 . 10–3 – x = x
2x = 2,5 . 10–3
x = 1,25 . 10–3 mol
pH > 7
bÆsico
0,1 mol ____ 1000 mL
NaOH < 1,25 . 10–3 mol ____ V
V = 12,5 mL
azul
D) HC amarelo
E)
pH
pH = 7
4
neutro verde
12,5 mL
V NaOH (mL)
26.03) B
2 CrO24−( aq) + 2H(+aq) Cr2O72(−aq) + H2O( )
cor laranja pH = 4
amarelo
26.02) A – ácido acético
B – amônia
C – acetato de sódio
D – cloreto de hidrogênio
E – cloreto de sódio
C
H
[H+ ]↑ pH↓
[H+ ]↑ lado
contrário
−
○
H
A) H
– amarelo
– azul
– azul
– amarelo
– verde
OH
Aula 27
pH↑
⎧pH > 7
⎪
⎨caráter básico
⎪ Faz hidrólise.
⎩
(CO3)–2 + 2H+|OH+ H2CO3 + 2(OH)−
[OH− ]↑ [H+ ]↓ pH↑
2
Química C
⊕
alaranjada
amarelo
27.01) E
−
○
⊕
2−
2 CrO24− + 2H+ Cr2O7 + H2O
O
C
alaranjada
27.02) C
Gabarito
27.03) B
pH > 7
caráter básico
Faz hidrólise.
CH3COO– + H+|OH– H3CCOOH + (OH)−
[OH− ]↑ [H+ ]↓ pH↑
impuro
Aula 28
28.01) E
C = 0,045 g/L
T = 25 ºC
KPS = ?
C = M . mol
0,045 g/L = M . 303 g/mol
207 32 16
Pb S O4
303 g /mol
M = 1,49 . 10–4 mol/L
28.03) 48
KPS ↓
− solúvel
○
⊕ precipita
149
, . 10
Pb(+aq2 ) + SO4−2( aq)
, . 10−4
149
149
, . 10−4
KPS = [Pb+2]1 . [ SO4−2 ]1
KPS = 1,49 . 10–4 . 1,49 . 10–4
KPS = 2,22 . 10–8
CdCO3 (5, 2 . 10−12 )
PbCO3(s) Pb+2 + CO3−2
+1
PbSO4( s )
−4
PbCO3 (1, 0 . 10−13 )
− solúveis
○
–2
Na2 (CO3 )
[CO3−2 ] ↑
lado
contrário
○
⊕ − ○
−
sal
⊕ inteiro
Facilita a precipitação.
28.02) E
AgBr( s ) Ag(+aq1 ) + Br(−aq1 )
KPS = 5,2 . 10–13
[Br–] = 2 . 10–2
[Ag+] = ?
KPS = [Ag+] . [Br–]
5,2 . 10–13 = [Ag+] . [2 . 10–2]
[Ag+ ] = 2,6 . 10−11
Química C
3
Gabarito
Testes
Aula 25
25.01) C
−
○
⊕
HNO2 H + OH
+
+
[H ]↓
lado
contrário
−
a) NaC Na C ⎯→
⎯ NaOH + HC
base
ácido
+
−
forte
forte
H OH
pH = 7
+
−
○
+
−
[NH4+ ]↑ NH4OH esquerda
NH4 + OH
+
–
−
3
−
⎯ NaOH + HNO3
b) NaNO3 Na NO ⎯→
ácido
base
+
forte
forte
H OH
pH = 7
Base
fica ⊕
int eira.
α↑
[OH− ] ↓ pOH ↑ pH ↓
25.03) E
c) NaNO2 Na+ NO2− ⎯→
⎯ NaOH + HNO2
ácido
base
2
−
mod erado
forte
H OH
ólise.
Faz hidro
d) NH4C NH4+ C − ⎯→
⎯ NH4OH + HC
ácido
base
+
−
forte
fraca
H (OH)
acetato de amônio
Faz hidrólise.
ácido mod erado
sal
H+ NO2−
Na+ NO2−
ânion
mod erado
ânion
origina
moderado
Faz hidrólise.
−
+
2
−
NO + H |OH− ⎯→
⎯ HNO2 + OH
[H3CCOO–]
H
acetato
lado contrário
H
ânion
mod erado
sal de caráter básico
H
Libera OH− (hidrólise).
H
sal
NH+4
origina cátion
cátion
C
esquerda
O
H
H
25.04) D
Libera.
NH4+
C − sal de caráter ácido
Libera H+ (hidrólise).
cátion
fraco
[H+ ]↑ pH↓
+
−
−
−
[NH+4 ]↑ NH4OH NH4 + OH
25.02) D
+
4
−
+
4
−
NH |OH NH + OH
NH4+ | C − NH4+ + C −
lado
contrário
⊕
○
−
K b − Não se altera.
α ↓ − base ⊕ inteira
pH↓ − [OH− ]↓ pOH↑ pH↓
4
Química C
○
−
NH+4 + OH−
NH4OH esquerda
Base
fica ⊕
inteira.
α↓
C
H
Faz hidrólise.
+
NH4+ + H+ OH− ⎯→
⎯ NH4OH + H
+ H+
O–
H
O
[H+ ]↓ pH ↑
fraco
fraco
C
–
+
K (cons tan te) − Não se altera.
α ↓ Fica ⊕ inteiro.
C −
O
C
H
Ácido fica mais inteiro.
base fraca
OH−
C
H
OH
H
[OH− ]↑ [H+ ]↓ pH↑
NH4+
C
H
Libera.
Na+ NO2−
C
H
O
O
C
–
+ H+
O–
Gabarito
25.05) D
25.08) C
–14
H
H
K w = 10
O
C
C
O
10
H
tampão
ácido fraco
H
H
–
K w = [H+ ] . [OH ]
0,1 M
H
O
0,1 M
C
C
(25 °C)
ONa
H
sal do ácido
–14
–
= [H+ ] . [OH ]
14 = pH + pOH (25 °C)
25.09) B
25 ºC
kw = 10–14
escala de pH
25.06) C
I. H
H
H
C
C
H
H
H
II. H
OH álcool
O
C
C
sal
–
O Na
tampão ácido
H
+
–
+
III. NH4 OH
base fraca
IV. H2CO3
ácido fraco
H
V. H
C
0, 01 mol de NaOH ____ 1 L
O
C
H
OH
massa
massa molar
0, 5 g
= 0, 0034 mol
nadípico =
↑
146 g / mol
nmálico =
tampão
Comprove: pH = 4, 76 após adição da
base (NaOH).
ácido fraco
⎧⎪ácido adípico massa molar K a
25.07) ⎨
146 4 . 10 −5
⎪⎩ácido málico
134 3 . 10 −4
Refrigerantes C = 0,5 g/L
0,5 g de ácido málico correspondem a um número de mols ligeiramente maior do que 0,5 g de
ácido adípico, porque a massa molar do ácido
adípico é maior.
n=
⎧0, 5 M CH3COOH
25.10) ⎨
⎩0, 5 M CH3COONa
tampão ácido pH = 4,74
0, 5 g
= 0, 00373 mol
↑
134 g / mol
Como a constante de ionização do ácido málico é
maior, na solução obtida haverá maior [H+] e, portanto, menor pH.
K a ↑ α↑ M↑ [H+ ]↑ pH↓ acidez↑
Considere pKa = 4,76.
pH = pKa + log
[sal]
[ácido]
pH = 4,76 + log [0, 5 m]
[0, 5 m]
pH = 4,76 + log 1
pH = 4,76 + 0
pH = 4,76
25.11) AgOH
VB = 1 L
M B = 0,1 M
nB = M B . V B
nB = 0,1 . 1
nB = 0,1 mol
AgNO3
Vsal = 0, 5 L
M sal = 0, 2 M
nsal = Msal . Vsal
nsal = 0,2 . 0,5 = 0,1 mol
a) Os ânions (OH)– da base forte (NaOH) reagem
com os cátions Ag+ da solução tampão, formando o AgOH, base insolúvel.
Ag+ + OH− ⎯→
⎯ AgOH ↓
0 ,1 mol
0 ,1 mol ⎯⎯→
0 ,1 mol
Química C
5
Gabarito
Para consumir todo o Ag+ (0,1 mol), é necessário 0,1 mol de (OH)– do (NaOH), assim:
[H+ ] = 8 . 10
[H+ ] = 10
n
NaOH
⇒ n = mol ⇒ m = n . mol
mol = 40 g
m = 0,1 . 40
m=4g
b) Os cátions H+ (ou H3O+) do ácido forte ( HCO4 )
reagem com os ânions (OH)– da solução tampão, formando água.
25.12) A
Kw = 10–13
T = 100 ºC
Kw = [H+] . [OH–]
10–13 = [H+] . [OH–]
7
−
H + OH ⎯→
⎯ H2O
0 ,1 mol
0 ,1 mol
pH
pH = 10,3 – log 8
pH = 10,3 – 0,9
pH = 9,4
O efeito tampão cessa pela adição de 4 g de
NaOH, pois todo o Ag+ é consumido e o tampão deixa de existir (funcionar).
+
10,3
0
0 ,1 mol
6,5
13
pH > 6,5 básica
Para consumir todo (OH)– (0,1 mol), é necessário 0,1 mol de HCO4 ou 0,1 mol de H+.
HCO4 n = m ⇒ m = n . mol
mol
mol = 100 ,5 g
m = 0,1 . 100, 5 g
m = 10, 05 g
25.13) D
H
H
de 10,05 g de HCO4 , porque todo (OH)– oriundo da base fraca é neutralizado.
c) Após a mistura das duas soluções, temos:
Vf = VB + Vs = 1 L + 0,5 L = 1,5 L
nB = 0,1 mol
ns = 0,1 mol
⎧
= 0,1 = 0, 067 molar
⎪⎪mB 1, 5
após a mistura ⎨
⎪n S = 0,1 = 0, 067 molar
⎪⎩
1, 5
K b = 2 . 10
K b = 10
pOH = 3,7 + log
H
H
C
C
ONa
H
sal
Ka = 2 . 10–5
pH = ?
⎧M = 0, 05 M
⎨
−2
⎩M = 5 . 10 M
−5
α2 = 2 . 10 −2
5 . 10
[OH− ] = 10−3,7
pOH = 3,7
na temperatura (T) ⎯→
⎯ K w = 8 . 10
–
Kw = [H ] . [OH ]
8 . 10–14 = [H+] . 10–3,7
−14
[H+] = 8 . 10
10−3,7
+
[H ] = 8 . 10–10,3
14
+ H+
O–
α2 = 0,4 . 103
α2 = 4 . 10–4
α =
H
H
2 . 10–5 = 5 . 10–2 α2
[0, 067]
C
H
O
2
Ka = M . α
(1 − α)
[0, 067]
C
O
ácido fraco
pH = 3
pOH = pKb + log [sal]
[base]
Química C
H
α
[H+] = 5 . 10–2 . ○
+
–2
[H ] = 5 . 10 . 2 . 10–2
[H+] = 101 . 10–2 . 10–2
[H+] = 10–3
[H+] = 10–pH
pKb
pK b = 3,7
6
O
[H+] = M . α
4
pKb = 4 – log 2
pKb = 4 – 0,3 = 3,7
+
H
C
C
H
O efeito também deixa de existir com a adição
H
O
4 . 10−4
α = 2 . 10 2
pH = 3, H3CCOONa
C
H
O
C
+ Na+
O–
Gabarito
25.14) C
tampão
ácido fraco + seu sal
base fraca + seu sal
a) Na2CO3
NaOH – base forte
b) NaHCO3
NaOH – base forte
c) Na2+1|CO3−2
Na+1|HCO3−1
NaOH
H2CO3 − ácido fraco
NaOH
H2CO3 − ácido fraco
d) NaC
HC – ácido forte
e) Na2SO4
H2SO4 – ácido forte
25.16) B
fórmula de Henderson-Hasselbach
pH = pKa + log [BA ]
[HA ]
25.17) B
pH = ?
[HCO3− ] = 2,5 . 10–3 M
[H2CO3] = 1,25 . 10–4 M
pKa = 6,1
T = 38 ºC
[sal]
[ácido]
−3
pH = 6,1 + log [2, 5 . 10 ]
[1, 25 . 10−4 ]
pH = 6,1 + log 2 . 101
pH = 6,1 + log 2 + log 10
pH = 6,1 + 0,3 + 1
pH = 7,4
25.18) C
−2
⎧
tampão ⎨HPO4
−
⎩ H2PO4
Mácido . Vácido = M2 . V2
1 . 86 mL = M . 98,5 mL
2
15
M2 = 0,0582
pH = pKa + log [sal]
[ácido]
pKa = pH – log [sal]
[ácido]
pKa = 6 – log [0, 00846]
[0, 0582]
pKa = 6 – log 0,145
pK a = 6,8
log 0,145 = –0,8
25.19) C
pH = 2
V1 = 50 mL
V2 = 500 mL
pH = ?
[H+] = 10–pH
[H+ ] = 10−2
M 1V 1 = M 2V 2
10–2 M . 50 mL = M2 . 500 mL
1
−2
M2 = 5 . 10
50 10
−2
M2 = 10 1
10
M2 = 10–2 . 10–1
M2 = 10–3 M
[H+] = M . α
pH = 6,0
⎧M = 1
⎪ sal
HPO4−2 ⎨
15
⎪⎩ Vsal = 12, 5 mL
[H+] = 10–3 . ○
1
[H+] = 10–3
[H+ ] = 10−pH
pH = 3
25.20) B
Mg(OH)2
↑
–
(OH) ↑ [H+ ] pH↑
↑
–
[HCO3 ]↑ [H+ ] pH ↑
↑
[OH – ]↑ [H+ ] pH ↑
–
+1
Na HCO3
↑
A (OH)3
↑
Vtotal = 12,5 mL + 86 mL = 98,5 mL
alfa
alfa = 100%
↑
1
⎧M
⎪ ácido =
H2PO4− ⎨
15
⎪⎩ Vácido = 86 mL
Msal . Vsal = M1V1
M1 = 0,00846 M
pK a = 6 –(– 0,8)
pKa = 6 + 0,8
25.15) B
pH = pKa + log
1 . 12,5 mL = M . 98,5 mL
1
15
+
+
H3O = H(aq)
Química C
7
Gabarito
Aula 26
26.01) C
suco de limão
vinagre
suco de laranja
água do mar
detergente com amoníaco
pH < 7 ácido
pH < 7 ácido
pH < 7 ácido
pH > 7 básico
pH > 7 básico
meio ácido ⇒ cor rosa
meio básico ⇒ cor azul
tornassol
26.02) 17
exo
+
−2
26.05) Cr2O7−2 + OH− + H2O H3O + 2 CrO4
endo
+
A) pH
solo básico ⇒ róseas
solo ácido ⇒ azuis
+
amarelo
K i (constante)
2–
B) K2 Cr2 O7
–
[Cr 2 O 7 ]
lado contrário
+
amarelo
Ki (constante)
–
C) NH4 C
fraco forte
+
+
NH 4 + H OH
01. Verdadeira
erdadeira.
⎧⎪[OH ] < 10
⎨ +
−7
+
⎩⎪[H ] > 10 [H ]↑ pH↓
−
–
[H ]
mesmo lado
da retirada
+
hortências
amarelo
laranja
−7
[H +]
+
lado
contrário
alaranjada
–
+
NH4OH + H
caráter
ácido
–
K i = constante
02. Falsa
alsa.
Ca+2 CO3−2
Ca(OH)2 − base forte
H+ (OH)−
H2CO3 − ácido fraco
pH > 7
básico
04. Falsa
alsa.
pH = 8,4 (básico)
08. [H+] < 10–7
D) NH3 atrai H3O+ (H+ ) .
[H + ]
E) T
endo
+
alaranjada
26.03) D
[H ] = 10
−pH
pH = 8 (básico)
cor rosa
26.04) B
suco de tomate
agua de chuva
agua do mar
p
R+
+
−1
26.06) HIn + H2O H3O + In
i
d
vermelha
incolor
I. [OH− ]↑
pH = 4,8 [H+] = 10–4,8
pH = 5,6 [H+] = 10–5,6
pH = 8,2 [H+] = 10–8,2
azul de bromotimol
p–
R+
Ki=
+
–
endo
16. Verdadeira
erdadeira.
pH = 6,2 (ácido)
[H+ ] = 10−8
+
amarela
K i = constante
+
[H ]↓ pH↑
–
mesmo lado
da retirada
[H+ ] > 10−6 amarelo
[H+ ] < 2, 5 . 10−5 azul
amarelo [H+] > 10–6---10–5---10–4---10–3
azul [H+] < 10–4,6---10–5---10–6---10–7
[H+] = 10–pH
[H+] = 2,5 . 10–5
pH = 5 – log 2,5
pH = 5 – 0,4
pH = 4,6
suco de tomate – amarelo
água de chuva – amarelo
água do mar – azul
+
↓
3
mesmo lado da retirada
[H O ]
26.07) A
V H2O = 4,5 L
V1 = 0, 5 L
V2 = 5 L
M1 = 10 M M2 = ?
−3
M 1V 1 = M 2V 2
10–3 M . 0,5 L = M2 . 5 L
M2 = 10–4 M
[H+ ] = 10−4
[H+ ] = 10−pH
pH = 4 final
[H+ ] = 10−3
pH = 3 inicial
[H+ ] = 10−pH
pH = 3
pH = 4
Aumenta de 1 unidade.
Química C
D
⊕
vermelha
⎯ Na+1 + 2H2O
II. NaOH + H3O+ ⎯→
inicial ⎯→
⎯ final
8
○
− i
Gabarito
26.08) E
HIn H+ + In–
[NH3 ]↑ atrai
26.12) CO2(g) + H2O HCO3− + H+ [H+ ]↑ pH↓
óxido ácido
[H+ ]↓
mesmo lado da retirada
esquerda
○
− ⊕
vermelha
26.09) D
ácido acético
H
I. H
26.13) Ao adicionarmos vinagre, estaremos introduzindo
íons H+, o que desloca o equilíbrio para a esquerda a fim de formar mais HR, amarelo, de acordo
com o princípio de Le Chatelier.
O
incolor
C
OH
H
a) amarela (pH < 7 solução ácida)
b) Com o tempo, o CO2 do ar reage com a água,
de acordo com o equilíbrio, e dá origem a íons
H+. Isso torna a solução ácida, o que explica a
cor amarela da solução.
HR H+ + R +
ácido fraco
amarelo
ácido sulfúrico
III. H2SO4 – incolor
roxo
vinagre [H+ ]↑
ácido forte
○
⊕ −
amarelo
lado
contrário
V. ácido perclórico – incolor
ácido ⊕ forte
II. hidróxido de alumínio – vermelho
roxo
26.14) B
+
−5
⎪⎧[H ] = 10
⎨ +
−pH
⎪⎩[H ] = 10
A(OH)3
base fraca
VI.hidróxido de cálcio – vermelho
pH = 5
Ca(OH)2
alaranjado-de-metila 3, 0 − 4, 5
base forte
IV. hidróxido de sódio – vermelho
azul-de-bromotimol 6, 0 − 7, 5
NaOH
base forte
26.15) D
26.10) D
+1
–1
Li NO3
H+
(OH)–
LiOH – base forte
HNO3 – ácido forte
pH = 7 neutro
tornassol pH de viragem (4,5 – 8,3)
cor abaixo cor transição cor acima
vermelha
azul
púrpura
1o papel (vermelho)
2o papel (azul)
100% = 1
26.11) I. H C
[H+] = M . a
26.16) E
[H+] = 10 –2 . 1
pH > 7
[H+] = 10–2
[H+] = 10–pH
II. CH3COO H
a = 1% = 0,01
M = 0,01M
pH = 2
KOH
caráter básico
[H+] = M . a
[H+] = 10 –2 . 10 –2
+
[H ] = 10
–4
[H+] = 10–pH
I. vermelha (alaranjado-de-metila)
amarela (azul-de-bromotimol)
II. amarela (alaranjado-de-metila)
amarela (azul-de-bromotimol)
Reage com HC.
Conduz corrente elétrica.
pH = 4
26.17) C
a) Certa
Certa.
NaOH é uma base forte.
b) Certa
Certa.
HB + NaOH vermelha
c) Errada
Errada.
HA é um ácido (forte).
Química C
9
Gabarito
d) Certa
Certa.
HB é um ácido mais fraco do que o HA.
e) Certa
Certa.
d) pH = 1
○I
[H+] = M . α
⎧caráter basico (vermelha)
fenolftaleína ⎨
⎩caráter incolor (ácido)
26.18) a) urina
pH = 6
[H+] = 10–1 . α
100 %
1
[H+] = 10−1 . 1
[H+] = 10−pH
[H+ ] = 10−6 mol/L
pH = 1
pH = 7
II
○
b) vinagre
pH = 3
[H+] = 10–3
pH = 13
III
○
[OH− ] = 10−11 mol/L
c) suco de laranja – pH = 3
urina – pH = 6
1
↓
[OH–] = M . α
α = 100% = 1
[OH–] = 10–1 . 1
[OH–] = 10–1
[OH–] = 10–pOH
[H+] = 10–3
[H+] = 10–6
suco de laranja = 10−3 = 103
urina
10−6
1000 vezes mais ácido.
d) tornassol azul ____ vinagre
+
↓
pOH = 1
pH = 13
[H ]
Apresentará cor vermelha.
26.20) B
[H+] = 1 . 10–2
[H+] = 10–pH
pH = 2 – log 1
pH = 2
[H+] = 10–5
[H+] = 10–pH
pH = 5
26.19)
a) (I) ⇒ vermelha; (II) ⇒ púrpura; (III) ⇒ azul
b) (I) ⇒ azul; (II) ⇒ púrpura; (III) ⇒ vermelho
c) (I) ⇒ incolor; (II) ⇒ incolor; (III) ⇒ vermelho
1a
pH = 2,
(1o)
⎫⎪
pH = 2 ⎬ ⊕ ácida
⎪
pH = 5 ⎭
Aula 27
27.01) a) NH+ NO−
4
3
fraca
Kh = K w
Kb
10−14
1, 8 . 10−5
(CO4 )−1 Não faz hidrólise.
c) K +
forte forte
−1
d) Mg1+2 (CO)2
fraco
ácido
Kh = 5,56 . 10–10
b) Na+1 (HCO3 )−1
fraco
Kh = K w
Ka
ácido
Kh =
Kh = K w
Ka
10
10−14
5, 6 . 10−4
Kh = 1,79 . 10–11
base
Kh =
Kh =
Química C
10−14
3, 2 . 10−8
Kh = 3,12 . 10–7
Gabarito
Ka = 0,2 . (0,0085)2
e) Cu+1 − OOC − CH3
fraco fraco
ácido
base
Kh =
Kh =
K a = 1,45 . 10−5
27.04) A
M = 0,1 M
α = 0,135% = 0,00135
Kw
K a . Kb
CH3COO−
−14
10
1, 8 . 10−5 . 2, 0 . 10−4
ácido
fraco
Kh = 3,33 . 10–6
+1
4 2
Na+
Faz hidrólise.
−2
f) (NH ) (SO4 )
fraca
base
2
Ka = M . α
(1 − α)
Ka = 0,1 . (0,00135)2
Kh = K w
Kb
Kh =
K a = 1,82 . 10−7
27.05) A
10−14
1, 8 . 10−5
K 2+1
(CO3 )−2
forte fraco → pH < 7
Kh = 5,56 . 10–10
27.02) B
Na+1 CN−1
forte fraco → pH > 7
O
H
NH3
básico
base fraca
K b = 1,8 . 10
C
O
H
+
ácido fraco
K a = 1,8 . 10 –4
NH4+1 C −1
fraco forte → pH > 7
–5
27.06) B
Na+1 (HCO3 )−1
forte fraco → pH > 7
básica
O
C
H
+1
2
Na
(CO3 )
forte fraco → pH > 7
+
–
−2
O NH 4
básica
H+ OH –
O
H
27.07) C
C
NH4OH
OH
Ka
Na+1 (HCO3 )−1
forte fraco
>
Faz hidrólise.
Kb
caráter ácido
pH > 7
→ caráter básico
(HCO3 )−1 + H+ | OH− H2CO3 + (OH)−
*
hidrólise
27.03) E
27.08) 20
+1
−1
Na CN
forte fraco
ácido
M = 0, 2 M
α = 0, 85% = 0, 0085
Ka = ?
2
Ka = M . α
(1 − α)
Na+ CN−
pH > 7
forte fraco → básico
Faz hidrólise.
CN− + H+ OH− HCN + (OH)−
ácido
base
conjugada
*
caráter básico
01. Falso
also.
M = 0, 5 mol = 1 M
0, 5 L
02. Falso
also.
caráter básico
Química C
11
Gabarito
1 Na SO
○
04. Verdadeiro
erdadeiro.
KHCN . KCN = KW
08. Falso
also.
16. Verdadeiro
erdadeiro.
2
B+ A −
fraca fraco
Na2+1 (SO4 )−2
forte forte
base ácido
16. Correto
Correto.
32. Incorreto
Incorreto.
Kw
K a . Kb
27.13) 28
27.10) D
1) CH3COOH
+
2) Na | C
3) NH4OH
4) HC
5) NaOH
−
sal neutro
base fraca
ácido forte
base forte
pH = 7
pH > 7
pH < 7
pH > 7
⎯→
⎯ 2 A(OH)3( s ) + 3H2SO4(aq)
b) Como o hidróxido de alumínio é uma base fraca e o ácido sulfúrico é um ácido forte, o sistema apresenta caráter ácido. Para corrigir a acidez, adiciona-se cal – CaO – que é um óxido
básico. Esse óxido reage com o ácido sulfúrico,
neutralizando o meio.
+ CaO(s) ⎯→
⎯ CaSO4 + H2O( )
27.12) 26
I. M =
9, 8 g
98 g/mol . 0, 5 L
M = 0,2 M
II. V = 2 L
pH = 13
pOH = 1
[OH–] = 10–1 = 0,1
M=
−
dupla-troca
Não muda o Nox.
01. Incorreto
Incorreto.
02. Incorreto
Incorreto.
04. Correto
Correto.
08. Correto
Correto.
⎛ 23 1 1216 ⎞
⎛ 1 35,5 ⎞
1⎜ NaHCO3 ⎟ + 1⎜ HC ⎟
⎝
⎠
⎝
⎠
1(84 g) ____ 1(36,5 g)
2,1 g ____ x
x=0,9125g
16. Correto
Correto.
27.14) D
antiácidos
pH > 7
caráter básico
27.15) E
base forte (monobase)
XOH
V = 0,1 L
pH = 13
[H+] = 10–13 M
[OH–] = 10–1
ácido forte diluído HA (monoácido)
V = 0,4 L
pH = 2
[H+] = 10–2 M
m1
mol . V(L )
0,1 M =
m1
40 . 2L
m1 = 8 g
⎧M = 0, 3 mol / L
III.Na2SO4 ⎨
⎩ V = 0, 2 L
M=
12
+
ácido fraco pH < 7
27.11) a) A 2 (SO4 )3( s ) + 6H2O ( ) ⎯→
⎯
H2SO
−
+
1 Na HCO3 + 1 H C
NaOH > NH4OH > NaC > CH3COOH > HC
+
4( aq )
2 Na+ + ○
1 (SO4)–2
⎯→
⎯ ○
0,06 ⎯→
⎯ 0,12 + 0,06
01. Incorreto
Incorreto.
02. Correto
Correto.
04. Incorreto
Incorreto.
08. Correto
Correto.
27.09) A
Kh =
4
Química C
n
v
excesso = 0,006
0, 004 = 0,010 (sobra) ⎯→
⎯ base
0
, 004
0
, 004
=
+
−
H
OH
excesso = 0,006 = 6 . 10–3
[OH–] = 6 . 10–3
[OH–] = 10–pOH
pOH = 3 – log 6
Gabarito
pOH = 3 – 0,77
27.17) A
hortências azuis – pH < 7
⎧pOH = 2, 23
⎨
⎩pH = 11, 77 ≅ 12
27.16) 22
01. Incorreta
Incorreta.
02. Correta
Correta.
[H+] = 10–6
[H+] = 10–pH
pH = 6
ácido
04. Correta
Correta.
[OH–] = 10–1
[OH–] = 10–pOH
pOH = 1
pH = 13
básico
08. Incorreta
Incorreta.
16. Correta
Correta.
[OH–] = 10–5
[OH–] = 10–pOH
pOH = 5
pH = 9
básico
[H+ ]↑ pH↓
27.18) B
27.19) B
+
H
→ Na2CO3 + CO
+ H2O
NaHCO3 + H2O ⎯⎯⎯
2
óxido
ácido
27.20) C
⎧azul ____ pH < 5, 5
⎨
⎩rosa ____ pH > 6, 5
vaso I
– CaCO3
– caráter básico
*vaso II – A 2 (SO4 )3 – caráter ácido
vaso III – KNO3
– caráter neutro
Aula 28
28.01) C
[Ag+] = 2,2 . 10–4 mol/L
1 Ag
○
+1
2
−2
(C2O4 )
−2
○
2 Ag+1 + ○
1 C2O4
KPS = ?
KPS = [Ag+1]2 . [ C2O4−2 ]1
KPS = [2,2 . 10–4]2 . [1,1 . 10–4]1
KPS = 5,3 . 10−12
28.02) D
solubilidade = 0,137 mg/L
1 Pb
○
−3
(PO4 )2−3 3Pb+2 + 2 (PO4 )
3 . (1,69 . 10–7) + 2 . (1,69 . 10–7)
KPS = ?
C = 0,137 . 10–3 g/L
207
+2
3
3116
Pb3 (PO4 )2
621 190
811
C = M . moL
0,137 . 10–3 g/L = M . 811 g/moL
M = 1,69 . 10–7 mol/L
KPS = [Pb+2]3 . [ PO4−3 ]2
KPS = [5,07 . 10–7]3 . [3,38 . 10–7]2
KPS = 1,488 . 10–32
28.03) A
BaSO4 Ba+2 + SO4−2
KPS = [Ba+2] . [ SO4−2 ]
KPS = [2 . 10–8]1 . [5 . 10–3]1
KPS = 10−10
28.04) BaSO4 Ba+2 + SO4−2
a) KPS = [Ba+2]1 . [ SO4−2 ]1
b) KPS = [Ba+2] . [ SO4−2 ]
KPS = [1,0 . 10–5]1 . [1,0 . 10–5]1
KPS = 10−10
28.05) Mg(OH)2
KPS = 4 . 10–12
1 Mg(OH)
○
2
○
2 (OH)−
1 Mg+2 + ○
X
X
a) KPS = [X]1 . [X]2
4 . 10–12 = x3
X=
3
4 . 10−12
X ≅ 10−4
b) 2 HC + Mg(OH)2 ⎯→
⎯ MgC 2 + 2H2O
KPS ≅ 1,5 . 10−32
Química C
13
Gabarito
28.06) A
1 PbSO
○
4
○
1 Pb
+2
+ ○
1 SO
[ PO4−3 ]2 = 0,125 . 10–16
−2
4
[ PO4−3 ]2 = 12,5 . 10–18
−2
4
KPS = [Pb+2] . [ SO ]
[ PO4−3 ] =
1,3 . 10–8 = [1,0 . 10–3]1 . [ SO4−2 ]
[PO4−3 ] = 3,5 . 10−9 mol/L
[SO4−2 ] = 1,3 . 10−5 mol/L
Para precipitar, o valor deve ser superior a
1,3 . 10–5 mol/L de (SO4)–2.
28.12) Pb +2 (SO4 )−2 Pb+2 + (SO4)–2
207 32 16
28.07) A
KPS = ?
Pb S O4
303 g / mol
Ag3+1 (PO4 )1−3 3(Ag+1) + 1( PO4−3 )
C = M . mol
0,045 g/L = M . 303 g/moL
KPS = [Ag+1]3 . [ PO4−3 ]1
M = 1,49 . 10 −4 mol/L
28.08) a) BaSO4(s) Ba(+2aq) + SO4−2(aq)
KPS = [Pb+2] . [ SO4−2 ]
KPS = [1,49 . 10–4]1 . [1,49 . 10–4]
b) KPS = [Ba+2]1 . [ SO4−2 ]1
KPS = [10–5]1 . [10–5]1
KPS = 2,22 . 10−8
c) KPS = 10−10
28.13) A
28.09) D
1 Ag S CN ○
1 Ag
○
108 32 12 14
40 12 16
CaCO3
Ca
+2
−2
3
+ CO
M=
M = 13 . 10 −5 mol/L
24
1 Mg
1 Mg(OH) ○
○
Hg+2 S(−s2) Hg(+aq2 ) + S(−aq2 )
KPS = [Hg+2]1 . [S–2]1
KPS = [1 . 10–26]1 . [1 . 10–26]1
KPS = 10–52
ou
KPS = (1 . 10–26)2
28.11) Ca3+2 (PO4 )2−3 3Ca+2 + 2 . (PO4)–3
[Ca+2] = 2 . 10–3 mol/L
KPS = 1 . 10–25
+2
5 . 10−4
KPS = [Mg+2] . [OH–]2
KPS = [5 . 10–4] . [10 . 10–4]2
KPS = 5 . 10–4 . 100 . 10–8
KPS = 500 . 10–12
KPS = 5 . 10−10
28.15) B
1 Ba S O ○
1 Ba
○
137 32 16
+2
1 SO4−2
+○
233 g / L
[ PO ] = ?
KPS = [Ca+2]3 . [ PO4−3 ]2
1 . 10–25 = [2 . 10–3]3 . [ PO4−3 ]2
−3 2
4
= 8 . 10 . [ PO ]
2 (OH)−
+○
58 g / mol
M = 5 . 10−4 M
4
−3
4
Química C
16 1
2
28.14)
−25
[ PO4−3 ]2 = 1 . 10
8 . 10−9
m1
166 g /mol . 0, 25 L
m1 = 4,15 . 10−5 g
−8
28.10) E
1 . 10
m1
mol . V(L )
10–6 mol/L =
KPS = [Ca+2]1 . [ CO3−2 ]1
KPS = [13 . 10–5] . [13 . 10–5]1
KPS = 169 . 10–10
–9
X
X = 10−12
X = 10–6 mol/L
−3
M = 13 . 10
100
–25
1 SCN−1
+○
KPS = [X]1 . [X]1
10–12 = x2
C = 13 mg/L
C = 13 . 10–3 g/L
C = M . moL
13 . 10–3 g/L = M . 100 g/mol
KPS = 1,69 . 10
+1
X
166 g /mol
mol = 100 g / mol
14
12, 5 . 10−18
C = 0,0932 . 10–3 g/L
C = M . moL
0,0932 . 10–3 = M . 233
M = 4 . 10–7 M
KPS = [Ba+2] . [ SO4−2 ]
KPS = [4 . 10–7] . [4 . 10–7]
KPS = 1,6 . 10−13
10 . 10−4
Gabarito
28.16) A
Hg+2|S–2 Hg+2 + S–2
KPS = [Hg+2] . [S–2]
KPS = [1,3 . 10–27] . [1,3 . 10–27]
KPS = 1,69 . 10–54
KPS = 1,7 . 10−54
28.17) D
28.18) E
1 Ag
○
1 Ag+1 + ○
1 Br −
|Br − ○
KPS = 5,2 . 10–13
5,2 . 10–13 = [Ag+1] . [Br–]
5,2 . 10–13 = [Ag+1] . [2 . 10–2]
+
[Ag+1] = 2,6 . 10−11 mol/L
28.19) A
28.20) D
Química C
15
