Erval Oliveira
ALUNO (a): ____________________________________________
1º) Um corpo possui massa de 500 gramas e calor específico 0,4 g/cal ºC.
Qual a quantidade de calor que o corpo deve receber para que sua
temperatura varie de 5 ºC para 35 ºC;
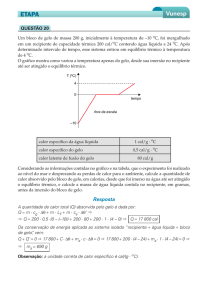
2º) A passagem da fase sólida para líquida de 200 g de uma substância
determinada, em função do calor Q absorvido, é representada no gráfico
abaixo. Os calores específicos dessa substância, nas fases sólida e
líquida são, respectivamente, em cal/gºC, de
3º) O gráfico representa a variação da temperatura de um corpo sólido,
em função do tempo, ao ser aquecido por uma fonte que libera energia a
uma potência constante de 150 cal/min. Sendo a massa do corpo igual a
100g, o seu calor
específico será de:
8º) Para a verificação das Leis da Calorimetria, durante uma aula de
laboratório, os estudantes colocaram uma pedra de gelo em fusão com
massa igual a 200g dentro de um calorímetro de capacidade térmica
desprezível. A esse calorímetro fez-se chegar vapor de água a 100°C. O
sistema atingiu o equilíbrio térmico a 60°C. É correto afirmar que a massa
de vapor de água existente nesse momento no calorímetro foi igual a:
9º) Uma pedra de gelo a 0°C é colocada em 200g de água a 30°C, num
recipiente de capacidade térmica desprezível e isolado termicamente. O
equilíbrio térmico se estabelece a 20°C. É correto afirmar que a massa da
pedra de gelo vale :
Dados ; cágua = 1 cal/g°C, cgelo=0,5 cal/g°C, Lfusão= 80 cal/g
10º) Um engenheiro trabalhando em uma indústria que produz
eletrodomésticos, deseja resfriar 0,25kg de água a ser ingerida por ele,
inicialmente a uma temperatura de 25ºC, adicionando gelo a -20ºC. A
quantidade de gelo que deverá ser utilizada para que a temperatura final
seja igual a 0ºC, sabendo-se que o gelo se funde e que o calor específico
do recipiente pode ser desprezado, deverá ser aproximadamente igual a:
Dados:
cágua = 4190 J/kg.K Lfusão = 3,34.105 J/kg
Q = m.L
Q = C.∆T
cgelo = 2,1.103 J/kg.k
Q = m.c. ∆T
11º) Para o estudo do equilíbrio térmico o professor de Física solicitou aos
estudantes que todos os colocassem em um recipiente termicamente
isolado, com capacidade térmica desprezível, 200 g de água a 10°C e em
seguida, adicionassem um bloco de ferro de 500g a 140°C. Qual
a temperatura final do equilíbrio térmico?
Dados : calor específico da água : 1 cal/gC calor específico do ferro : 0,12
cal/g°C
4º)Um bloco metálico está com uma temperatura inicial de 20ºC. Sabendose que quando o bloco recebe uma quantidade de calor igual a 330cal, a
sua temperatura se eleva para 50ºC. Determine a capacidade térmica do
bloco.
5º) Um calorímetro contém 200ml de água, e o conjunto está à
temperatura de 20°C. Ao ser juntado ao calorímetro 125g de uma liga
a 130°C, verificamos que após o equilíbrio térmico a temperatura final é
de 30°C. Qual é a capacidade térmica do calorímetro?
Dados:
calor específico da liga: 0,20cal/g°C
calor específico da água: 1cal/g°C
densidade da água: 1000kg/m3
6º) Durante um experimento com o objetivo de determinar a temperatura
de equilíbrio térmico de um determinado sistema, um estudante misturou
200 g de água, a 80oC, com 800g de água, a 10oC. Calcule a temperatura
encontrada pelo estudante.
7º) Uma barra de determinado material com 0,5 Kg de massa deve ser
aquecida de 300oC até 500oC. Sendo 0,11 cal/g.oC o calor específico do
material em questão, podemos afirmar que a quantidade de calor que a
barra receberá vale, em cal:
12º) Num dia muito quente, Roberto pretende tomar um copo de água
bem gelada. Para isso, coloca, num recipiente termicamente isolado e de
capacidade térmica desprezível, 1000 g de água a 15ºC e 200 g de gelo a
-6ºC. Esperando pelo equilíbrio térmico, Roberto obterá: São dados:
• calor específico da água = 1 cal/gºC
• calor específico do gelo = 0,5 cal/gºC
• calor latente de fusão do gelo = 80 cal/g
a) 1020 g de água e 180 g de gelo, ambos a 0ºC;
b) 1180 g de água e 20 g de gelo, ambos a 0ºC;
c) 1100 g de água e 100 g de gelo, ambos a -1ºC;
d) 1200 g de água a 0ºC;
e) 1200 g de água a 1ºC
13º) Um calorímetro de capacidade térmica 11 cal/ºC contém 20 g de gelo.
O calor necessário para aquecer o sistema de 270 K a 300 K, em calorias,
vale:
Dados:
Calor específico do gelo = 0,50 cal/gºC
Calor específico da água = 1,0 cal/gºC
Calor latente de fusão do gelo = 80 cal/g
a) 3,3.102 b) 6,3.102 c) 9,3.102 d) 2,5.103 e) 6,3.103
1
[email protected] / prof-ervaloliveira9.webnode.com