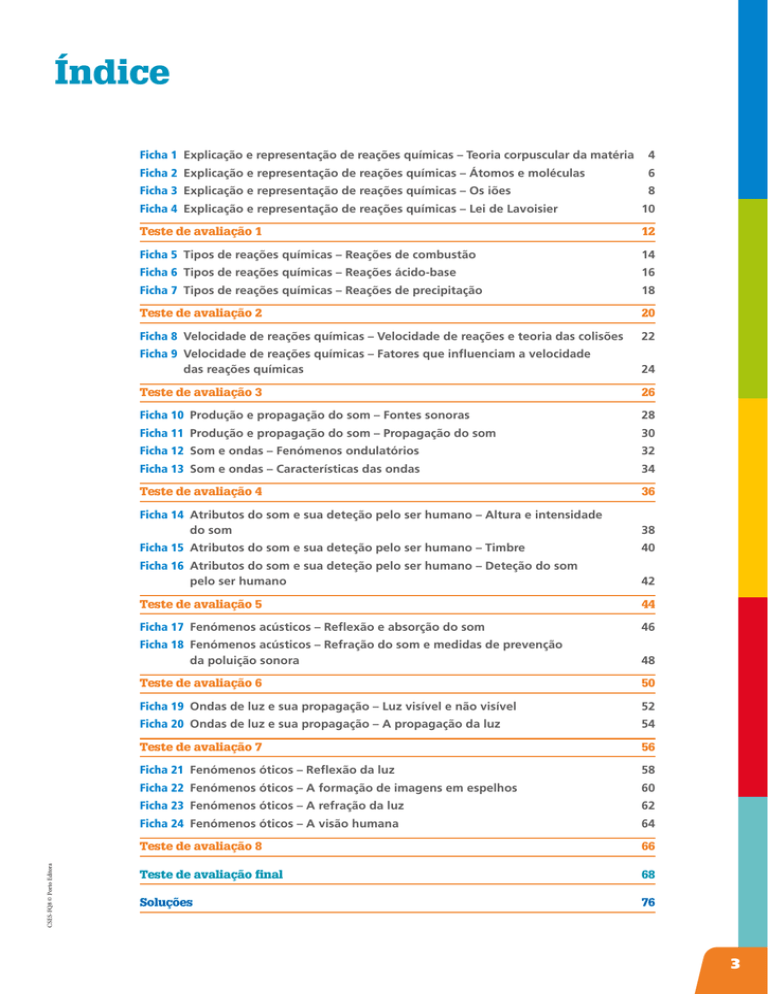
Índice
CSES-FQ8 © Porto Editora
Ficha 1 Explicação e representação de reações químicas – Teoria corpuscular da matéria 4
Ficha 2 Explicação e representação de reações químicas – Átomos e moléculas
6
Ficha 3 Explicação e representação de reações químicas – Os iões
8
Ficha 4 Explicação e representação de reações químicas – Lei de Lavoisier
10
Teste de avaliação 1
12
Ficha 5 Tipos de reações químicas – Reações de combustão
14
Ficha 6 Tipos de reações químicas – Reações ácido-base
16
Ficha 7 Tipos de reações químicas – Reações de precipitação
18
Teste de avaliação 2
20
Ficha 8 Velocidade de reações químicas – Velocidade de reações e teoria das colisões
22
Ficha 9 Velocidade de reações químicas – Fatores que influenciam a velocidade
das reações químicas
24
Teste de avaliação 3
26
Ficha 10 Produção e propagação do som – Fontes sonoras
28
Ficha 11 Produção e propagação do som – Propagação do som
30
Ficha 12 Som e ondas – Fenómenos ondulatórios
32
Ficha 13 Som e ondas – Características das ondas
34
Teste de avaliação 4
36
Ficha 14 Atributos do som e sua deteção pelo ser humano – Altura e intensidade
do som
38
Ficha 15 Atributos do som e sua deteção pelo ser humano – Timbre
40
Ficha 16 Atributos do som e sua deteção pelo ser humano – Deteção do som
pelo ser humano
42
Teste de avaliação 5
44
Ficha 17 Fenómenos acústicos – Reflexão e absorção do som 46
Ficha 18 Fenómenos acústicos – Refração do som e medidas de prevenção
da poluição sonora
48
Teste de avaliação 6
50
Ficha 19 Ondas de luz e sua propagação – Luz visível e não visível
52
Ficha 20 Ondas de luz e sua propagação – A propagação da luz
54
Teste de avaliação 7
56
Ficha 21 Fenómenos óticos – Reflexão da luz
58
Ficha 22 Fenómenos óticos – A formação de imagens em espelhos
60
Ficha 23 Fenómenos óticos – A refração da luz
62
Ficha 24 Fenómenos óticos – A visão humana
64
Teste de avaliação 8
66
Teste de avaliação final
68
Soluções 76
3
Ficha 5
Tipos de reações químicas – Reações de combustão
As combustões
As combustões são reações químicas que se incluem na categoria das reações de oxidação-redução.
CSES-FQ8 © Porto Editora
Comburente
É o reagente que se reduz.
Combustão
O comburente mais comum é o
dioxigénio (O2).
Quando o combustível e o comburente reagem entre si libertam grande quantidade de
energia sob a forma de calor.
Geralmente, as combustões são
muito rápidas e acompanhadas
de chama.
Combustível
É o reagente que se oxida.
Combustíveis comuns: madeira,
gasolina, butano, papel, álcool
etílico, carvão.
Fig. 1 Combustão da
madeira.
Representação simbólica de reações de combustão
Combustão do etino (acetileno dos maçaricos)
2 C2H2(g) + 5 O2(g) 4 CO2(g) + 2 H2O(g)
Combustão do magnésio
O2(g) + 2 Mg(s) Combustão do butano (utilização doméstica)
13 O2(g) + 2 C4H10(g) CO2(g) + 10 H2O(g)
2 MgO(s)
Combustão do enxofre
S8(s) + 8 O2(g) 8 SO2(g)
Na categoria das reações de oxidação-redução também se incluem, além das combustões, a respiração celular e a
corrosão dos metais.
Reações de
oxidação-redução
Combustão
São geralmente acompanhadas por chama e
elevada libertação de energia. Ex.: carvão a arder.
CO2(g)
C(s) + O2(g)
Corrosão
Ocorrem muito lentamente quando os metais
reagem com o dioxigénio. Ex.: enferrujamento.
2 Fe2O3(s)
4 Fe(s) + 3 O2(g)
Respiração
Reações que ocorrem sem formação de chama,
são geralmente lentas. Ex.: respiração celular.
C6H12O6(s) + 6 O2(g)
6 CO2(g) + 6 H2O(g)
Problemas ambientais provocados pelas reações de combustão
As combustões são importantes na produção de energia, mas a sua utilização excessiva tem fortes impactos
ambientais, nomeadamente na poluição da atmosfera, devido à libertação de:
• dióxido de carbono: principal responsável pelo aumento do efeito de estufa;
• óxidos de nitrogénio e enxofre: principais responsáveis pelas chuvas ácidas.
O recurso a fontes de energia renováveis não poluentes e a utilização de dispositivos que minimizem estas emissões,
na indústria e nos transportes, devem ser uma prioridade para todos os países.
14
Tipos de reações químicas – Reações de combustão
1. Considera as seguintes situações em que ocorrem reações de combustão:
(A)
Boca de gás doméstica.
(B)
Maçarico.
(C)
Enxofre a arder.
1.1. Para cada uma das situações identifica o combustível.
(A) (B) (C) 1.2. O comburente é o mesmo em todas as reações referidas. Identifica-o.
(D)
Lamparina de álcool.
(D) 1.3. A equação de palavras que traduz a combustão do álcool etílico (C2H6O) na lamparina é a seguinte:
Álcool etílico(L) + Dioxigénio(g) Dióxido de carbono(g) + Água(g)
Escreve a equação química respetiva e acerta-a.
1.4. A equação química que traduz a combustão do enxofre é: S8(s) + 8 O2(g) Explica por que razão, neste caso, a água não é um dos produtos da reação.
8 SO2(g).
2. Os motores de combustão dos automóveis produzem dióxido de
carbono e óxidos de enxofre e nitrogénio. O conversor catalítico
é um componente que minimiza a emissão destes poluentes.
2.1. No catalisador ocorre a transformação do NO2 em duas substâncias elementares. Que substâncias serão essas?
2.2. O trióxido de enxofre (SO3) é uma das substâncias que resultam da queima de combustíveis fósseis.
Quando o SO3 se combina com a água atmosférica, dá origem ao ácido sulfúrico (H2SO4).
Escreve a equação química que traduz a reação descrita.
2.3. Que consequências tem para a Natureza o excesso de SO3 lançado para atmosfera?
3. Associa o tipo de reação de oxidação-redução às situações referidas.
Coluna I
CSES-FQ8 © Porto Editora
(A) Combustão
(B) Respiração
(C) Corrosão
Coluna II
(1) Lenha a arder numa lareira.
(2) Portão de ferro exposto ao ar.
(3) Produção de energia numa célula viva.
(4) Fogo de artifício numa festa popular.
(5) Carroçaria metálica de um carro abandonado.
(6) Folha de papel a arder.
15
Teste de avaliação 2
Coluna I
Coluna II
(A) H2SO4(aq) + 2 NaOH(aq) (B) 2 Mg(s) + O2(g) (1) Combustão
2 MgO(g)
(C) K2CO3(aq) + Pb(NO3)2(aq) (2) Ácido-Base
(3) Precipitação
Na2SO4(aq) + 2 H2O(L)
PbCO3(s) + 2 KNO3(aq)
(D) 2 HNO3(aq) + Ca(OH)2(aq) Ca(NO3)2(aq) + 2 H2O(L)
(E) Na2CO3(aq) + Ca(NO3)2(aq) CaCO3(s) + 2 NaNO3(aq)
(F) 2 C4H10(aq) + 13 O2(g) 8 CO2(g) + 10 H2O(g)
2. As imagens seguintes referem-se a reações de combustão.
(A)
(B)
(C)
Boca de fogão.
Lareira.
(D)
Motor de carro.
(E)
Vela.
Magnésio a arder.
2.1. Para cada uma das situações, refere qual é o combustível.
(A)
(B)
(C)
(D)
(E)
2.2. Identifica o comburente que é comum a todas as reações apresentadas.
2.3. A equação química, não acertada, que traduz a reação que ocorre na situação A é a seguinte:
C4H10(g) +
O2(g) CO2(g) +
H2O(g)
2.3.1. Faz o acerto desta equação química determinando os coeficientes em falta.
2.3.2. Faz a leitura quantitativa da equação química já acertada.
2.4. Refere um efeito nocivo das emissões de dióxido de carbono para a atmosfera e propõe uma medida que
permita diminuir o volume dessas emissões.
3. Completa as equações químicas seguintes colocando nos espaços as fórmulas químicas em falta.
(A) CH4(g) + 2 O2(g) (B) HCL(aq) +
(g) + 2 H2O(g)
NaCL(aq) + H2O(L)
(aq) (C) AgNO3(aq) + NaCL(aq) (D) H2SO4(aq) + Ca(OH)2(aq) (E) C(s) +
(F) 3
20
(g) (s) + NaNO3(aq)
CO2(g)
(aq) + AL2(SO4)3(aq) (aq) + 2 H2O(L)
3 BaSO4(s) + 2 ALCL3(aq)
CSES-FQ8 © Porto Editora
1. Associa o tipo de reação indicada na coluna I às equações químicas apresentadas na coluna II.
4. Considera as cinco soluções aquosas que se encontram
nos tubos de ensaio ao lado e a escala colorimétrica utilizada para o papel indicador universal.
1
2
3
4
5
6
7
8
9
10 11 12 13 14
4.1. Indica o carácter químico de cada uma das soluções.
A:
B:
C:
D:
E:
A
B
C
D
E
4.2. Associa as soluções A, C e D a cada uma das seguintes soluções do
dia a dia.
Água com sal:
Detergente:
Sumo de limão:
4.3. Se quisesses aumentar o valor de pH da solução A, por adição de outra solução, qual das hipóteses
seguintes escolherias?
(A) Ácido clorídrico concentrado
(B) Umas gotas de água destilada
(C) Hidróxido de sódio dissolvido em água
(D) Ácido nítrico
5. Na figura ao lado encontras o rótulo de uma garrafa de
água mineral com informação sobre as suas características físico-químicas e composição química.
5.1. Refere o carácter químico desta água mineral.
5.2. Comenta a seguinte afirmação: “O pH desta água não foi determinado com tornesol nem com papel indicador”.
Características físico-químicas:
pH a 25 °C .......................................... 5,85
SiO2 ............................................ 72,8 mg/L
Mineralização total .................. 126,9 mg/L
Composição química (mg/L)
Aniões
Catiões
Bicarbonato ..... 72,7 Cálcio............ 16,6
Cloreto ............. 11,1 Sódio............. 15,2
Fluoreto ............. 0,1 Magnésio ........ 0,5
5.3. Aconselharias esta água a uma pessoa que sofresse de excesso de acidez no estômago? Porquê?
5.4. Explica por que razão não se encontra cloreto de sódio depositado no fundo das garrafas.
6. Classifica em verdadeiras (V) ou falsas (F) as afirmações seguintes.
(A) As combustões são geralmente acompanhadas por libertação de uma grande quantidade de
energia.
(B) O hidróxido de sódio é um ácido usado para o desentupimento de canos.
CSES-FQ8 © Porto Editora
(C) Um indicador ácido-base permite determinar com exatidão o pH de uma solução.
(D) Em geral, os solos graníticos do Norte de Portugal dão origem a águas macias.
(E) Os anticalcários são particularmente úteis em zonas de águas macias.
(F) As pessoas só devem beber águas duras para ficarem fortes.
21
Ficha 16
Atributos do som e sua deteção pelo ser humano – Deteção do
som pelo ser humano
Ouvido humano
Tímpano
Cóclea
ou caracol
Pavilhão
auricular
Canal
auditivo
Ossículos
(martelo,
bigorna
e estribo)
Ouvido
médio
Ouvido externo
Ouvido
interno
Fig. 1 Ouvido humano.
Espetro sonoro
O espetro sonoro compreende os sons audíveis e não audíveis
pelo ser humano:
• Infrassons: sons com uma frequência compreendida entre
0 Hz e 20 Hz;
20 Hz
20 000 Hz
HwIwJHwIwJHwIwJ
0 Hz
• Sons audíveis pelo ser humano: sons com uma frequência
compreendida entre 20 Hz e 20 000 Hz;
Infrassons
Sons audíveis
Ultrassons
Fig. 2 Espetro sonoro.
• Ultrassons: sons com uma frequência superior a 20 000 Hz.
Os infrassons e os ultrassons são inaudíveis para o ser humano, mas são audíveis para muitos animais.
Nível de intensidade sonora
A membrana do tímpano consegue suportar uma determinada intensidade sonora máxima, a partir da qual
se podem sofrer danos auditivos.
A combinação da frequência do som emitido e do nível
de intensidade sonora permite definir os sons que realmente são audíveis pelo ser humano.
O nível de intensidade sonora é uma grandeza física
que se usa para descrever a resposta do ouvido humano
a um som, expressa-se em decibéis (dB) e pode ser medida com um sonómetro.
Nível de
intensidade
sonora (dB)
Limiar de dor
100
Escala de decibéis
au
diç
ã
50
de
iar
Lim
Sons
não
audíveis
Sons não audíveis
o
içã
d
au
de
Limiar de dor
Nível sonoro máximo
suportado pelo ouvido
humano.
iar
Limiar de audição
Nível sonoro mínimo a
partir do qual o ouvido
humano deteta o som.
o
Sons audíveis
120 db
Lim
0 db
Sons dolorosos
150
0
10 000
20 000
Frequência (Hz)
Fig. 3 Gráfico do nível de intensidade sonora em função da
frequência.
Repousante
0
10
20
30
Incomodativo
40
Limiar de audição
50
60
70
80
90
Doloroso
100 110 120 130 140
Nível de intensidade sonora (dB)
Fig. 4 Nível de intensidade sonora.
42
Fatigante Perigoso
Limiar de dor
CSES-FQ8 © Porto Editora
O ouvido é um recetor de som. Neste, as vibrações sonoras são comunicadas ao tímpano,
que passa também a vibrar. A vibração é amplificada pelos ossículos (martelo, estribo e bigorna). Ao atingir os canais semicirculares e
posteriormente a cóclea (ou caracol), a vibração é convertida em impulsos nervosos canalizados pelo nervo auditivo até ao cérebro.
O cérebro descodifica e interpreta o som.
Canais
semicirculares
Atributos do som e sua deteção pelo ser humano – Deteção do som pelo ser humano
1. Observa atentamente a figura seguinte.
A
D
E
F
B
C
1.1. Faz a legenda da figura.
1.2. Descreve o modo como o ouvido humano consegue ouvir um som emitido.
2. Completa as frases seguintes com as palavras do quadro de forma a obteres afirmações cientificamente corretas.
limiar de audição limiar de dor ultrassons nível de intensidade sonora
sonómetro 20 Hz sons audíveis infrassons recetor 20 000 Hz
(A) O ouvido humano é um
do som.
(B) O ser humano consegue ouvir sons com frequências compreendidas entre
, os designados
.
(C) Certos animais conseguem captar sons com frequências inferiores a
.
apresentam uma frequência superior a
(D) Os
mais como, por exemplo, pelos morcegos.
(E) Os
e os
e
, designados
e são audíveis por muitos ani-
não são audíveis pelo ser humano.
(F) A grandeza física que descreve a resposta do ouvido humano ao som designa-se
pode ser medida com um
.
(G) O nível sonoro mínimo audível pelo ser humano designa-se por
suportável designa-se por
.
e
e o nível sonoro máximo
3. Classifica em verdadeiras (V) ou falsas (F) as seguintes afirmações.
(A) O limiar de audição corresponde a 0 dB.
CSES-FQ8 © Porto Editora
(B) O nível de intensidade sonora expressa-se em hertz (Hz).
(C) O limiar da dor é de 120 dB.
(D) O nível sonoro máximo suportado pelo ser humano corresponde a 0 dB.
(E) O nível sonoro pode ser detetado com um sonómetro.
43
Teste de avaliação final
7. Na tabela seguinte representam-se algumas moléculas com modelos de esferas coloridas.
B
C
D
E
F
G
H
I
J
CSES-FQ8 © Porto Editora
A
Legenda:
Oxigénio
Hidrogénio
Nitrogénio
Carbono
Enxofre
7.1. Identifica…
7.1.1. … as substâncias elementares.
7.1.2. … as substâncias compostas.
7.2. Escreve a fórmula química de cada uma das substâncias representadas.
7.3. Seleciona a opção que completa corretamente a afirmação seguinte:
“Todas as substâncias representadas têm um número de eletrões
seu número de
(A) … menor que o … protões
(B) … igual ao … neutrões
(C) … maior que o … protões
(D) … igual ao … protões
.”
8. Nas imagens representam-se simbolicamente três amostras do ponto de vista submicroscópico.
(A)
(B)
(C)
8.1. Indica a letra correspondente a…
8.1.1. … uma substância elementar.
8.1.2. … uma substância composta.
8.1.3. … uma mistura.
8.2. Em (A) encontram-se representados 2 H2O2 e 5 H2O. Escreve as representações das amostras (B) e (C),
sabendo que as esferas azuis representam o elemento nitrogénio.
70
9. Os sais são compostos iónicos que…
(A) … não têm unidades estruturais com carga elétrica.
(B) … têm unidades estruturais com carga elétrica.
(C) … têm um número de aniões superior ao dos catiões.
(D) … têm um número de catiões superior ao dos aniões.
(Seleciona a opção que completa corretamente a frase.)
10.Escreve a fórmula química de um ião que…
10.1.… resulta de um átomo de cloro que captou um eletrão.
10.2.… resulta da cedência de 3 eletrões por parte de um átomo de alumínio.
10.3.… resulta da captação de 3 eletrões por parte de um conjunto de um átomo de fósforo e 4 de oxigénio.
10.4.… resulta da cedência de um eletrão por parte de um conjunto de um átomo de nitrogénio e quatro de
hidrogénio.
11. Representa simbolicamente…
11.1.… 10 átomos de hélio.
11.2.… 5 moléculas de água.
11.3.… 2 moléculas de dióxido de carbono.
11.4.… 4 catiões amónio.
11.5.… 3 aniões carbonato.
11.6.… 2 moléculas de dioxigénio.
12. Escreve a fórmula química dos seguintes compostos iónicos.
12.1.Hidróxido de potássio.
12.2.Óxido de cálcio.
12.3.Fosfato de magnésio.
12.4.Carbonato de magnésio.
12.5.Sulfato de alumínio.
12.6.Nitrato de sódio.
CSES-FQ8 © Porto Editora
13. Escreve o nome dos compostos iónicos seguintes.
13.1.K3PO4.
13.2.CaO.
13.3.Mg(NO3)2.
13.4.ALPO4.
13.5.NaCL.
13.6.NH4NO3.
71