NOTAS SOBRE OS MECANISMOS DA VISÃO DE SERES VIVOS
H.M. de Oliveira, DES-UFPE
Um seminário sobre o processo de visão, para Engenheiros Biomédicos.
Abordagem preliminar de fatos anatômicos, fisiológicos, e bioquímicos.
Figura. Espectro de ondas eletromagnéticas, com destaque a faixa visível.
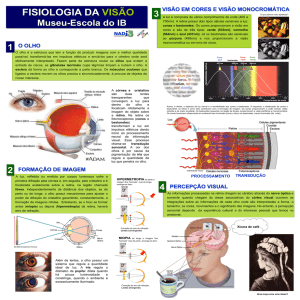
Olho: Anatomia e Funcionamento
A anatomia humana foi por cerca de 15.000 anos baseada nos
trabalhos pioneiros de Galeno de Pergamum (130-200 AD). Devido à
proibição das dissecações e autopsias, a compreensão só avançou
após a Renascença, particularmente com Andreas Vesalius (15141564).
Figura. Detalhes da estrutura anatômica de um olho.
ESTRUTURA DO OLHO HUMANO
• As principais estruturas são:
íris, lente, pupila, córnea, retina, humor vítreo, disco óptico e nervo.
O globo ocular é revestido (córnea à parte) de uma parede com três camadas
concêntricas: esclerótica, caróide, retina.
1. Esclerótica: confere estabilidade mecânica,
2. Caróide: irrigação sangüínea e a
3. Retina: células sensoriais.
Dentro do globo há um líquido transparente: o humor aquoso.
• A pupila é um orifício circular de diâmetro ajustável, através da ação dos
músculos, para regular a quantidade de luz que penetra no olho.
• Estes músculos (íris) exercem esforços radiais sobre a pupila.
• O cristalino é uma lente gelatinosa deformável pela ação dos músculos ciliares.
Já no século XVII, descobriu-se que a retina e não a córnea era
responsável pela detecção da luz. Johannes Kepler e René
Descartes efetuaram os principais avanços da época.
Kepler propôs que a imagem era focalizada na retina. Poucas décadas após,
Descartes mostrou que Kepler estava correto. Para a demonstração, ele
removeu cirurgicamente o olho de um boi. Ele postulou também que a imagem
era invertida, além de concluir que o astigmatismo é conseqüência de
curvatura imprópria da córnea.
Células bastonetes e células cones na retina
Muito embora o microscópio tenha suas primeiras aplicações científicas no
final do Século XVI e inicio do Século XVII, estas técnicas só se tornaram
sofisticadas no Século XIX e foram de auxílio no entendimento da estrutura do
olho.
Na década de 1830, vários pesquisadores alemães usaram microscópio para
examinar a retina. Dois tipos de células foram descobertos na retina – os
bastonetes e os cones – assim chamados devido ao seu formato quando
vistos no microscópio.
Uma visão microscópica de bastonetes de um peixe é exibida a seguir para
indicar como tais células são nos animais. Ambas são fotossensíveis.
Figura. Bastonetes vistos em microfotografia (peixe zebra).
Max Schultze (1825-1874) descobriu que os cones são os receptores de
cores nos olhos e os bastonetes não são sensíveis à cor, mas muito sensíveis
a baixos níveis de luminosidade (vide figura). No olho humano há
abundantemente mais bastonetes do que cones.
Grosso modo, ≅109 bastonetes/retina e ≅106 cones/retina.
Figura. Sensibilidade dos bastonetes (rod) e dos cones (cone) à
incidência de fótons de luz.
Pigmentos Visuais
Durante o século XIX, os pigmentos visuais foram descobertos na retina.
Dissecando os olhos de rãs, verificou-se que a cor modificava-se com a
incidência de luz (a retina é fotossensível). Os discos de membrana
situados nos bastonetes contêm rodopsina (Mr 40.000), uma proteína
sensível à luz. Nos cones, há tipos diferentes de rodopsina, o que
possibilita a visão colorida.
A sensibilidade é devida a um pigmento chamado rodopsina. Estudos
posteriores mostraram que esta é uma proteína e a opsina foi também
descoberta. Pigmentos também são encontrados nos cones e há três tipos de
células cone, de acordo com o pigmento que elas contêm.
Uma teoria original para a visão colorida foi proposta por Thomas Young (1773-1829)
circa 1790, antes mesmo da descoberta das células cone na retina. Young foi pioneiro
em propor que o olho humano vê somente as três cores primárias, R, B e Y e que
todas as cores são combinações destas. Ora, apesar de simplista como teoria, o
trabalho de Young estabeleceu as bases da teoria da visão colorida.
Há menos células cones que células bastonetes na retina. Nos cones, há tipos
diferentes de rodopsina, o que possibilita a visão colorida. O fotorreceptor nos
bastonetes é a rodospsina, constituída de uma apoproteína transmembranar
(opsina) ligada covalentemente ao pigmento absorvedor de luz (11-cis-retinal).
Estrutura 3D da rodopsina.
A percepção de cores em mamíferos se faz através de receptores (células
cones) contendo pigmentos em diferentes sensibilidades espectrais.
• No homem, há usualmente três tipos de cones, conferindo uma visão
tricromática. Nos mamíferos, há cones com sensibilidade (máxima)
nos comprimentos de onda 424 nm, 530 nm e 560 nm. No olho humano,
os cones são maximamente receptivos a três faixas de comprimento de onda
– curto, médio e longo, chamados de cones S, M, L. (tabela).
• Nas aves e peixes, há cones sensíveis nos comprimentos de onda 370
nm (UV), 445 nm, 508 nm e 565 nm.
• Outros primatas e mamíferos são apenas dicromáticos e muitos outros
sequer possuem visão de cor.
• Já nos pássaros e outros seres do reino animal, há evidências definitivas
que a luz ultravioleta desempenha papel fundamental na percepção de
imagens coloridas. Eles possuem visão tetracromática, com quatro tipos
distintos de cones. As aves, lagartos, tartarugas entre outros, possuem
capacidade de visão superior aos mamíferos.
Tabela. Cones presentes no olho humano
Faixa de
Pico de
resposta
sensibilidade
400- 500 nm
420 nm
M
γ (Azul esverdeado) 450 - 630 nm
534 nm
L
ρ (Verde amarelado) 500 - 700 nm
564 nm
Cone
Nome do pigmento
S
β (Azul)
Figura. Resposta dos cones S, M e L no olho humano em função do
comprimento de onda da luz incidente (absorção espectral de rodopsina
purificada). A curva central pontilhada corresponde à resposta global.
Figura. Os quatro tipos de pigmentos presentes nas retinas de aves e
répteis. O pigmento em 370 nm proporciona uma visão em ultravioleta.
Figura. Simulação de detalhes percebidos pela sensibilidade da visão em UV.
Detalhes provavelmente percebidos pelas aves, embora não notados pelo
homem.
http://en.wikipedia.org/wiki/Color_vision
Micrografia de cones e bastonetes em humanos.
O gene “azul” da opsina está localizado no cromossomo 7, enquanto que os genes
“vermelho” e “verde” estão localizados no cromossomo X.
A cegueira para cores, tais como a inabilidade de distinguir vermelho e verde, é
comumente hereditária.
John Dalton (1766 – 1844)
Há vários tipos de cegueira à cor, dependendo da mutação ocorrida na opsina.
Algumas vezes, não há resposta em uma dada faixa espectral, conduzindo a uma
visão dicromática (dicromáticos vermelho- e dicromáticos verde-).
Em alguns casos, existem os fotoreceptores para R e G, mas a mudança na proteína
conduz a uma mudança na faixa espectral absorvida, resultando em visão anormal
(tricromáticos vermelho–anômalo, tricromáticos verde–anômalo).
Os
mecanismos
de
percepção
de
cor
dependem
de
fatores
evolucionários, que provavelmente tem ligação com os imperativos na
busca e reconhecimento de fontes de alimentos.
Nos primatas herbívoros, a percepção de cor é essencial para encontrar
alimentos adequados (por exemplo, maduros). Por outro lado, mamíferos de
hábitos noturnos têm sistemas com sensibilidade reduzida à cor, uma vez que
não há luz suficiente para o funcionamento adequado de cones.
Figura. Visão monocromática × visão tricromática. Efeitos evolucionários.
Os pigmentos presentes nos cones L e M são codificados no cromossomo X do
genoma; e sua deficiência conduz as formas mais comuns de cegueira a cores. As
freqüências da luz que estimula cada dentre estes tipos de receptores com uma
intensidade variável.
• A luz amarela, por exemplo, estimula ambos os cones L e M com extensão moderada, mas
apenas fracamente os cones do tipo S.
• A luz vermelha, por outro lado, estimula quase que exclusivamente os cones do tipo L, e
• A luz azul quase que exclusivamente os cones S.
O sistema visual combina a informação dos receptores e dá origem a
diferentes percepções para diferentes comprimentos de onda da luz.
Quando um pigmento dos cones absorve fótons de luz, a energia recebida o faz mudar
de conformação, o que desencadeia eventos moleculares que conduzem à excitação
da célula cônica. Esta célula ativa, por sua vez, neurônios na retina, transmitindo
informação sobre a luz recebida através do nervo óptico até o cérebro. Quanto mais
intensa a fonte luminosa, mais fótons absorvidos e maior a excitação dos cones.
PERCURSO DA INFORMAÇÃO VISUAL
Bastonetes e cones formam sinapses com vários neurônios interconectores que
transportam e integram os sinais elétricos.
As
sinapses
dos
fotorreceptores
interneurônios
que
são
fotorreceptoras.
inervados
ocorrem
por
em
diferentes
camadas
superpostas
combinações
de
de
células
Os sinais passam aos neurônios ganglionares para o nervo óptico e seguem daí até
o cérebro.
As células ganglionares transmitem características visuais distintas em via paralelas
múltiplas; esse processo permite a interpretação de diferentes características do
estimulo visual (forma, cor, profundidade, movimento etc.).
Todos esses sinais são processados e interpretados por uma porção do
cérebro denominada córtex visual.
Figura. Detalhes da estrutura de bastonetes. Ligação neuronal para
transmissão da informação.
FIGURA. Localização dos sítios de processamento da informação óptica no cérebro.
FATOS BIOQUÍMICOS – TRANSDUTORES SENSORIAIS (ÓPTICOS)
O fotorreceptor nos bastonetes é a rodospsina, constituída de uma apoproteína
transmembranar (opsina) ligada covalentemente ao pigmento absorvedor de luz (11cis-retinal).
Passo no mecanismo da visão.
P1. cis-retinol é convertido em todo trans-retinol
P2. rodopsina torna-se ativada
P3. A concentração de cGMP decresce (guanosina-monofosfato cíclico)
P4. Bloqueio de entrada de Na+ (fechamento do canal)
P5. bastonete hiperpolarizado
P6. Liberação de glutamato (ou aspartato)
P7. Um potencial de ação despolariza a célula adjacente
P8. Isto despolariza o neurônio ganglionar associado o qual envia o sinal ao córtex.
A incidência de luz dispara mudanças de conformação no receptor rodopsina.
Mudanças conformacionais devidas à absorção de fótons na rodopsina.
E1 – o pigmento 11-cis-retinóico absorve luz visível
E2 – isomerização da porção 11-cis-retinóica para todo-trans-retinal.
E3 – opsina ativada é instável e dissocia-se espontaneamente,
liberando opsina e todo-trans-retinol.
E4 – no escuro, o todo-trans-retinol é convertido em 11-cis-retinol.
Rodopsina na membrana celular.
Bastonetes e cones tem um potencial transmembranar elétrico produzido pelo
bombeamento de Na+, K+ ATPase (segmento interno) e um canal iônico permite a
passagem de Na+ ou Ca2+, controlado por cGMP.
cenário
Potencial da
Canais
neurotransmissores
membrana
iônicos
No escuro
- 30 mV
abertos
Secretando continuamente
No claro
-35 mV
fechados
Decréscimo da liberação
Na conformação excitada, a rodopsina interage com a transducina que paira
próxima aos discos. A transducina (T) pertence à família de proteínas ligantes
ao GTP (guanosina-trifosfato) como a Gs e G1. No escuro, a GDP (guanosina
di-fosfato) é liberada e as subunidades Tα , Tβ e Tγ permanecem juntas.
Quando a rodopsina é excitada pela luz
dissociando Tα e Tβ,γ.
A Tα ligada à GTP conduz o sinal ao cGMP fosfodiesterase (PDE), uma
enzima que converte o cGMP em 5’-GMP.
3’,5’-cGMP + H2O Æ 5’-GMP
A PDE é uma proteína integral com sítio ativo no lado citosólico do disco
membranar. Quando a Tα-GTP liberada e a atividade da enzima cresce em
ordens de magnitude.
Cada PDE ativa consegue degradar muitas moléculas de cGMP em 5’-GMP
inativo, baixando então a concentração de cGMP no segmento externo.
Com a baixa da concentração, o canal iônico controlado por cGMP fecha e a
entrada de Na+ e Ca2+ é bloqueada, hiperpolarizando a membrana do
bastonete ou cone. Por este processo, o estímulo inicial (fóton) modifica o
potencial membranar da célula.
AMPLIFICAÇÃO
Cada molécula de rodopsina ativa pelo menos 500 moléculas de transducina,
cada uma das quais pode ativar uma molécula de PDE. O PDE tem uma
enorme quantidade de voltas e pode hidrolisar cerca de 4.200 moléculas de
cGMP por segundo. A ligação do cGMP ao canal iônico é cooperativa (≥ 3
moléculas de cGMP devem estar ligadas para abrir o canal). Assim, a
absorção de um único fóton leva ao fechamento de milhares de canais iônicos
e modifica o potencial da membrana em aproximadamente 1 mV.
Quanto maior a incidência de fótons, mais canais iônicos se fecham e menos
Na+
cruza
a
membrana.
Isto
implica
em
menor
liberação
de
neurotransmissores.
Células em humanos podem detectar flash de cinco fótons, bloqueando o
influxo de 10.000.000 íons de Na+/fóton devido ao fechamento de centenas de
canais.
TERMINAÇÃO
Imediatamente após cessar a iluminação dos fotorreceptores, o sistema
fotossensível desliga-se. A subunidade Tα da transducina tem atividade
GTPase intrínseca. Em milissegundos, o GTP é hidrolisado e a Tα ressocia-se
com Tβ,γ. A subunidade inibitória I da PDE que tinha se ligado ao Tα-GTP
reassocia-se ao PDE. A concentração de cGMP retrona ao nível do escuro e a
enzima gualilil ciclase converte a GTP em cGMP numa reação que é inibida
por uma alta concentração de Ca2+.
O domínio carboxil-fosforilado terminal da rodopsina é ligado pela arrestina
(evitando interações entre a rodopsina ativada e a transducina).
Após um longo período (segundos ou minutos), o todo-trans-retinol da
molécula de rodospsina excitada é removido e substituído pelo 11-cis-retinol,
produzindo assim rodopsina pronta para a próxima rodada de excitação
óptica.
CONCLUSÃO
Procurou-se apresentar uma visão panorâmica de aspectos ligados à
visão de seres vivos, no intuito de melhor conhecer a abordagem
adotada pela natureza.
A idéia é que tais mecanismos possam auxiliar nos modelos de visão
biônica, artificial e/ou computacional.
Aumento da resolução da imagem
original