ECO 184
Economia da Energia
André G.Ghirardi
Energia e Termodinâmica1
Todos os processos, naturais ou fabricados, requerem a transformação de uam forma de energia para alguma
outra. A termodinâmica estuda os princípios que regem estas transformações.
A contabilização da energia em suas diversas transformações está fundamentada em dois conceitos conhecidos
como priemira e segunda leis da termodinâmica.
A primeira lei, também conhecida como lei de conservação de energia, afirma que energia não pode ser
criada nem destruída. Se alguma forma de energia desaparece, isto é compensado pelo aparecimento da
mesma quantidade de energia sob alguma outra forma, ou em outro lugar. Isto é, a quantidade total de energia
num sistema fechado é constante, embora transformações possam alterar a distribuição da energia no sistema.
Em vista disto, é incorreto falar em consumo de energia. Energia pode ser usada, mas nuca consumida. O
que pode ser consumido são as diversas formas de energia como combustíveis e eletricidade. Considere-se a
queima de uma quantidade de combustível. Toda a energia química ali contida reaparece na forma de energia
mecânica, térmica, eletromagnética e outras que, somadas, são exatamente iguais à energia originalmente
contida no combustível.
Se a energia é a capacidade de realizar trabalho e não pode ser destruída, o que é perdido numa
transformação? o que ocorre é que as diferentes formas de energia não são igualmente conversíveis em
trabalho útil ou aplicado. A perda que ocorre numa transformação refere-se à conversão de energia de uma
forma “mais útil” para outras “menos úteis”. O grau de conversibilidade da energia em trabalho útil é às vezes
denominado disponibilidade.
As formas de energia com alta disponibilidade são aquelas que podem ser pode ser facilmente convertidas em
trabalho útil. São formas nobres. Por outro lado, há formas de energia que dificilmente podem ser
convertidas em trabalho útil. São formas pobres. Energia que passa de uma forma nobre para uma forma
pobre sofre um processo de degradação. A eletricidade e a energia química da gasolina são exemplos de
formas nobres. O calor contido nos resíduos de combustão de um motor é um exemplo de forma pobre de
energia.
O indicador de disponibilidade de energia térmica de uma substância é a diferença entre a temperatura
desta substância e a de seu ambiente. Quanto maior a diferença de temperatura entre uma substância e seu
ambiente, maior é a capacidade de conversão da energia térmica em trabalho útil.
A segunda lei da termodinâmica afirma que todos os processos, naturais ou fabricados, ocorrem de forma tal
que a disponibilidade da energia diminui. O que se consome ao usarmos energia não é a energia em si, mas
sua disponibilidade para se converter em trabalho útil. A segunda lei tem várias formulações e implicações,
tais como:
em qualquer transformação de energia, parte da energia é degradada.
é impossível existir um processo cujo único resultado seja a transformação de energia térmica em
trabalho útil.
é impossível existir um processo cujo único resultado seja a transferência de calor de um corpo
mais frio para outro mais quente.
a disponibilidade de uma dada quantidade de energia só pode ser usada uma vez.
1
Adaptado de Erlich,P., Erlich,A.; e Holdren, J.- Ecoscience. W.H.Freeman &Co, 1977.
1
em todo processo espontâneo concentrações tendem a se dispersar, estrutura tende a desaparecer,
e ordem tende a desordem.
A relação formal entre ordem e disponibilidade de energia é estabelecida em termodinâmica através do
conceito de entropia. Entropia é uma medida de desordem e que pode também medir a indisponibilidade de
energia. Pode-se formular a segunda lei como: todos os processos físicos acontecem de forma que a entropia
total do universo aumenta.
Dois corpos, um quente e outro frio, são colocados em contato. A temperatura do corpo quente diminui e a do
corpo frio aumenta, até ficarem iguais. Calor flui do corpo mais quente para o mais frio. O processo inverso
(calor flui do frio para o quente) não transgride a primeira lei, de conservação de energia, mas é impossível em
vista da segunda lei.
Em muitas situações as leis da termodinâmica permitem pre-determinar a eficiência máxima que poderia ser
atingida por uma máquina perfeita, sem necessidade de especificar nenhum detalhe da máquina. Esta
eficiência é definida como a razão entre trablho útil e o fluxo total de energia).
Existem portanto limites determinados à inovação tecnológica. Estes limites decorrem de leis fundamentais
da natureza.
Decorre das leis da termodinâmica que toda a energia usada na terra, qualquer que seja sua origem, terminará
degradada em calor. É portanto possível que a sociedade humana torne a Terra intoleravelmente quente com
os resíduos de energia degradada, muito antes de exaurir as formas nobres de energia.
Identificação da Energia2
O trabalho de Carnot se baseou num engano. Assim mesmo se constituiu na base para o estudo da
termodinâmica. Carnot acreditava que a quantidade de calórico se conservasse na realização do trabalho. Ele
imaginou que a quantidade de calor se conservasse, e que o trabalho fosse gerado pelo fluxo de fluido calorico
da fonte quente para a fria.
Esta confusão foi resolvida por três pessoas, todas elas nascidas em torno de 1820.
O primeiro foi J.P. Joule. Seus experimentos realizados na década de 1840 confirmaram que o calor não se
conserva. Ele demonstrou que através de medidas precisas que o trabalho pode ser convertido
quantitativamente em calor, dando origem ao conceito de equivalente mecânico de calor, pelo qual calor e
trabalho são mutuamente conversíveis, e que calor não é uma substância, um fluido.
William Thomson (Lord Kelvin) encountrou-se com Joule em 1824 e ficou surpreso pela refutação da
conservação de calor apresentada por Joule. Ele desenvolveu a idéia de que havia duas leis subjacentes a
estas experiências, e intuiu que o trabalho de Carnot poderia sobreviver sem contradizer as descobertasde
Joule. Daí surgiu o estudo da termodinâmica, a teoria da ação mecânica do calor.
A terceira pessoa foi Rudolf Clausius. Ele também notou que o caso de Carnot vs Joule poderia ser resolvido
se houvesse dois princípios naturais subjacentes. Ele eliminou o conceito de calórico e foi mais
adiante,conjeturando sobre como calor poderia ser explicado em termos do comportamento das partículas que
compõem a matéria. Data daí a termodinâmica moderna.
Nascido numa geração posterior, Ludwig Boltzman estabeleceu a ligação entre propriedades da matéria
extensa e o comportamento de suas partículas individuais, seus átomos. Note-se que ele realizou este trabalho
antes que a existência de átomos fosse amplamente aceita (verificar datas Dalton).
As Leis da Termodinâmica
2
Adaptado de Atkins, P.W. - The 2nd Law - Energy, Chaos and Form, Scientific American Books, NY, 1984.
2
A termodinâmica se baseia em algumas proposições que resumem a experiência acumulada com a forma como
a energia se comporta através de suas transformações. Estas proposições são as leis da termodinâmica.
Há quatro leis. A chamada Lei Zero é como uma reflexão final; foi a última a ser estabelecida. Formulada
em torno de 1931, ela se reporta à possibilidade de definir a temperatura de corpos e substâncias.
A Primeira Lei é enunciada popularmente como “a energia se conserva”. Esta foi a idéia chave apresentada
ao mundo na década de 1850 por Kelvin e Clausius. O que se conserva é energia e não calor. Energia
destronou o conceito mais tangível de força, que era considerado o conceito unificador, desde que Newton
mostrou como tratá-lo matematicamente.
A Segunda Lei reconhece a existência de uma dissimetria fundamental na natureza: embora a quantidade de
energia se conserve em todos os processos, a distribuição desta energia se altera de uma forma irreversível.
A Terceira Lei se refere à propriedade de substâncias a temperaturas muito baixas. Ela afirma que não se
pode levar matéria à temperatura de zero absoluto em um número finito de passos. Há uma diferença entre
esta lei e as outras. Esta parece assumir que a matéria é atômica, enquanto que as outras são sumários de
experiência direta, não dependendo deste tipo de hipótese.
O Ciclo de Carnot
A máquina a vapor (motor) é essencialmente algo que converte calor em trabalho mecânico de forma cíclica,
retornando periodicamente a sua condição inicial. Em princípio pode operar indefinidamente, alimentando-se
da energia suprida pela fonte quente que, por sua vez, é alimentada pela energia da queima do combustível.
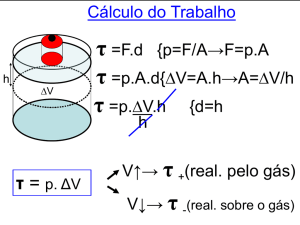
O ciclo de Carnot é uma abstração. Consiste de gás confinado num cilindro dotado de um pistão. O cilindro
pode ser posto em contato com uma founte quente, ou uma fonte fria, ou ser isolado termicamente. Note-se
que o motor de Carnot não captura o funcionamento real de um motor, já que no motor de Carnot o vapor não
é admitido diretamente no cilindro.
Para compreender o ciclo do motor é preciso conhecer algumas propriedades elementares dos gases. A
primeira delas é que à medida que uma dada quantidade de gás é confinada em um volume cada vez menor (à
medida que o pistão entra no cilindro), sua pressão aumenta. A dimensão deste aumento depende de como é
feita a compressão. Se o gás é mantido em contato com um reservatório térmico (bloco de ferro, gelo, água),
sua temperatura permanece constante, e a compressão é dita isotérmica. Nesta circunstâncias o aumento de
pressão segue uma das isotermas.
FIGURA
Por outro lado, o gás pode ser térmicamente isolado (cilindro enrolado em material isolante), de forma que
não haja troca de calor entre o gás e seu entorno. Esta compressão é dita adiabática.
A observação experimental mostra que durante uma compressão adiabática a temperatura do gás aumenta. O
aumento de temperatura amplia o aumento de pressão que resulta do confinamento propriamente dito (porque
a pressão aumenta com a temperatura); de forma que durante uma compressão adiabática, a pressão sobe mais
rapidamente do que durante uma compressão isotérmica.
Este comportamento se inverte no caso de expansão. Se a expansão for isotérmica, a pressão cai à medida que
aumenta o volume; se a expansão for adiabática, a pressão cai ainda mais rapidamente, porque o gás também
se esfria.
O primeiro estágio do ciclo de Carnot é a expansão isotérmica do gás. A alta pressão empurra o cilindro, e o
eixo se move. Esta é a fase potente do ciclo. Para compensar a tendência do gás a esfriar durante a expansão,
3
deve-se suprir energia da fonte quente. Portanto esta também é a fase que consome combustível, absorve
calor, da fonte quente.
Poderíamos simplesmente permitir que o eixo continuasse a rodar, retornando o pistão a sua posição inicial
por uma compressão igualmente isotérmica. O gás seria restituído a seu estado original. Este ciclo satisfaria
um dos critérios, ou seja, o ciclo seria completo, o gás retornaria ao estado inicial, e o motor estaria pronto
para um novo ciclo. Este seria o chamado Ciclo Atkins, que é totalmente inútil, já que para retornar o pistão
à posição inicial, é necessário o mesmo trabalho feito durante a fase de potência.
Para tornar útil o ciclo, temos que fazer de forma que nem todo o trabalho gerado na fase de potência seja
reabsorvido para restituir o gás a sua condição inicial. Uma forma de reduzir a pressão do gás é reduzir sua
temperatura. Pode-se fazer isto incluindo no ciclo um estágio de expansão adiabática.
O passo essencial no ciclo de Carnot, portanto, é interromper o contato com a fonte quente antes que o pistão
chegue ao fim da descida. O eixo continua a se mover e o gás continua a se expandir, só que de forma
adiabática, de forma que tanto sua temperatura como sua pressão caem. Esta fase ainda é de potência, só que
agora estamos realizando a energia acumulada no gás, já que ele não conta mais com o suprimento da fonte
quente.
Temos agora que retornar o gás a sua condição inicial. O primeiro passo para isto requer que se empurre o
pistão-realizando trabalho-reduzindo o volume até seu valor inicial. Este passo é feito com o gás em contato
com a fonte fria, de modo a garantir que a pressão se mantenha o mais baixa possível. à medida que o pistão
sobe, o gás tende a se aquecer, mas o contato com a fonte fria permite que se descarregue a energia excedente.
O volume do gás se encontra agora próximo ao original, mas a temperatura está baixa. Assim, antes que o
eixo complete a volta, interropemos o contato com a fonte fria, e permitimos que o trabalho de compressão
adiabática aumente a temperatura do gás. Escolhendo o momento certo, podemos fazer com que este final de
curso do pistão comprima o gás até o volume inicial e também o aqueça até a temperatura inicial. Desta forma
o ciclo está completo.
O motor retornou exatamente a sua posição inicial, ese produziu trabalho. Mais trabalho foi produzido na
fase de potência do que foi absorvido na fase de restauração, porque o trabalho de compressão foi feito a
pressão menor.
Há um ponto extremamente importante, que é a fonte fria. Sem a fonte fria estamos confinados ao inútil ciclo
Atkins. O preço que pagamos para obter trabalho do calor absorvido da fonte quente é que temos que jogar
fora parte deste calor. Isto capta a essência da visão de Carnot de que o motor é uma máquina de energia.
Energia cai da fonte quente para a fria e é conservada; mas em virtude da necessidade de acelerar este fluxo
do quente para o frio, podemos aproveitar apenas parte da energia na forma de trabalho.
Pode-se generalizar. O ciclo de Carnot é apenas uma forma de se extrair trabalho do calor. Mas a experiência
mostra que em todo motor deve haver uma fonte fria, e durante algum ponto do ciclo alguma parte da
energia tem que ser descartada.
Surge então a segunda lei. A natureza aceita a equivalência de calor e trabalho, mas exige uma contribuição
sempre que calor é convertido em trabalho. Eis a dissimetria: a natureza não exige contribuição para
converter trabalho em calor: podemos dissipar trabalho em calor completamente. Há um imposto sobre calor,
mas não sobre trabalho.
A Natureza do Calor e Trabalho
Talvez as contribuições mais significativas da termodinâmica do século XIX tenha sido a compreensão de que
calor e trabalho são nomes de métodos, e não nomes de coisas. Ambos são formas de transferência de
energia. Aquecer um objeto é transferir energia para ele através de diferença de temperatura, colocando-o em
contato com um corpo mais quente. Resfriar um objeto é retirar energia dele através de diferença de
4
temperatura, colocando-o em contato com um corpo mais frio. Trabalho é a transferência de energia que não
requer diferença de temperatura como, por exemplo, levantar um corpo a uma certa altura, ou deslocar um
corpo sobre uma superfície.
Portanto, é impreciso dizer que “calor foi convertido em trabalho”; o que ocorre é que energia foi
transferida de uma fonte via aquecimento e em seguida transferida novamente na forma de trabalho.
Uma das versões formais da segunda lei é a de Kelvin , segundo a qual nenhum processo é possível cujo
único resultado seja a absorção de calor de um reservatório e sua completa conversão em trabalho. Note-se
a dissimetria: a lei diz que é impossível a completa conversão de calor em trabalho, mas nada diz sobre o
inverso, a conversão de trabalho em calor. Portanto, embora calor e trabalho sejam equivalentes no sentido
de que são formas de conversão de energia, eles não são equivalentes quanto à forma desta conversão.
Outra versão formal da segunda lei é a de Clausius e diz que nenhum processo é possível cujo único
resultado seja a transferência de energia de um corpo frio para um corpo quente.
5