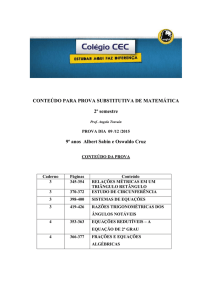
EQUAÇÕES DE ESTADO
Prof. Dr. Félix Monteiro Pereira
Equações de Estado
• São expressões analíticas que relacionam as
propriedades volumétricas de um fluido da
seguinte forma:
P PT ,V , n1 , n2 ,
V V T , P, n1 , n2 ,
Equações de Estado
Equações de Estado (EDE)
• Equação corrigida do gás perfeito
• Equação do virial
• Equações cúbicas
• Equações não-cúbicas
Equações de Estado
EDE – Fator de compressibilidade Z (gráfico)
P.v Z.R.T
É NECESSÁRIO CONHECER PR E TR PARA DETERMINAR Z
P
PR
PC
T
TR
TC
Equações de Estado
EDE – Fator de compressibilidade Z (gráfico)
Equações de Estado
EDE – Fator de compressibilidade Z (gráfico)
Z = 1 (Pressões baixas)
• moléculas estão muito afastadas umas das outras,
• não há efeito de forças intermoleculares,
• o fluido se comporta como um gás ideal.
Z < 1 (Pressões moderadamente altas)
• as moléculas vão se aproximando umas das outras,
• as forças de atração intermolecular tornam-se dominantes,
• o volume diminui mais do que deveria diminuir se não houvesse forças de
atração intermolecular.
Z > 1 (Pressões muito altas)
• as moléculas ficam muito próximas umas das outras, de tal forma que as
forças repulsivas tornam-se dominantes,
• como consequência, o volume aumenta mais do que deveria aumentar se
não houvesse forças de repulsão intermolecular.
Equações de Estado
EDE - Equação do Virial
• É obtida a partir da expansão de Z como uma série de
potências de (1/V), a certa temperatura T, e pressão P0,
da seguinte forma: Z 1 B C D
V
V2
V3
• Essa equação pode ser escrita em termos de uma
expansão em série de potências para a pressão, dada por:
Z 1 B'.P C'.P 2 D'.P 3
• Os 2o e 3o. coeficientes viriais dessas 2 equações se
relacionam da seguinte forma:B' B C' C B 2
R .T
R.T 2
Equações de Estado
EDE - Equação do Virial
• Na prática, a equação virial é utilizada truncada no 2o
termo. O segundo coeficiente virial pode ser obtido de 2
formas: - A partir de dados PVT experimentais;
- A partir de correlações empíricas (predição), na
ausência de dados PVT (Ex: correlações de
Tsonopoulos, Hayden-O’Connell, etc.)
F 0 0,1445
BPc
F 0 F 1
RTc
F
1
0,330 0,1385 0,0121 0,000607
2
3
TR
TR
TR
TR8
0,331 0,423 0,008 log P
0,0637 2 3 8
P
TR
TR
TR
c
sat
1,000
TR 0, 7
Equações de Estado
EDE – Equações Cúbicas – Forma generalizada
(explícita em P)
R.T
a
P
2
v b v u.b.v wb 2
Equações de Estado
EDE – Equações Cúbicas – Observações
• As EDE cúbicas devem descrever o comportamento dos
fluidos no ponto crítico, satisfazendo as condições
matemáticas nesse ponto, dadas pelas seguintes equações:
P
0
V Tc
2P
0
V 2
Tc
onde P = Pc e V = Vc.
• Os parâmetros a e b são determinados a partir dessas
equações.
Equações de Estado
EDE – Equações Cúbicas – Substâncias Puras
Comportamento PTv calculado pela EDE
Equações de Estado
EDE – Equações Cúbicas – Substâncias Puras
• A temperaturas supercríticas (T > TC), todas as EDEs
cúbicas, quando resolvidas para o volume, apresentam 1
raiz real e 2 raízes complexas.
• A temperaturas subcríticas (T < TC), as EDEs cúbicas
podem ter até 3 raízes reais. Nesse caso, a maior raiz
corresponde ao volume do vapor, a menor raiz é o
volume da fase líquida e a raiz intermediária não tem
significado físico.
• As EDEs cúbicas cujo parâmetro “a” não seja função da
temperatura (ex: VdW e RK) não dão bons resultados
para o cálculo da pressão de vapor.
Equações de Estado
EDE – Equações Cúbicas – Substâncias Puras
• As EDEs cúbicas cujo parâmetro “a” é função da
temperatura (ex: SRK e PR) dão bons resultados para o
cálculo da pressão de vapor de compostos apolares.
• As EDEs cúbicas SRK e PR dão bons resultados também para
o volume molar do vapor.
• Para compostos apolares e TR < 1, os resultados do cálculo
de volume do vapor são satisfatórios. Para TR = 1 e PR > 1, os
resultados apresentam grandes erros, pois o volume nessa
região é muito sensível à pressão.
Equações de Estado
EDE Polinomiais em Z - Exemplos
Van der Waals
R.T
a
P
2
v b v
v
ZRT
P
A
aP
R 2T2
B
bP
RT
Peng-Robinson
P
v
R.T
a
v b vv b b(v b)
ZRT
P
A
aP
R 2T2
B
bP
RT
Z 3 (1 B) Z 2 ( A 2B 3B 2 ) Z
AB B 2 B 3 0
Equações de Estado
EDE – Equações Cúbicas – Exemplo
Determinação das propriedades termodinâmicas
usando EDE cúbicas
Calcular o volume do CO2 a 230 °C e 5 MPa de pressão
usando os seguintes métodos:
a) Tabelas termodinâmicas,
b) EDE cúbica (VDW e PR).
Solução.
Para o CO2, tem-se
PC = 7,383 MPa ; TC = 304,21 K
;
w = 0,22362
Equações de Estado
EDE – Equações Cúbicas – Exemplo
a) Tabelas termodinâmicas.
P (kPa)
3000
5000
6000
v (m3/kg)
0,03103
v
0.01522
v (m3/kg) = 0,02049
Equações de Estado
EDE – Equações Cúbicas – Exemplo
Van der Waals
ZRT
v
P
A
aP
R 2T2
bP
B
RT
Resolvendo no scilab:
coef 1
coef 2
coef 3
coef 4
Z1
Z2
Z3
1
-(1+B)
A
-AB
1.0000
-1.0512
0.1044
-0.0053
0.9469
0.0521 + i* 0.0536
0.0521 - i* 0.0536
Apenas uma raiz real !!!!!!!!!!!!!!!!!!!!
ZRT
v
P
v
792.22
cm3/mol
v
0.0180
m3/kg
Equações de Estado
EDE – Equações Cúbicas – Exemplo
c) EDE CÚBICA.
PENG-ROBINSON
R.T
a
P
v b vv b b(v b)
v
ZRT
P
A
aP
R 2T2
B
Tc
Pc
w
R
PM
T
P
Z 3 (1 B) Z 2 ( A 2B 3B 2 ) Z
AB B 2 B 3 0
bP
RT
304.21
K
7.383
MPa
0.2236
8.3145 cm3.MPa/K.mol
44.01 g/mol
503.15
5
K
MPa
Equações de Estado
EDE – Equações Cúbicas – Exemplo
b=
a=
m
a(T)
a1
b1
0.8231
0.5845
231589.15
26.65
(cm3)2.MPa/mol2
cm3/mol
A
B
0.0662
0.0319
(adimensional)
(adimensional)
Equações de Estado
EDE – Equações Cúbicas – Exemplo
Peng-Robinson
Z 3 (1 B) Z 2 ( A 2B 3B 2 )Z AB B 2 B3 0
Z1
Z2
Z3
coef 1
coef 2
1
-(1-B)
1.0000
-1.0319
coef 3
A - 2B - 3B2
-0.0006
coef 4
-AB + B2 + B3
-0.0011
1.0335
-0.0008 + i* 0.0326
-0.0008 - i* 0.0326
ZRT
v
P
Apenas uma raiz real !!!!!!!!!!!!!!!!!!!!
v
864.73
cm3/mol
v
0.0196
m3/kg