Capitulo 17: Ciclo de divisão celular (aula 7 -
2º semestre)
- forma fundamental de reprodução dos seres vivos
- substituição de células danificadas ou perdidas por morte celular programada
- produz um par de células geneticamente idênticas, após replicação fiel do
DNA e segregação de duas células filhas
Sistema de controlo do ciclo celular
Antigamente: estudado pela observação de eventos de segregação
cromossómica por microscopia óptica e replicação do DNA medindo-se a
incorporação de precursores radioactivos.
Recentemente: pensa-se que o sistema coordena um ciclo como um todo
através da activação/desactivação de proteínas.
O ciclo celular é dividido em interfase e mitose seguido de citocinese.
Interfase
Periodo mais longo, de duração variável, no qual ocorre aumento celular e
replicação do DNA
G1- intervalo entre o término da mitose e a síntese de DNA, no qual a células
monitoriza o seu crescimento e tamanho.
Fase S – momento de replicação do DNA e génese dos centriolos.
G2- intervalo entre a síntese e o inicio da mitose seguinte, fornecendo um
intervalo que assegura uma completa replicação.
G1 e G2 proporcionam o tempo necessário ao crescimento celular. Células em
G1 podem interromper o seu crescimento e permanecer num estado de
repouso chamado G0.
Os ciclos de células embrionárias nos estágios iniciais são os ciclos mais
curtos que se conhecem, pois ocorrem sem crescimento – G1 e G2 são
drasticamente encurtados – sendo metade do tempo gasto com a fase S e
metade com a fase M.
Como podemos saber em que parte do ciclo celular se encontra uma
célula?
Células em fase S podem ser reconhecidas pela incorporação de moléculas
marcadas de timidina – composto utilizado pelas células exclusivamente para
síntese de DNA. O marcador pode ser radioactivo ou químico (3H- timidina ou
bromodesoxiuridina – BrdU). Os núcleos das células são reconhecidos por
auto-radiografia (aparecem grânulos de prata – manchas pretas) ou por
coloração com anticorpo anti-BrdU)
Normalmente, numa população de células em crescimento cerca de 30%
estarão em fase S (são marcadas pelo precursor de DNA): Esta técnica permite
também calcular o tempo que uma célula demora a passar da fase S para
G2→fase M→fase G1→novamente fase S.
Podemos também saber em que fase do ciclo se encontra a célula pela
medição do seu conteúdo de DNA, o qual duplica na fase S, usando um
aparelho que mede a fluorescência das células activadas (directamente
proporcional à quantidade de DNA) → técnica que permite a análise de um
elevado número de células e saber a duração das fases G1, S e G2+M
seguindo-se um conjunto de células em dada fase, usando as medidas de DNA
para monitorizar o progresso destas.
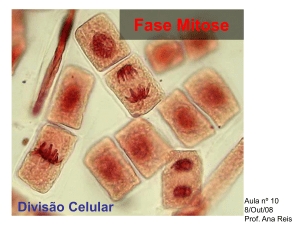
Mitose
A mitose começa com a profase, que é marcada por um aumento da
fosforilação da proteínas especificas, disparado pela actividade da MPF
(proteinoquinase mitose-induzida). Uma consequência dessa fosforilação é
uma distribuição anormalmente dinâmica dos microtubulos, agregados nos
centrossomas duplicados que formam os pólos do fuso. Um subgrupo dos
microtubulos de cada centrossoma torna-se estável aparentemente por
ligações cruzadas a microtubulos do centrossoma oposto, formando os
microtubulos polares, que parecem agastar os pólos. Após o desmantelamento
do envelope nuclear na pró-metafase os cinetocoros nos cromossomas
condensados capturam e estabilizam outros subgrupos de microtbulos dos
tantos que crescem continuamente em cada pólo do fuso. Os microtubulos com
cinetocoros de pólos opostos empurram os cinetocoros de cada cromossoma
duplicado em direcções opostas, criando uma tensão que estabiliza a ligação
com o cinetocoro. Forças em equilíbrio nos cinetocoros também conduzem os
cromossomas para o equador do fuso, formando a placa metafásica. As
subunidades de tubulina nos microtubulos do fuso na metáfase sofrem uma
transferência continua do equador para os pólos do fuso. Na anafase, as
cromatides-irmãs afastam-se repentinamente e são puxadas para pólos
opostos (movimento da anafase A). Neste meio tempo, os dois pólos afastamse (movimento da anafase B). na telofase, o estágio final da mitose, o envelope
nuclear é reconstruído na superfície de cada grupo de cromossomas separado,
à medida que proteínas foram fosforiladas no inicio da fase M vão sendo
desfosforiladas.
Ambiente e crescimento
O crescimento é um processo contínuo, no qual ocorre síntese de RNA a
velocidade constante, interrompido brevemente pela mitose, em que os
cromossomas se condensam para permitir a transcrição, e citocinese, quando
a células se divide.
A maioria das proteínas são sintetizadas aleatoriamente durante as várias
fases do ciclo, havendo, no entanto, proteínas-chave que são activadas a alta
velocidade em estágios específicos: histonas na fase S (formação de nova
cromatina)
Sistema controle geral
Dispositivo bioquímico que opera ciclicamente seguindo uma sequencia
especifica, constituindo por uma série de proteínas em interacção que induzem
e coordenam os processos dependentes → regulado por processos de
retroalimentação para que em caso de atraso/interrupção de uma fase a
células não fique comprometida.
Pontos de controlo: pontos estratégicos de interrupção por sinais de
retroalimentação → previnem que seja accionado um processo sem que o
anterior esteja concluído.
→ permitem que o ciclo celular também seja regulado por
factores ambientais (normalmente no final de G1 e G2)
Ponto de inicio/START: é o ponto de controlo de G!, determinado
essencialmente por sinais externos (nutrientes disponíveis).
- depois de passar este ponto é activada a fase S, seguindo-se a divisão celular
- se as circunstancias impedem a divisão celular é neste ponto que as células
repousam
- supõe um ponto de decisão em que a célula supervisiona os sinais ambientais
e coordena o crescimento para que seja viável na divisão celular.
O sistema de controlo baseia-se em proteínas que são:
Proteinoquinases. Há duas famílias
- proteinoquiases ciclino-dependentes (Cdk) – induzem processos
dependentes pela fosforilação de proteínas seleccionadas ao nível dos seus
resíduos de serina e treonina. Cada passo de activação/inactivação inicia
reacções que desencadeiam o processo seguinte, marcando uma transição no
ciclo celular.
- ciclinas – proteínas activadoras especializadas que se ligam CdK e
controlam a sua capacidade de fosforilar proteínas-alvo. As ciclinas são assim
chamadas por sofrerem um ciclo de síntese e degradação em cada ciclo
celular. Há ciclinas mitóticas – ligam-se às Cdk durante G2 para iniciar a mitose
– e ciclinas G1 – unem-se às Cdk durante G1 para iniciar a fase S.
A formação, activação e separação dos complexos de ciclina-Cdk. Uma
acumulação de cilcinas fá-las formar complexos com as Cdk (MPF). À medida
que estes complexos se formam as Cdk’s são fosforiladas em 2 posições
importantes: ao nível da treonina 161, que torna as Cdk’s activas e duplamente
ao nível de treonina 14 e treonina 15. Esta fosforilação ao nível da tirosina 15
vai levar à inactivação das Cdk’s, o que leva à acumulação dos complexos
inactivos. Cdk-ciclina. A transição G1-M é feita pela desfosforilação da tirosina
15 e treonina 14 pela fosfatase cdc 25. Uma vez activadas as cdk’s vão
fosforilar diversas proteínas que induzem os acontecimentos da fase M. por
ouro lado, estando as cdk’s activas, então elas vão despoletar a degradação de
ciclinas.
Em leveduras, a mesma Cdk fornece a actividade quinásica em ambos os
pontos de controlo (G1 e G2) enquanto que em mamíferos há pelo menos duas
proteínas, um em cada ponto de controlo.
Quais os eventos que levam a célula a entrar em mitose?
Processo de entrada em mitose:
- acumulação de ciclinas mitoticas durante a fase G2
- ligação destas com as Cdk
- formação do complexo MPF (factor promotor da fase M)
↓
Convertido à forma activa pela sua fosforilação e desfosforilação efectuadas
por enzimas. A activação final é quase explosiva devido a um mecanismo de
retroalimentação positivo, em que o MPF activo aumenta a actividade das
enzimas que activam a MPF. A [MPF] activo eleva-se rapidamente até atingir um
ponto onde o fluxo deste desencadeia os eventos que levam a célula à mitose. É
inactivado pela degradação da ciclina mitótica, permitindo sair da mitose.
Processo de entrada na fase S:
- formação de um complexo compreendendo a Cdk e as ciclinas G1, que faz a célula
atingir o ponto G1 havendo activação dos eventos que induzem a replicação do DNA.
Em resumo…
Em cada ciclo de divisão celular uma célula precisa de replicar o seu DNA. A
maioria das células pode crescer e duplicar o seu conteúdo. Durante a fase M,
os cromossomas replicados são segregados em núcleos separados (por
mitose) e a célula divide-se em duas (por citocinese). A outra parte muito mais
longa da ciclo é conhecida como interfase. Este período de continuo
crescimento celular inclui a fase S, quando ocorre a duplicação do DNA e duas
fases intercalares entre a fase S e a fase M, que são G1 e G2. A sequencia dos
eventos do ciclo celular é governada por um sistema controlo, o qual
ciclicamente desencadeia os processos essenciais da reprodução celular
, tais como replicação de DNA e segregação cromossomica no coração deste
sistema está uma série de complexos de proteínas formados por dois tipos
básicos de componentes: subunidades de proteinoquinase (chamadas
proteínas Cdk) e proteínas activantes (chamadas ciclinas). No mínimo dois
destes complexos proteicos regulam o ciclo celular normal, um no ponto de
controlo G1, que se situa antes do inicio da fase S, e o outro em G2 antes do
inicio da fase M. estes complexos de proteínas exercem o seu controlo através
da actividade quinásica, pela activação e desactivação das quinases em pontos
estratégicos do ciclo.
Estudo do Oócito de Xenopus
Célula esférica gigante: o citoplasma ocupa um grande volume por possuir os
nutrientes requeridos para a formação do girino.
O oócito prepara-se para a fecundação, reduzindo o número de cromossomas
a metade através da mitose
↓
O crescimento do oócito ocorre durante um longo período de tempo controlado
pela fase G2 da primeira divisão mitótica. (correspondente ao ponto de controlo
G2 de um ciclo celular padrão)
↓
Neste ponto há hormonas que agem sobre o oócito fazendo-o prosseguir até
um segundo ponto de controlo incomum, a fase M da segunda divisão meiótica,
formando o ovo maduro. Este atravessa o oviduto e corre a fecundação.
↓
Liberta o ovo da metáfase, completando o segundo ciclo meiótico, e
desencadeia uma sequência muito rápida de divisões celulares, na qual a
célula é clivada, sem crescimento, para gerar um embrião que consiste em
milhares de células menores.
Importância biológica: tanto o oócito como o ovo fornecem uma grande
quantidade de citoplasma, e também é fácil injectar substâncias devido ao seu
tamanho.
Experiências (foram feitas experiencias para perceber qual o factor que promove a
maturação de oócitos a ovo)
- injecta-se o citoplasma de um ovo maduro não fertilizado na fase M num
oócito em fase G2 →o oócito é direccionado para a fase M completando a
maturação. A actividade vista no citoplasma foi chamada de factor de
promoção de maturação por induzir a passagem do oócio a ovo maduro.
- feita em células de mamíferos – visto não serem suficientemente grandes
para injecções citoplasmáticas faz-se a fusão de uma célula mitótica com outra
em interfase, expondo a última aos componentes activos da primeira → a
célula em inetrfase é dirigida para a mitose, tendo ou não o seu DNA replicado:
1. Célula mitótica + célula G1 → mitose feita com cromatides (com n DNA)
2. Célula mitótica + célula S → mitose com cromatia (aspecto pulverizado)
permanece imaturo.
3. Célula mitótica + célula G2 → mitose com cromátides longas (com 2n de
DNA)
Posteriormente demonstrou-se que os princípios que induziram aos resultados
das experiencias são os mesmos, ou seja: factor promotor de maturação =
factor promotor da fase M = MPF
Actividade do MPF
Os ovos e oócitos fornecem um grande suprimento de material para a
purificação e ensaio de MPF.
Depois de purificado verificou-se que o MPF é uma proteinoquinase que
fosforila proteínas em resíduos de serina e treonina, e que consiste de duas
subunidades: uma Cdk chamada Cdc2 e uma ciclina mitótica
Experiencias com oócitos e ovos Xenopus mostram que a actividade de MPF é
máxima na mitose e mínima na interfase. Com um pico em cada mnutos no
ovo em processo de clivagem. Observou-se que a acção de MPF é universal
do ciclo celular eucariótico, razão pela qual um oócito ertilizado com citoplasma
de uma célula em fase M, entra em fase M e um oócito fertilizado com
citoplasma de uma célula em fase S, permanece imaturo (nessa mesma fase).
Estabeleceu-se que o pico de actividade de MPF, que ocorre a cada 30
minutos no embrião de Xenopus, em processo de clivagem é ocasionado por
oscilações citoplasmáticas que operam mesmo na ausência de núcleo →
comprimiu-se um ovo activado, antes da primeira divisão, separando-o numa
parte com o núcleo e outra anucleada → a parte nucleada continua
normalmente com as clivagens rápidas, e a anucleada continua com uma série
de oscilações (ciclos repetidos de contracção e endurecimento do citoplasma
cortical), que ocorrem em sincronia com as clivagens da parte nucleada.
Se forem injectadas, em intervalos de tempo, amostras de citoplasma de
células anucleadas de Xenopus em oócitos demonstra-se que as oscilações
visíveis reflectem oscilações da actividade de MPF. Conclui-se que as
oscilações que conduzem à divisão ocorrem independentemente de quaisquer
quantidade de DNA:
Controlo de MPF
Os ciclos de divisão podem ocorrer na ausência de DNA mas não de síntese
proteicas.
A síntese de proteínas foi examinada pela fertilização de ovos em água do mar
contendo um a.a. radioactivo (35S-metionina), removendo amostras
periodicamente e separando-as em gel → as proteínas recém formadas eram
visualizadas pela sua radioactividade → observou-se que a maioria das
proteínas se acumulam continuamente após a fertilização, enquanto que as
ciclinas revelam um padrão periódico: acumulam-se na interfase até à transição
metáfase-anafase, sendo subitamente destruídas (por proteólise) → levou à
hipótese de que estas eram produzidas até um limiar para activar o MPF, e que
eram depois destruídas para o inactivar e terminar a mitose.
Outra forma de estudo foi a obtenção de ciclos celulares in vitro, reparados por
centrifugação de ovos, para que se rompam e se possa recolher os seus
citoplasmas. Adicionam-se espermatozóides e ATP para que as células
repliquem o DNA e entrem em mitoses sucessivas.
1. Destruindo todo o mRNA o ciclo celular interrompe-se na interfase.
2. A adição isolada de mRNA de ciclina purificado restabelece a
capacidade de adicionar o MPF e induz a mitose.
Conclui-se que é somente a ausência de síntese de ciclina que interrompe o
ciclo. Mas o tempo de activação de MPF depende também da regulação da
subunidade de Cdk por outras proteínas.
Por injecção de uma pequena quantidade de MPF a oócitos de rã reprimidos
notou-se que as células eram induzidas a gerar mais MPF activo – processo
autocatalitico. Resumindo: acumulação de ciclnas leva a uma explosão
autocatalitica da actividade de MPF → desencadeia eventos de mitose,
iniciando a destruição da ciclina → cessa a actividade de MPF e começa a
acumulação de ciclina
Degradação da ciclina
Normalmente a ciclina é destruída rapidamente por proteolise na transição
metáfase-anafase. Este processo requer um sinal na cadeia polipeptidica da
ciclina (fornecimento de um sitio de ligação para a ubquitina) e é dependente
da activação do MPF.
Tesou-se uma forma “mutilada” de ciclina que acciona o MOF mas não possui
a sequencia sinal para ser degradada → o mRNA de ciclina é adicionado, e o
extracto entra em mitose mas não consegue sair.
A principal ciclina mitótica é a ciclina 8, mas ciclinas como a G1 têm um papel
importante na activação da proteinoquinase que leva as células a saírem de G1
e iniciar a replicação do DNA.
MPF induz eventos da Mitose
O MPF induz processos como a condensação dos cromossomas, a ruptura do
invólucro nuclear e formação de fuso mitótico, através da sua actividade
quinásica: ou directamente por fosforilação dos componentes-chave, ou
indirectamente por fosforilação que activam proteinoquinases.
A desestruturação da lâmina nuclear é catalisada pela fosforilação de resíduos
de serina. O MPF pode fosforilar a histona H1 induzindo a condensação dos
cromossomas, nos nuceossomas. Os nucleossomas podem então justapor-se
uns aos outros sob a acção de H1 e tornar as fibras de 30nm
A adição e MPF a um sistema livre de células que contenham centrossomas,
tubulina e outros componentes de citoplasma em interfase faz com que estes
se disponham adequadamente para a mitose.
Mutações que inactivem a proteínas Fosfatase I retardam os eventos que se
seguem à inactivação do MPF.
Para sair da mitose as células tem de reverter todas as fosforilações.
Tempo de segurança
A replicação do DNA e dos processos que necessita de tempo suficiente para
se completar e possa haver uma mitose viável.
Nos estágios iniciais do embrião não existem não existem mecanismos de
retroalimentação, sendo o tempo pré-calculado e invariável graças aos factores
externos. O DNA e todos os componentes requeridos estão permanentemente
disponíveis. Se a replicação for interrompida a célula é levada para uma mitose
desastro.
Caso o DNA não esteja totalmente replicado é enviado 1 sinal de
retroalimentação que evita que a célula entre em mitose sem estar
devidamente preparada.
Assim o sistema de controlo garante maior segurança, evitando que não haja
cromossomas por replicar.
Bloqueio de Re-Replicação
É importante que o DNA não seja replicado mais que uma vez. Isto é evitado
por m dispositivo autolimitante: cada segmento de cromatina replicado altera-se
de forma a impedir que seja replicado novamente.
Quando se funde uma célula em G1 com uma célula e fase S, o núcleo de G1
é induzido a começar a síntese de DNA. A célula em fase S possu indutores de
síntese de DNA no seu citoplasma e as células em G1 são susceptíveis a eles.
Quando se funde uma célula em G2 com uma em fase S, o núcleo G2 não
retoma a síntese de DNA, pois possui componentes refractários à acção do da
fase S.
O bloqueio de re-replicação tem de ser removido entre G2 e a fase S para que
possa haver um novo ciclo de replicação. Nos embriões a remoção do bloqueio
de re-replicação parece depender da ruptura do invólucro nuclear.
O controlo no embrião inicial descreve-se por: desencadeia-se a mitose em
intervalos fixos de tempo, e em cada um o DNA recebe licença para se replicar
→ completada a replicação e inibida para prosseguir além de um ciclo pelo
bloqueio re-replicação → inicia-se a fase M e a segregação dos cromossomas
em células separadas.
Em ciclos de divisão celular padrão o sistema de controlo é mais complexo,
mas o bloqueio de re-replicação tem um papel similar (apresenta algumas
excepções por exemplo nas moscas)
Em resumo…
O embrião inicial de muitas espécies animais passa por ciclos celulares
excepcionalmente rápidos através dos quais uma célula grade, o ovo, é
subdividida em diversas células menores, sem necessidade de crescimento.
Estas células embrionárias inicias, nas quais as fases S e M se alternam em
sucessões rápidas sem ocorrência das fases G1 e G2, demonstram o
funcionamento do sistema-controle do ciclo celular na sua forma mais simples.
O componente-chave do sistema-controle é uma proteinoquinase, MPF, cuja
activação por um processo explosivo autocatalitico leva a célula à mitose; a
inactivação do MPF é ciclicamente activado e inactivado nos ciclos
embrionários iniciais independentes do núcleo. Ele consiste de duas
subunidades principais: uma quinase dependente da ciclina chamada de Cdc2
e ciclina. A Cdc2 precisa estar associada à ciclina para se tornar activa, na
forma de MPF. A destruição da ciclina inactiva o MPF no final da mitose e o
acumulo de ciclina recém-sintetizada permite a reactivação do MPF no próximo
ciclo. Neste embriões iniciais, o tempo necessário para a reactivação do MPF
após o término da mitose é o suficiente para permitir um ciclo de replicação de
DNA. Um bloqueio de replicação é imposto em cada segmento do DNA assim
que ele é replicado e este bloqueio é removido somente durante a mitose.
Desta maneira, o sistema-controle do ciclo celular alterna ciclos de replicação
de DNA e segregação dos cromossomas.
Capitulo 18: A mecânica da divisão celular (aula 8 -
2º semestre)
A fase M (ou fase de divisão celular) inclui a divisão nuclear
(nucleocinese), mais divisão citoplasmática (citocinese), em que o conteúdo da
célula mãe, duplicado na interfase, é seprado em duas células filhas.
Começa com a activação da proteína quinase indutora da quinase
(MPF), através de uma cascata de fosforilações (induzidas pela acumulação de
ciclinas, e termina com a inactivação do MPF, como consequência de uma
proteolise das ciclinas B, na via da ubiquitina.
Ocorre nesta fase: fase M
Os cromossomas são condensados (H1)
O envelope nuclear é desmantelado;
O reticulo endoplasmático e o complexo de Golgi são fragmentados;
A célula perde a adesão a outras células e à matriz extracecular;
Transformação do citoesqueleto para separar os cromossomas e dividir
a célula.
Fase M
Separar os cromossomas duplicados e dividir o citoplasma em duas metades.
Condensação, fuso mitótico e anel contráctil
A condensação cromossomica é necessária para a separação dos
cromossomas em células-filhas, e é acompanhada pela fosforilação (por MPF)
das moléculas de Histona H1.
É a activação do MPF, que vai provocar a fosforilação das H1 e assim
cromossomica, contribuir para a condensação.
A mitose e a citocinese são executadas por duas estruturas do citoesqueleto –
fuso mitótico e anel contráctil (formado por actina e miosina II).
Fuso mitótico – composto de microtubulos e proteinas associadas, serve para
alinhar os cromossomas replicados num plano que divide a célula em duas
partes iguais, cada cromossoma é separado em 2 cromatideos que são
movidos para pólos opostos.
Anel contráctil – composto por filamentos de actina e de miosina II. Quando o
anel se contrai, puxa a membrana para dentro, de modo a dividir a célula em
duas. Cada célula com um conjunto completo de cromossomas com metade do
citoplasma
Nas plantas como a parede celular é mais rígida, há um mecanismo diferente
de citocinese. Nas bactérias a separação dos cromossomas é feita por um
mecanismo que envolve a ligação do cromossoma à membrana plasmática
(pois não há nem actina, nem microtubulos).
Divisão celular e duplicação do centrossoma
Centrossoma – uma nuvel de material pericêntrico, pobremente definido,
associado a um par de centriolos. É o principal centro organizador de
microtubulos.
Ocorre a duplicação dos centrossomas para criar as células filhas responsáveis
pela formação dos dois pólos opostos.
Ciclo do centrossoma – duplicação e separação do centrossoma. A
duplicação ocorre na inetrfase, mas a separação deste complexo ocorre na
mitose.
Áster (?) – um aglomerado radial de microtubulos. Os 2 ásteres movem-se para
lados opostos do núcleo para formar os dois pólos do fuso mitótico. Cada célla
filha fica com um centrossoma.
O ciclo do centrossoa é um processo autónomo. O ciclo de divisão celular
depende, e é em parte organizado, pelo áster de microtúbulos, este último é
organizado pelo centrossoma
Divisão da fase M
Mitose (profase + pró-metafase + metáfase + anafase + telofase) + citocinese
Mitose e classificação dos microtubulos
Fuso é formado fora do núcleo e os cromossomas condensados durante a
profase. Quando o envelope nuclear se rompe na pró-metafase, os
microtúbulos do fuso capturam os cromossomas, estes são alinhados e formam
a placa metafásica. Na anafase, o centrómero que une as cromatides irmãs
quebra-se as cromatides irmãs são separadas e levadas para pólos opostos.
Quando os microtubulos chegam aos pólos são libertados e o envelope nuclear
é regenerado (na telofase)
Três grupos de microtubulos:
Microtubulos polares – que se sobrepõem na linha média do fuso e são
responsáveis pelo afastamento dos pólos (alongamento das células).
Microtubulos com cinetocoros – quando se ligam ao cinetocoro (que se situa no
centrómero de cada cromossoma duplicado) e manobram os cromossomas
pelo fuso.
Microtubulos astrais ou axiais – são os radiais (isto é, em todas as direcções).
Contribuem para o afastamento dos pólos e seu posicionamento em relação ao
resto da célula.
Formação do fuso mitótico
Na fase M há uma rápida transição de microtubulos longos e em baixo número,
que se estendem do centrossoma para a periferia celular (distribuição na
interfase), para um grande número de microtubulos curtos que envolvem cada
centrossoma (microtubulos astrais).
Durante a interfase, ocorre o desarranjo dos microtubos longos, neste processo
está envolvida a fosforilação de uma ou mais proteínas que interagem com os
microtubulos, pela SMPF.
Durante a profase, enquanto o envelope nuclear ainda está intacto, alguns
microtubulos longos que emanam de cada cromossoma parecem unir-se com
microtubulos de polaridade oposta crescendo do outro centrossoma. Na região
de sobreposição, no ponto mediano entre os dois cromossomas, formam-se
ligações cruzadas, que estabilizam as pontas destes microtubulos polares.
Forma-se então um fuso bipolar.
Os microtubulos são unidos por proteínas, que tem 2 funções: esabilizar o fuso
e empurra a porção de cada um dos microtubulos antiparalelos, na direcção
que tende a forçar o distanciamento dos pólos.
Ligação dos cromossomas aos microtubulos pelos cinetocoros
No inicio da fase M, cada cromossoma foi replicado e consiste em dois
cromatideos unidos ao comprido com uma constrição numa única região
chamada centrómero onde a cromatina parece estar especialmente
condensado.
Durante a profase forma-se em casa lado do centrómero um cinetocoro
(complexo de proteínas especializadas). O microtubulo liga-se a cada
cromatide do cromossoma pelo cinetocoro. Estes microtubulos com cinetocoros
servirão mais tarde na anafase para separar as cromátides-irmãs para pólos
opostos.
A extremidade mais dos microtubulo com o cinetocoro
Durante a metase é incorporada tubulina nos microtubulos nas regiões
próximas ao ponto de ligação com o cinetocoro. Durante a anafase ocorre a
reacção inversa, ou seja, a libertação de tubulina na mesma região.
Durante a adição ou remoção de tubulina, o cinetocoro mantém uma ligação
mecânica firme com os microtubulos. É a adição e a libertação de subunidades
de tubulina que fazem com que o cinetocoro deslize para trás e para a frente
(respectivamente) no microtubulo.
Os pólos do fuso repelem os cromossomas
Enquanto os microtubulos com cinetocoros tendem a puxar os cromossmas na
direcção dos pólos, outra força actua na força oposta, repelindo qualquer
objecto grande que se aproxime demais dos pólos.
Enquanto o cinetocoro é atraído para o pólo, os braços do cromossoma tendem
a distanciar-se.
A origem desta força de repulsão não é conhecida, mas pode ser a
responsável pelo alinhamento dos cromossomas na placa metafásica.
As cromátides-irmãs
cinetocoros.
ligam-se
aos
pólos
opostos
do
fuso
pelo
A consequência final da interacção entre os cinetocoros e os microtubulos é a
separação fiel das duas cromátides-irmãs de cada par cromossómico para
lados opostos da célula. Isto requer que os cinetocoros-irmãos se liguem a
microtubulos vindos de direcções opostas. Um erro mitótico comum é que as 2
cromatides irmãs terminem juntas numa das células filhas. Este erro pode
acontecer se não houver separação do cromossoma na anafase ou se na prómetafase, os 2 cinetocoros-irmãos de um cromossoma se ligar ao mesmo pólo.
Forças bipolares equilibradas mantém os cromossomas na placa
metafásica
Os cromossomas na pró-metafase movem-se até ao ponto em que ficam
equidistantes dos dois pólos, começando a metáfase.
O que traz os cromossomas a esta posição precisa?
Uma hipótese propõe que o “empurrão” exercido por um microtubulo com
cinetocoro aumenta à medida que o microtubulo fica maior; a força resultante
no cromossoma então será na direcção do pólo que está mais distante, com
uma resultante zero quando o cromossoma está equidistante dos pólos. Um
mecanismo plausível para gerar um força proporcional ao comprimento do
microtubulo seria ter microtubulos motores direccionado na ponta mais. Assim
quanto maior o microtubulo com o cinetocoro, mais destes motores estariam
anexados, movendo o microtubulo de volta ao pólo do fuso.
Outra hipótese propor que a força de oclusão astral é responsável pela
centralização de cada cromossoma no fuso. Empurrando mais fortemente para
longe do pólo, quanto mais perto dele se aproximar.
Durante a anafase os cromossomas podem ser vistos com pequenas
oscilações para trás e para a frente.
Dinamismo dos microtubulos no fuso metafasico
Todos os microtubulos do fuso, apesar da sua aparente estabilidade, estão
continuamente a trocar subunidades de tubulna, com a pool de tubulina livres
em solução.
Tanto o cinetocoro como os microtubulos polares e as subunidades de tubulina
se movem em direcção aos pólos num processo chamado transferência
continua. Ma vez que os microtubulos com cinetocoros no uso metafasico
permanecem com um tamanho constante, deve existir um equilíbrio entre a
edição de subunidades de tubulna na extremidade + (no equador do fuso) e a
remoção dessas subunidades na extremidade menos ligadas ao pólo -.
As cromátides irmãs separam-se repentinamente na anafase.
A anafase é activada pela degradação da ciclina e consequente inactivação do
MPF, que leva à separação do cromossoma em 2 cromatides irmãs, cada uma
com um cinetocoro. Assim os cinetocoros começam o movimento em direcção
aos pólos do fuso.
Acredita-se que as cromátides são mantidas unidas ao longo do seu
comprimento por proteínas cromossomais, que se alteram no inicio da anafase
(por processos ainda desconhecidos) permitindo a separação dos cromatides)
A anafase é retardada até que todos os cromossomas estejam na placa
metafasica
A metáfase ocupa uma porção substancial do período mitótico devido à pausa
das células neste estágio até que todos os cromossomas estejam alinhados na
placa metafásica. A inactivação do MPF, que sinaliza a transição da metáfase
para a anafase é bloqueada se o fuso estiver desmontado.
Dois processos separam as cromatides irmãs na anafase
Anafase A- consiste no movimento das cromatides em direcção ao pólo,
acompanhado do encurtamento dos microtubulos com cinetocoros.
Anafase B – cnsiste na separação dos próprios pólos, acompanhado do
alongamento dos microtubulos polares (alongamento da célula).
Os microtubulos com cinetocoros são desmontados durante a Anafase A
À medida que cada cromossoma se move para os pólos, os mocrotubulos com
cinetocoros são despolimerizaos, até que quase desaparecem na telofase.
A informação de que o cinetocoro é o principal sitio de despolimerização na
anafase sugere que ele também seja o principal sitio onde a força de
movimento dos cromossomas é produzido. Há dois modelos para tentar
explicar a razãopela qual o cinetocor se move para o pólo durante a anafase A:
1 modelo – existe uma proteína motora na extremidade menos (-) do cinetocor,
que hidroliza ATP para se mover ao longo do seu microtubulo, estando
associada à extremidade + do microtubulo, e simultaneamente vai-se
despolimerizando – á medida que se torna exposta
2 modelo – afirma que é a despolimerização do próprio microtubulo que
provoca o movimento passivo do cinetocoro porque o cinetocoro pemanece
ligado ao microtubulo à medida que a despolimerização ocorre. O movimento
dos cromossomas é conduzido para a desmontagem dos microtubulos: à
medida que as subunidades de tubulina são dissociadas, o cinetocoro é
obrigado a deslizar em direcção do pólo para se manter ligado às paredes dos
microtubulos.
Duas forças separadas podem contribuir para a Anafase B
A anafase B aumenta a distância entre os dois pólos do fuso e é acompanhada
pelo alongamento dos microtubulos. À medida que os dois pólos se afastam, os
microtubulos polares entre eles alongam-se aparentemente pela polimerização
das extremidades “mais” distais.
Movimentos de anafase em células de “datamáceos” lisadas → modelo em que
o movimento dos diatomáceos da anafase B é bloqueada por um anticorpo que
reconhece as proteínas motoras dos microtubulos da família das cenisinas,
sugerindo que o movimento é executado por uma proteína motora desta
família. A proteína motora parece estar localizada na zona de sobreposição,
onde actua afastando os 2 meios-fusos. (ver figura pag 932 18-30A)
Tanto em fusos de animais como de fungos, o rompimentodo fuso central não
bloqueia a separação dos pólos do fuso, na verdade acelera o movimento. Isto
sugere que os microtubulos astrais apontando para fora do fuso produzem uma
força neste sentido, auxiliando na separação dos pólos, possivelmente pela
interacção com as proteínas motoras direccionadas na extremidade “menos”
ligadas ao córtex celular ou a outras estruturas citoplasmáticas. (ver figura 1830B) .
O envelope nuclear durante a telofase.
Na telofase é formado o envelope nuclear em redor de cada grupo de
cromossomas, formando 2 núcleos filhos. Três partes do complexo do
envelope nuclear devem ser consideradas durante o rompimento e
regeneração da mitose:
- As membranas interna e externa – que são continuas com a membrana do
reticulo endoplasmático;
- A lâmina nuclear adjacente (uma fina camada de filamentos intermediários
formada a partir das lâminas nucleares), que interagem com a membrana
interna, com a cromatina e com os poros nucleares.
- Os poros nucleares, que são formados por grandes complexos proteicos,
formados por nucleopurinas.
Na telofase as vesículas da membrana nuclear associam-se com a superfície
de cromossomas individuais e fundem-se formando novamente a membrana
nuclear, a qual parcialmente reúne conjuntos de cromossomas antes de se
condensar, e regenerar o envelope nuclear completo. Os poros nucleares são
reconstituídos e as lâminas desfosforiladas são reassociadas formando a
lamina nuclear.
Tanto o desmantelamento como a regeneração nuclear ocorrem em extractos
de ovos de Xenopes. Nesses substractos, o processo inteiro, envolvendo a
lâmina, os poros nucleares e a membrana nuclear, progridem em resposta aos
ciclos de fosforilação e desfoforilação.
A actina e a miosina na citocinese
A clivagem do citoplasma é conseguida pela contracção do anel contráctil que
é composto por uma rede de filamentos de actina sobrepostos e de filamentos
bipolares de miosina II. O anel está ligado à face citoplasmática da membrana
plasmática por proteína de ligação não caracterizadas. O anel forma-se no
inicio da anafase. Uma vez formado ele adquire uma grande força sendo que
esta resulta do deslizar.
Durante a divisão celular normal, o anel não se torna mais espesso devido à
invaginação do sulco. O anel contráctil é dissolvido no final da clivagem, à
medida que a membrana plasmática do sulco de clivagem se estreita formando
um corpo mediano, que permanece como uma conexão entre as duas célulasfilhas. (imagem 18-34 pag p37)
O processo de citocinese envolve uma reorganização total dos filamentos de
actina, de miosina para a formação do anel contráctil.
Capitulo 20: células germinativas e fertilização (aula 9 (?) Meiose:
2º semestre)
- compreende duas divisões celulares consecutivas e uma só
replicação (obtém-se assim apartir de uma célula diplóide , 4
células haplóides).
- ocorre nas células germinativas.
1ª divisão heterotipoca
- divisão reducional – numero de cromossomas torna-se metade
- cromatides irmãs formam uma unidade que emparelha com o seu homólogo
formando um bicalente ou tetrada cromatidica
- origina-se uma célula com n crmossomas.
2ª divisão homotipica
- divisão equacional – não ocorre replicação ficando as células filhas com com
n cromossomas simples.
Meiose – permite por meio de uma redução do número de cromossomas inicial
juntamente com a fecundação a manutenção do numero de cromossomas de
uma espécie; contribui para a variabilidade genética (crossing over no
paquiteno e disjunção dos homólogos na anafase I)
1ª divisão
Profase – leptóteno, zigóteno, paquiteno, diplóteno, diacinese
Na profase I ocorre nos cromossomas: condensação, emparelhamento,
recombinação síntese e descondensação.
Léptoteno
- cromatina diferencia-se em cromossoms muito longos e finos em numero
diploide (cromómeros: zonas de espirilização variável de cromatina que e
dispõe ao longo dos cromossomas)
- os cromossomas estão unidos pelos telómeros à lâmina nuclear (o que irá
contribuir para o alinhamento e emparelhamento dos homólogos)
- não se distinguem ao MO dois cromatideos
- período tempo curto
Zigóteno
- emparelhamento dos homólogos inicialmente nos telómeros e depois ao
longo dos cromossomas (sinapse) – diades cromossómicas/tetradas
cromatideas
- formação complexo sinaponémico
- tempo de duração curto
Paquiteno
- fim de emparelhamento dos homólogos (mais curtos e espessos)
- ocorre troca de genes alelos entre cromatides não irmãs por cruzamento dos
homólogos nos pontos de quiasma – crossing over
Diplóteno
- os dois cromatideos do homólogo ficam mais evidentes
- despiralização parcial dos cromossomas – activos na transcrição de RNA
- em determinados locais formam-se pontos de quiasma e noutros locais estão
afastados.
- pode demorar um longo período de tempo
Diacinese
- grande actividade metabólica
- desintegração do invólucro nuclear e dos nucléolos
- inicio da diferenciação do fuso acromático
- espiralização acentuada cromossomas – terminalização do desaparecimento
dos quiasma ficando o ponto de contacto quase nos telómeros.
Metáfase I
Os cromossomas ligam-se pelos cinetocoros ao fuso acromático dispondo-se
na placa equatorial pelos centrómeros.
Anafase I
disfunção
aleatória/independente
dos
cromossomas
homólogos
(variabilidade)
- no final da anafase cada pólo do fuso recebe n cromossomas com 2n DNA –
redução cromática
Telofase I
- terminação da migração bivalentes para os pólos.
- reconstituição dos núcleos filhos
Citocinese: alongamento celular divisão citoplasmática desigual.
(intercinese)
2ª divisão
Profase II:
- desintegração do invólucro nuclear
- desintegração dos nucléolos
- condensação dos cromossomas
- inicio da formação do fuso acromático
- inicio da migração dos cromossomas par ao plano equatorial unidos com os
microtubulos pelos cinetocoros
Metáfase II máximo encurtamento)
- os n cromossomas ligados ao fuso acromático dispõe-se na placa equatorial –
os cinetocoros colocam-se em frente aos pólos apostos do fuso
- os dois cromatideos unem-se pelos telómeros, centrómero e pelas partes
proximais dos braços dos cromossomas.
Anafase II
- divisão do centrómero havendo migração de cada cromatideo para seu pólo
Telofase II
- terminação da migração de cada cromatideo para pólos opostos
- reconstituição dos núcleos filhos
- formação de 4 células filhas haplóides geneticamente diferentes entre si e da
célula mãe.
Citocinese: reaparecimentos dos nucléolos, alongamento celular, divisão
citoplasmática desigual.
Gametogénese
Óvulos
– célula totipotente, aquando da fecundação são activadas e podem originar
um novo ser.
- esféricas, ovóides, imóveis
- citoplasma com reservas nutritivas (lipidos, proteínas e polissacarideos)
- involucro composto por glicoproteinas
- vesículas secretoras especializadas abaixo da membrana plasmática na
região externa citoplasma.
- um óvulo em desenvolvimento designa-se por: oócito
Células germinativas → oogónicas → (mitoses sucessivas) → oócitos primários
→ (primeira divisão meiótica) → 1º corpo polar → oócito secundário →
(segunda divisão meiótica) →2º corpo polar + óvulo
Sequencia da oogénese.
1 – As células germinativas migram para as gónadas tornando.se oogénicas
2 – oogénicas proliferam no feto difereciando-se em oócitos primários
3 – oócitos primários iniciam a primeira divisão meiótica onde:
- DNA replicado, cromossomas homólogos emparelham (zigóteno),
crossing over (paquiteno)
- permenecem emprofase I (diplóteno) durante muito tempo sntetizando
invólucro e grânulos corticais (necessários depois para o crescimento
inicial do embrião)
- a partir puberdade estimulado por hormonas o oócito recomeça o seu
desenvolvimento; cromossomas recondensam (diacinese); invólucro
nuclear quebrado; ocorre anafase I, telofase I e citocinese.
Θ divisão 1: formam-se 2 células: 1º corpo polar e oócito secundário
4 – o oócito secundário matura até metáfase II e ai fica à espera de ser
fertilizado;
5- na ovulação o oócito secundário é libertado e caso ocorra fertilização é
estimulado o fim da meiose originando óvulo e 2º corpo polar.
Espermatozoides:
- só se inicia apartir da puberdade a espermatogenese e meiose.
- as espermatogónias (nos tubos seminiferos proximais lamina basal)
proliferam mitoticamente
- algumas cessam proliferação e diferenciam-se em espermatócitos primários.
- os espermatócitos primários sofrem meiose e produzem os espermatócitos
secundários (22 autossomas + x/y) que sofrem a divisão II originando
espermátides que se diferenciam nos espermatozóides (vão para o tubos
seminiferos e depois para o epidididmo onde são guardados e maturados)
Senicio: descendentes da
citoplasmáticas
mesma
espermatozónia
ligado
por
pontes
Os espermatozóides são células sem organelos com RE, Complexo de Golgi,
… equipadas com um flagelo
- são fromados po as regiões contidas numa só membrana citoplasmática:
- cauda – impulsiona o espermatozóide e ajuda a penetrar o óvulo
- cabeça – um núcleo haplóide condensado (protaminas – empacotar
DNA)
Na cabeça junto à extremidade anterior do envelope nuclear existe a vesícula
acrossomal com enzimas hidroliticas que lhe permitem penetrar e fixarem-se
ao óvulo.
A cauda é um flagelo com axonema central (que tem origem no corpo basal na
parte posterior do núcleo). O axonema consiste em 2 microtubulos centrais
simples com 9 microtubulos duplos em volta. Possui ainda 9 fibras externas
densas, rígidas e contrácteis de queratina (filamento intermediário)
O movimento das fibras deve-se à hidrolise de ATP feita por proteínas motoras
– ameinas (?) – protinas motoras da extremidade (-)
Fertilização – fusão dos núcleos de 2 gâmetas
Após entrarem na cavidade uterina os espermatozóides sofrem capacitação,
que consiste na alteração da composição lipídica e glicoproteica da membrana
plasmática aumentando o seu metabolismo e mobilidade, por secreções do
tracto reprodutor feminino
Trajecto dos espermatozóides para fecundar o óvulo:
1- Penetra nas células foliculares
2- Liga-se à zona pelúcida. Esta tem três glicoproteinas (zp2 e sp2 que se
agrupam em filamentos e zp1 que faz as ligações cruzadas dos
ligamentos). As enzimas da cabeça do espermatozóide ligam-se a
glicoproteinas zp3.
3- Reacção acrossómica: o espermatozóide lança proteases e
hialuronidase que permitem a penetração na zona pelucida (outras
ligam-se à zp2 e permitem que o espermatozóide se mantenha ligado)
PH-30 – proteína da superfície do espermatozóide que medeia a ligação
à membrana do óculo e a fusão de ambas as membranas; em duas
subunidades transmembranares glicosiladas (a e b) unidas não
covalentemente; a subunidade b liga-se à integrina no óvulo.
4- Fusão depois da fusão (?) – o espermatozóide é sugado pelo óvulo.
Pode acontecer: poli-espermia – mais que um espermatozóide funde o óvulo
Contudo para que tal não aconteça há:
- bloqueio primário da poliespermia – a fusão conduz á despolarização da
membrana do óvulo impedindo nova fusão
- bloqueio secundário da poliespermia – reacção cortical em que os grânulos
libertam enzimas que alteram a zona plúcida ficando mais endurecidos,
impedindo a ligação dos espermatozóides, produzindo uma resposta lenta.
Entre as alterações na zona pelúcida estão a clivagem proteolitica da ZP2 e a
hidrolise dos grupos açúcar na ZP3.
Os espermatozóides contribuem não só com DNA mas também com o centriolo
que auxilia a organização do 1º fuso mitótico