Resumo de Química
Inês Barreiros
A origem dos materiais:
De acordo com as suas origens os materiais podem ser:
Sintéticos – resultam de transformações de outros materiais. (exemplo: plástico)
Naturais -são utilizados tal como surgem na natureza.
Substâncias e misturas de substâncias: (página 12 e 13)
As substâncias são constituídas por um único componente. (exemplo: ouro)
As misturas de substâncias são constituídas por substâncias combinadas em proporções
que podem variar.
Classificação de misturas: (página 14 e 15)
Mistura de substâncias
Homogéneas
Heterogéneas
Coloidais
Misturas coloidais – misturas que a olho nu nos parecem homogéneas, mas a microscópio se
vê que são na verdade heterogéneas.
Concentração mássica:
A concentração mássica de um soluto é a massa de soluto existente por unidade de
volume de solução.
Unidade SI: kg/m3.
Cm
m
Cm – concentração
m – massa do soluto
V – volume da solução
Classificação de substâncias: (página 18 e 19)
Substâncias simples ou elementares – substâncias constituídas por átomos de um elemento
químico, não podendo ser decompostos em substâncias mais simples.
Substâncias compostas – são substâncias constituídas por átomos de mais que um elemento químico,
podendo ser decompostas em substâncias mais simples, e eventualmente, nos elementos que as constituem.
Diferentes estados físicos das substâncias:
(página 20 e 21)
Estado líquido:
Estado sólido:
Estado gasoso:
1
Resumo de Química
Inês Barreiros
Estrutura do átomo:
Átomo:
Protões – p+
Neutrões – nº
Electrões – e –
Unidade de massa atómica: (páginas 29 e 30)
1u=1,66x10-27kg
A massa de um átomo está praticamente toda concentrada no núcleo.
Massa atómica relativa de um elemento químico e isótopos: (páginas 34 e 35)
Isótopos – são átomos do mesmo elemento que diferem no número de massa (número de
neutrões).
Massa isotópica relativa – média dos valores obtidos multiplicando as massas relativas
dos isótopos pelas respectivas abundâncias.
Organização dos elementos químicos na tabela periódica: (páginas 36 e 37)
Período – mesmo número de níveis de energia.
Grupo – mesmo número de electrões de valência.
Grupos:
1-metais alcalinos
2-metais alcalino-terrosos
3 Ao 12-metais de transição
13 Ao 15-alguns são semi-metais e outros são não metais
16-calcogéneos
17-halogéneos
18-gases nobres
Iões e substâncias iónicas: (página 41)
Na+:
- 11 Protões
- 12 Neutrões
- 10 Electrões
Na:
- 11 Protões
- 12 Neutrões
- 11 Electrões
Fórmulas químicas: (páginas 44 a 46)
Definição – é uma forma de representar um electrão químico.
Ay
x
x=nº de unidades estruturais
2
Resumo de Química
Inês Barreiros
Y = Número de partículas que constituem unidade estrutural
Exemplo: sulfato de amónio
SO422NH4+
NH4+
+
SO42-
=
(NH4)2SO4
2ºTeste:
Unidade astronómica – corresponde à distância média da Terra ao Sol.
1UA=15x107
Ano-luz – corresponde à distância percorrida pela luz num ano.
1a.l.=946x1010
Parsec – distancia a um astro com paralaxe de um segundo.
1pc=309x1011
Estrelas mais quentes – azuis.
Estrelas mais frias – vermelhas.
A evolução das estrelas depende da sua massa.
Lei da atracção universal – no universo, todos os corpos se atraem. A forca de
atracção entre dois corpos designasse forca gravitacional e é tanto mais intensa quanto
maiores forem as suas massas e menor a distância que os separa.
Universo – é constituído por todos os astros e pelo o espaço vazio entre eles, ou seja, é
tudo o que existe.
Estrelas – são corpos celestes que têm luz própria, são corpos luminosos. São os corpos
mais abundantes no universo.
Enxames de galáxias – aglomerados de galáxias.
Super -enxames – agrupamentos de enxames de galáxias.
A nossa galáxia situa se no enxame chamado Grupo Central.
Origem da luz das estrelas – vem de transformações que ocorrem no seu interior.
Estas transformações fazem com que as estrelas se vaiam modificando durante a sua
longa vida.
As estrelas têm um período de vida estável durante o qual mantêm a sal luminosidade e
o seu brilho.
Mais tarde as estrelas sofrem uma expansão e também uma contracção. A fase final de
uma estrela depende muito da quantidade de matéria que possui.
3
Resumo de Química
Inês Barreiros
Nebulosa – formações pouco densas constituídas por gases e poeiras resultantes da
desintegração de estrelas, e que podem vir a ser a matéria-prima para a formação de
novas estrelas.
Buracos negros – regiões do espaço com uma densidade muito elevada, originando uma
forca gravitacional tão grande que não permite que quer matéria, quer energia consigam
escapar.
Quasares – astros de extrema luminosidade, que foram observados através de
potentes telescópios nos confins do universo conhecido.
Cosmos <aglomerados (enxames) <Via Láctea <Sistema Solar
Via láctea – galáxia em que se encontra o nosso sistema solar.
Localização do sistema solar – localiza se na Via Láctea, num dos seus braços de
espiral.
Teoria do Big Bang – o universo ter se à formado há 13,7 milhões de anos, a partir de
uma explosão de um núcleo inicial, pequeno, denso e sujeito a temperaturas
elevadíssimas. A partir da explosão inicial, o universo tem vindo a expandir se,
arrefecendo progressivamente.
Provas a favor da existência do Big Bang:
A expansão do Universo;
A radiação cósmica de micro-ondas;
A abundância relativa dos elementos no universo.
Limitações da teoria do Big Bang – não sabe dar respostas a muitas perguntas, como
por exemplo:
Como ocorreu o Big Bang?
Qual o destino do universo?
Irá haver um Big Crunch ou o Universo expandir se á definitivamente?
A origem dos elementos químicos:
(páginas 66 a 72)
Processos de formação dos elementos químicos:
Nucleossíntese durante o Big Bang;
Nucleossíntese durante a evolução estelar;
Nucleossíntese interestelar.
Nuvem de gás protoestrela estrela
Estrela gigante supernova: - pulsar ou estrela de neutrões (se massa <25 massa
do sol)
-buraco negro (se massa> 25 massa do sol)
O hidrogénio e o hélio são os elementos mais abundantes no universo.
4
Resumo de Química
Inês Barreiros
Reacções nucleares e reacções químicas: (páginas 74 a 79)
Nucleossíntese – síntese dos núcleos de dois elementos químicos.
Reacções nucleares:
Fusão – corresponde à formação de núcleos mais pesados, mas mais estáveis, a partir
de núcleos mais leves, com libertação de energia; só ocorre a temperaturas muito
elevadas.
Fissão ou cisão – corresponde à formação de núcleos mais leves e também de neutrões,
a partir de núcleos mais pesados e instáveis.
A formação dos elementos químicos nas estrelas envolve reacções nucleares que põem
em jogo energias muito elevadas e inúmeras partículas.
Exemplo de uma reacção de fusão nuclear:
12H + 13H 24H + 01n
Exemplo de uma reacção de fusão nuclear:
42335U + 01n 36190Be + 3693Kr + ∂
Reacções nucleares:
Lei da conservação da massa
Lei da conservação do numero atómico
Reacções químicas:
Lei da conservação da massa
Lei da conservação de carga eléctrica
A radioactividade é um fenómeno que consiste na emissão espontânea de partículas alfa
(núcleos de hélio), partículas beta (electrões) ou raios gama (radiação
electromagnética).
Diferenças entre:
Reacções nucleares
Reacções químicas
Os núcleos atómicos são modificados;
Os
núcleos
atómicos
permanecem
inalterados;
Os átomos de um mesmo elemento não são
destruídos nem criados;
Os núcleos não são destruídos não são
destruídos nem criados, são apenas
reorganizados levando à formação de
átomos novos;
Os isótopos reagem de modo diferente;
Há variação significativa de massa;
Envolvem valores de energia da ordem dos
108KJ;
Os isótopos reagem do mesmo modo;
A variação de massa não é detectável;
Envolvem energias entre os 10 e os 103KJ;
5
Resumo de Química
Inês Barreiros
A velocidade destas reacções não é
normalmente influenciada pela pressão,
temperatura ou catalizadores.
A velocidade destas reacções é
normalmente influenciada pela pressão,
temperatura ou catalizadores.
Neutrão – 01n
Protão – 11p
Espectros radiações e energia:
(a partir da página 84)
nm (manómetro) – unidade de comprimento igual a 10-9 metros.
Espectro electromagnético:
Espectrosocópio – é um equipamento que
electromagnéticos, incluindo o espectro visível.
permite
analisar
os
espectros
Espectro de emissão contínuo – as radiações que formam o espectro têm valores de
energia muito próximos constituindo uma gama variada e contínua de cores.
Por ser formada por varias radiações monocromáticas sobrepostas, a luz branca diz-se
policromática.
Espectro contínuo – espectro com intensidades não nulas numa gama praticamente
contínua de energias.
Espectro de absorção – as riscas escuras que se sobrepõem ao espectro contínuo
correspondem às radiações que foram absorvidas.
O espectro electromagnético: (páginas 92 a 95)
6
Resumo de Química
Inês Barreiros
C – a velocidade de propagação da luz no vazio.
C = 3x108m/s
A análise da luz de uma estrela permite nos saber a sua temperatura e a sua
composição química.
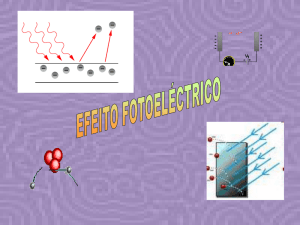
Efeito fotoeléctrico: (páginas 97 a 98)
No efeito fotoeléctrico libertam se fotões.
Cada fotão, caso tenha energia suficiente, consegue provocar a ejecção de um e apenas
um electrão.
Se E. radiação> E. remoção há efeito fotoeléctrico;
Se E. radiação = E. remoção não há efeito fotoeléctrico; os átomos são ionizados
e os electrões ficam à superfície;
Se E. radiação <E. remoção não ocorre qualquer efeito.
E. Radiação = E. remoção + E. cinética
Energia cinética – associada ao movimento.
Para um dado metal, se a radiação incidente não provocar efeito fotoeléctrico, um
aumento de intensidade, isto é do número de fotões, também não o fará.
O aumento da intensidade da radiação incidente faz aumentar o número de electrões
que são ejectados e não a sua energia.
Átomo de hidrogénio e estrutura atómica: (a partir da página 102)
O espectro de emissão do átomo de hidrogénio pode ser obtido recorrendo a um tubo
de descarga.
Por convenção, um electrão livre é um electrão infinitamente afastado do núcleo, com
energia igual a zero.
En = -2,18 x 10-18 x (1/n2) J – permite determinar os valores de energia possíveis
para o electrão do átomo de hidrogénio.
O estado fundamental é o estado de menor energia.
A excitação electrónica ocorre se o átomo absorver uma quantidade adequada de
energia.
A excitação electrónica ocorre se o átomo absorver uma quantidade adequada de
energia.
Constante de Plank – 6,626 x 10-34J/S
Podemos estabelecer uma analogia entre os níveis de energia e subir escadas.
7
Resumo de Química
Inês Barreiros
Algumas séries espectrais do átomo de hidrogénio:
Lyman – 2,3,4,5, …infinito 1 – ultravioleta
Balmer – 3,4,5, …infinito 2 – visível
Paschen – 4,5,6…infinito 3 – infravermelho
Números quânticos:
Número quântico principal – n, relacionado com a energia.
n = 1,2,3…
Número quântico secundário ou azimutal –
(subníveis).
l = 0 a n-1
-
l = 0 (s)
l = 1 (p)
l = 2 (d)
l = 3 (f)
l = 4 (g)
l = 5 (h)
Número quântico magnético –
l, relacionado com a forma da orbital
ml, relacionado com a orientação da orbital.
ml = -l, 0, + l
(n, l, ml) – caracterizam uma orbital.
Numero quântico de spin – ms, relacionado com a rotação do electrão.
ms = ½; - ½
(n, l, ml, ms) – caracterizam um electrão.
2n2 – número máximo de electrões no nível.
A configuração de uma orbital depende do subnível a que pertence.
São necessários quatro números quânticos para caracterizar um electrão.
Princípio da energia mínima – os electrões distribuem se pelas orbitais por ordem
crescente de energia.
1s2 2s2 2p6 3s2 3p6 4s2 3d10
Principio da exclusão de Pauli – de acordo com o qual não pode haver dois electrões
num átomo com os quatro números quânticos iguais (isto é, numa orbital não pode haver
dois electrões com o mesmo ms).
Regra de Hund – a distribuição mais favorável dos electrões por orbitais degeneradas
(orbitais com a mesma energia) é a aquela que conduz à obtenção do número máximo de
spins paralelos.
8
Resumo de Química
Inês Barreiros
Tabela periódica: organização dos elementos químicos:
(a partir da página 125)
Períodos – linhas horizontais (7 linhas).
Grupos – colunas verticais (18 grupos).
Mendelev enunciou a lei periódica – as propriedades variam periodicamente à medida
que aumenta a massa atómica.
A maior parte dos elementos da tabela periódica são metais.
O período em que se situa cada um dos elementos é dado pelo número quântico n das
suas orbitais de valência.
Os electrões de valência são os electrões do último nível de energia. Os elementos de
um mesmo grupo têm o mesmo número de electrões de valência.
Blocos:
Bloco d – o grupo é igual à soma dos electrões das duas ultimas orbitais.
Bloco s – o grupo é igual ao número de electrões de valência.
Bloco p – o grupo.
É importante não confundir as propriedades dos elementos com as propriedades
periódicas das respectivas substâncias elementares.
Carga nuclear – carga do núcleo, positiva e de valor igual ao numero de protões que o
constituem.
Ao longo de um grupo (mesma configuração dos electrões de valência):
Aumento de z:
-
Aumento da carga nuclear;
Maior força atractiva sobre os electrões mas a carga nuclear efectiva é
constante.
Menor forca atractiva do núcleo sobre os electrões de valência;
Maior afastamento do nível de valência do núcleo;
Aumento de n – aumenta o número de grupo.
Ao longo de um período:
Aumento de z:
-
Carga do núcleo aumenta;
-
Maior força atractiva sobre os electrões;
- Aumenta a carga nuclear efectiva;
Mantém se o n – não interfere na variação das propriedades periódicas.
Raio atómico: (página 139)
Raio atómico aumenta diminui a energia de ionização.
Raio atómico diminui aumenta a energia de ionização.
9
Resumo de Química
Inês Barreiros
Para partículas isolectrónicas, quanto maior o numero atómico (maior carga nuclear)
menor o raio.
As camadas da atmosfera terrestre
Troposfera:
É a camada da atmosfera que está em contacto com a superfície terrestre e que
contém o ar que respiramos;
Tem altitude entre 8Km a 16Km;
É a camada menos espessa, mas é a mais densa;
O ar junto ao solo é mais quente, diminuindo de temperatura com a altitude até
atingir -60ºC;
A zona limite chama-se tropopausa. Aqui a temperatura mantém-se constante.
Estratosfera
Situa-se entre os 12Km a 50Km;
É aqui que está a camada de ozono;
Nesta camada a temperatura aumenta de -60ºC a 0ºC. Este aumento deve-se à
interacção química e térmica entre a radiação solar e os gases aí existentes;
As radiações absorvidas são as ultravioletas (6,6 a 9,9 x10-19 J);
A zona limite chama-se estratopausa. Aqui a temperatura mantém-se constante.
Mesosfera
Situa-se entre os 50Km a 80Km;
Trata-se da camada mais fria da atmosfera;
A temperatura volta a diminuir com a altitude, chegando aos -100ºC aos 80Km;
A absorção da radiação solar é fraca;
A zona limite chama-se mesopausa. Aqui a temperatura mantém-se constante.
Termosfera
É a camada mais extensa;
Começa nos 80Km e vai para além dos 1000Km;
Trata-se da camada mais quente da atmosfera;
A temperatura pode atingir os 2000ºC;
Absorvem-se as radiações solares mais energéticas (energia superior a 9,9 x10-19
J);
Subdivide-se em duas partes a ionosfera (entre 80 e 550Km) e a exosfera (parte
exterior da atmosfera que se dilui no espaço a partir dos 1000Km de altitude).
Formação de radicais livres na atmosfera
As dissociações de moléculas que ocorrem por acção da luz chamam-se fotólises ou
reacções fotoquímicas.
Este tipo de reacções acontece, principalmente, na parte de cima da troposfera e na
estratosfera.
Dissociação de uma molécula é o mesmo que quebrar as suas ligações. É como um
chocolate que partimos a metade: seria a dissociação de um chocolate.
Destas dissociações saem partículas muito reactivas chamadas radicais.
10
Resumo de Química
Inês Barreiros
Dissociação e ionização de partículas
Energia de dissociação:
É a energia necessária para quebrar as ligações de uma molécula.
Exemplo: A energia de dissociação da molécula de oxigénio (O2) é 8,3x10-19J.
Se a radiação incidente tiver
energia igual a 8,3x10-19J.
Se a radiação incidente
tiver energia inferior a
8,3x10-19J.
Se a radiação incidente tiver
energia superior a 8,3x10-19J.
A molécula separa-se em
radicais livres (O˙), que não
têm energia cinética.
Há apenas efeito térmico.
A energia cinética da
partícula aumenta.
A molécula separa-se em radicais
livres (O˙), que possuem energia
cinética.
Formação de iões na atmosfera:
A energia solar é absorvida para extrair um electrão.
Se a radiação tiver energia superior à energia de primeira ionização consegue retirar
um ião à partícula e ionizá-la.
Como as energias de ionização são relativamente elevadas, as ionizações são mais
frequentes na termosfera (ionosfera).
Também podem ocorrer dissociações seguidas de ionizações.
Energia de primeira ionização:
É a energia necessária para tirar um electrão a uma molécula ou átomo.
Exemplo: A energia de primeira ionização da molécula de oxigénio (O2) é 1,9x1018J.
Se a radiação incidente tiver Se a radiação incidente
Se a radiação incidente tiver
energia igual a 1,9x10-18J.
tiver energia inferior a
energia superior a 1,9x10-18J.
1,9x10-18J.
A molécula é ionizada e
torna-se O2+.
Há apenas efeito térmico.
11
A molécula é ionizada e torna-se
O2+ e fica com energia cinética.
Resumo de Química
Inês Barreiros
12