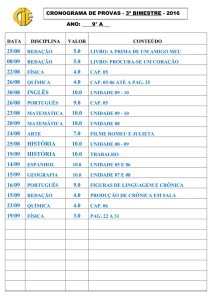
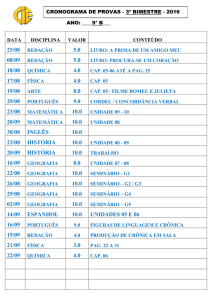
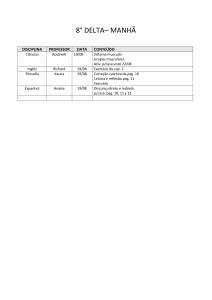
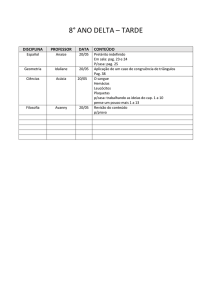
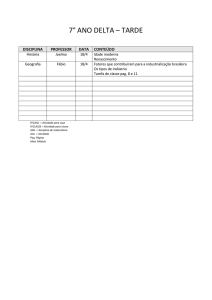
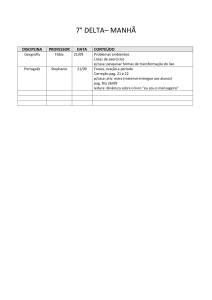
Exercícios: Cap. 6
1- Que massa de cloro é necessária para reagir completamente com 1,45 g de fósforo
(P4). Que masa de PCl3 é formada?.
2- O metanol utilizado como combustível pode ser produzido pela reação de monóxido
de carbono com hidrogênio.
CO (g) + 2 H2 (g) CH3OH (l)
Suponha que 356 g de CO sejam misturados com 65 g de H2. a) Qual o reagente
limitante?, b) Qual a massa de metanol que pode ser produzida?, c) Qual é a massa de
reagente em excesso que sobra quando todo o reagente limitante é consumido?.
3- No preparo de aspirina partiu-se de 14,4 g de ácido salicílico e um excesso de
anidrido acético. A quantidade de aspirina obtida foi de 6,26 g. Qual o rendimento
percentual desta reação.
C7H6O3 (s) + C4H6O3 (l) C9H8O4 (s) + CH3CO2H (l)
ac. salicílico
an. acético
aspirina
ac. acético
4- A Cerussita, mineral que contem chumbo, e carbonato de chumbo impuro, (PbCO3),
ao analisar uma amostra desse mineral para conhecer o teor de carbonato de chumbo,
uma pequena amostra é tratada com ácido nítrico.
PbCO3(s) + 2 HNO3(aq) Pb(NO3)2(aq) + H2O(l) + CO2(g)
A adição posterior de ácido sulfúrico, leva à formação de sulfato de chumbo insolúvel.
O precipitado é isolado e pesado. Suponha que uma massa de 0,583 g de mineral tenha
produzido 0,628 g de precipitado (PbSO4). Qual a porcentagem em massa de PbCO3 no
mineral.
5- Quantas moléculas de glicose existem em 5,23g de C6H12O6?. pag 81.
6- O ácido ascórbico (vitamina C) contêm 40,92% de C, 4,58% de H e 54,50% de O em
massa. Qual é a fórmula mínima do ácido ascórbico. pag 83.
7- O mesitileno, hidrocarboneto encontrado em pequenas quantidades no petróleo, tem
uma fórmula mínima C3H4. A massa molecular, determinada experimentalmente, para
essa substância é 121 u. Qual é a fórmula molecular do mesitileno?. pag 84.
8- Quantas gramas de água são produzidos na oxidação de 1,00 g de glicose, C 6H12O6?.
pag 87.
9- O hidróxido de lítio sólido é usado em veículos espaciais para remover o dióxido de
carbono exalado. O hidróxido de lítio reage com o dióxido de carbono gasoso para
formar carbonato de lítio sólido e água líquida. Quantas gramas de dióxido de carbono
podem ser absorvidos por 1,00 g de hidróxido de lítio. pag. 89.
10- Considere a seguinte reação:
2 Na3PO4 (aq) + 3 Ba(NO3)2 (aq) Ba3(PO4)2 (s) + 6 NaNO3 (aq)
Suponha que uma solução contendo 3,50 g de Na3PO4 é misturada com uma solução
contendo 6,40 g de Ba(NO3)2. Quantos gramas de Ba3(PO4)2 podem ser formados.
pag.91.
11- Qual o princípio científico ou lei usada no processo de balanceamento de equações?.
No balanceamento de equações, por que os índices inferiores nas fórmulas químicas não
podem ser modificados?. Quais são os símbolos usados para representar gases, líquidos,
sólidos e soluções aquosas em reações químicas?. pag. 94. R.
12- Faça o balanceamento das seguintes equações e indique se são reações de
combinação, decomposição ou combustão: pag.94. R
a) Al(s) + Cl2(g) AlCl3 (s)
b) C2H4(g) + O2(g) CO2(g) + H2O(g)
c) Li(s) + N2(g) Li3N(s)
d) PbCO3(s) PbO(s) + CO2(g)
e) C7H8O2(l) + O2(g) CO2(g) + H2O(g)
13- Calcule a porcentagem em massa de oxigênio em cada um dos seguintes compostos:
a) SO2, b) sulfato de sódio, c) C2H5COOH, d) Al (NO3)3, e) nitrato de amônio.
14- Qual é a massa, em gramas, de 2,50 x 10-3 mol de sulfato de alumínio?. Qual é a
quantidade de matéria de íons cloreto existente em 0,0750 g de cloreto de alumínio.?
15- A efervescência produzida quando um comprimido de Alka-Seltzer é dissolvido em
água deve-se à reação entre o bicarbonato de sódio (NaHCO3) e o ácido cítrico
(H3C6H5O7):
3 NaHCO3(aq) + H3C6H5O7(aq) 3CO2(g) + 3H2O(l) + Na3C6H5O7(aq)
Em determinado experimento 1,00 g de bicarbonato de sódio e 1,00 g de ácido cítrico
são deixados reagir; a) Qual é o reagente limitante?, b) Quantos gramas de dióxido de
carbono são formados?, c)Quantos gramas de reagente em excesso sobram depois que o
reagente limitante é completamente consumido?. pag. 99.R
Exercícios adicionais
1- Que você entende pelo termo reações químicas, de combinação, decomposição e
combustão?, Mencione alguns exemplos.
2- Que pode ser observado quando reagentes são convertidos em produtos?.
3- Que são os coeficientes estequiométricos?, Coloque um exemplo usando uma reação
química.
4- Que você entende pelo termo estequiometria?, Que conceito o lei está relacionada
com esta parte da química.
5- Qual é o conceito do termo “mol”?.
6- Qual é o conceito o lei que justifica a fórmula de um composto químico?.
7- Em que consistem os termos reagente limitante, e reagente em excesso?.