Vestibular1 - A melhor ajuda ao vestibulando na Internet
Acesse Agora ! www.vestibular1.com.br
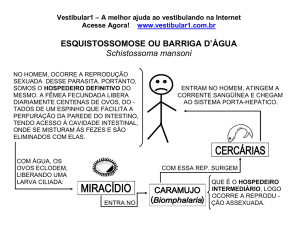
EXERCÍCIOS DE QUÍMICA – ESTEQUIOMETRIA E INORGÂNICA
1. (Mackenzie 97) No freon, (CCl 2 F2 ), a porcentagem, em massa, de carbono, é:
[Massa molar (g/mol): C = 12; Cl = 35; F = 19]
a) 12 %
b) 10 %
c) 1 %
d) 66 %
e) 20 %
2. (Cesgranrio 99) Um composto de massa molar (massa de 1mol de moléculas) igual a 46g/mol, com cadeia
carbônica homogênea, apresenta composição centesimal de 52,2% de carbono, 34,8% de oxigênio e 13% de
hidrogênio. Podemos afirmar que ocorre entre as suas moléculas no estado líquido o tipo de ligação:
a) iônica.
b) coordenada.
c) covalente simples.
d) de Van der Waals.
e) por pontes de hidrogênio.
3. (Vunesp 98) A massa de 1 mol de vanilina, uma substância utilizada para dar sabor aos alimentos, é
constituída por 96g de carbono, 8g de hidrogênio e 48g de oxigênio. São dadas as massas molares, em g/mol:
vanilina=152; H=1; C=12; O=16. As fórmulas empírica e molecular da vanilina são, respectivamente,
a) C 3 H 4O e C 9H 12O 2
b) C 3H 4 O 2 e C 7H 12 O4
c) C5H5 O e C 10H 10 O 2
d) C 5H 5O e C 11H 14O.
e) C 8H 8O
3
e C 8H 8 O 3
4. (Puccamp 94) Á amostra de uma substância orgânica utilizada em análises químicas contém 0,50 mol de
hidrogênio, 0,50 mol de carbono e 1,0 mol de oxigênio. Sabendo-se que a massa molar da substância é igual a
90g/mol, pode-se afirmar que as fórmulas mínima e molecular são:
a) C o,5 H 0,5 O 1 e CHO2
b) CHO 2 e CHO 2
c) C 2H 2 O 4 e C 2H 2 O 4
d) CHO 2 e C 2H 2O 4
e) CHO 2 e C 3H 3 O 6
5. (Fatec 98) Dois eletrodos conectados a uma lâmpada são imersos em solução de Ca(OH) 2 (água de cal). A
lâmpada se acende com luz intensa. Com um canudo de plástico assopra-se o ar expirado nesta solução.
Vestibular1 - A melhor ajuda ao vestibulando na Internet
Acesse Agora ! www.vestibular1.com.br
À medida que o ar é assoprado, um sólido branco vai-se depositando no fundo do béquer e a luz vai
enfraquecendo, até apagar-se.
Tais fatos são devidos
a) à dissolução do gás CO do ar expirado.
b) à evaporação dos íons H+ e OH - provenientes da água.
c) à precipitação do sólido CaCO3 que reduz a quantidade de íons na solução.
d) à dissolução do gás O 2 do ar expirado.
e) ao aumento da concentração de íons H + e OH - da água.
6. (Ita 2001) A calcinação de 1,42g de uma mistura sólida constituída de CaCO 3 e MgCO 3 produziu um
resíduo sólido que pesou 0,76g e um gás. Com estas informações, qual das opções a seguir é a relativa à
afirmação CORRETA?
Dados
Massas molares (g/mol): CaCO 3 =100,09; CaO=56,08; MgCO 3 =84,32; MgO=40,31
a) Borbulhando o gás liberado nesta calcinação em água destilada contendo fenolftaleína, com o passar do
tempo a solução irá adquirir uma coloração rósea.
b) A coloração de uma solução aquosa, contendo fenolftaleína, em contato com o resíduo sólido é incolor.
c) O volume ocupado pelo gás liberado devido à calcinação da mistura, nas CNTP, é de 0,37L.
d) A composição da mistura sólida inicial é 70%(m/m) de CaCOƒ e 30%(m/m) de MgCO 3 .
e) O resíduo sólido é constituído pelos carbetos de cálcio e magnésio.
7. (Ufc 2001) A acidez do solo é considerada um dos graves problemas para a cultura de diversos produtos
agrícolas. Dentre as substâncias abaixo, qual seria adequada para corrigir um solo ácido?
a) HNO 3
b) B(OH) 3
c) C 3 H 7 OH
d) CH 3CH 2 COOH
e) CaCO 3
8. (Vunesp 2001) O magnésio pode ser obtido da água do mar. A etapa inicial deste processo envolve o
tratamento da água do mar com óxido de cálcio. Nesta etapa, o magnésio é precipitado na forma de:
QUÍMICA – ESTEQUIOMETRIA E INORGÂNICA
2
Vestibular1 - A melhor ajuda ao vestibulando na Internet
Acesse Agora ! www.vestibular1.com.br
a) MgCl 2.
b) Mg(OH) 2.
c) MgO.
d) MgSO 4
e) Mg metálico.
9. (Uerj 2001) Para o tratamento da acidez estomacal, recomenda-se a ingestão de antiácidos que contenham
hidróxido de alumínio em sua formulação. A função dessa substância é neutralizar o excesso do ácido
produzido pelo estômago.
Os produtos da reação de neutralização total entre o hidróxido de alumínio e o ácido do estômago são água e
um sal, cuja fórmula está contida na seguinte alternativa:
a) AlCl
b) AlCl 3
c) AlSO 4
d) Al 2 (SO4) 3
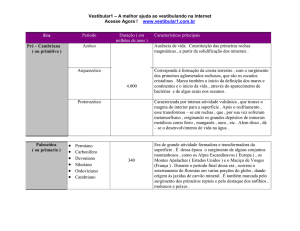
10. (Uerj 2000) As regras utilizadas para nomenclatura de substâncias inorgânicas estão baseadas no número
de oxidação de seus elementos químicos.
Observe o quadro abaixo, em que o cloro apresenta diferentes números de oxidação:
A alternativa que mostra a ordenação das substâncias citadas no quadro, segundo o número de oxidação
crescente do cloro, é:
a) cloreto de sódio, cloro gasoso, hipoclorito de sódio e clorato de potássio
b) clorato de potássio, cloreto de sódio, hipoclorito de sódio e cloro gasoso
c) hipoclorito de sódio, cloro gasoso, cloreto de sódio e clorato de potássio
d) hipoclorito de sódio, cloreto de sódio, cloro gasoso e clorato de potássio
11. (Uerj 2000) Em dois tubos de ensaio contendo água destilada, são dissolvidas quantidades significativas
de óxido de enxofre IV, no tubo 1 , e de óxido de sódio, no tubo 2.
Após a dissolução, as soluções contidas em cada tubo apresentam, respectivamente, o seguinte caráter:
a) ácido e ácido
b) ácido e básico
c) básico e ácido
d) básico e básico
12. (Ufsm 2000) Observe a equação e, após, assinale a alternativa que completa, corretamente, as lacunas.
X(aq) + Na 2 CO 3(s) Y(aq) + CO 2(g) + H 2 O(l)
QUÍMICA – ESTEQUIOMETRIA E INORGÂNICA
3
Vestibular1 - A melhor ajuda ao vestibulando na Internet
Acesse Agora ! www.vestibular1.com.br
O composto representado por X é um(a) ______ e pode ter fórmula________.
a) ácido - H 2SO4
b) base
- NH 4 OH
c) óxido ácido - MgO
d) sal neutro - NaCl
e) sal básico - NH 4Cl
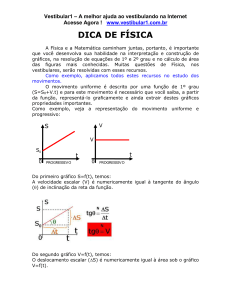
13. (Ufsm 2000) X, Y e Z representam genericamente três ácidos que, quando dissolvidos em um mesmo
volume de água, à temperatura constante, comportam-se de acordo com a tabela
Assinale as afirmações, considerando os três ácidos.
I. X representa o mais forte.
II. Z representa o mais fraco.
III. Y apresenta o maior grau de ionização.
Está (ão) correta (s)
a) apenas I.
b) apenas II.
c) apenas III.
d) apenas I e II.
e) I, II e III.
14. (Fuvest 2000) Deseja-se distinguir, de maneira simples, as substâncias de cada um dos pares a seguir,
utilizando-se os testes sugeridos do lado direito da tabela:
As substâncias dos pares I, II e III podem ser distinguidas, utilizando-se, respectivamente, os testes:
a) X, Y e Z
b) X, Z e y
c) Z, X e y
d) Y, X e Z
e) Y, Z e X
QUÍMICA – ESTEQUIOMETRIA E INORGÂNICA
4
Vestibular1 - A melhor ajuda ao vestibulando na Internet
Acesse Agora ! www.vestibular1.com.br
15. (Uece 99) Considere os seguintes ácidos, com seus respectivos graus de ionização (a 18°C) e usos:
H 3PO 4 (=27%), usado na preparação de fertilizantes e como acidulante em bebidas refrigerantes
H 2S (=7,6x10-2 %), usado como redutor
HClO 4 (=97%), usado na medicina, em análises químicas e como catalisador em explosivos
HCN (=8,0x10
árvores
–3
%), usado na fabricação de plásticos, corantes e fumigantes para orquídeas e poda de
Podemos afirmar que:
a) HClO 4 e HCN são triácidos
b) H 3PO 4 e H 2S são hidrácidos
c) H 3PO 4 é considerado um ácido semiforte
d) H 2 S é um ácido ternário
16. (Fatec 99) Certas regiões do Brasil apresentam excessiva acidez do solo, o que é prejudicial à agricultura.
O procedimento mais adequado (e sua correta explicação) para corrigir a acidez do solo seria adicionar a ele
a)H 3PO 4 - pois esta é uma substância básica que irá neutralizar a acidez.
b)H 2O 2 - pois este é um peróxido capaz de oxidar os ácidos do solo.
c) NaOH - pois esta é uma substância alcalina, além de ser ótimo fertilizante.
d) CaCO 3 - pois este irá neutralizar a acidez sem alcalinizar excessivamente o solo.
e) P 2O 5 - pois este é um sal básico que irá oxigenar o solo.
17. (Fatec 99) São conhecidos vários óxidos de nitrogênio. Abaixo listamos propriedades de alguns desses
óxidos:
I. Dissolve-se em água, formando HNO2 e HNO 3.
QUÍMICA – ESTEQUIOMETRIA E INORGÂNICA
5
Vestibular1 - A melhor ajuda ao vestibulando na Internet
Acesse Agora ! www.vestibular1.com.br
II. Forma-se pelo aquecimento de N 2(g) e O 2(g) e não reage com a água.
III. Decompõe-se por aquecimento, em NO 2.
As propriedades I, II e III podem ser atribuídas, respectivamente, a:
a) N 2O, N 2O4 , N 2O.
b) NO, NO, N 2O.
c) NO, N 2O, N 2O4.
d) NO 2 , N 2 O, NO.
e) NO 2 , NO, N 2 O4
18. (Fatec 98) Uma pequena quantidade de diferentes sólidos brancos, aparentemente muito semelhantes, foi
colocada em pequenos frascos, como discriminado a seguir:
I. Óxido de alumínio
II. Sulfato de magnésio
III. Carbonato de magnésio
IV. Maisena
Adicionando-se a cada um dos frascos certo volume de HCl 1 mol/L, será observada forte efervescência
a) apenas no frasco III.
b) apenas no frasco II.
c) apenas no frasco I.
d) nos frascos III e IV.
e) nos frascos I, II e III.
19. (Ufscar 2001) Os números de oxidação do enxofre em H 2 S, S 8 e Na 2SO 3 são, respectivamente,
a) +2, -8 e -4.
b) -2, zero e +4.
c) zero, -4 e +3.
d) +1, -2 e -3.
e) -6, +8 e -5.
20. (Vunesp 2000) O desinfetante ClO2 é preparado por decomposição do ácido cloroso, de acordo com a
equação
xHOClO(aq) yClO 2 (aq)+1Cl2 ‚(g)+zH 2O(l)
Os coeficientes x, y e z dessa equação são iguais, respectivamente, a
a) 2, 4 e 2.
b) 3, 5 e 3.
c) 6, 2 e 4.
d) 6, 4 e 3.
e) 8, 6 e 4.
21. (Uece 99) Ajuste os coeficientes numéricos da equação proposta a seguir, calculando os valores pelo
método de oxidação-redução ou outro. A seguir, substitua os coeficientes literais, a, b, c, d, e pelos valores
correspondentes obtidos por cálculo.
QUÍMICA – ESTEQUIOMETRIA E INORGÂNICA
6
Vestibular1 - A melhor ajuda ao vestibulando na Internet
Acesse Agora ! www.vestibular1.com.br
AP4 + bHNO3 + cH 2O dH 3PO4 + eNO
Após ajustamento, os valores encontrados para alguns dos coeficientes são os seguintes:
a) a = 4, b = 20, d = 16
b) a = 3, c = 8, e = 20
c) a = 3, b = 12, e = 12
d) b = 16, c = 10, d = 20
22. (Ufrs 98) Para a reação:
S-2 + H+ + NO3 - S + NO + H 2O,
os coeficientes estequiométricos ajustados, lidos da esquerda para a direita, são:
a) 2 - 4 - 2 - 2 - 2 - 2
b) 3 - 2 - 3 - 3 - 3 - 2
c) 3 - 8 - 2 - 3 - 2 - 4
d) 2 - 6 - 3 - 2 - 3 - 3
e) 2 - 8 - 3 - 2 - 3 - 4
23. (Mackenzie 98) KmnO4 +H 2 O2 +H 2SO 4 MnSO4 + K 2SO4 + O2 + H 2O
Da equação anterior, afirma-se que:
I- após o balanceamento, o coeficiente mínimo inteiro da água é igual a 8.
II- o peróxido de hidrogênio atua como oxidante.
III- no MnSO 4 , o número de oxidação do manganês é igual a +1.
IV- o permanganato de potássio é o agente oxidante.
Das afirmações feitas, são corretas apenas:
a) I e IV.
b) II e III.
c) I e III.
d) III e IV.
e) I e II.
24. (Ufpe 2001) A azida de sódio, NaN3 , quando inflamada sofre decomposição rápida fornecendo nitrogênio
gasoso que é utilizado para inflar os sacos de ar ("air-bags") de automóveis, de acordo com a reação:
2 NaN3 (s) 2 Na(s) + 3 N2 (g).
Quantos mols de azida de sódio são necessários para gerar nitrogênio suficiente para encher um saco de
plástico de 44,8 L à 0°C e à pressão atmosférica?
Dados: R = 0,082 L atm mol-1 K-1
Massa molar (g mol-1): N = 14; Na = 23.
Considere que o nitrogênio gasoso tem
comportamento ideal nas condições acima.
a) 1/3
b) 2
c) 3
d) 2/3
e) 4/3
QUÍMICA – ESTEQUIOMETRIA E INORGÂNICA
7
Vestibular1 - A melhor ajuda ao vestibulando na Internet
Acesse Agora ! www.vestibular1.com.br
25. (Ufscar 2001) A massa de dióxido de carbono liberada na queima de 80g de metano, quando utilizado
como combustível, é:
(Massas molares, em g/mol: H=1; C=12; O=16.)
a) 22g.
b) 44g.
c) 80g.
d) 120g.
e) 220g.
26. (Uff 2001) O fósforo elementar é, industrialmente, obtido pelo aquecimento de rochas fosfáticas com
coque, na presença de sílica.
Considere a reação
2 Ca 3(PO4)2 + 6 SiO2 + 10 C P4 + 6 CaSiO3 + 10 CO
e determine quantos gramas de fósforo elementar são produzidos a partir de 31,0g de fosfato de cálcio.
Dados
Massas molares (g/mol): P=31,0; Ca 4 (PO4)2=310,0
a) 3,10 g
b) 6,20 g
c) 12,40 g
d) 32,00 g
e) 62,00 g
27. (Fuvest 2001) Para se determinar o conteúdo de ácido acetilsalicílico (C 9 H 8O4 ) num comprimido
analgésico, isento de outras substâncias ácidas, 1,0g do comprimido foi dissolvido numa mistura de etanol e
água. Essa solução consumiu 20mL de solução aquosa de NaOH, de concentração 0,10mol/L, para reação
completa. Ocorreu a seguinte transformação química:
C 9H8 O 4 (aq) + NaOH(aq) NaC 9H 7O4 (aq) + H 2O(l)
Logo, a porcentagem em massa de ácido acetilsalicílico no comprimido é de, aproximadamente,
Dados:
massa molar do C 9H 8O4 = 180 g/mol
a) 0,20%
b) 2,0%
c) 18%
d) 36%
e) 55%
28. (Uepg 2001) Quando 1mol de ________________ é submetido a oxidação total, ele consome 128g de
oxigênio e produz 132g de gás carbônico e 54g de água. Dentre os compostos orgânicos abaixo, assinale os
que completam corretamente esta afirmação.
Dados
Massas molares (g/mol): C = 12; H = 1; O = 16
01) propanal
02) ácido propanóico
04) propanol
QUÍMICA – ESTEQUIOMETRIA E INORGÂNICA
8
Vestibular1 - A melhor ajuda ao vestibulando na Internet
Acesse Agora ! www.vestibular1.com.br
08) propanona
16) propano
29. (Unirio 2000) ''A contaminação da água com arsênio está preocupando a Primeira-Ministra de Bangladesh
(...) que já pediu ajuda internacional.''
(''JB'', 05/10/99.)
O arsênio não reage rapidamente com a água. O risco da permanência do As em água é o seu depósito nos
sedimentos. É a seguinte a reação do arsênio com NaOH:
2 As + 6 NaOH 2 Na 3AsO3 + 3 H2
75g de arsênio reagiram com NaOH suficiente, produzindo 25,2L de H‚, nas CNTP. O rendimento percentual
da reação foi de:
(Dados: Massas atômicas: H=1u; O=16u; Na=23u; As=75u e Vm=22,4L)
a) 75%
b) 80%
c) 85%
d) 90%
e) 95%
30. (Vunesp 2000) São colocadas para reagir entre si as massas de 1,00g de sódio metálico e 1,00g de cloro
gasoso. Considere que o rendimento da reação é 100%. São dadas as massas molares, em g/mol: Na=23,0 e
Cl=35,5. A afirmação correta é:
a) há excesso de 0,153 g de sódio metálico.
b) há excesso de 0,352 g de sódio metálico.
c) há excesso de 0,282 g de cloro gasoso.
d) há excesso de 0,153 g de cloro gasoso.
e) nenhum dos dois elementos está em excesso.
31. (Fuvest 2000) Misturando-se soluções aquosas de nitrato de prata (AgNO3 ) e de cromato de potássio (K
2CrO4 ), forma-se um precipitado de cromato de prata (Ag 2CrO4), de cor vermelho-tijolo, em uma reação
completa.
A solução sobrenadante pode se apresentar incolor ou amarela, dependendo de o excesso ser do primeiro ou
do segundo reagente. Na mistura de 20mL de solução 0,1 mol/L de AgNO3 com 10mL de solução 0,2 mol/L
de K 2CrO4 , a quantidade em mol do sólido que se forma e a cor da solução sobrenadante, ao final da reação,
são respectivamente:
a) 1 × 10-3 e amarela.
c) 1 e amarela.
e) 2 × 10-3 e incolor.
b) 1 × 10-3 e incolor.
d) 2 × 10-3 e amarela.
32. (Uece 99) Partindo-se de 200g de soda cáustica, por neutralização completa com ácido clorídrico obtêmse 234g de cloreto de sódio. A porcentagem de pureza da soda cáustica é de:
a) 58,5 %
b) 23,4 %
c) 60 %
d) 80 %
33. (Uel 99) A combustão completa de 0,10mol de um composto orgânico constituído de carbono, hidrogênio
e oxigênio gastou 0,30mol de O‚ e produziu 8,8g de dióxido de carbono e 5,4g de água. Esse composto
orgânico poderá ser
QUÍMICA – ESTEQUIOMETRIA E INORGÂNICA
9
Vestibular1 - A melhor ajuda ao vestibulando na Internet
Acesse Agora ! www.vestibular1.com.br
a) CH 3OH
b) CH 3CHO
c) C 2H 5OH
d) CH 3COCH3
e) HCOOH
34. (Pucmg 99) O medicamento "Leite de Magnésia" é uma suspensão de hidróxido de magnésio. Esse
medicamento é utilizado para combater a acidez estomacal provocada pelo ácido clorídrico, encontrado no
estômago.
Sabe-se que, quando utilizamos 12,2g desse medicamento, neutraliza-se certa quantidade do ácido clorídrico,
produzindo 16,0 gramas de cloreto de magnésio.
O grau de pureza desse medicamento, em termos do hidróxido de magnésio, é igual a:
Massas molares (g/mol):
H = 1; CØ = 35,5; Mg = 24
a) 90 %
b) 80 %
c) 60 %
d) 40 %
e) 30 %
35. (Pucmg 99) A água oxigenada, usada para desinfecção e para clarear cabelos, decompõe-se segundo a
equação:
H 2O2 H 2 O + 1/2 O2
Considerando a decomposição completa de 500mL de H‚O‚ e 3,4% p/v, o volume de gás oxigênio, em litros,
produzido nas CNTP, é igual a:
a) 1,12
b) 2,24
c) 5,60
d) 22,40
e) 112,0
36. (Uff 99) O Cloreto de Alumínio é um reagente muito utilizado em processos industriais que pode ser
obtido por meio da reação entre alumínio metálico e cloro gasoso.
Se 2,70g de alumínio são misturados a 4,0g de cloro, a massa produzida, em gramas, de cloreto de alumínio é:
Massas molares (g/mol): Al = 27,0; Cl = 35,5
a) 5,01
b) 5,52
c) 9,80
d) 13,35
e) 15,04
37. (Fei 95) Na neutralização total de 80,0g de hidróxido de sódio - NaOH por 98,0g de ácido sulfúrico –H
2SO4 a 25°C, a quantidade de água obtida é igual a:
a) 1mol de moléculas
b) duas moléculas
c) 1,204.1024 moléculas
QUÍMICA – ESTEQUIOMETRIA E INORGÂNICA
10
Vestibular1 - A melhor ajuda ao vestibulando na Internet
Acesse Agora ! www.vestibular1.com.br
d) 18 gramas
e) 2 moles de 22,4 litros
Massas atômicas: H=1u ; O=16u ; Na=23u; S=32u
38. (Uff 2000) Um meteorito de 4,5 bilhões de anos, que caiu numa cidadezinha do Texas, trouxe uma
surpresa para os cientistas: "vestígio de água"
(transcrito de "O Globo" 30/08/99).
Na investigação sobre a vida em outros planetas, procura-se verificar a existência ou não de água, pois, esta é
elemento essencial à vida, nos moldes até agora conhecidos.
Considere a reação completa de 1,5m3 de H2 (g) com O2 à temperatura de 27°C e pressão de 8,2atm. Nestas
condições, a massa de água produzida e o volume de O2 consumindo são, respectivamente:
a) 1,80 kg e 15,00 m3
b) 4,50 kg e 3,00 m3
c) 9,00 kg e 0,75 m3
d) 18,00 kg e 1,50 m3
e) 45,00 kg e 30,00 m3
39. (Mackenzie 99) Na síntese de 1,5 litros de amônia, ocorrida a pressão e temperatura constantes, o volume
total dos gases que reagem, em litros, é igual a:
a) 4,50
b) 3,00
c) 1,50
d) 0,75
e) 2,00
40. (Fatec 99) A queima de uma amostra de palha de aço produz um composto pulverulento de massa
a) menor que a massa original da palha de aço.
b) igual à massa original da palha de aço.
c) maior que a massa original da palha de aço.
d) igual à massa de oxigênio do ar que participa da reação.
e) menor que a massa de oxigênio do ar que participa da reação.
41. (Ita 98) São feitas as seguintes afirmações a respeito das contribuições do pesquisador francês A. L.
Lavoisier (1743-1794) para o desenvolvimento da ciência:
I) Desenvolvimento de um dos primeiros tipos de calorímetros.
II) Participação na comissão responsável pela criação do sistema métrico de medidas.
III) Proposta de que todos os ácidos deveriam conter pelo menos um átomo de oxigênio.
IV) Escolha do nome oxigênio para o componente do ar atmosférico indispensável para a respiração humana.
V) Comprovação experimental da conservação de massa em transformações químicas realizadas em sistemas
fechados.
Qual das opções a seguir contém a(s) afirmação(ções) CORRETA(S)?:
a) I, II, III, IV e V.
b) Apenas I, II, e IV.
c) Apenas II e III.
d) Apenas IV e V.
e) Apenas V.
42. (Mackenzie 97) Na reação dada pela equação A + B ë C, a razão entre as massas de A e B é 0,4. Se 8g de
A forem adicionados a 25g de B, após a reação verificar-se-á:
QUÍMICA – ESTEQUIOMETRIA E INORGÂNICA
11
Vestibular1 - A melhor ajuda ao vestibulando na Internet
Acesse Agora ! www.vestibular1.com.br
a) a formação de 28g de C, havendo excesso de 5g de A.
b) um excesso de 4,8g de A e consumo total da massa de B colocada.
c) a formação de 20g de C, havendo excesso de 13g de B.
d) o consumo total das massas de A e B colocadas.
e) um excesso de 5g de B e consumo total da massa de A colocada.
43. (Fei 97) Sejam m A e m B as massas de A e B respectivamente que reagem estequiometricamente para
formar C na reação representada pela equação:
A+B C
Ao misturarmos as massas m' A e m' B de A e B respectivamente para formar C, tal que m' A/m'B > mA/mB
então:
a) A é o reagente em excesso
b) B é o reagente em excesso
c) C é o reagente em excesso
d) não há excesso
e) os dados são insuficientes para a conclusão
44. (Mackenzie 97) A tabela a seguir, com dados relativos à equação citada, refere-se a duas experiências
realizadas. Então podemos afirmar que:
a) X é menor que a soma dos valores das massas dos reagentes da 1ª experiência.
b) X = Y
c) Y é igual ao dobro do valor da massa de carbono que reage na 2ª experiência.
d) 32/Y = X/132
e) Y = 168
45. (Fuvest 99) Têm-se amostra de 3 gases incolores X, Y e Z que devem ser H2 , He e SO2 , não
necessariamente nesta ordem. Para identificá-los, determinaram-se algumas de suas propriedades, as quais
estão na tabela a seguir:
QUÍMICA – ESTEQUIOMETRIA E INORGÂNICA
12
Vestibular1 - A melhor ajuda ao vestibulando na Internet
Acesse Agora ! www.vestibular1.com.br
Com base nessas propriedades, conclui-se que X, Y e Z são respectivamente,
a) H2 He e SO2.
b) H2 , SO2 e He.
c) He, SO2 e H2.
d) SO2 He e H2.
e) SO2 , H2 e He.
46. (Fuvest 2000) Ácido clorídrico pode reagir com diversos materiais, formando diferentes produtos, como
mostrado no esquema a seguir:
Os seguintes sinais evidentes de transformações químicas: liberação de gás, desaparecimento parcial ou total
de sólido e formação de sólido são observáveis, respectivamente, em:
a) I, II e III
b) II, I e III
c) II, III e I
d) lII, I e II
QUÍMICA – ESTEQUIOMETRIA E INORGÂNICA
13
Vestibular1 - A melhor ajuda ao vestibulando na Internet
Acesse Agora ! www.vestibular1.com.br
e) III, II e I
47. (Ufmg 98) Considere as seguintes reações químicas, que ocorrem em recipientes abertos, colocados sobre
uma balança:
I - Reação de bicarbonato de sódio com vinagre, em um copo.
II - Queima de álcool, em um vidro de relógio.
III - Enferrujamento de um prego de ferro, colocado sobre um vidro de relógio.
IV - Dissolução de um comprimido efervescente, em um copo com água.
Em todos os exemplos, durante a reação química, a balança indicará uma diminuição da massa contida no
recipiente, EXCETO em
a) II
b) I
c) IV
d) III
48. (Uel 99) A combustão completa de 120g de gás butano libera energia térmica suficiente para elevar, de
10°C a 40°C, a temperatura de 50kg de água. Admitindo que a massa molar do gás em questão é 60g.mol -1 e o
calor específico da água é 4kJ.kg-1°C-1, pode-se calcular que a entalpia de combustão completa, por mol de
butano, é, da ordem de,
a) 1000 kJ mol-1
b) 2000 kJ mol-1
c) 3000 kJ mol-1
d) 4000 kJ mol-1
e) 6000 kJ mol-1
49. (Vunesp 2001) Duas fitas idênticas de magnésio metálico são colocadas, separadamente, em dois
recipientes. No primeiro recipiente adicionou-se solução aquosa de HCl e, no segundo, solução aquosa de CH
3COOH, ambas de concentração 0,1mol/L.
Foram feitas as seguintes afirmações:
I - As reações se completarão ao mesmo tempo nos dois recipientes, uma vez que os ácidos estão presentes na
mesma concentração.
II - O magnésio metálico é o agente oxidante nos dois casos.
III - Um dos produtos formados em ambos os casos é o hidrogênio molecular.
IV - As velocidades das reações serão afetadas se as fitas de magnésio forem substituídas por igual quantidade
deste metal finamente dividido.
São verdadeiras as afirmações:
a) I e II, apenas.
b) II e III, apenas.
c) I e III, apenas.
d) III e IV, apenas.
e) II, III e IV, apenas.
50. (Fuvest 99) A criação de camarão em cativeiro exige, entre outros cuidados, que a água a ser utilizada
apresente pH próximo de 6. Para tornar a água, com pH igual a 8,0 adequado à criação de camarão, um
criador poderia
a) adicionar água de cal.
b) adicionar carbonato de sódio sólido.
QUÍMICA – ESTEQUIOMETRIA E INORGÂNICA
14
Vestibular1 - A melhor ajuda ao vestibulando na Internet
Acesse Agora ! www.vestibular1.com.br
c) adicionar solução aquosa de amônia.
d) borbulhar, por certo tempo, gás carbônico.
e) borbulhar, por certo tempo, oxigênio.
GABARITO
QUESTÃO
ALTERNATIVA
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
37
38
39
40
41
42
43
44
45
E
B
D
E
C
A
E
D
E
D
C
B
A
B
E
C
A
B
A
B
C
B
E
C
A
D
B
C
D
C
9
A
B
E
E
A
B
B
C
C
A
A
D
E
E
QUÍMICA – ESTEQUIOMETRIA E INORGÂNICA
15
Vestibular1 - A melhor ajuda ao vestibulando na Internet
Acesse Agora ! www.vestibular1.com.br
46
47
48
49
50
QUÍMICA – ESTEQUIOMETRIA E INORGÂNICA
C
D
C
D
D
16
Vestibular1 - A melhor ajuda ao vestibulando na Internet
Acesse Agora ! www.vestibular1.com.br
QUÍMICA – ESTEQUIOMETRIA E INORGÂNICA
17