AMEI Escolar
Físico-Química
9º Ano
Resumo nº 3
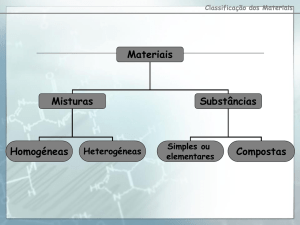
Classificação dos materiais (parte 1)
Estrutura e constituição dos átomos
Conteúdos desta unidade:
Estrutura e
constituição dos
átomos;
Tamanho e massa
dos átomos;
Níveis de energia e
distribuição
electrónica;
Metais e não-metais.
Como já aprendeste, todas as substâncias são
constituídas por corpúsculos – átomos –,
muito pequenos e muito leves, em número muito grande e sempre
irrequietos (quanto maior for a temperatura mais irrequietos). Os
corpúsculos são, assim, ínfimos, invisíveis, incontáveis e irrequietos.
Os corpúsculos não se vêem mas podemos provar a sua existência
através dos fenómenos que eles produzem. Por exemplo, quando
borrifamos o ar com perfume, os corpúsculos do perfume saem do
frasco e misturam-se com os corpúsculos do ar e, apesar de não os
conseguirmos ver, conseguimos detectar a sua existência através da
sensação olfactiva que produzem.
Os átomos são constituídos por:
protões – com carga eléctrica positiva;
neutrões – sem carga eléctrica;
electrões – com carga eléctrica negativa.
Os átomos possuem um núcleo, onde se encontram os protões e os
neutrões, à volta do qual se movem os electrões. Os átomos são
electricamente neutros, contudo estes podem ganhar ou perder
electrões, transformando-se em corpúsculos com carga eléctrica
(negativa ou positiva) – os iões.
Evolução do modelo atómico
A descoberta da constituição dos átomos foi um processo lento, que
ficou a dever-se a vários cientistas e esteve ligada à noção de carga
eléctrica e à descrição da electricidade. A ideia que a matéria é feita
de pequeníssimos corpúsculos surgiu na Grécia Antiga no século V
a.C. A palavra átomo vem do grego, de a + thomos, que significa
“sem devisão”.
Só a partir de 1803 é que o químico inglês John Dalton e outros
cientistas desenvolveram a teoria atómica que teve origem nos
filósofos gregos. Na sequência dos trabalhos
de Dalton:
aos átomos de elementos diferentes
passaram a atribuir-se massas
diferentes e propriedades químicas
distintas;
os compostos passaram a ser
considerados associações de átomos
de elementos diferentes;
as reacções químicas foram
Ilustração 1: Modelo atómico de
explicadas com base em rearranjos de Dalton
átomos, sem criação nem destruição
de matéria, de acordo com a Lei de Lavoisier.
Dalton criou, também, símbolos para os elementos conhecidos. Para
Dalton, cada átomo era uma porção esférica de matéria mal definida.
Em 1897, o físico inglês Joseph
Thomson descobriu o electrão e, em
1904, propôs um novo modelo
atómico que ficou conhecido por
modelo do “bolo de passas”. O
modelo atómico de Thomson
representava o átomo como uma
esfera de carga positiva,
uniformemente distribuída, onde
Ilustração 2: Modelo atómico de Thomson
estariam mergulhadas pequenas
esferas de carga negativa – os
electrões.
Em 1911, o físico inglês de origem neozelandesa, Ernest Rutherford e os seus
colaboradores concluíram nas suas
experiências que a carga positiva não
estava distribuída uniformemente mas
concentrada no centro do átomo: o
núcleo atómico. Concluíram, também,
que o núcleo é muito pequeno
comparado com o átomo, sendo muito
denso e possuindo uma grande massa, e
Ilustração 3: Modelo atómico de
Rutherford
que os electrões movem-se à volta deste.
Na sequência dos estudos de
Rutherford, o físico dinamarquês
Niels Bohr adoptou uma analogia
com o sistema solar, com os
electrões a descreveram órbitas em
torno do núcleo, mas acrescentando
que só determinadas órbitas seriam
possíveis, correspondendo maior
energia aos electrões que
descreviam órbitas com maiores
raios.
Ilustração 4: Modelo atómico de Bohr
Mais tarde reconheceu-se que a noção de órbita não é apropriada
para descrever os electrões nos
átomos. Para qualquer zona em
redor do núcleo há uma certa
probabilidade de encontrar
electrões, sendo maior a
probabilidade de os electrões
estarem perto do núcleo do que
mais longe. Uma maneira de
representar graficamente esta
probabilidade consiste em utilizar Ilustração 5: Modelo da nuvem atómica
uma mancha contínua em volta de
cada núcleo, que é mais escura onde é mais provável encontrar os
electrões. Obtém-se assim a representação em nuvem atómica.
O modelo actualmente aceite é este último, o modelo da nuvem
atómica:
cada átomo é constituído por uma pequena zona central de
dimensões muito reduzidas – o núcleo atómico;
o núcleo atómico tem carga eléctrica positiva, é formada por
protões e neutrões e nele concentra-se quase toda a massa do
átomo;
os electrões ocupam o espaço à volta do núcleo, criando uma
zona de carga eléctrica negativa – nuvem electrónica;
em geral, os electrões de cada átomo não têm todos a mesma
energia e só determinados valores de energia são possíveis;
não se fala em órbita de um electrão mas em orbital – zona do
átomo onde, com maior ou menor probabilidade, se pode
encontrar um electrão com certa energia.
Assim, o núcleo está relacionado com a massa do átomo enquanto a
nuvem electrónica está relacionada com o tamanho do átomo. O
núcleo possui carga eléctrica positiva, determinada pelos protões
que o constituem, e a nuvem electrónica possui carga eléctrica
negativa, determinada pelos electrões que a constituem. Como existe
o mesmo número de protões e electrões em cada átomo, estes
apresentam-se neutros.
Tamanho e massa dos átomos
Os átomos não são todos iguais. Os átomos de elementos diferentes
têm, em regra, tamanhos diferentes e massa distinta. Por isso se usam
esferas de tamanhos diferentes para os representar quer sozinhos
quer formando moléculas.
O átomo de hidrogénio é o átomo mais leve e a estrutura mais
simples, pois possui um só protão e um só electrão. A massa
atómica relativa (Ar), ou apenas massa atómica, de um átomo é o
número de vezes que esse átomo é mais pesado do que o átomo de
hidrogénio.
Assim, como o átomo de hélio é 4 vezes mais pesado que o átomo de
hidrogénio, a sua massa atómica relativa é 4, como o átomo de oxigénio é
16 vezes mais pesado do que o átomo de hidrogénio, a sua massa atómica
relativa é 16 e como o átomo de ferro é 56 vezes mais pesado que o átomo
de hidrogénio, a sua massa atómica relativa é 56.
O número atómico (Z) de um átomo é o número de protões do seu
núcleo atómico. O número de massa (A) de um átomo é o número
total de partículas (protões e neutrões) existentes no seu núcleo. O
número de massa e o número atómico relacionam-se através da
seguinte igualdade:
Para indicar o número atómico e o número de massa de um átomo
utiliza-se a seguinte representação (X é o símbolo do elemento
químico):
Os isótopos (do grego “isos”, o mesmo, e “tópos”, lugar) são
espécies do mesmo elemento químico que têm o mesmo número
atómico (Z), ou seja, igual número de protões, e diferente número de
massa (A), ou seja, diferente número de neutrões. Os isótopos de um
elemento têm propriedades químicas idênticas e ocupam a mesma
posição quando se dispõe segundo o seu comportamento químico,
designadamente na Tabela Periódica dos elementos.
A maioria dos elementos químicos possui dois ou mais isótopos
naturais, mas nem todos são estáveis. A existência de um grande
número de neutrões relativamente aos protões torna os núcleos dos
isótopos, instáveis, ou radioactivos.
Níveis de energia e distribuição electrónica
Como já referimos, o tamanho dos átomos depende da maneira como
os electrões ocupam o espaço à volta do núcleo, sendo que, os
átomos maiores têm nuvens electrónicas maiores. Em muitos casos,
átomos com mais electrões são maiores, mas nem sempre é assim.
Isto deve-se ao tamanho da carga nuclear, quanto maior esta for,
maior será a força de atracção e menor será a nuvem electrónica.
O modelo atómico da nuvem atómica tem certos aspectos que temos
de ter em atenção:
os electrões dos átomos só podem ter determinados valores de
energia – níveis de energia –, preferindo os níveis de menor
energia;
em cada nível de energia só pode haver até certo número de
electrões. Este número máximo é dado pela expressão
,
sendo n o número do nível de energia.
1º nível de energia
2º nível de energia
3º nível de energia
4º nível de energia
5º nível de energia
electrões
electrões
electrões
electrões
electrões
…
A distribuição electrónica é então a distribuição dos electrões de
um átomo pelos diferentes níveis de energia.
Distribuição electrónica:
Hidrogénio
1
Hélio
2
Carbono
2,4
Oxigénio
2,6
Flúor
2,7
Sódio
2,8,1
Magnésio
2,8,2
São electrões de valência os electrões do último nível de energia de
cada átomo (mais afastados, em média, do núcleo). Deve-se a eles o
tamanho do átomo, a interacção do átomo com outros átomos e o
comportamento químico dos elementos. Um átomo apenas pode ter
entre 1 e 8 electrões de valência.
Como estudaste antes, quando um átomo perde ou ganha electrões
recebe o nome de ião. Se perder iões torna-se um ião positivo e
recebe o nome de catião. Se ganhar iões torna-se um ião negativo e
recebe o nome de anião. Num catião a nuvem electrónica é menor do
que a nuvem electrónica do átomo que lhe deu origem. Num anião a
nuvem electrónica é maior do que a nuvem electrónica do átomo que
lhe deu origem.
Quando um átomo tem 8 electrões de valência, é estável e por isso
não forma iões (isto também se aplica ao átomo de hélio pois tem o
primeiro nível de energia completamente preenchido). Quando um
átomo tem entre 1 e 7 electrões de valência têm tendência a formar
iões, a perder ou ganhar electrões, tornando-se estável. Ou seja, um
átomo com 1, 2 ou 3 electrões de valência tem tendência a perde-los
para se estabilizar e um átomo com 5, 6 ou 7 electrões de valência
tem tendência a ganhar 3, 2 ou 1 electrões respectivamente para se
estabilizar. Quando o átomo tem 4 electrões de valência tem tanta
tendência a perdê-los como de ganhar 4 electrões de valência.
Metais e não-metais
Atendendo à enorme diversidade dos materiais e das suas
propriedade é necessário estabelecer esquemas de organização e
classificação. Existem pouco mais de uma centena de átomos de tipo
diferente, isto é, cerca de 100 elementos diferentes, cada um deles
caracterizado pelo número atómico.
Conforme as suas propriedades, as diferentes substâncias
elementares podem organizar-se em duas grandes classes: metais e
não-metais. Estes podem ser distinguidos pelas suas propriedades
físicas e químicas. São exemplos de propriedades físicas a
densidade, o brilho, a condutividade eléctrica e térmica, a ductilidade
e a maleabilidade, o ponto de fusão e o ponto de ebulição.
PROPRIEDADES FÍSICAS
Metais
Não-metais
- são quase todos sólidos à temperatura
- podem ser sólidos (grafite, diamante, enxofre e
ambiente e pressão normal. Excepção: mercúrio iodo) ou gasosos (oxigénio, ozono, nitrogénio e
(líquido).
hélio). Excepção: bromo (líquido).
- têm uma estrutura que os torna, no geral, mais - apresentam densidade muito variáveis e, em
densos do que os não-metais.
geral, menores que os metais.
- os metais não oxidados são brilhantes – brilho - em regra, são baços.
metálico.
- apresentam elevada condutividade eléctrica e - são maus condutores eléctricos e térmicos.
térmica.
Excepção: grafite.
- apresentam ductilidade e maleabilidade –
- quando se encontram no estado sólido são
dobram sem quebrar.
quebradiços.
- têm pontos de fusão e de ebulição elevados. - têm pontos de fusão e de ebulição baixos.
PROPRIEDADES QUÍMICAS
Metais
- os óxidos de metais (Na2O, MgO e CaO) têm
um comportamento básico na presença de
água.
- os óxidos de metais são compostos iónicos,
sólidos à temperatura ambiente.
- os metais são, em geral, muito reactivos.
- os átomos de metais originam normalmente
iões de carga positiva.
Não-metais
- os óxidos de não-metais (CO2, SO2 e SO3)
têm um comportamento ácido na presença
de água.
- os óxidos de não-metais não são compostos
iónicos e são gases à temperatura ambiente.
- podem ou não ser reactivos.
- os átomos de metais originam normalmente
iões de carga negativa.
Há um pequeno conjunto de substâncias elementares que não cabe
nem na classe dos metais nem na dos não-metais. Designam-se
semimetais ou semicondutores e têm certas propriedades eléctricas
que os tornam muito úteis em electrónica. São exemplo o silício (Si)
e o germânio (Ge).