Química dos Elementos dos
Grupos 13 a 18
Grupo 13
• Neste grupo temos o boro (não-metal) e
outros quatro elementos metálicos.
• A química do boro é tão diferente que
merece uma discussão separada.
• O boro é um não-metal e possui a
tendência a formar ligações covalentes.
• Ele se parece mais com o carbono e o
silício do que com os elementos do seu
grupo.
• Forma hidretos (como o carbono)
• Forma minerais complexos com o
oxigênio (como o silício)
• O elemento puro possui diversas formas
alotrópicas baseadas em unidades
icosaédricas de B12.
• Nos hidretos de boro (boranas), o
hidrogênio faz o papel de ponte entre os
átomos de boro.
• Como é possível?
• O diborano possui 12
elétrons de valência.
• A abordagem de Lewis
coloca quatro elétrons
nas pontes.
• Este tipo de ligação é
chamada de centro de
três centros e dois
elétrons.
• Para entender como este tipo de ligação é
possível, precisamos estudar as
interações entre orbitais nessa molécula.
• A simetria do diborano é D2h. Se usarmos
a estratégia do orbital de grupo podemos
ver as representações irredutíveis que se
combinam.
• Temos orbitais de
grupo com a mesma
simetria.
• O resultado é um
orbital ligante e um
anti-ligante.
• No caso do ligante,
os lóbulos envolvem
as pontes B-H-B,
favorecendo a
estabilidade da
molécula.
• Ligações semelhantes
ocorrem em outros
boranos, bem como em
alguns carboranos, que
contém átomos de boro e
de carbono em arranjos
de clusters.
• Imagem:
• Base conjugada de um
carborano ácido.
• Cl – verde
• H – branco
• C – preto
• B - rosa
• Outras informações químicas:
• B e Al formam ácidos de Lewis de
coordenação 3 capazes de receber um
par de elétrons, aumentando o número de
coordenação.
• O boro forma trihaletos ácidos (BX3), que
são moléculas planares. Esses ácidos
recebem pares de elétrons de íons haleto
e formam íons tetraborato (BX4-).
• Os haletos de boro servem como
catalisadores ao receberem haletos.
Vejamos uma reação de Friedel-Crafts
(alquilação de hidrocarbonetos
aromáticos):
BF3 + RX R+ + BF3XR+ + PhH H+ + RPh
H+ + BF3X- HX + BF3
--------------------------------RX + PhH RPh + HX
• O caráter metálico dos elementos do
grupo 13 aumenta a medida que se desce
no grupo.
• Al, Ga, In, Tl formam íons 3+ pela perda
dos elétrons p e dos elétrons s de
valência. O tálio também forma íons 1+
pela perda apenas do elétron p. Os
elétrons s que permanecem formam um
par inerte.
• Uma explicação simplificada pode ser
dada pela estabilidade da subcamada
preenchida. Os elétrons s que não reagem
aparentam uma “inércia”.
• Existem paralelos entre a química do grupo
principal e a química orgânica. Um dos mais
interessantes é a comparação da borazina
(B3N3H6, “benzeno inorgânico”) com o benzeno.
• A química dos dois compostos é bem diferente.
A diferença de eletronegatividade entre o N e o
B da borazina dá um caráter polar às ligações
B—N que o benzeno não possui. Com isso, a
borazina é mais propensa a ataques por
nucleófilos (no boro) e por eletrófilos (no
nitrogênio) do que o benzeno.
Benzeno
Borazina
Ponto de fusão (ºC)
6
-57
Ponto de ebulição
80
55
Densidade no ponto de fusão (g/cm)
0,81
0,81
Tensão superficial no ponto de fusão
(N/m)
0,0310
0,031
Momento dipolo
0
0
• Outro paralelo interessante ocorre com os
nitretos de boro (BN). Assim como o carbono,
estes compostos ocorrem em formas
semelhantes ao diamante e ao grafite.
• No caso da estrutura semelhante ao grafite, há
menos deslocalização das núvens p e, por isso,
o BN é um mau condutor de eletricidade.
• Alumínio
• Da bauxita é retirada a alumina que, por meio do
processo de redução, é transformada em alumínio.
Depois de minerada, a bauxita é transportada para a
fábrica. Lá, é iniciada a primeira de muitas reações
químicas. A bauxita é moída e acrescida de uma solução
de soda cáustica, que a transforma em pasta. Aquecida
sob pressão e recebendo novas quantidades de soda
cáustica, esta massa se dissolve e forma uma solução
que passa por processos de sedimentação e filtragem.
Nesta etapa, são eliminadas todas as impurezas e a
solução restante fica pronta para que dela seja extraída
a alumina.
Em precipitadores, a alumina contida na solução é
precipitada pelo processo de "cristalização por
semente". O material resultante é lavado e seco por
aquecimento. Assim, é obtido o primeiro estágio da
produção de alumínio: a alumina, que se apresenta sob
a forma de pó branco e refinado.
•
A bauxita é dissolvida em soda cáustica e, posteriormente, filtrada para
separar todo o material sólido, concentrando-se o filtrado para a
cristalização da alumina. Estes cristais são secos e calcinados a fim de
eliminar a água. Então, a alumina é finalmente transformada em alumínio
por meio de um processo de eletrólise.
•
Durante a eletrólise, uma corrente elétrica passa pela alumina fundida
dissolvida em um banho de criolita (920-980 ºC). Com isso, o metal é
separado
Grupo 14
• Os elementos desse grupo variam desde
o carbono (não metal) até o estanho e o
chumbo (metais) com os elementos
intermediários apresentando caráter semimetálico.
• Formas alotrópicas do carbono:
• Diamante
• Grafite
• Fulerenos
• O silício é o segundo elemento mais
abundante do nosso planeta, aparecendo
principalmente na forma de SiO2.
• Estanho e chumbo são conhecidos desde
a antiguidade.
• O estanho era combinado com o cobre na
formação de bronze. Foram encontradas
ferramentas de bronze com mais de 5000
anos.
• O chumbo foi usado pelos egípcios na
cerâmica
e
pelos
romanos
em
encanamentos.
• Embora o carbono apareça principalmente
como o isótopo 12C na natureza (base do
nosso sistema de massa atômica), o
isótopo 13 tem abundância relativa de
1,11%. Por conta do spin nuclear do 13C
ser ½, ele é usado como base para
observações de RMN em compostos que
contenham carbono.
• O 14C é formado na atmosfera a partir da reação
de nitrogênio com nêutrons acelerados
14 N + 1 n 14 C + 1 H
7
0
6
1
Esse carbono é muito raro (1,2x10-10% do
carbono atmosférico), mas é incorporado aos
tecidos vivos por processos biológicos. Quando
o ser vivo morre, o processo de troca com o
ambiente cessa e o 14C fica preso. Com o
tempo, este isótopo decai com meia vida de
5730 anos.
14 C 14 N + e- (decaimento beta)
6
7
• Medindo-se a quantidade de 14C restante
numa amostra fóssil é possível medir o
grau de decaimento e, portanto, o tempo
estimado desde a morte. Muitas amostras
arqueológicas são datadas assim.
• Até 1985, só eram conhecidas duas
formas alotrópicas de carbono: diamante e
grafite.
• O diamante é formado por estruturas
tetraédricas, rígidas, formando uma das
substâncias mais duras conhecidas
• O grafite é formado por camadas de
carbono em anéis. Pode-se imaginar os
átomos na forma de híbridos sp2. Os
orbitais p não usados formam ligações p,
deslocalizando elétrons sobre as
camadas.
• As camadas do grafite interagem
fracamente entre si e deslizam umas
sobre as outras, tornando a substância um
bom condutor elétrico e um bom
lubrificante.
• Um dos maiores desenvolvimentos da
química moderna foi a síntese do
“buckminsterfulereno” ou simplesmente
“fulereno”.
• Hoje, são conhecidas moléculas de forma
quase esféricas com composição C60, C70
e C80.
• Em trabalhos posteriores, vários grupos
foram conectados ao lado externo das
estruturas. Moléculas pequenas também
já foram colocadas dentro dos fulerenos.
• Nove anos depois da síntese dos primeiros
fulerenos, depósitos naturais foram descobertos
em sítios de impacto de meteoritos.
• Extensões da família dos fulerenos incluem os
nanotubos de carbono. Que podem ser
sintetizados tanto na forma de parede simples
como na forma de paredes múltiplas.
• Silício e germânio cristalizam numa
estrutura semelhante ao diamante, mas
possuem ligações covalentes mais fracas
que o carbono e, por isso, seus pontos de
fusão são mais baixos. Ambos são
semicondutores.
• O estanho possui dos alótropos: uma
forma semelhante à do diamante (a) e
uma metálica (b) que é mais estável.
• O chumbo é sempre metálico e é um dos
metais mais densos e tóxicos.
• Compostos
• O carbono não tem apenas a coordenação 4.
Existem exemplos de carbono pentacoordenado
como no Al2(CH3)6.
• O óxidos de carbono, CO e o CO2, são
gases incolores e inodoros. O CO é
extremamente tóxico pois forma ligações
mais estáveis com o Fe na hemoglobina
do que o O2. Como vimos, o HOMO do
CO está localizado no carbono, o que
permite que a molécula interaja com
vários metais. Os metais podem doar
elétrons de seus orbitais d para os orbitais
p* vazios (LUMO) do CO.
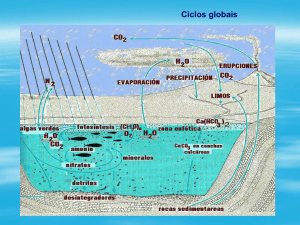
• O CO2 é a quinta substância mais
abundante na atmosfera e é o produto da
respiração, combustão e de outros
processos industriais e naturais. Devido
às energias dos níveis vibracionais do
CO2, ele absorve muita energia térmica e
age como um “cobertor” atmosférico.
• O carbono forma vários ânions,
especialmente com metais eletropositivos,
chamados de carbetos. O CaC2 é o mais
importante deles.
• Apesar da grande quantidade de
compostos que o carbono pode formar, o
elemento mais abundante deste grupo é o
silício. Este elemento é usado na indústria
de semicondutores em campos como
informática e energia solar.
• O silício aparece na
forma de minerais
compostos
de
unidades SiO4.
• O dióxido de silício
ocorre em várias
formas,
principalmente
quartzo, que é o
principal constituinte
do arenito e do
granito.
• O SiO2 tem importância industrial pois é o
principal componente do vidro, dos
suportes para a cromatografia, como
substrato catalítico, como auxiliar de
filtração e várias outras aplicações.
• Embora o carbono forme muitos
compostos, os outros elementos do grupo
não seguem a mesma tendência. O silano
SiH4 é estável e compostos de fórmula
SinHn+2 com até 8 átomos de silício foram
sintetizados mas eles têm estabilidade
decrescente com o aumento da cadeia.
• Germanos, desde o GeH4 até o Ge5H12
foram preparados, assim como o
estanano SnH4 e o Sn2H6, possivelmente
exista o plumbano, PbH4. A química
nesses casos é bem mais restrita.
• Por que esses compostos são bem menos
estáveis?
• No caso do silício, a ligação Si-Si é um pouco
mais fraca do que a C-C, as ligações Si-H
também são mais fracas do que as C-H. O Si é
menos eletronegativo do que o H e bem menos
do que o C, por isso o Si é mais propenso a um
ataque nucleofílico. Os átomos de Si são
maiores, o que aumenta a área para um ataque
nucleofílico. Além disso, o Si possui elétrons d
de baixa energia que podem receber elétrons
dos nucleófilos.
• Argumentos similares podem ser usados para
os demais elementos do grupo.
• Os elementos germânio, estanho e
chumbo mostram forte tendência ao
estado de oxidação 2+, em conseqüência
do efeito do par inerte.
• Todos os três elementos formam haletos
de fórmula MX4 e MX2.
• Para o germânio, os haletos mais estáveis
têm fórmula GeX4. No caso do chumbo,
os mais estáveis são PbX2.
• Nos dihaletos o metal possui um par inerte
estereoquimicamente ativo, levando a uma
geometria distorcida nas moléculas livres e a
estruturas cristalinas com os pares inertes
evidentes
Grupo 15
• O nitrogênio é o componente mais
abundante da atmosfera (78,1% por
volume). Entretanto, ele só foi isolado em
1772.
• O fósforo foi isolado a partir da urina em
1669 por Brandt.
• Os outros elementos
já eram conhecidos
desde a antiguidade.
• O comportamento
dos elementos deste
grupo varia desde o
caráter não-metálico
do nitrogênio e do
fósforo até o caráter
metálico do bismuto.
Os elementos entre
eles (arsênio e
antimônio) possuem
caráter
intermediário.
• O nitrogênio é um gás diatômico incolor.
Ele possui uma ligação tripla de grande
estabilidade, por isso é muito pouco
reativo (mas não é completamente inerte).
• É usado em muitas situações onde é
necessária uma atmosfera inerte. Na
forma líquida (77K) é usado como
refrigerante de baixa temperatura.
• O fósforo possui várias formas alotrópicas.
As mais comuns são:
• Fósforo branco: a-P4(cúbico), b-P4(hexagonal)
• A condensação do fósforo nas fases líquidas ou
gasosas leva à forma alfa, que se converte
lentamente para a forma beta.
• Durante o contato com o ar, o a-P4se oxida
lentamente, emitindo uma luz amareloesverdeada. Para reduzir a oxidação, o fósforo
branco é guardado em água.
• O fósforo branco era utilizado em palitos
de fósforo, mas por questões de
segurança e toxicidade, foi substituído por
P4S3 e pelo fósforo vermelho.
• O fósforo vermelho é obtido pelo
aquecimento do fósforo branco na
ausência de ar. É um material amorfo.
• Outro alótropo é o fósforo preto, que é a
forma mais estável termodinamicamente.
É obtido a partir do fósforo branco por
aquecimento em altas pressões.
• O fósforo existe na forma de
moléculas tetraédricas P4 nas
formas gasosa e líquida. Em
altas temperaturas, ele se
dissocia em P2.
• O arsênio, o antimônio e o
bismuto também exibem
alotropia.
• O bismuto é o elemento mais
pesado com núcleo não
radioativo. Todos os
elementos a partir do polônio
são radiotivos.
• Hidretos
• Além da amônia, o nitrogênio forma
hidretos N2H4 (hidrazina), N2H2 (diazeno)
e o ácido hidrazóico, HN3.
• A química da amônia e do íon amônio é
vasta. O uso industrial da amônia é muito
grande. Nenhum outro produto químico é
mais produzido. Cerca de 80% de toda a
produção é usada na fabricação de
fertilizantes. O restante é usado em
explosivos, fibras sintéticas, além de
várias sínteses orgânicas e inorgânicas.
• Na natureza, a amônia é produzida pelas
bactérias fixadoras de nitrogênio. Essas
bactérias contém nitrogenases, que são
enzimas contendo ferro e molibdênio que
catalisam a formação de NH3.
• Na indústria, o NH3 é produzido pelo
processo Haber-Bosch, que usa o ferro
finamente dividido como catalisador:
N2 + 3 H2 2NH3
Mesmo com catalisador, o processo exige
temperaturas de mais de 380ºC e
pressões de 200 atm.
• A oxidação da hidrazina é altamente
exotérmica
N2H4 + O2 N2 + 2H2O
DHº= -622kJ/mol
Por conta dessa reação, a hidrazina tem sido
usada como combustível para foguetes.
Ela também é um bom agente redutor tanto em
meio ácido (na forma de N2H5+) como em meio
básico. Pode ser oxidada por 1, 2 ou 4 elétrons,
dependendo do oxidante usado.
N2H5+ NH4+ + ½N2 + H+ + eEº=1,74V
N2H5+ ½NH4+ + ½HN3 + 5/2 H+ + 2e- Eº=-0,11V
N2H5+ N2 + 5 H+ + 4eEº= 0,23V
• A fosfina (PH3) é um gás altamente tóxico.
Essa molécula possui atrações
intermoleculares mais fracas do que a
amônia . Os derivados da fosfina ,PR3
(R=H, alquil, aril) e P(OR)3 (fosfitos) são
ligantes importantes são ligantes
importantes para vários compostos de
coordenação.
• Óxidos e oxiânions de nitrogênio
Óxido nitroso, N2O:
Anestésico e propelente para aerossóis.
Se decompõe em gases seguros para o
meio-ambiente. Entretanto, ele é um gás
que contribui para o efeito estufa.
Óxido nítrico, NO:
Ligante eficiente para a química de
coordenação. Possui vários usos
biológicos.
N2O4 e NO2:
Formam um par que, na temperatura ambiente,
está em equilíbrio:
N2O4
2NO2
DHº=57,20 kJ/mol
O N2O4 é incolor e diamagnético e possui uma
ligação N—N fraca que pode se dissociar para
gerar o NO2 que é marrom e paramagnético.
• O óxido nítrico (NO) é formado pela
combustão de combustíveis fósseis e
pela ação de relâmpagos na atmosfera,
onde ele pode ser oxidado a NO2. Estes
gases, chamados de NOx, contribuem
para o problema da chuva ácida,
principalmente porque o NO2 reage com a
umidade do ar para formar ácido nítrico:
• 3 NO2 + H2O 2 HNO3 + NO
• O ácido nítrico tem imensa importância
industrial, principalmente na síntese do
nitrato de amônio, entre outros produtos.
• O nitrato de amônio é usado como
fertilizante e também sofre decomposição
exotérmica violenta sob o efeito da
temperatura:
2NH4NO3 2N2 + O2 + 4H2O
• Por conta da exotermicidade da reação e
da grande liberação de gases, seu uso
como explosivo só perde em importância
para a indústria de fertilizantes.
• O ácido nítrico também é usado como solvente
não aquoso e sofre auto-ionização:
• 2 HNO3
H2NO3+ + NO3• H2NO3+ + NO3H2O + NO2+ + NO3• O ácido nítrico é sintetizado comercialmente
via dois óxidos de nitrogênio. Inicialmente, a
amônia é oxidada a óxido nítrico na presença
de catalisador de Pt-Rh.
• 4 NH3 + 5O2 4NO + 6H2O
• O óxido é oxidado pelo ar é pela água:
2 NO + O2 2NO2
3NO2 + H2O 2HNO3 + NO
• Se um catalisador específico não for
usado na oxidação da amônia, haverá
formação de N2.
4 NH3 + 3O2 2N2 + 6H2O
• O ácido fosfórico só perde em importância
para o ácido sulfúrico na produção
industrial. Dois métodos são usados:
• 1) Combustão de um spray de fósforo
fundido numa mistura de ar e vapor numa
câmara de aço inoxidável. O P4O10
formado é convertido em H3PO4.
P4 + 5 O2 P4O10
P4O10 + 6H2O 4 H3PO4
• 2) Tratamento de minerais contendo
fosfato com ácido sulfúrico. Por exemplo:
Ca3(PO4)2 + 3 H2SO4 2 H3PO4 + 3CaSO4
Grupo 16
• Os dois primeiros elementos do grupo são
familiares na forma de O2 e enxofre.
• O selênio não é muito conhecido, mas é usado
no processo de fotocópia. Embora seja muito
tóxico, em traços é essencial à vida.
• Telúrio é usado em ligas, vidros e catalisadores
da indústria de borracha.
• Todos os isótopos do polônio são radioativos e
seu decaimento altamente exotérmico é usado
como fonte de energia para satélites.
• O enxofre ocorre como elemento livre em
depósitos naturais. Despertou interesse de
alquimistas e, após o desenvolvimento da
pólvora (mistura de enxofre, nitrato de potássio
e carvão em pó), no século XIII, de líderes
militares também.
• O oxigênio compõe cerca de 21% da atmosfera
na forma molecular e, combinado com outros
elementos, forma 46% da massa da crosta
terrestre, além dos corpos de água.
• Apesar da sua grande abundância, o oxigênio só
foi isolado na década de 1770 por Scheele e
Priestley. A síntese do oxygênio por Priestley foi
realizada pelo aquecimento do HgO com uma
lente de aumento e é considerada um marco da
química experimental.
• O selênio e o telúrio foram descobertos logo em
seguida e, por conta das suas similaridades,
têm nomes que homenageiam a Lua (selene,
em grego) e a Terra (tellus, em latim).
• O polônio foi descoberto por Marie Curie em
1898; como o rádio, foi isolado em quantidades
traço a partir de toneladas de minério de urânio.
• O oxigênio existe principalmente na forma de O2, mas
traços de ozônio, O3, são encontrados na alta atmosfera e
nas vizinhanças de descargas elétricas. O2 é
paramagnético e o O3 é diamagnético. O paramagnetismo
do O2 é uma conseqüência dos dois elétrons de spin
paralelo ocupando os orbitais p*(2p). Além disso, são
conhecidos dois estados excitados do O2 que possuem
elétrons p* de spins opostos e possuem maior energia.
• Os estados excitados do O2 podem ser atingidos quando
fótons são absorvidos na fase líquida durante colisões
moleculares e, sob estas circunstâncias, um único fóton
pode excitar duas moléculas simultaneamente. Esta
absorção ocorre na faixa do visível, em 631 e 474 nm,
tornando o oxigênio líquido azul. Estes estados excitados
são importantes para vários processos oxidativos.
• O2 é fundamental para a respiração, sendo transportado
pela hemoglobina.
• O ozônio absorve radiação ultravioleta entre 200 e 360
nm, protegendo a superfície da Terra desta radiação de
alta energia.
• Na alta atmosfera, o ozônio é formado a partir
do O2.
O2 + hn 2O
O + O2 O3
A absorção de radiação UV pelo ozônio o
decompõe em O2. Na alta atmosfera, é atingida
uma concentração estacionária de ozônio,
suficiente para proteger a superfície da Terra da
radiação UV.
• Poluentes na alta atmosfera, como os óxidos de nitrogênio
oriundos de aviões e átomos de cloro provenientes da
decomposição fotocatalisada de clorofluorcarbonos
(CFCs) catalisam a decomposição do ozônio.
• O processo completo que governa a concentração de
ozônio na atmosfera é complexo. Acredita-se que algumas
das reações abaixo sejam exemplos de processos
envolvidos.
NO2 + O3 NO3 + O2
NO3
NO + O2
NO + O3 NO2 + O2
-------------------------------2 O3
3 O2 (global)
Cl + O3 ClO + O2
ClO + O Cl + O2
-------------------------------O3 + O 2 O2 (global)
• O ozônio é um oxidante mais forte do que o oxigênio e em
solução ácida, só perde para o flúor como agente
oxidante.
• Espécies envolvendo o oxigênio:
Fórmula Nome
Dist. O-O (pm) Observações
O2+
Dioxigenil
112,3
Ordem de ligação 2,5
O2
Dioxigênio
120,7
Coordena com metais de
transição, forma excitada
(singuleto) é importante em
processos fotoquímicos,
agente oxidante.
O2-
Superóxido
128
Agente redutor moderado
O2=
Peróxido
149
Agente oxidante forte, forma
compostos iônicos.
O3
Ozônio
127,8
Agente oxidante forte.
Absorve no UV.
O3-
Ozônidio
134
Formado pela reação do O3
com hidróxidos de metais
alcalinos secos.
• O enxofre é o elemento com o
maior número de alótropos. A
forma
mais
estável
na
temperatura ambiente é o a-S8.
• O aquecimento do enxofre muda
a sua viscosidade. A cerca de
119ºC, o enxofre se funde num
líquido amarelo, cuja viscosidade
diminui por conta do aumento do
movimento térmico até 155ºC. A
partir desta temperatura, a
viscosidade aumenta muito. A
partir de 200ºC a viscosidade
volta a diminuir e o líquido fica
avermelhado.
• A explicação para o fenômeno está na tendência das
ligações S—S de se romperem e se re-formarem em
altas temperaturas. Acima de 159ºC, os anéis de S8
se abrem e as cadeias abertas forçam os anéis ainda
fechados a formarem cadeias maiores com 16, 24 ou
mais átomos.
• Quanto maiores as cadeias, maior a viscosidade. A
união das extremidades das cadeias pode levar a
grandes anéis. Em temperaturas maiores, o
rompimento térmico supera a propagação das
cadeias, levando a formação de cadeias menores e
uma redução da viscosidade. Em altas temperatura, a
espécie mais importante é o S3, de cor avermelhada.
• Se o enxofre viscoso aquecido for vertido
sobre a água, ele forma um sólido “plástico”
que pode ser moldado. Entretanto, com o
tempo, esta forma volta ao estado a-S8 que é
mais estável termodinamicamente.
• O ácido sulfúrico é o produto químico mais
produzido industrialmente. O processo de
fabricação começa com a síntese do SO2 por
combustão do enxofre ou aquecimento na
presença de oxigênio de sulfetos:
S + O2 SO2
(combustão)
MxSy + O2 y SO2 + MxOy (aquecimento)
O SO2 é convertido em SO3 pela reação
exotérmica:
SO2 + ½ O2 SO3
Usando-se V2O5 ou outro catalisador como
conversor catalítico multiestágio.
• O SO3 reage com a água para formar ácido
sulfúrico.
SO3 + H2O H2SO4
• Se o SO3 passar diretamente sobre a água, um
aerossol fino de H2SO4 será formado. Para evitar
isso, o SO3 é absorvido em H2SO4 (98%) para
formar o ácido dissulfúrico:
SO3 + H2SO4 H2S2O7
O H2S2O7 então será misturado à água para formar
o ácido sulfúrico:
H2S2O7 + H2O 2H2SO4
Grupo 17
• Compostos contendo halogênios têm sido
usados desde a antiguidade. O primeiro
uso provavelmente deve ter sido do sal
marinho (principalmente NaCl) na
preservação de alimentos.
• Todos os halogênios neutros são diatômicos e
são reduzidos rapidamente em ânions. Todos se
combinam com o hidrogênio para formar gases
que, com exceção do HF, são fortes em solução
aquosa.
• A química dos halogênios é governada pela sua
tendência em adquirir um elétron para atingir a
configuração de gás nobre. Por isso, os
halogênios são ótimos agentes oxidantes,
sendo o F2 o agente mais oxidante de todos os
elementos. Esta tendência está também
presente nas altas afinidades eletrônicas e
eletronegatividades.
• F2 é altamente reativo. Ele é preparado
pela eletrólise de fluoretos fundidos como
o KF.
• Cl2 é um gás amarelo e possui um odor
característico
• Br2 é um líquido vermelho escuro que
evapora facilmente
• I2 é um sólido negro, sublimável à
temperatura ambiente, que um vapor
púrpura e, como os outros halogênios, é
altamente solúvel em solventes apolares.
Moléculas de Halogênio X2
Elemento
E. Ioniz
(kJ/mol)
Afin.
Eletr.
(kJ/mol)
P. Fusão
(ºC)
P. Ebulição
(ºC)
Eletroneg
(Pauling)
Dist. X-X
(pm)
DH dissoc
(kJ/mol)
F
1681
328
-218,6
-188,1
3,98
143
158,8
Cl
1251
349
-101,0
-34,0
3,16
199
242,6
Br
1140
325
-7,25
59,5
2,96
228
192,8
I
1008
295
113,6
185,2
2,66
266
151,1
At
930
270
302
2,2
• Várias tendências nas propriedades
físicas dos halogênios podem ser vistas
na tabela anterior. A medida que o número
atômico aumenta, a habilidade do núcleo
de atrair os elétrons mais afastados
diminui. Com o aumento do tamanho e do
número de elétrons nas moléculas
diatômicas, as interações de London
aumentam. Por isso, F2 e Cl2 são gases,
Br2 é líquido e I2 é sólido, por conta
dessas interações.
• As tendências não são totalmente
previsíveis pois o flúor e seus compostos
possuem características que são
diferentes das previstas por extrapolação.
• Uma das propriedades mais marcantes do
F2 é a baixa entalpia de dissociação. Por
extrapolação das entalpias de dissociação
das outras moléculas X2, teríamos um
valor de 290kJ/mol, mas o valor real é
aproximadamente a metade disso.
• Uma explicação possível é a repulsão
entre pares de elétrons não ligantes. Pelo
tamanho dos átomos de flúor, esses pares
ficam muito próximos. As repulsões
eletrostáticas entre esses pares resultam
em ligações mais fracas e numa distância
de equilíbrio maior do que seria esperada
na ausência dessas repulsões.
• Em termos de orbitais, pode-se dizer que
o tamanho dos átomos de flúor leva a uma
sobreposição fraca entre os orbitais
ligantes e uma grande sobreposição de
orbitais p* anti-ligantes.
• Efeitos similares são encontrados no O2 e no N2.
• Entre os ácidos HX, o HF é o mais fraco em
solução aquosa (pKa=3,2 a 25ºC). HCl, HBr e HI
são ácidos fortes. Embora o HF reaja com a
água, ligações de hidrogênio fortes ocorrem
entre o F- e o íon hidrônio (F- -H+-OH2) para
formar o par íonico H3O+F-, o que reduz o
coeficiente de atividade do H3O+. A medida que a
concentração de HF aumenta, aumenta a
concentração de H3O+
H3O+ + F- + HF
H3O+ + HF2-
• Além dos íons monoatômicos comuns, várias
espécies poliatômicas, tanto catiônicas como
aniônicas, já foram preparadas.
• I2 + II3K698 a 25ºC em solução aquosa
• Os halogênios Cl2, Br2 e I2 também podem ser oxidados. Por
exemplo, Br2+, I2+, I3+ e I5+. O I2+ dimeriza em I42+:
• 2 I2+
I42+
• Os halogênios formam muitos compostos
contendo dois ou mais halogênios
diferentes. Estes compostos podem ser
diatômicos (p.ex. ClF) ou poliatômicos
(p.ex.ClF3, BrF5, IF7, etc.). O efeito do
tamanho do átomo central pode ser visto,
com o iodo sendo o único elemento capaz
de ter até sete átomos de cloro numa
única molécula, enquanto o cloro e o
bromo têm no máximo cinco átomos de
flúor.
Estado de oxidação Número de pares Compostos e íons
do átomo central
inertes no átomo
central
+7
0
IF7
IF6+
IF8-
+5
1
ClF5, BrF5, IF5
ClF4+, BrF4+, IF4+
BrF6-, IF6-
+3
2
ClF3, BrF3, IF3, I2Cl6
ClF2+, BrF2+, IF2+, ICl2+, IBr2+, IBrCl+
ClF4-, BrF4-, IF4-, ICl4-
+1
3
ClF, BrF, IF, BrCl, ICl, IBr
ClF2-, BrF2-, IF2-, BrCl2-, ICl2-, IBr2Br2Cl-, I2Cl-, I2Br-, IBrCl-
• Interhalogênios neutros podem ser
preparados por vários modos, incluindo a
reação direta dos elementos.
• Cl2 + F2 2ClF
(225ºC)
• I2 + 5F2 2IF
(T. amb)
• I2 + 3 XeF2 2 IF3 + 3 Xe (T<-30ºC)
• I2 + AgF IF + AgI
(0ºC)
Grupo 18
• Embora tenham sido chamados de gases
“inertes” ou “raros”, esses elementos não
possuem essas características.
• O hélio é o segundo elemento mais
abundante do universo e o argônio é o
terceiro componente do ar seco, sendo 30
vezes mais abundante (em volume) do
que o CO2.
• Em 1776, Cavendish isolou uma fração do
ar que resistia a todas as tentativas de
reação. Essa fração, descobriu-se mais
tarde, era uma mistura de argônio e outros
gases nobres.
• Durante um eclipse solar em 1868, uma
linha de emissão nova, que não
correspondia
a
nenhum
elemento
conhecido, foi observada na coroa solar.
Locklear e Frankland propuseram um
novo elemento, chamado de hélio (“sol”
em grego).
• Hélio é usado como atmosfera inerte, em
balões e misturas gasosas para
mergulhadores. O hélio líquido (p.ebulição
4,2K) tem sido usado como refrigerante de
magnetos supercondutores em aparelhos
de RMN.
• Argônio é usado como atmosfera inerte
para estudo de reações químicas e em
processos metalúrgicos em alta
temperatura. Também é usado em
lâmpadas incandescentes.
• Uma propriedade útil dos gases nobres é
a capacidade de emitir cores vivas quando
uma descarga elétrica passa por eles.
• Por muitos anos acreditou-se que esses
elementos eram inertes por terem
configuração eletrônica estável. Os
primeiros compostos contendo gases
nobres descobertos foram os clatratos,
que são compostos em forma de “gaiola”,
que aprisionam os gases nobres.
• Soluções aquosas ou
contendo quinona (pdihidroxibenzeno, HO-C6H4OH) quando cristalizam em
altas pressões sob a ação
de certos gases, formam
estruturas contendo ligações
de hidrogênio com
cavidades internas.
Clatratos contendo gases
nobres como argônio,
criptônio e xenônio, bem
como outros gases como
SO2, CH4 e O2 foram
preparados.
• Na década de 1960, descobriu-se que o
PtF6 era um oxidante forte capaz de reagir
com o xenônio. O produto da reação é
uma mistura complexa de vários
compostos de xenônio. Foram os
primeiros compostos covalentes de gases
nobres descobertos. Meses após essa
descoberta, foram sintetizados o XeF2 e o
XeF4.
• Algumas dezenas de compostos de gases
nobres são conhecidos hoje. Os
compostos estáveis envolvem apenas Kr,
Xe, Rn.
• Algumas espécies transientes contendo
hélio e neônio foram detectadas por
espectrometria de massa. Os compostos
mais estáveis são os que contêm xenônio
com elementos altamente eletronegativos
como F, O e Cl. Existem relatos de
compostos com Xe-N, Xe-C e até mesmo
Xe-Cr.
• Acredita-se que a reação original de
Bartlett tenha sido:
Xe + PtF6 [XeF]+[PtF6]- + PtF5 [XeF]+[Pt2F11]-
[XeF]+ não existe como íon discreto mas ligado
covalentemente a um fluoreto num ânion, coomo
[XeF]+[RuF6]-.
Tem havido interesse no uso de compostos de gases
nobres em sínteses orgânicas e inorgânicas porque o
subproduto de tais reações é geralmente o próprio gás
nobre. Os fluoretos de xenônio têm sido usados como
agentes de fluoretação:
2 SF4 + XeF4 2SF6 + Xe
C6H5I + XeF2 C6H5IF2 + Xe
Os óxidos XeO3 e XeO4 são altamente explosivos e
devem ser manuseados com cuidado. XeO3 é um
poderoso agente oxidante em solução aquosa.
XeO3 + 6H+ + 6e- Xe + 3H2O
Em solução alcalina:
XeO3 + OH-
HXeO4-
Eº=2,10V
K=1,5x10-3
O HXeO4- se desproporciona, formando o íon perxenato, XeO64-:
2 HXeO4- + 2 OH- XeO6- + Xe + O2 + 2 H2O